双特异性抗体的配方优化的制作方法
双特异性抗体的配方优化
1.相关申请的交叉引用
2.本技术主张2019年8月20日(20,08,2019)提交的美国临时专利申请第62/889,354号的优先权和权益,其内容通过引用整体并入本文。
技术领域
3.本发明整体上涉及用于双特异性抗体的配方优化的方法和系统。本发明还提供用于选择肽或蛋白质组合以产生双特异性抗体的方法和系统,并提供用于其配方优化的方法。
背景技术:
4.双特异性抗体是非常有价值的生物制药产品,与传统的单克隆抗体相比,它具有更高的功效和靶向特异性,因为双特异性抗体靶向两种不同的抗原。双特异性抗体的设计可以针对联合小分子药物的多种组织特异性抗体,例如联合多种组织特异性抗体和细胞毒性药物,从而在肿瘤附近释放药物。小药物分子可以与纯化的双特异性抗体缀合以产生抗体-药物缀合物(adc)。然而,双特异性抗体的药物开发和配方优化因其结构和组成的复杂性而具有挑战性,因为双特异性抗体的两个fab臂是异质的,源自两种不同的亲本抗体。
5.双特异性抗体的两个异质fab臂可以具有不同的理化性质,例如在表面疏水性或表面电荷方面的差异。双特异性抗体的结构复杂性导致理化性质的变化,这对水溶性具有负面或不利影响。挑战包含在双特异性抗体的配方开发期间由于高粘度或乳光导致溶解度降低。水溶性是对药物配方生物利用度的限制。开发稳定的基于蛋白质的配方对于与免疫原性反应相关的安全问题、合理保质期内的药物稳定性以及注射给药优化至关重要。了解蛋白质在各种配方条件下(例如ph、离子强度、缓冲盐或温度)的稳定性和溶解度有益于优化双特异性抗体的配方。
6.应当理解的是,需要选择具有目标理化性质的肽或蛋白质组合以产生双特异性抗体的方法和系统。还需要优化用于双特异性抗体配方开发的组合物的方法。
技术实现要素:
7.由于异质fab臂,双特异性抗体的结构复杂,可对水溶性产生负面或不利影响。挑战包含在双特异性抗体配方开发期间的高粘度或乳光。本技术提供了选择用于构建双特异性抗体的备选分子及其配方优化的方法和系统。对双特异性抗体及其亲本抗体的理化参数谱进行表征。基于这些理化参数提供了各种配方优化策略。
8.本公开提供了一种生产具有目标理化性质的肽或蛋白质组合的方法,其包括:接收所述肽或蛋白质的多个氨基酸序列;选择具有所需氨基酸序列的所述肽或蛋白质;确定具有所需氨基酸序列的所述肽或蛋白质的蛋白质-蛋白质相互作用谱;选择具有所需氨基酸序列的所述肽或蛋白质的蛋白质-蛋白质相互作用的目标谱;以及根据所述蛋白质-蛋白质相互作用的所述目标谱生产具有所需氨基酸序列的所述肽或蛋白质组合。在一些示例性
实施例中,在本技术所述的方法中,所述蛋白质-蛋白质相互作用可以是排斥性或吸引性蛋白质-蛋白质相互作用,其中所述蛋白质-蛋白质相互作用谱可以通过测量具有所需氨基酸序列的所述肽或蛋白质的相互作用参数来确定。
9.在一些示例性实施例中,本技术所述的方法进一步包括确定具有所需氨基酸序列的所述肽或蛋白质的理化性质谱,其中根据所述蛋白质-蛋白质相互作用的所述目标谱和所述理化性质谱可以生产具有所需氨基酸序列的所述肽或蛋白质组合,其中所述理化性质可以是理论等电点、实验等电点、表面疏水性、相对表面疏水性、疏水性指数、表面电荷、电荷异质性、第二渗透维里系数、搅拌稳定性、乳光、粘度或界面敏感性。在一些示例性实施例中,所述表面疏水性或表面电荷可以通过对具有所需氨基酸序列的所述肽或蛋白质进行结构建模来确定。
10.在一些优选的示例性实施例中,在本技术所述的方法中,具有所需氨基酸序列的所述肽或蛋白质组合的浓度可以为约20mg/ml至约200mg/ml,或至少约70mg/ml,或至少约100mg/ml。
11.在一些示例性实施例中,在本技术所述的方法中,具有所需氨基酸序列的所述肽或蛋白质组合可以是双特异性抗体或多特异性抗体,其中本技术所述的方法进一步包括确定所述双特异性抗体或所述多特异性抗体的可变区的疏水性指数、表面电荷或电荷异质性,用于生产所述双特异性抗体或所述多特异性抗体。
12.本公开至少部分地提供了一种用于生产具有目标理化性质的肽或蛋白质组合的系统,其包括:所述肽或蛋白质的多个氨基酸序列;选择具有所需氨基酸序列的所述肽或蛋白质;具有所需氨基酸序列的所述肽或蛋白质的蛋白质-蛋白质相互作用谱;具有所需氨基酸序列的所述肽或蛋白质的蛋白质-蛋白质相互作用的目标谱;以及具有所需氨基酸序列的所述肽或蛋白质组合,其中根据所述蛋白质-蛋白质相互作用的所述目标谱选择具有所需氨基酸序列的所述肽或蛋白质。在一些示例性实施例中,在本技术所述的系统中,所述蛋白质-蛋白质相互作用可以是排斥性或吸引性蛋白质-蛋白质相互作用,其中所述蛋白质-蛋白质相互作用谱是通过测量具有所需氨基酸序列的所述肽或蛋白质的相互作用参数来确定的。
13.在一些示例性实施例中,本技术所述的系统进一步包括具有所需氨基酸序列的所述肽或蛋白质的理化性质谱,其中具有所需氨基酸序列的所述肽或蛋白质组合是根据所述蛋白质-蛋白质相互作用的所述目标谱和所述理化性质谱选择的,其中所述理化性质可以是理论等电点、实验等电点、表面疏水性、相对表面疏水性、疏水性指数、表面电荷、电荷异质性、第二渗透维里系数、搅拌稳定性、乳光、粘度或界面敏感性。在一些示例性实施例中,所述表面疏水性或表面电荷可以通过对具有所需氨基酸序列的所述肽或蛋白质进行结构建模来确定。
14.在一些优选的示例性实施例中,在本技术所述的系统中,具有所需氨基酸序列的所述肽或蛋白质组合的浓度可以为约20mg/ml至约200mg/ml,或至少约70mg/ml,或至少约100mg/ml。
15.在一些示例性实施例中,在本技术所述的系统中,具有所需氨基酸序列的所述肽或蛋白质组合可以是双特异性抗体或多特异性抗体,其中本技术所述的系统进一步包括所述双特异性抗体或所述多特异性抗体的可变区的疏水性指数、表面电荷或电荷异质性的
谱。
16.本公开至少部分地提供了一种优化或选择配方中至少一种组分的方法,其中所述配方包括根据本技术所述的具有所需氨基酸序列的所述肽或蛋白质组合,所述方法包括:基于具有所需氨基酸序列的所述肽或蛋白质的所述蛋白质-蛋白质相互作用的所述目标谱调整所述配方的离子强度,以及基于具有所需氨基酸序列的所述肽或蛋白质的所述蛋白质-蛋白质相互作用的所述目标谱调整所述配方的ph值。
17.在一些优选的示例性实施例中,本技术中所述的配方优化方法进一步包括基于具有所需氨基酸序列的所述肽或蛋白质的所述蛋白质-蛋白质相互作用的所述目标谱向所述配方中添加盐。在一些优选的示例性实施例中,本技术中所述的配方优化方法进一步包括基于具有所需氨基酸序列的所述肽或蛋白质的所述蛋白质-蛋白质相互作用的所述目标谱向所述配方中添加疏水性赋形剂,其中所述至少一种组分为氯化钠、乙酸盐、组氨酸或精氨酸盐酸盐。
18.本公开至少部分地提供了一种优化双特异性或多特异性抗体配方的方法,其包含优化或选择配方中至少一种组分的方法,其中所述配方包括双特异性抗体或多特异性抗体。所述方法包括:确定所述双特异性抗体或所述多特异性抗体的蛋白质-蛋白质相互作用谱;以及基于所述双特异性抗体或所述多特异性抗体的所述蛋白质-蛋白质相互作用谱优化或选择所述配方中的所述至少一种组分。
19.在一些示例性实施例中,在所述优化双特异性或多特异性抗体配方的方法中,可以通过测量所述双特异性抗体或所述多特异性抗体的相互作用参数来确定所述蛋白质-蛋白质相互作用谱。在一些示例性实施例中,所述优化双特异性或多特异性抗体配方的方法进一步包括基于所述双特异性抗体或所述多特异性抗体的所述蛋白质-蛋白质相互作用谱调整所述配方的离子强度,或基于所述双特异性抗体或所述多特异性抗体的所述蛋白质-蛋白质相互作用谱调整所述配方的ph值。
20.在一些示例性实施例中,所述优化双特异性或多特异性抗体配方的方法进一步包括确定所述双特异性抗体或所述多特异性抗体的理化性质谱,其中优化或选择所述配方中的所述至少一种组分基于所述双特异性抗体或所述多特异性抗体的所述蛋白质-蛋白质相互作用谱以及所述双特异性抗体或所述多特异性抗体的所述理化性质谱。
21.在一些示例性实施例中,所述优化双特异性或多特异性抗体配方的方法进一步包括基于所述双特异性抗体或所述多特异性抗体的所述蛋白质-蛋白质相互作用谱向所述配方中添加盐,或基于所述双特异性抗体或所述多特异性抗体的所述蛋白质-蛋白质相互作用谱向所述配方中添加疏水性赋形剂。在一些示例性实施例中,在所述优化双特异性或多特异性抗体配方的方法中,所述至少一种组分是氯化钠、乙酸盐、组氨酸或精氨酸盐酸盐。
22.在一些示例性实施例中,在所述优化双特异性或多特异性抗体配方的方法中,所述理化性质为理论等电点、实验等电点、表面疏水性、相对表面疏水性、疏水性指数、表面电荷、电荷异质性、第二渗透维里系数、搅拌稳定性、乳光、粘度或界面敏感性,其中可以通过对所述双特异性抗体或所述多特异性抗体进行结构建模来确定所述表面疏水性或表面电荷。
23.在一些示例性实施例中,在所述优化双特异性或多特异性抗体配方的方法中,所述蛋白质-蛋白质相互作用是排斥性或吸引性蛋白质-蛋白质相互作用。在一些示例性实施
arghcl的缓冲液组成。
32.图4示出了根据示例性实施例,用于研究各种配方中bsab1界面敏感性的搅拌稳定性的测量值。所述测量包含对照和搅拌的蛋白质配方。h6表示ph为6的10mm组氨酸的缓冲液组成。h6n表示ph为6的10mm组氨酸和150mm nacl的缓冲液组成。h6arg表示ph为6的10mm组氨酸和150mm arghcl的缓冲液组成。
33.图5a示出了根据示例性实施例,各种缓冲液组成(包含mab-a和mab-b的复合配方)中bsab1、mab-a和mab-b的相互作用参数(kd)的测量值。a5表示ph为5的10mm乙酸盐的缓冲液组成。h6表示ph为6的10mm组氨酸的缓冲液组成。h6n表示ph为6的10mm组氨酸和150mm nacl的缓冲液组成。h6arg表示ph为6的10mm组氨酸和150mm arghcl的缓冲液组成。图5b示出了根据示例性实施例,使用成分梯度-多角度光散射(cg-mals),在各种蛋白质浓度下于ph为6的10mm组氨酸中bsab1配方的第二渗透维里系数b
22
的测量值。
34.图6a示出了根据示例性实施例,(在浓度为150mg/ml时)的乳光和相互作用参数kd的相关分析。图6b示出了根据示例性实施例,粘度和相互作用参数kd的相关分析。图6c示出了根据示例性实施例,(在浓度为70mg/ml时)的乳光和相互作用参数kd的相关分析。
具体实施方式
35.双特异性抗体是下一代抗体,其旨在通过两个不同的抗原结合位点实现卓越的治疗效果,与传统的单克隆抗体相比,其可以提高疗效和靶向特异性。双特异性抗体的应用涵盖了广泛的治疗领域,包含自身免疫、肿瘤学或慢性炎症适应症。例如,在癌症治疗中,双特异性抗体可以同时刺激多种免疫受体,从而触发和增强肿瘤细胞毒性免疫反应。
36.双特异性抗体的施用主要是在肠胃外,例如静脉内注射或皮下注射。由于皮下给药需要小注射量以提高患者依从性,因此对高蛋白质浓度配方的需求正在增加。通常,对皮下配方中蛋白质浓度的需求可能会超过100mg/ml。然而,开发高浓度蛋白质配方可能具有挑战性,因为蛋白质分子在高浓度下往往会聚集和/或沉淀,高浓度可能会导致高粘度和乳光。蛋白质在高浓度下通常具有较高的自缔合倾向。
37.双特异性抗体的两个fab臂是异质的,因为它们源自两种不同的亲本抗体。双特异性抗体的结构和组成复杂性会对配方开发带来挑战,例如乳光、高粘度或界面敏感性问题,因为两个异质fab臂可能具有显著不同的理化性质。本技术提供了一种选择用于构建双特异性抗体的备选分子的方法和系统,例如基于具有所需氨基酸序列的肽或蛋白质的蛋白质-蛋白质相互作用谱和/或理化性质谱来选择肽或蛋白质组合以产生双特异性抗体。
38.本技术进一步提供了一种用于双特异性抗体的配方优化的方法,所述双特异性抗体可以使用本技术所述的方法产生。本技术提供了通过对所述双特异性抗体及其亲本抗体进行结构建模,研究高浓度下双特异性抗体不良蛋白质行为的分子机制的方法和系统。可以在所述双特异性抗体及其亲本抗体之间表征和比较理化参数谱。基于所述理化参数提供各种配方优化策略。
39.本技术提供了使用蛋白质相互作用参数kd量化蛋白质-蛋白质相互作用,预测蛋白质行为的方法和系统。具体地,本技术提供了双特异性抗体在溶液中,特别是在高蛋白质浓度下的分子机制的表征。本技术提供了在双特异性抗体配方开发期间探索各种配方条件(例如调整离子强度、ph值或缓冲盐)影响以减少乳光和高粘度的方法和系统。
40.蛋白质-蛋白质相互作用(例如排斥性或吸引性蛋白质-蛋白质相互作用)与溶液中高蛋白质浓度的蛋白质行为有关。排斥性蛋白质-蛋白质相互作用通常是优选的,因为吸引性蛋白质-蛋白质相互作用可能归因于不良的蛋白质行为。表征蛋白质-蛋白质相互作用的方法包含动态光散射(dls)、静态光散射(sls)、小角度x射线(saxs)、分析超速离心(auc)和膜渗透压法。在dls测量中,蛋白质-蛋白质相互作用的性质和大小可以从相对稀释的情况下扩散系数对蛋白质浓度的非理想依赖性外推为相互作用参数kd。sls测量非理想光散射强度随蛋白质浓度梯度的变化。可以使用sls测量第二渗透维里系数b
22
。
41.蛋白质-蛋白质相互作用可以在溶液中高蛋白质浓度下决定蛋白质的特征(蛋白质行为)。本技术提供了使用相互作用参数kd来预测高蛋白质浓度下双特异性抗体行为的方法和系统。相互作用参数kd可提供对蛋白质高浓度行为的合理预测,用于选择备选分子以构建双特异性抗体及其配方优化。本技术所述的方法和系统可用于通过测量kd来预测蛋白质行为,选择备选分子以产生双特异性抗体。此外,本技术提供了优化或选择含有双特异性抗体的配方中至少一种组分的方法。
42.本技术所述的方法提供预测以获得用于双特异性抗体配方优化的乳光/粘度和相互作用参数kd之间的合理相关性。本技术所述的方法还提供预测以获得用于双特异性抗体配方优化的乳光/粘度和蛋白质-蛋白质相互作用之间的合理相关性。
43.在一些示例性实施例中,双特异性抗体中蛋白质-蛋白质相互作用的理化性质可以主要是静电的,并且增加离子强度和调整ph值的策略可以有效改善双特异性抗体配方优化的结果。
44.本技术提供了一种优化含有双特异性抗体配方的方法,其中所述方法包括测定所述双特异性抗体的蛋白质-蛋白质相互作用(例如吸引性蛋白质-蛋白质相互作用)谱。双特异性抗体形成物的乳光和/或粘度可以通过基于所述双特异性抗体的所述蛋白质-蛋白质相互作用谱调整所述配方的离子强度或ph值来显著降低,例如通过增加离子强度或降低ph值,从而通过减轻吸引性蛋白质-蛋白质相互作用来降低乳光和粘度。
45.双特异性抗体的卓越治疗效果使得对双特异性抗体配方优化的需求不断增加。本文公开的示例性实施例通过提供以下方法和系统来满足上述需求,通过提供以下方法和系统来满足上述需求,即根据相互作用参数kd的测量值基于具有所需氨基酸序列的肽或蛋白质的蛋白质-蛋白质相互作用的目标谱选择肽或蛋白质组合以产生双特异性抗体。本公开还提供了一种优化含有双特异性抗体配方的方法。可以通过预测相互作用参数kd指导所述优化策略。这些策略还满足了在双特异性抗体配方开发期间解决高粘度或乳光问题的长期需求。
46.术语“一个(种)”应理解为意指“至少一个(种)”;并且如本领域普通技术人员所理解的,术语“约”和“近似地”应理解为容许标准偏差;并且在提供范围时,包含终点在内。
47.如本文所使用,术语“包含(include、includes和including)”意图为非限制性的且应理解为分别意指“包括(comprise、comprises和comprising)”。
48.在一些示例性实施例中,本公开提供了一种生产具有目标理化性质的肽或蛋白质组合的方法,其包括:接收所述肽或蛋白质的多个氨基酸序列;选择具有所需氨基酸序列的所述肽或蛋白质,确定具有所需氨基酸序列的所述肽或蛋白质的蛋白质-蛋白质相互作用谱;选择具有所需氨基酸序列的所述肽或蛋白质的所述蛋白质-蛋白质相互作用的目标谱;
以及根据所述蛋白质-蛋白质相互作用的所述目标谱生产具有所需氨基酸序列的所述肽或蛋白质组合。
49.如本文所用,术语“肽”或“蛋白质”包含具有共价连接的酰胺键的任何氨基酸聚合物。蛋白质包括在本领域中通常称为“肽”或“多肽”的一个或多个氨基酸聚合物链。蛋白质可以含有一个或多个多肽以形成单个功能性生物分子。在一些示例性实施例中,所述蛋白质可以是抗体、双特异性抗体、多特异性抗体、抗体片段、单克隆抗体、宿主细胞蛋白质或它们的组合。
50.在一些示例性实施例中,本公开提供了一种优化或选择配方中至少一种组分的方法,其中所述配方包括双特异性抗体或多特异性抗体,所述方法包括:确定所述双特异性抗体或所述多特异性抗体的蛋白质-蛋白质相互作用谱,以及基于所述双特异性抗体或所述多特异性抗体的所述蛋白质-蛋白质相互作用谱优化或选择所述配方中的所述至少一种组分。
51.如本文所用,“抗体”旨在指由通过二硫键相互连接的四条多肽链、两条重(h)链和两条轻(l)链组成的免疫球蛋白分子。每条重链具有重链可变区(hcvr或vh)和重链恒定区。重链恒定区包含三个结构域ch1、ch2和ch3。每条轻链具有轻链可变区和轻链恒定区。轻链恒定区包含一个结构域(cl)。所述vh区和vl区可以进一步细分为高变区,称为互补决定区(cdr),散布着更保守的区域,称为框架区(fr)。每个vh和vl可由三个cdr和四个fr组成,从氨基末端到羧基末端按以下顺序排列:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4。术语“抗体”包含提及的任何同种型或亚类的糖基化和非糖基化免疫球蛋白。术语“抗体”包含但不限于通过重组方式制备、表达、产生或分离的抗体,例如从转染以表达抗体的宿主细胞中分离的抗体。igg包括抗体的子集。
52.示例性实施例
53.本文公开的实施例提供了生产具有目标理化性质的肽或蛋白质组合的方法和系统,其包括:接收所述肽或蛋白质的多个氨基酸序列;选择具有所需氨基酸序列的所述肽或蛋白质,确定具有所需氨基酸序列的所述肽或蛋白质的蛋白质-蛋白质相互作用谱;选择具有所需氨基酸序列的所述肽或蛋白质的所述蛋白质-蛋白质相互作用的目标谱;以及根据所述蛋白质-蛋白质相互作用的所述目标谱生产具有所需氨基酸序列的所述肽或蛋白质组合。
54.在一些示例性实施例中,本公开所述的方法进一步包括确定具有所需氨基酸序列的所述肽或蛋白质的理化性质谱,其中根据所述蛋白质-蛋白质相互作用的所述目标谱和所述理化性质谱生产具有所需氨基酸序列的所述肽或蛋白质组合。在一些示例性实施例中,所述理化性质是理论等电点、实验等电点、表面疏水性、相对表面疏水性、疏水性指数、表面电荷、电荷异质性、第二渗透维里系数、搅拌稳定性、乳光、粘度或界面敏感性。
55.在一些优选的示例性实施例中,在本技术所述的方法中,具有所需氨基酸序列的所述肽或蛋白质组合的浓度为约20mg/ml至约200mg/ml,或至少约70mg/ml,或至少约100mg/ml、约1mg/ml至约400mg/ml、约50mg/ml至约300mg/ml、约100mg/ml至约300mg/ml、约80mg/ml至约250mg/ml、约80mg/ml至约150mg/ml、至少约50mg/ml、至少约67mg/ml、至少约70mg/ml、至少约75mg/ml、至少约90mg/ml、至少约120mg/ml或至少约150mg/ml。
56.应当理解的是,所述系统不限于上述药物产品、肽、蛋白质、抗体、抗药物抗体、抗
原-抗体复合物、蛋白质药物产品、色谱柱或质谱仪中的任一种。
57.本文用编号及/或字母提供的方法步骤的连续标记并不旨在将所述方法或其任何实施例局限于所指示的特定次序。
58.本说明书通篇引用多项公开案,包含专利、专利申请、公开的专利申请、访问编号、技术论文及学术论文。这些引用的参考文献各自以全文引用的方式并入本文中且用于所有目的。除非另外描述,否则本文所使用的所有技术及科学术语均具有与本发明所属领域的普通技术人员通常所理解相同的含义。
59.参照以下实例将更充分地理解本公开,提供这些实例以更详细地描述本公开。其旨在说明本公开的范围且不应解释为限制本公开的范围。
60.实例
61.材料和试剂制备
62.1.1制备双特异性抗体
63.双特异性抗体是使用“杵臼”(knob-in-hole)技术制备的(xu等人,“使用无细胞表达系统在“杵臼”中生产双特异性抗体(production of bispecific antibodies in"knobs-into-holes"using a cell-free expression system)”,《单克隆抗体(mabs)》,2015,7(1):231-242)。bsab1是一种igg 4单克隆抗体,它是使用“杵臼”技术从亲本mab-a和mab-b构建的。bsab1具有共同的轻链和两个不同的fab臂。bsab1配方在中等至高蛋白质浓度下显示出高粘度和乳光,例如含有在ph约为6的10mm组氨酸和约70mg/ml-85mg/ml的bsab1的配方。
64.2.1制备目标配方缓冲液
65.如表1所示,制备了各种目标配方缓冲液,包含乙酸盐、组氨酸、精氨酸盐酸盐或氯化钠的组分,ph值范围约为5-8。将初始配方缓冲液中的所有蛋白质样品透析成目标配方缓冲液,如表i所示。使用可变光程紫外/可见光谱仪(solonpe,c-technologies inc,新泽西州)测量蛋白质浓度。所有化学品均为试剂级或更高级别的化学品。
66.表1.目标配方缓冲液的组成
67.目标配方缓冲液简称10mm乙酸盐,ph 5a510mm组氨酸,ph 6h610mm组氨酸,150mm nacl,ph 6h6n10mm组氨酸,150mmarghcl,ph 6h6arg10mm tris,ph 8t8
68.表征抗体理化性质的方法
69.1.1浊度测量
70.使用紫外/可见光自动扫描仪(spectramax 190,molecular devices,加利福尼亚州)测量405nm处的光密度,以量化室温下蛋白质配方的浊度和乳光。
71.2.1疏水相互作用色谱-高效液相色谱(hic-hplc)用于获得无量纲保留时间
72.在agilent 1200hplc仪器(agilent,圣克拉拉,加利福尼亚州)中与叔丁基疏水相互作用色谱(hic)柱(tosoh bioscience,宾夕法尼亚州)结合的蛋白质在(nh4)25o4梯度下降的情况下被洗脱。获得保留时间以使用以下等式1计算无量纲保留时间(drt):
conformation,apparent solubility,and protein-protein interactions on the rates and mechanisms of aggregation for an igg1 monoclonal antibody)”,《物理化学杂志b(the journal of physical chemistry b)》,2016,120(29):7062-7075。
[0086][0087]
其中mw是质均分子量,c是蛋白质浓度,r(θ)是过量瑞利比,k作为光学常数在等式4中描述:
[0088][0089]
其中n0为溶剂折射率,dn/dc表示折射率增量,na为阿伏伽德罗数,并且λ为入射光束的波长。
[0090]
7.1差示扫描量热法测量
[0091]
差示扫描量热法(dsc),例如microcal vp-dsc(malvern instruments,伍斯特郡,英国),用于测量热升温过程中蛋白质的表观熔化温度(tm)。在典型的实验环境中,将不同配方条件下的空白对照剂和1mg/ml蛋白质溶液以1℃/min的速率从20℃加热到105℃。从空白对照剂中减去获得的热电图数据,并通过origin 7.0软件使用非二态展开模型分析tm。
[0092]
8.1测量搅拌稳定性
[0093]
在室温下以1000rpm速率涡旋混合1mg/ml的无表面活性剂蛋白质溶液。随后,聚集谱通过微流成像(mfi)和尺寸排阻色谱(sec)进行表征。
[0094]
实例1.测定双特异性抗体及其亲本抗体的理化性质
[0095]
对bsab1、mab-a和mab-b进行了蛋白质同源建模,包含序列分析和结构分析。分析了蛋白质的表面性质。对双特异性抗体,例如bsab1及其亲本抗体,如mab-a和mab-b的理化性质进行测定,如表2所示。基于静态模型结构,测定了抗体的理论等电点(pi)。使用icief测量pi的实验值。pi的实验值与pi的理论值相似,但略有不同。有趣的是,bsab1的pi值大于mab-a的pi值,但小于mab-b的pi值。hic-hplc测量的相对表面疏水性表明bsab1和mab-b具有相对较高的疏水性。考虑到mab-a、mab-b和bsab1的恒定区具有相似性,对这些抗体的可变区(fv)进行建模以通过测定fv电荷、fv疏水性指数和fv电荷异质性来确定它们之间的pi差异。
[0096]
表2.bsab1、mab-a和mab-b的理化性质。
[0097]
理化性质bsab1mab-amab-bpi(理论)6.846.37.77pi(实验,icief)约6.9约6.3约7.3hφ%(hic-hplc)302032fv表面电荷3-18fv疏水性指数1.151.081.23fv电荷异质性-13-539
[0098]
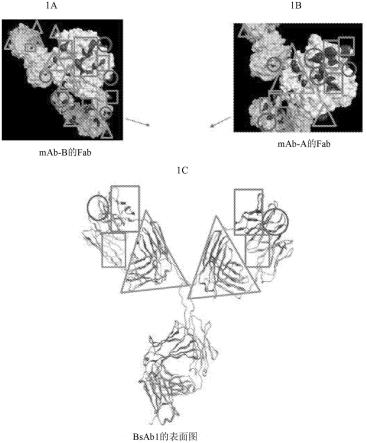
根据表面性质分析,建模结果表明mab-b具有最高的fv表面电荷(总电荷)和fv疏水性。fv表面电荷值和fv疏水性值从高到低依次为mab-b、bsab1和mab-a。然而,fv电荷异质性值与表2中所示的顺序相反。作为表面图的bsab1、mab-a的fab和mab-b的fab的结构模型
示于图1中。矩形中的阴影区域表示疏水补丁的位置。圆圈中的阴影区域表示负电荷补丁的位置。三角形中的阴影区域表示正电荷补丁。如图1中表面图所示,bsab1的两个fab臂具有不同的表面性质,例如不同的表面电荷和疏水性。这些结果表明mab-a的fv区高电荷异质性和低表面电荷可能归因于mab-a和bsab1在较高浓度下的不良行为。
[0099]
测定了这些抗体的熔化温度,例如tm。结果表明,熔融温度之间没有显著差异。这表明双特异性抗体,例如bsab1及其亲本抗体,例如mab-a和mab-b具有相当的构象稳定性。
[0100]
实例2.测量蛋白质配方的乳光
[0101]
通过测量405nm处的光密度来表征蛋白质溶液的乳光。对bsab1、mab-a和mab-b的蛋白质配方进行了od 405nm处的光密度测量,如图2a-2c所示。如表1中的目标配方缓冲液所示,a5表示ph为5的10mm乙酸盐的组成。h6表示ph为6的10mm组氨酸的组成。h6n表示ph为6的10mm组氨酸和1 50mm nacl的组成。t8表示ph为8的10mm tris的组成。当bsab1在ph为6的10mm组氨酸配方缓冲液(在图2a中指定为h6)中制备时,bsab1的蛋白质浓度和od405的测量值在20mg/ml至1 50mg/ml范围内具有线性依赖性,如图2a所示。然而,当bsab1的蛋白质浓度高于50mg/ml时,肉眼观察到明显的浑浊。当bsab1的配方缓冲液中包含150mm nacl时,蛋白浓度高于50mg/ml下的乳光显著降低,并且od450的测量值仍然线性依赖于bsab1的蛋白质浓度。还通过在含有ph为5的10mm乙酸盐的配方缓冲液(图2a中指定为a5)中制备bsab1来研究ph范围的影响。当bsab1配方缓冲液的ph值降低(例如从ph 6降低到ph 5)时,乳光显著降低。相反,当ph升高到8时,乳光有显著的线性增加。尽管未在图2a中显示,但如表3所示,在ph为8的含有10mm的配方缓冲液(指定为t8)中测量bsab1的乳光:
[0102]
表3.ph为8的tris中bsab1的乳光
[0103]
bsab1的浓度(在t8中制备)od@40520.4mg/ml0.07849.0mg/ml0.12567.2mg/ml0.152
[0104]
相比之下,与bsab1相比,亲本mab-a和mab-b已完成不同的乳光谱,如图2b和2c所示。mab-a在ph为6的10mm组氨酸配方缓冲液中不稳定,其在蛋白质浓度为6.3mg/ml时会出现严重沉淀并最终与上层相分离。当在mab-a的配方缓冲液中包含150mm nacl以增加离子强度时,乳光显著降低并且溶解度增加(图2b中的h6n)。还通过在含有ph为5的10mm乙酸盐的配方缓冲液(图2b中的a5)中制备mab-a来研究ph范围的影响。当mab-a的配方缓冲液的ph值降低时,例如从ph 6降低至ph 5,乳光显著降低。在三种配方缓冲液中制备mab-b(图2c),并且mab-b的od405测量值在所有三种条件下均较低。降低ph值(图2c中的a5)的策略,例如从ph 6降低到ph 5,仅产生最小的影响。当mab-b的配方缓冲液中包含150mm nacl以增加离子强度时,乳光轻微增加(图2c中的h6n)。
[0105]
实例3.测量蛋白质配方的粘度
[0106]
使用基于微芯片的粘度计测量各种条件下蛋白质配方的溶液粘度。该方法既可以避免空气-水界面的干扰,又可以利用样品用量少的特点。bsab1、mab-a或mab-b在各种配方缓冲液中制备,如图3a-3c所示,包含ph为5的10mm乙酸盐的组成(a5)、ph为6的10mm组氨酸的组成(h6)、ph为6的10mm组氨酸和150mm nacl的组成(h6n)、ph为6的10mm组氨酸和1 50mm arghcl的组成(h6arg)以及ph为8的10mm tris(t8)。bsab1在ph为6的10mm组氨酸中的粘度
显示出对蛋白质浓度的指数依赖性,并在150mg/ml时高达120cp,这远远超过了药物制造和施用的可接受范围(图3a中的h6)。作为对照,通过门尼方程计算了直径为10nm的免疫球蛋白在150mg/ml时的理论粘度。所获得的结果为仅约4cp,得出只有硬球排斥有助于分子间相互作用的假设(图3a)。所述bsab1配方的粘度通过添加150mm nacl以增加离子强度或通过降低ph值(例如从ph 8降低到ph 5)而显著降低。当bsab1配方中包含150mm arghcl(图3a中的h6arg)时,所述bsab1配方粘度降低的程度在所有配方缓冲液中最大。含有150mm arghcl的所述bsab1配方在各种蛋白质浓度下的粘度与通过门尼方程计算和预测的理论粘度相似。离子强度和ph值的变化对mab-a配方显示出类似的影响(图3b)。虽然未在图3a中示出,如表4所示,还测量了配方t8中bsab1的粘度
[0107]
表4.ph为8的tris中bsab1的粘度
[0108]
bsab1的浓度(在t8中制备)粘度(cp)20.4mg/ml1.2749.0mg/ml1.8567.2mg/ml2.37
[0109]
如前面的实例(图2b)中所讨论的,通过添加150mm nacl或降低ph(例如,从ph 6降低到ph 5),mab-a能够在高于150mg/ml的情况下重新溶解。然而,在蛋白质浓度为150mg/ml时,mab-a在ph为5的10mm乙酸盐(a5)中的粘度显著高于ph为6的10mm组氨酸和150mm nacl(h6n)中的粘度,如图3b所示。使用150mm arghcl也能够在高达150mg/ml的情况下溶解mab-a(图3b中的h6arg)。此外,在mab-a配方中使用150mm arghcl进一步降低了粘度,使其接近理论预测值。相比之下,mab-b配方在不同ph值或离子强度下的粘度相似且具有可比性。在mab-b配方中使用150mm arghcl不会造成显著的差异,其仅将粘度略微提高到理论值(图3c)。
[0110]
由于添加arghcl可以显著降低bsab1、mab-a和mab-b配方的粘度,这表明这些蛋白质在高浓度下的行为受到这些蛋白质表面疏水性的影响。bsab1的两个异质fab臂之间可能存在最小的交叉相互作用。bsab1的高粘度和乳光可能是由于mab-a的fab臂。
[0111]
实例4.离子强度、ph值和赋形剂对搅拌稳定性的影响
[0112]
测量搅拌稳定性,从而研究bsab1在各种配方中的界面敏感性。在室温下以1000rpm的速率涡旋混合1mg/ml的蛋白质溶液。随后,聚集谱通过微流成像(mfi)和尺寸排阻色谱(sec)进行表征。如图4所示,增加离子强度的策略可以显著减少搅拌时不可见微粒的形成。arghcl的存在可以改善空气-水界面稳定性。结果表明,bsab1的界面敏感性受到蛋白质-蛋白质相互作用的显著调整。如图4所示,h6表示ph为6的10mm组氨酸的组成。h6n表示ph为6的10mm组氨酸和150mm nacl的组成。h6arg表示ph为6的10mm组氨酸和150mm arg hcl的缓冲液组成。
[0113]
实例5.测量相互作用参数和第二渗透系数
[0114]
使用动态光散射(dls),例如wyatt dynapro读板器(wyatt technology,加利福尼亚州)测量从2mg/ml到10mg/ml的相互作用参数kd。kd值按照方法部分中的描述进行估计。第二渗透维里系数b
22
通过wyatt成分梯度-多角度光散射(cg-mals)系统测量,如方法部分所述。
[0115]
蛋白质相互作用参数(kd)由dls测量。结果显示,bsab1的相互作用参数kd在ph为6
(图5a中的h6)和ph为8(表5)的10mm组氨酸的存在下具有显著的负值,表明在ph为6时,存在强烈的吸引性蛋白质-蛋白质相互作用。增加离子强度(添加150mm nacl或150mm arghcl)和改变ph值(从ph 6降低到ph 5)的策略可以增加bsab1配方的kd值,如图5a所示。虽然未在图5a中示出,如表5所示,还测量了其他配方中bsab1的粘度。
[0116]
表5.ph为8的tris中bsab1的粘度
[0117][0118][0119]
如图5a和表5所示,在bsab1配方中添加150mm arghcl或将ph值从ph 8降低至ph 5可将所述bsab1配方的kd值增加至kd为约-5.37ml/g的θ条件。当kd值达到θ条件时,除了拥挤浓度下的硬球排斥外,不存在净蛋白质-蛋白质相互作用。
[0120]
与bsab1相比,mab-a的相互作用参数kd在ph为6的10mm组氨酸存在下具有更大的负值(图5a),表明存在更强的吸引性蛋白质-蛋白质相互作用。增加离子强度(添加150mm nacl或150mm arghcl)和改变ph值(从ph 8降低到ph 5)的策略可以增加mab-a配方的kd值,如图5a和表5所示。然而,与相应配方中的bsab1配方的情况相比,mab-a配方的调整kd值仍然更负。如图5a和表5所示,在mab-a配方中添加150mm arghcl可以将mab-a配方的kd值提高到θ条件。相比之下,mab-b配方的kd值接近或高于θ条件,如图5a(误差=三次重复的标准差)所示。与bsab1相比,mab-a和mab-b的复合配方的蛋白质-蛋白质相互作用水平相似。基于所述结果,增加离子强度、降低ph值和使用疏水性赋形剂可以有效减少吸引性蛋白质-蛋白质相互作用。
[0121]
分子间相互作用参数kd分析表明,在ph为6的10mm组氨酸中,bsab1分子之间存在显著的吸引性蛋白质-蛋白质相互作用。ph为6的配方的ph值接近bsab1的pi,约为6.9。因此,已经证明,向配方中添加150mm nacl的策略可以将蛋白质-蛋白质相互作用显著降低至最低水平。考虑到bsab1在ph为6时的整体低蛋白质电荷,由于调整离子强度可以显著降低所述配方的粘度,这表明短程静电相互作用(例如偶极-偶极相互作用)是吸引性蛋白质-蛋白质相互作用的原因,可能造导致bsab1的不良高浓度行为。
[0122]
bsab1在高蛋白质浓度下的高粘度和乳光归因于短程静电相互作用和疏水相互作用,其中一个fab臂决定了吸引性自相互作用。因此,通过增加离子强度和/或添加疏水性赋
形剂,可以有效减少配方中bsab1的不良高浓度行为。这些结果表明,bsab1的分子间相互作用参数kd可以提供对蛋白质高浓度行为的合理预测。因此,kd的测量值可用于选择构建双特异性抗体及其配方优化的备选分子。
[0123]
bsab1配方在ph为6的10mm组氨酸中于各种蛋白质浓度下的第二渗透维里系数b
22
通过wyatt成分梯度-多角度光散射(cg-mals)测量,如图5b所示。结果显示了较大的负b
22
值,这表明存在ph为6的10mm组氨酸的情况下,bsab1配方中存在强烈的吸引性蛋白质-蛋白质相互作用。这些结果证实,基于相互作用参数kd的测量值,预测蛋白质-蛋白质相互作用是可靠的。
[0124]
实例6.与相互作用参数相关的相关性分析
[0125]
如图6a(浓度为150mg/ml)和图6c(浓度为70mg/ml)所示,使用皮尔逊相关性分析乳光与相互作用参数kd之间的关系。虽然未在图6a中示出,如表6所示,还测量了其他配方中bsab1的乳光与相互作用参数kd之间的关系。
[0126]
表5.ph为8的tris中bsab1的粘度
[0127]
bsab1的配方组分od405(在70mg/ml下)乙酸盐,ph5.0+脯氨酸0.1179乙酸盐,ph5.0+柠檬酸盐0.2194乙酸盐,ph5.0+mgcl20.1815乙酸盐,ph5.0+na2so40.2657his,ph6.0+脯氨酸0.2187his,ph6.0+柠檬酸盐0.1848his,ph6.0+mgcl20.1799his,ph6.0+na2so40.2202tris,ph8.00.152(在67mg/ml下)tris,ph8.0+脯氨酸0.15tris,ph8.0+柠檬酸盐0.152tris,ph8.0+mgcl20.1711tris,ph8.0+na2so40.1595
[0128]
如图6b所示,使用皮尔逊相关性分析粘度和相互作用参数kd之间的关系。皮尔逊相关系数(例如皮尔逊r)是两个变量之间线性相关性的度量。乳光/粘度与相互作用参数kd之间存在合理的相关性。结果表明,乳光/粘度和蛋白质-蛋白质相互作用之间存在合理的相关性。在溶液中高蛋白质浓度下,蛋白质-蛋白质相互作用决定着蛋白质的特征(蛋白质行为)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1