川崎病罹患判定试剂盒和川崎病罹患判定方法与流程
1.本发明涉及川崎病罹患判定试剂盒和川崎病罹患判定方法。
背景技术:
2.川崎病(kawasaki disease:以下有时表述为“kd”)是以全身性血管炎为特征的发热性疾病。主要在小于5岁的儿童期多发,在无治疗的情况下以约25~30%的比例并发冠状动脉病变(coronary artery lesions:cal),因而能够成为由血栓形成等造成的心肌梗塞发病的风险因子。因此,现在认识到kd是发达国家中的儿童期发病心脏病的主要原因(非专利文献1~3)。
3.川崎病从1967年被报告以来已经经过了半个世纪以上,但现在其病因和与成人心血管疾病的相关性仍然不明(非专利文献1、4)。
4.多伦多儿童医院的环境流行病学研究提示,根据流行病学的研究,在变应原、大气中生物粒子等外界刺激少的良好卫生环境中生活的儿童会在之后由于暴露于某些感染性或环境诱导因子而发病kd(非专利文献5)。因此认为,kd以某些环境因子为契机而产生过度的免疫应答,在具有特定的遗传因子的儿童中引发血管炎。
5.作为kd的原因,虽然到目前为止报告了大量的病原体,但在不同的同生群中得到了一致的结果的研究基本没有。唯一例外是属于肠杆菌科的假结核耶尔森氏菌(yersinia pseudotuberculosis),实际上,在日本,结核耶尔森氏菌(y.pseudotuberculosis)感染者的约10%发病kd(非专利文献6)。在欧洲也确认了在结核耶尔森氏菌(y.pseudotuberculosis)感染蔓延时kd发生率上升。另外,也已知在kd患者中,结核耶尔森氏菌(y.pseudotuberculosis)感染患者比非感染患者冠状动脉病变(cal:coronary artery lesions)的发生率高(非专利文献7)。
6.由以上的结果表明,在kd的发病中先天性免疫系统发挥重要的作用,但关于其发生机理、致病因子依然不明。因此,kd的诊断尚未确立客观的检查法,现在也依赖于临床表现、和基于此的其他疾病的排除诊断。因此,kd的诊断存在容易伴有医生的主观、误诊这样的问题。
7.现有技术文献
8.非专利文献
9.非专利文献1:hara t.,et al,2016,clin exp lmmunol,186:134-143.
10.非专利文献2:mccrindle b.w.,et al.,2017,circulation,135:e927-e999.
11.非专利文献3:nakamura y.,2018,int j rheum dis,21:16-19.
12.非专利文献4:burgner d.&harnden a.,2005,int j lnfect dis,9:185-194.
13.非专利文献5:manlhiot c,et al.,2018,plos one,13:e0191087.
14.非专利文献6:sato k.et al.,1983,pediatr infect dis,2:123-126.
15.非专利文献7:vincent,p.,2007,pediatr infect dis j 26:629-63.
技术实现要素:
16.发明所要解决的课题
17.本发明鉴定kd罹患判定用标志物,开发、提供能够使用该标志物对怀疑患有kd的受检者直接且客观地判定kd罹患的有无的试剂盒和方法。
18.用于解决课题的手段
19.为了解决上述课题,本发明者们以kd的致病因子的探索为目的,使用kd患者群的血清通过lc-ms(liquid chromatography mass spectrometry)分析法进行了脂质组学分析。其结果鉴定了多个分子可以作为“川崎病特异性的分子”。发现了其中28个分子在多个不同的kd患者群中被重复检测到(未发表)。进而,其中2个分子与已知在kd中并发的冠状动脉异常相关。对于这2个分子使用lc-ms/ms(lc-tandem mass spectrometry)分析法进行了结构分析,结果表明,1个分子具有氧化磷脂酰胆碱(氧化pc)结构。氧化pc以与载脂蛋白b结合的状态形成lab(含载脂蛋白b的lox-1配体)。lab已知是与动脉硬化的发病相关的分子,与lox-1蛋白质(凝集素样氧化低密度脂蛋白受体1蛋白质)特异性地结合,但关于与kd关联的报告目前没有。因此,对于kd患者、健常者的血浆中的lab存在量,使用lox-1蛋白质作为捕获体进行了验证,结果确认了,在kd患者中,其量有意义地多。kd患者的血浆中的lab量在kd患者进入恢复期之后,其量减少到与健常者确认不到显著性差异的程度。这些结果提示,lab可以成为关于kd罹患的生物标志物。本发明是基于关于kd的上述新见解而完成的,提供以下发明。
20.(1)包含lab捕获器的川崎病罹患判定试剂盒,所述lab捕获器包含固相化于基材表面的凝集素样氧化低密度脂蛋白受体1蛋白质(lox-1蛋白质)和/或该蛋白质的具有lab结合能力的一部分。
21.(2)根据(1)所述的川崎病罹患判定试剂盒,所述lox-1蛋白质是以下(a)~(c)所示的任一多肽。
22.(a)包含序列号2所示的氨基酸序列的多肽
23.(b)在序列号2所示的氨基酸序列中添加、缺失、或替换了1个或多个氨基酸的多肽
24.(c)相对于序列号2所示的氨基酸序列具有90%以上的氨基酸同一性的多肽
25.(3)根据(1)所述的川崎病罹患判定试剂盒,所述该蛋白质的具有lab结合能力的一部分是以下(d)~(f)所示的任一多肽。
26.(d)包含序列号3~5的任一项所示的氨基酸序列的多肽
27.(e)在序列号3~5的任一项所示的氨基酸序列中添加、缺失、或替换了1个或多个氨基酸的多肽
28.(f)相对于序列号3~5的任一项所示的氨基酸序列具有90%以上的氨基酸同一性的多肽
29.(4)根据(1)~(3)的任一项所述的川崎病罹患判定试剂盒,进一步包含lab检测剂。
30.(5)根据(4)所述的川崎病罹患判定试剂盒,所述lab检测剂被进行了标记。
31.(6)根据(4)或(5)所述的川崎病罹患判定试剂盒,所述lab检测剂是抗lab抗体或该抗体的具有lab结合能力的片段。
32.(7)川崎病的罹患判定方法,所述方法包括:测定从受检体采集的每单位量的血液
试样中所包含的lab的量并获得其测定值的测定工序、和基于所述测定工序中获得的测定值判定该受检体中的川崎病的罹患的有无的判定工序。
33.(8)根据(7)所述的川崎病的罹患判定方法,所述判定工序在所述测定工序中获得的测定值高于规定的截止值的情况下,或者所述测定工序中获得的测定值与从健常体组采集的每单位量的血液试样中所包含的lab量相比有意义地高的情况下,判定该受检体患有川崎病。
34.(9)根据(7)或(8)所述的川崎病的罹患判定方法,所述测定工序使用lab与lox-1蛋白质的受体-配体活性进行测定,和/或使用lab与lox-1蛋白质的具有lab结合能力的一部分的受体-配体活性进行测定。
35.(10)根据(7)~(9)的任一项所述的川崎病的罹患判定方法,所述血液试样是血液、血清和血浆的任一者。
36.(11)lab作为用于川崎病的罹患判定的生物标志物的用途。
37.本说明书包含成为本技术的优先权基础的日本专利申请号2019-163111号的公开内容。
38.发明的效果
39.根据本发明,通过对怀疑患有kd的受检者应用利用了kd罹患判定用标志物的kd罹患判定方法,从而能够将一直以来不得不依赖于临床表现和排除诊断的kd的诊断直接且客观地进行判定。
附图说明
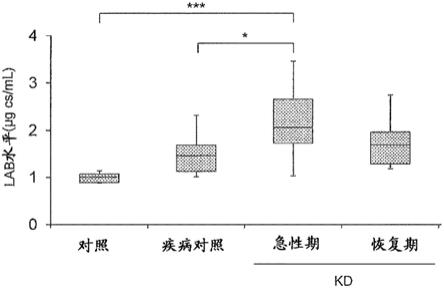
40.图1是显示kd患者的血浆中的lab水平的箱线图。图中,“对照”表示通常对照者(n=5)的血浆试样,“疾病对照”表示疾病对照(n=7)的血浆试样,另外川崎病(kd)中“急性期”表示急性期kd患者(n=16)来源的血浆试样,并且“恢复期”表示进入了恢复期的原kd患者(n=8)的血浆试样。图中,“*”表示p《0.05,另外“***”表示p《0.001(tukey’s hsd检验)。
具体实施方式
41.1.川崎病罹患判定试剂盒(kd罹患判定试剂盒)
42.1-1.概要
43.本发明的第1方案是川崎病罹患判定试剂盒(kd罹患判定试剂盒)。本发明的试剂盒包含lab捕获器作为必须构成要素,另外包含lab检测剂作为选择性构成要素。根据本发明的kd罹患判定试剂盒,能够高准确度且高灵敏度地判定一直以来诊断方法只有基于仅有基于临床表现的排除诊断的kd的罹患,能够辅助医生的kd诊断。
44.1-2.定义
45.本说明书中频繁使用的术语在以下进行定义。
46.所谓“川崎病(kawasaki disease:kd)”,如前所述,是以全身性血管炎为特征的儿童性发热性疾病。本说明书中,是以罹患判定为目的的对象疾病。
47.所谓“川崎病(kd)罹患判定(判定川崎病(kd)罹患)”,是指受检体中的kd罹患的有无的判定,即判定是否怀疑受检体患有kd的诊断辅助。
48.所谓“lox-1(lectin-like oxidized low-density lipoprotein receptor-1:凝集素样氧化低密度脂蛋白受体-1/凝集素样氧化ldl受体-1)蛋白质”(本说明书中,有时表述为“lox-1蛋白质”),是n末端侧在细胞质内、并且c末端侧露出细胞质外的1次跨膜型的受体型膜蛋白质。通过二硫键而形成同源二聚体,在血管内皮细胞、平滑肌、和巨噬细胞等中表达,作为后述的氧化ldl的清道夫受体发挥功能,但近年作为动脉硬化的促进因子也受到关注。已知lox-1蛋白质通过血小板、内皮细胞、血管平滑肌、神经元和巨噬细胞中的缺血再灌注损伤、活性氧、和炎症性细胞因子,从而其表达被诱导。
[0049]“ldl(低密度脂蛋白:low-density lipoprotein)”,是指由包含载脂蛋白b(apo-proteinb:apob)的蛋白成分、与包含胆固醇、甘油三酯、和磷脂的脂质成分结合而成的脂蛋白中密度较低的。ldl具有将肝脏中生产的胆固醇经由血液输送到全身的功能。因为ldl的血中浓度的增加成为动脉硬化的风险因子,因此ldl一般被成为“坏胆固醇”。
[0050]
所谓“氧化ldl(oxidized ldl:ox-ldl)”,是指ldl中的脂质成分或蛋白质成分通过活性氧等自由基而受到了氧化修饰、氧化损伤的ldl。氧化ldl也被称为变性ldl或lab(lox-1ligand containing apolipoprotein b:含载脂蛋白b的lox-1配体)。本说明书中,只要不特别说明,将氧化ldl或变性ldl表述为“lab”。因为在kd罹患患者中,血液中的lab的量有意义地增加,因此lab在本说明书作为kd罹患判定用标志物使用。
[0051]
本说明书中,所谓“kd罹患判定用标志物”由lab构成,是能够判定kd罹患的有无的生物标志物。
[0052]
1-3.构成
[0053]
本说明书的kd罹患判定试剂盒包含lab捕获器作为必须构成要件,另外包括lab检测剂作为选择性构成要件。以下,对于各构成要件具体进行说明。
[0054]
1-3-1.lab捕获器
[0055]
本说明书中,“lab捕获器”具备基材、和固相化于其表面的lox-1蛋白质和/或其一部分。
[0056]
(1)基材
[0057]
本发明中,“基材”是用于将lox-1蛋白质和/或其一部分固相化的固相载体。
[0058]
基材的材质只要是至少在其表面能够直接或间接地固相化lox-1蛋白质和/或其一部分的材质即可。虽然不限定,但期望为非水溶性材料。例如,塑料、玻璃、金属、陶瓷、天然树脂(例如,天然橡胶或漆)、天然纤维或者化学纤维或它们的集合体(例如,纸、无纺布、过滤器)、琼脂这样的多糖类高分子(例如,琼脂)、凝胶化蛋白质(例如,明胶、胶原)、或它们的混合物。选择哪种材质,根据lab的测定方法适当选择即可。例如,用elisa法、荧光法、或比色法等酶联免疫测定法进行测定时,虽然不限定,但从成本面、加工面和操作等理由优选塑料、玻璃。透明材料是合适的。作为塑料,具体可以利用例如,聚氯乙烯、聚偏1,1-二氯乙烯、聚苯乙烯、聚氨基甲酸酯、聚砜、聚碳酸酯、共聚芳酯、聚酰胺、聚乙烯醇等。另外,在用spr测定传感器、qcm测定传感器等测定的情况下,优选构成传感器芯片的金(au)、铂(pt)、银(ag)、铜(cu)等金属。
[0059]
基材的形状可以根据本发明的试剂盒的用途而适当确定。作为形状例,可列举板(plate,包含96孔微量滴定板等的方形)、盘、管、棒、珠、平板、或试验片等。在珠表面形成的情况下,基材可以制成直径约1μm~约1cm的大小的球体。进而,例如,如果将本发明的试剂
盒在spr测定传感器的传感器芯片中使用,则基材制成适合所使用的spr测定传感器的形状即可。
[0060]
基材可以制成由二种以上的材质组成的多层结构体。例如,在玻璃表面叠层有金薄膜的基材。这样在基材具有多层结构的情况下,至少构成基材表面的层必须是能够将lox-1蛋白质和/或其一部分固相化的材质。
[0061]
所谓“基材表面”,是指能够与从受检体采集的血液试样直接接触的基材部分。因此,基材表面根据所使用的基材的形状而变化。例如,在基材是载玻片这样的平板状的形状的情况下,基材表面是表面、背面和/或侧面。另外,在基材是管形状的情况下,基材表面是管外面、内面和截面。进而,在基材是球体形状的情况下,基材表面一般是球体外表面,但在基材具有内部空间、该内部空间对外界一部分开放的情况下,也包含内部表面。例如,基材是中空珠的情况、多孔状材料的情况。
[0062]
所谓“固相化于基材表面”,是指在基材表面固定肽。这里所说的肽,在本说明书中,特别是lox-1蛋白质和/或其一部分。固相化的方法不限定。可列举例如,化学吸附、物理吸附、或亲和力。化学吸附包括共价键或离子键这样的化学键。另外,物理吸附包含范德华力。
[0063]
(2)lox-1蛋白质
[0064]
本说明书中的lox-1蛋白质是作为存在于血液试样中的kd罹患判定用标志物的lab的受体蛋白质。因此,lox-1蛋白质通过受体-配体活性而具有lab结合能力。本说明书中,所谓“受体-配体活性”,是指在配体与其受体之间产生的蛋白质之间的特异性的结合亲和活性。因此,在lab捕获器中,lox-1蛋白质和后述的其一部分通过受体-配体活性而与lab结合,作为用于检测的捕获体发挥功能。
[0065]
本说明书中的lox-1蛋白质只要不特别说明就指人lox-1蛋白质。lox-1蛋白质包含野生型和突变型。“野生型lox-1蛋白质”具体地是包含序列号2所示的氨基酸序列的人lox-1蛋白质。另外,“突变型lox-1蛋白质”是在野生型lox-1蛋白质的一部分发生了突变的多肽,并且是保持了与lab的结合能力的多肽。突变型lox-1蛋白质可列举例如,在序列号2所示的氨基酸序列中添加、缺失、或替换了1个或者多个氨基酸的多肽,或者相对于序列号2所示的氨基酸序列具有90%以上、91%以上、92%以上、93%以上、94%以上、95%以上、96%以上、97%以上、98%以上、或99%以上的氨基酸同一性的多肽。虽然不限定,但具体可列举剪接变体、基于snips等的突变体等。
[0066]
本说明书中,“多个”是指例如,2~20个、2~15个、2~10个、2~7个、2~5个、2~4个或2~3个。另外,所谓“氨基酸同一性”,是指在要比较的2个多肽的氨基酸序列中,以氨基酸残基的一致数为最大限的方式,根据需要在一方或双方中适当插入间隙而排列(比对)时,总氨基酸残基数中的一致氨基酸残基数的比例(%)。用于计算氨基酸同一性的2个氨基酸序列的排列可以使用blast、fasta、clustalw等已知程序进行。
[0067]
本说明书中,所谓“(氨基酸的)替换”,是指在构成天然蛋白质的20种氨基酸之间,电荷、侧链、极性、芳香族性等性质类似的保守性氨基酸组内的替换。可列举例如,具有低极性侧链的无电荷极性氨基酸组(gly,asn,gln,ser,thr,cys,tyr)、支链氨基酸组(leu,val,ile)、中性氨基酸组(gly,ile,val,leu,ala,met,pro)、具有亲水性侧链的中性氨基酸组(asn,gln,thr,ser,tyr,cys)、酸性氨基酸组(asp,glu)、碱性氨基酸组(arg,lys,his)、芳
香族氨基酸组(phe,tyr,trp)内的替换。已知只要是这些组内的氨基酸替换,则多肽的性质不易发生变化,因此优选。
[0068]
此外,lox-1蛋白质可以是重组lox-1蛋白质。所谓“重组lox-1蛋白质”,是使编码通过基因克隆技术而得的lox-1蛋白质的基因(lox-1基因),在使用宿主细胞的基因表达体系中表达而得的蛋白质。本说明书中的lox-1基因只要不特别说明就是人lox-1基因。lox-1基因也包含野生型和突变型。野生型人lox-1基因是编码包含序列号2所示的氨基酸序列的人lox-1蛋白质的基因。具体可列举包含序列号1所示的碱基序列的多核苷酸。“突变型lox-1基因”是指包含编码前述的突变型lox-1蛋白质的碱基序列的多核苷酸。重组lox-1蛋白质可以基于该领域的常规方法使lox-1基因在宿主细胞内表达而制备,也可以使用市售的重组lox-1蛋白质。
[0069]
(3)其一部分
[0070]
所述“其一部分”是所述lox-1蛋白质的部分片段,并且是保持了利用受体-配体活性的lab结合能力的区域。虽然不限定,但作为具体的例子,可列举可溶型lox-1蛋白质。
[0071]
所谓“可溶型lox-1蛋白质”(soluble form of lox-1 protein:本说明书中有时表述为“slox-1蛋白质”),是指包含lox-1蛋白质的细胞外区域的肽片段。lox-1蛋白质已知在存在于细胞外结构域的n末端侧的颈区(neck domain)存在蛋白酶感受性高的部位,在该部位被切断的情况下,细胞外区域成为游离状态而被释放到细胞外,出现在血液中。slox-1蛋白质由于具有与lab的结合区域,因而保持着与全长lox-1同样的lab结合能力。slox-1蛋白质如果是野生型,则可列举例如,在序列号2所示的lox-1蛋白质的氨基酸序列中,包含相当于61位~273位的由序列号3所示的氨基酸序列组成的213个氨基酸、相当于91位~273位的由序列号4所示的氨基酸序列组成的183个氨基酸、或相当于94位~273位的由序列号5所示的氨基酸序列组成的180个氨基酸的多肽。另外,如果是包含突变型lox-1蛋白质的细胞外区域的肽片段,则可列举例如,在序列号3~5的任一项所示的氨基酸序列中添加、缺失、或替换了1个或者多个氨基酸的多肽、或相对于序列号3~5的任一项所示的氨基酸序列具有90%以上、91%以上、92%以上、93%以上、94%以上、95%以上、96%以上、97%以上、98%以上、或99%以上的氨基酸同一性的多肽。
[0072]
上述其(lox-1蛋白质的)一部分可以使重组lox-1蛋白质的一部分。这样的重组lox-1蛋白质的一部分可以通过例如,使编码lox-1蛋白质中的所期望的区域的lox-1基因片段在基因表达体系中表达,从而获得。
[0073]
本发明的kd罹患判定试剂盒所包含的lab捕获器具有在基材表面上固相化有lox-1蛋白质的构成。因此,在lab捕获器中使用的lox-1蛋白质,与经由跨膜结构域而固定于生体膜的全长lox-1相比,像slox-1蛋白质这样为游离状态、并且保持lab结合能力的lox-1蛋白质的部分片段更加适合。
[0074]
1-3-2.lab检测剂
[0075]
所谓“lab检测剂”,是指对lab具有特异性的结合能力的药剂。lab检测剂可以由肽、核酸、低分子化合物、或其组合的任一者构成。
[0076]
(1)肽
[0077]
在lab检测剂由肽构成的情况下,作为其具体例,虽然不限定,但可列举抗体及其活性片段、肽适配体、和lab受体蛋白质等。
[0078]
(i)抗体及其活性片段
[0079]
能够作为lab检测剂使用的抗体,是指以lab作为抗原,能够与其免疫学且特异性地结合的抗lab抗体、和其具有lab结合能力的片段。
[0080]
抗体的来源生物种不特别限定。可以是包含哺乳动物和鸟类的动物来源。所述动物可列举例如,小鼠、大鼠、豚鼠、兔、山羊、驴、绵羊、骆驼、马、鸟或人等。
[0081]
抗体的种类可以使用多克隆抗体、单克隆抗体、重组抗体、合成抗体、及其组合的任一者。
[0082]“多克隆抗体”是指识别同一抗原的不同的表位而结合的多种免疫球蛋白群。多克隆抗体可以以靶标分子(这里为lab)作为抗原免疫动物,然后从该动物的血清获得。以lab作为抗原获得的多克隆抗体在本说明书中表述为“抗lab多克隆抗体”。
[0083]“单克隆抗体”是指单一免疫球蛋白的克隆群。构成单克隆抗体的各免疫球蛋白包含共同的框架区(frame work region:以下表述为“fr”)和共同的互补决定区(complementarity determining region:以下表述为“cdr”),能够识别同一抗原的同一表位并与其结合。单克隆抗体可以从单一细胞来源的杂交瘤获得。以lab作为抗原而得的单克隆抗体在本说明书中表述为“抗lab单克隆抗体”。
[0084]
典型的免疫球蛋白分子,是被称为重链和轻链的2条多肽链为一组、作为通过二硫键而2组彼此连接而成的四聚体而构成的。重链包含n末端侧的重链可变区(h链v区:以下表述为“vh”)和c末端侧的重链恒定区(h链c区:以下表述为“ch”),轻链包含n末端侧的轻链可变区(l链v区:以下表述为“vl”)和c末端侧的轻链恒定区(l链c区:以下表述为“cl”)。其中,vh和vl在参与抗体的结合特异性的方面特别重要。该vh和vl均包含约110个氨基酸残基,其内部从n末端侧起按照fr1、cdr1、fr2、cdr2、fr3、cdr3、和fr4的顺序依次具有直接参与与抗原的结合特异性的3个cdr(cdr1、cdr2、cdr3)、和作为可变区的骨架结构发挥功能的4个fr(fr1、fr2、fr3、fr4)。已知cdr形成与抗原分子互补的立体结构,决定抗体的特异性(e.a.kabat et al、1991、sequences of proteins of immunological interest、vol.1、eds.5、nih publication)。可变区中,所述cdr和fr从n末端向c末端方向按照fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4的顺序排列。在免疫球蛋白分子内,vl和vh通过相对地形成二聚体而形成抗原结合部位。
[0085]
在抗体是多克隆抗体或单克隆抗体的情况下,免疫球蛋白分子中已知igg、igm、iga、ige、和igd的各类别,本发明的抗体可以是任意类别。优选为igg。
[0086]
制作产生识别lab或其肽片段而结合的单克隆抗体的杂交瘤的具体的方法,依照该领域公知的抗体制作方法进行即可。
[0087]
本说明书中,“重组抗体”包含嵌合抗体、人源化抗体、或多特异性抗体。“嵌合抗体”是将不同的动物来源的抗体的氨基酸序列组合而制作的抗体,是指将某抗体的v区用其他抗体的v区替换而得的抗体。例如,将与人lab特异性地结合的小鼠来源的抗人lab单克隆抗体的v区替换成人抗体的v区,v区为小鼠来源、并且c区为人来源的抗体。所谓“人源化抗体”,是将来源于人以外的哺乳动物、例如与人lab特异性地结合的小鼠的抗人lab单克隆抗体的v区中的cdr(cdr1、cdr2、cdr3)替换成人单克隆抗体的cdr而得的移植抗体。“多特异性抗体”是指在多价抗体、即一分子内具有多个抗原结合部位的抗体中,各个抗原结合部位与不同的表位结合的抗体。例如,如果是像igg这样具有2个抗原结合部位的抗体,则可列举各
个抗原结合部位与第1方案所记载的相同或不同的lab特异性地结合的双特异性抗体(bispecific抗体)。
[0088]
本说明书中,“合成抗体”是指通过使用化学方法或重组dna法而合成的抗体。例如,是介由具有适当的长度和序列的连接物肽等使特定抗体的一个以上的vl与一个以上的vh人工地连接而成的单体多肽分子、或其多聚体多肽。作为这样的多肽的具体例,可列举单链fv(scfv:single chain fragment of variable region)(参照pierce catalog and handbook,1994-1995,pierce chemical co.,rockford,il)、双特异性抗体(diabody)、三特异性抗体(triabody)或四特异性抗体(tetrabody)等。在免疫球蛋白分子中,vl和vh通常位于分别的多肽链(l链和h链)上。“单链fv”是具有将这2个多肽链上的v区通过充分长度的柔性连接物连接,从而包含在1条多肽链中的结构的合成抗体片段。在单链fv内中,两个v区可以彼此自组装而形成1个功能性的抗原结合部位。单链fv可以通过将编码其的重组dna使用公知技术插入噬菌体基因组中使其表达而获得。“双特异性抗体”是以单链fv的二聚体结构为基础、具有2个功能性的抗原结合部位的分子(holliger et al.,1993,proc.natl.acad.sci.usa 90:6444-6448)。例如,在上述连接物的长度短于12个氨基酸残基的情况下,单链fv内的2个可变部位在结构上不能自组装化。但是,通过形成双特异性抗体而使2个单链fv彼此相互作用,从而一条fv链的vl能够与另一条fv链的vh组装,形成2个功能性的抗原结合部位(marvin et al.,2005,acta pharmacol.sin.26:649-658)。进而,通过在单链fv的c末端添加半胱氨酸残基,从而2条fv链彼此可以形成二硫键,也能够形成稳定的双特异性抗体(olafsen et al.,2004,prot.engr.des.sel.17:21-27)。这样双特异性抗体是二价的抗体片段,但各个抗原结合部位不需要与同一表位结合,也可以具有分别识别不同的表位而特异性地结合的双特异性。“三特异性抗体”和“四特异性抗体”与双特异性抗体同样地,具有以单链fv结构为基本的其三聚体、和四聚体结构。分别为三价、和四价的抗体片段,也可以是多特异性抗体。
[0089]
本说明书中,“其活性片段”是所述多克隆抗体或单克隆抗体的部分片段,是指具有与该抗体所具有的抗原特异性的结合活性实质上同等的活性的多肽链或其复合物。例如,是包含至少1个抗原结合部位的抗体部分、即具有至少1组的vl和vh的多肽链、或其复合物。作为具体例,可列举将免疫球蛋白用各种肽酶切断而产生的多个具有充分的特征的抗体片段等。作为更具体的例子,可列举fab、f(ab’)2、fab’等。fab是igg分子被木瓜蛋白酶在铰链部的二硫键的n末端侧切断而产生的片段,由包含构成vh和ch的3个结构域(ch1、ch2、ch3)中与vh相邻的ch1的多肽、和轻链构成。f(ab’)2是igg分子被胃蛋白酶在铰链部的二硫键的c末端侧切断而生成的fab’的二聚体。fab’与fab相比仅包含铰链部而h链稍长,但实质上具有与fab同等的结构(fundamental immunology,paul ed.,3d ed.,1993)。fab’可以通过将f(ab’)2在温和条件下还原,将铰链区域的二硫键连接切断而获得。这些抗体片段均包含抗原结合部位,具有与作为抗原的靶标分子特异性地结合的能力。
[0090]
(ii)肽适配体
[0091]“适配体”是具有通过立体结构而与靶标物质牢固且特异性地结合的能力的配体分子。根据构成适配体的分子的种类,可以大致区分为核酸适配体和肽适配体。
[0092]“肽适配体”是由氨基酸构成的适配体,是指与抗体同样地识别靶标分子的表面结构,能够通过立体结构而与靶标物质特异性地结合的1~6kd的肽分子。本说明书中的肽适
配体以lab作为靶标分子。肽适配体可以使用噬菌体展示法、细胞表层展示法来制造。肽适配体的制造方法基于该领域公知的方法制作即可。例如,参照whaley,s.r.,et al.,2000,nature,405,665-668。
[0093]
(iii)lab受体蛋白质
[0094]“lab受体蛋白质”可列举前述的lox-1蛋白质或其具有lab结合能力的片段。关于lox-1等,之前已经详细叙述,因此这里省略说明。
[0095]
(2)核酸
[0096]
在lab检测剂由核酸构成的情况下,作为其具体例不限定,但可列举核酸适配体。
[0097]
(i)核酸适配体
[0098]“核酸适配体”是指所述适配体中由核酸构成的适配体。构成核酸适配体的核酸可以是dna、rna或它们的组合的任一者。根据需要,可以包含pna、lna/bna、甲基磷酸酯型dna、硫代磷酸酯型dna、2
’‑
o-甲基型rna等的化学修饰核酸。
[0099]
核酸适配体可以以lab作为靶标分子,通过该领域公知的方法来制作。例如,如果是rna适配体,则可以使用selex(systematic evolution of ligands by exponential enrichment)法通过试验管内分选来制作。selex法,是将从由具有随机序列区域和在其两端的引物结合区域的多个rna分子构成的rna池中选择与lab结合的rna分子,回收后通过rt-pcr反应扩增,然后以所得的cdna分子作为模板进行转录,以其作为下一回合的rna池这样的一系列的循环重复数~数十回合,选择对lab结合力更强的rna的方法。随机序列区域和引物结合区域的碱基序列长不特别限定。一般随机序列区域为20~80碱基、引物结合区域分别为15~40碱基的范围。利用通过以上方法最终获得的rna分子作为lab结合性rna适配体。此外,selex法是公知的方法,具体的方法依照例如pan等(proc.natl.acad.sci.1995,u.s.a.92:11509-11513)进行即可。
[0100]
上述的lab检测剂均可以根据需要进行标记化。标记利用该领域公知的标记物质即可。在抗体和肽适配体的情况下,例如,可以通过荧光色素(荧光素、fitc、罗丹明、德州红、cy3、cy5)、荧光蛋白质(例如,pe、apc、gfp)、酶(例如,辣根过氧化物酶、碱性磷酸酶、葡萄糖氧化酶)、放射性同位素(例如,3h、
14
c、
35
s)或生物素或者(链霉)抗生物素蛋白来标记。另外,在核酸适配体的情况下,可列举例如,放射性同位素(例如,
32
p、3h、
14
c)、dig、生物素、荧光色素(例如,fitc、texas、cy3、cy5、cy7、fam、hex、vic、joe、rox、tet、bodipy493、nbd、tamra)、或发光物质(例如,吖啶酯)。标记可以是二种以上的不同的标记。被标记物质标记的lab检测剂可以成为在检测lab时有用的工具。
[0101]
2.川崎病罹患判定方法(kd罹患判定方法)
[0102]
2-1.概要
[0103]
本发明的第2方案是kd罹患判定方法。本发明如下构成:对于受检体的血液试样中所包含的第1方案所记载的作为kd罹患判定用标志物的lab,使用作为其捕获体的lox-1蛋白质和/或其一部分进行检测,通过其量的多寡来进行受检体的kd罹患判定。根据本发明的kd罹患判定方法,能够将到目前为止对怀疑患有kd的受检者不得不依赖于临床表现和排除诊断的kd诊断,直接且客观地判定kd罹患的有无。
[0104]
2-2.方法
[0105]
本发明的kd罹患判定方法包含测定工序和判定工序。以下,对于各工序具体进行
说明。
[0106]
2-2-1.测定工序
[0107]“测定工序”是指为了对于从怀疑患有kd的受检体采集的血液试样的每单位量所包含的lab进行定量,而测定其量获得测定值的工序。
[0108]
本说明书中,“受检体”是指供于本发明的kd罹患判定方法的动物个体。为了供于本发明的kd罹患判定方法,可列举例如,人、狗、猫、马、牛、绵羊、山羊、骆驼、兔、雪貂、仓鼠、小鼠等哺乳动物。优选为人。受检体优选为怀疑患有kd的个体。
[0109]
本说明书中,“怀疑患有kd的受检体”是从临床表现等呈现kd患者所见的症状的受检体,作为原则是指被医生等诊断为有该怀疑的个体。本说明书中,特别是指急性期、亚急性期、和慢性期的kd患者,对于已经不能看到症状的进入了恢复期的个体,作为kd恢复者或原kd患者与kd患者进行区别。诊断主要组合问诊、临床经验、身体诊察所见、和肌肉病理所见等来进行。
[0110]
本说明书中,“健常体”是至少明显未患kd的非kd罹患个体,作为原则,是指被医生等诊断为非kd的、与受检体同种的个体。优选为未患任何疾病的个体。
[0111]
本说明书中,“健常体组”是指由多个同种健常体组成的一组。个体数只要为2个体以上就不特别限定,优选为5个体以上、更优选为10个体以上、进一步优选为15个体以上。构成该个体组的各个体与受检体为同种,另外优选为同性、且年龄、身高、和体重等的各种身体条件也与受检体相同或近似。
[0112]“健常体组中的测定值”是指对由构成健常体组的各个体采集的血液试样的每单位量所包含的kd罹患判定用标志物、即lab的量进行测定而得的测定值。该测定值作为原则,是在所述测定工序中,使用与获得kd罹患受检体的测定值的方法同样的血液试样,通过相同的测定方法得到的测定值。健常体组中的测定值也可以使用预先将试样中的各kd罹患判定用标志物量用各测定方法测定时的测定值数据库化而得的值。
[0113]
本说明书中,“血液试样”是全血、血清、血浆、或间质液。
[0114]
本说明书中,“采集的血液试样”是指从受检体和后述的健常体组各自采集的血液试样。采集方法是已知的采血方法即可,不特别限定。例如,可以在外周部的静脉等进行注射而采集外周血。血液试样可以在采集后直接在判定方法中使用,但也可以将采集后进行冰冷却、通过离心处理而得的血清、血浆在超低温槽中保存,在需要时解冻而使用。另外,在本工序前、本工序时可以根据需要进行浓缩或者用生理盐水等稀释,或者也可以添加肝素这样的血液凝固抑制剂。
[0115]“单位量”是体积或重量的规定的单位,可列举例如,微升(μl)、毫升(ml)、微克(μg)、毫克(mg)、克(g)等。
[0116]
本说明书中,“测定值”是本工序中测定的显示lab的量的值。该量可以是用荧光强度、发光强度、浊度、吸光度、反射线量、离子强度、或浓度表示的相对量,也可以是试样中包含的lab的重量或体积这样的绝对量。
[0117]
本工序中,测定作为受检体来源的血液试样中所包含的kd罹患判定用标志物的lab的量。
[0118]
关于供于本发明的kd罹患判定方法所需要的血液试样的量,在使用全血的情况下,可以为至少100μl、优选为200μl。另外,在使用血清、血浆的情况下,可以为至少50μl、优
选为100μl。
[0119]
(1)测定方法
[0120]
lab是脂蛋白。因此,其测定方法使用公知的脂蛋白定量方法即可,不特别限定。可列举例如,免疫检测法、受体-配体结合分析法、适配体分析法、凝胶过滤hplc法、质量分析法、或其组合。
[0121]
(i)免疫检测法
[0122]“免疫检测法”是以靶标分子作为抗原,使用与其特异性地结合的抗体或其片段,形成与靶标分子的免疫复合物,检测和定量靶标分子的最一般的方法。本发明中,lab是靶标分子,因而是指使用抗lab抗体或其片段来测定血液试样中所包含的lab的量的方法。
[0123]
免疫检测法可列举例如,酶联免疫测定法、荧光免疫测定法、发光免疫测定法、表面等离子体共振法(spr法)、石英微晶体天秤(qcm)法、放射免疫测定法(ria)、免疫比浊法、胶乳凝集免疫测定法、胶乳比浊法、粒子凝集反应法、胶体金法、毛细管电泳法、蛋白质印迹法或免疫组织化学法(免疫染色法)。这些方法均为公知的方法,作为原则依照该领域中的通常的方法进行即可。可以参照例如,current protocols in protein sciences,1995,john wiley&sons inc.;current protocols in immunology,2001,john wiley&sons inc.;green&sambrook,molecular cloning,2012,fourth ed.,coldspring harbor laboratory press cold spring harbor,new york;日本临床病理学会编《臨床病理臨時増刊特集第53号,臨床検査
のためのイムノアッセイ
-技術
と
応用-》,临床病理刊行会,1983年;石川荣治等编《酵素免疫測定法》,第3版,医学书院,1987年;北川常广等编《
タンパク
質核酸酵素別冊no.31酵素免疫測定法》,共立出版,1987年;入江宝编《
ラジオイムノアッセイ
》,講談社
サイエンティフィク
,1974年;入江宝编《続
ラジオイムノアッセイ
》,講談社
サイエンティフィク
,1979年;永田和宏、半田宏编,生体物質相互作用
のリアルタイム
解析実験法,
シュプリンガー
·
フェアラーク
東京,1988年;森泉丰荣、中本高道,
センサ
工学,昭晃堂,1997年等所记载的方法。
[0124]“酶联免疫测定法”是将与靶标分子结合了的一抗经由被标记的二抗等进行检测,根据由该标记产生的显色浓度、荧光强度而定量靶标分子的方法。可列举例如,将作为与lab结合了的一抗的抗lab抗体,用与该一抗结合的标记化二抗捕获,基于来自标记的信号强度等间接地测定lab的方法。elisa法、夹心elisa法也包含在该方法中。
[0125]“表面等离子体共振(spr:surface plasmon resonance)法”是利用如果使向金属薄膜照射的激光的入射角度变化,则在特定的入射角度(共振角)反射光强度显著衰减这样的表面等离子体共振现象,高灵敏度地检测、定量金属薄膜表面上的吸附物的方法。本发明中,例如,将lox-1蛋白质或抗lab抗体在金属薄膜表面固相化,将其他金属薄膜表面部分封闭处理,然后使血液试样在金属薄膜表面流通,从而由样品流通前后的测定值的差异,检测、定量lab。利用表面等离子体共振法的检测、定量例如,可以利用由biacore社市售的spr传感器来进行。
[0126]“石英微晶体天秤(qcm:quarts crystal microbalance)法”是利用安在水晶振荡器上的电极表面如果吸附了物质,则根据其质量而水晶振荡器的共振频率数减少的现象,通过共振频率数的变化量来定量地捕获极微量的吸附物的质量测定法。利用本方法的检测、定量也与spr法同样地,可以利用市售的qcm传感器检测、定量靶标分子。本发明中,例
如,通过在电极表面固相化了的lox-1蛋白质或抗lab抗体与试样中的lab的抗原抗体反应来定量lab。
[0127]
(ii)受体-配体结合分析法
[0128]“受体-配体结合分析法”是在靶标分子是配体或受体的情况下能够应用的方法,利用受体-配体活性,使用其中一者来捕获在试样中存在的另一者,测定其量的方法。作为本发明的靶标分子的lab是配体分子,由于其特异性的受体是lox-1蛋白质,因而也可以应用本方法。作为具体的方法,可列举例如,将在免疫检测法中使用的酶联免疫测定法、荧光免疫测定法、发光免疫测定法、放射免疫测定法(ria)、表面等离子体共振法(spr法)、石英微晶体天秤(qcm)法、免疫比浊法、胶乳凝集免疫测定法、胶乳比浊法、粒子凝集反应法、胶体金法等进行了改变的方法。例如,可以将lox-1蛋白质或其具有lab结合能力的片段在基材进行固相化,测定与血液试样中的lab结合而形成的蛋白质复合物(受体-配体复合物)。可以根据酶联免疫测定法,通过将基材上的lab-lox-1蛋白质复合物用标记化抗lab抗体进行检测的改变夹心elisa法而间接地测定。另外,如果是spr法、qcm法,则可以直接测定在金属薄膜表面上、或电极表面上形成的lab-lox-1蛋白质复合物。
[0129]
(iii)适配体分析法
[0130]“适配体分析法”是使用核酸适配体或肽适配体定量靶标分子的方法。基本的方法只要将前述的免疫检测方法中的抗原结合性抗体变成与靶标分子特异性地结合的适配体即可。本发明中,将lab结合适配体(lab结合rna适配体、lab结合dna适配体、lab结合肽适配体)与免疫检测方法中的抗lab抗体同样地使用,检测、测定血液中的lab即可。
[0131]
(iv)质量分析方法
[0132]“质量分析法(mass spectrometry)”是将试样在高真空下离子化,电磁地分离其离子而分析试样中的物质的方法。在试样中的应检测的靶标分子明确的情况下,将以该靶标分子为标准品的质谱与试样的质谱进行比较,从而进行所关注的靶标分子的检测和定量。本发明中,lab相当于该靶标分子。
[0133]“质量分析法”可列举高速液相色谱质量分析法(lc-ms)、高速液相色谱串联质量分析法(lc-ms/ms)、气相色谱质量分析法(gc-ms)、气相色谱串联质量分析法(gc-ms/ms)、毛细管电泳质量分析法(ce-ms)和icp质量分析法(icp-ms)。
[0134]
本工序中,为了修正受检体的测定值、和健常体组中的测定值,可以测定期待在每单位量的试样中没有量的差异的公知的蛋白质作为内标。作为这样的内标用,可列举例如白蛋白。
[0135]
2-2-2.判定工序
[0136]“判定工序”是基于所述测定工序中获得的受检体的测定值,判定该受检体中的kd罹患的有无的工序。
[0137]
所谓“基于受检体的测定值”,是指作为所述测定工序的结果的“根据受检体的测定值的值”这样的含义,具体可列举例如,基于截止值,或基于受检体的测定值与健常体组中的测定值的统计学的显著性差异,判定受检体的kd罹患的有无。
[0138]
(i)基于截止值的判定方法
[0139]
所谓“基于截止值的判定方法”,是指将所述受检体的测定值与规定的截止值进行比较,根据其比较结果来判定kd的罹患的有无的方法。
[0140]
本说明书中,“截止值”是用于将测定值分类为阳性、阴性的边界值。这里所谓阳性,表示患有kd的可能性高,另外阴性表示患有kd的可能性低。截止值的设定法按照统计学领域公知的方法即可,不特别限定。例如,在由kd患者和健常体的测定值组成的测定值组中,可以以特定的百分位数作为截止值。例如,kd患者的几乎全部测定值包含在高于相当于所述测定值组中的90百分位数的测定值的值中的情况下,相当于90百分位数的测定值成为截止值。此时,在受检体的测定值高于截止值的情况下,可以判定受检体为阳性、即kd罹患的可能性高,相反在受检体的测定值为截止值以下的情况下,可以判定受检体为阴性、即kd罹患的可能性低。
[0141]
(ii)基于统计学的显著性差异的判定方法
[0142]
基于统计学的显著性差异的判定方法通过是否受检体的测定值比所述健常体组的测定值统计学上显著地高,来判断受检体的kd罹患的有无。
[0143]
本说明书中“统计学上显著”可列举所得的值的风险率(显著性水平)小的情况,具体为p<0.05(小于5%)、p<0.01(小于1%)或p<0.001(小于0.1%)的情况。这里,“p(值)”表示在统计学的检验中,统计量在假定的分布中,假定偶然变为正确的概率。因此,p值越小,意味着假定越接近真实。“有统计学上的显著性差异”,是指在统计学地处理受检体的测定值与个体群的测定值的差异时,两者之间有显著性差异。统计学处理的检验方法只要使用能够判断显著性的有无的公知的检验方法即可,不特别限定。例如,可以使用学生t检验法。
[0144]
本说明书中在基于统计学的显著性差异而判定kd的罹患时,在受检体中的kd罹患判定用标志物的测定值显著地大于健常体组中的其测定值的情况下,判定该受检体患有kd的可能性高。另一方面,在受检体中的kd罹患判定用标志物的测定值与健常体组中的其测定值之间没有显著性差异的情况下,判定该受检体未患kd的可能性高。
[0145]
3.川崎病罹患判定用标志物(kd罹患判定用标志物)
[0146]
3-1.概要
[0147]
本发明的第3工序是kd罹患判定用标志物。本发明的kd罹患判定用标志物使用lab作为kd罹患判定用的生物标志物。通过使用第2方案所记载的kd罹患判定方法测定受检体的血液试样中所包含的该标志物的量,从而可以判定受检体的kd的罹患的有无。
[0148]
3-2.构成
[0149]
kd罹患判定用标志物由lab或其保持lox-1结合能力的一部分构成。
[0150]
lab如前所述,是也被称为氧化ldl(变性ldl)的载脂蛋白,作为蛋白质成分包含载脂蛋白b(apob)。本说明书中的apob只要不特别说明就是人apob。apob包含野生型和突变型。野生型apob具体是包含序列号6所示的氨基酸序列的多肽。另外,本说明书中的突变型apob是野生型apob的一部分发生了突变的多肽,并且是保持了与lox-1的结合能力的多肽。突变型apob不限定,但可列举例如,在序列号6所示的氨基酸序列中添加、缺失、或替换了1个或者多个氨基酸的多肽、或相对于序列号6所示的氨基酸序列具有90%以上、91%以上、92%以上、93%以上、94%以上、95%以上、96%以上、97%以上、98%以上、或99%以上的氨基酸同一性的多肽。
[0151]
lab的一部分只要具有与lox-1的结合能力,就对其区域、氨基酸长度不特别限定。
[0152]
实施例
[0153]
(目的)
[0154]
在kd罹患患者中,对于血浆中存在的氧化ldl(lab)的量与健常者相比有意义地增加,使用作为lab受体的lox-1蛋白质进行验证。
[0155]
(方法)
[0156]
(1)试样的制备
[0157]
(血液试样的制备)
[0158]
从按照kd诊断指南(ayusawa,m.,et al.,2005,pediatr int 47:232-234)被诊断为kd的16名kd患者,在获得了知情同意之后采集血液。作为对照用,从通常对照者5名、和疾病对照者7名也同样地采集血液。这里,“通常对照者”是指虽然有食物变态反应的既往史,但无感染症的无热的对照者,另外“疾病对照者”是指肺炎、肠胃炎、细菌感染症、病毒感染症(人偏肺病毒、rs病毒)等有热性疾病患者。
[0159]
由各患者的血液采集在静脉内免疫球蛋白(ivig)疗法应用之前的急性期进行。对于8名患者,进行ivig疗法,在症状解除1个月之后作为追踪试样再次采集等量的血液。
[0160]
在cbcspitz管(edta2na)中采集1~1.5ml血液,立即离心分离,然后回收上清,获得血浆。所回收的血浆在-30℃保存至使用。
[0161]
(重组可溶性lox-1蛋白质溶液的制备)
[0162]
通过受体-配体活性,来制备用于捕获血浆中的lba的lox-1蛋白质。本实施例中,将由序列号3所示的氨基酸序列组成的人来源的重组可溶型lox-1(slox-1)蛋白质(横浜
バイオリサーチアンドサプライ
社)用pbs(-)稀释至最终浓度5μl/ml,然后使用。重组slox-1蛋白质相当于序列号3所示的氨基酸序列第61位~273位,维持着与lab的受体-配体活性。
[0163]
(封闭溶液的制备)
[0164]
将block ace粉末(
ケーエーシー
社)和蔗糖分别溶解于蒸馏水中,制备4%block ace溶液和30%蔗糖溶液。在制作slox-1固相化板的前一天以4%block ace:蒸馏水:30%蔗糖=9.0ml:2.2ml:0.8ml(=基本比率)制备封闭液(3%block ace、2%蔗糖)。
[0165]
(抗体溶液的制备)
[0166]
将hrp标记化鸟抗人载脂蛋白单克隆抗体(huc20:creative biolabs)溶解在pbs中,制备hrp(horse radish peroxidase)标记化抗载脂蛋白b抗体溶液(hrp-huc20抗体溶液)。hrp-huc20抗体特异性地识别人载脂蛋白b的细胞外结构域,经hrp标记化。
[0167]
(2)slox-1固相化板的制作
[0168]
在96孔微量板(株式会社
パーキンエルマージャパン
)的各孔中分注100μl的重组slox-1蛋白质溶液,用板振荡器(ika(注册商标)japan k.k.)以1000rpm搅拌3分钟。然后,将板密封,在4℃放置16小时以上。时间过去后将封条剥离,用380μl的洗涤液(
タカラバイオ
社)将孔洗涤1次。除去洗涤液后,将300μl的封闭溶液分注在孔中,将板再次密封,在4℃放置18~24小时。时间过去后将封条剥离,将封闭溶液吸引除去,然后在超净工作台内以室温(25~26℃)将板干燥18~24小时。干燥之后将板作为slox-1固相化板。
[0169]
(3)利用酶联免疫测定法的lab的血浆水平的测定
[0170]
(slox-1与lab的结合)
[0171]
将(2)中制作的slox-1固相化板的各孔在使用之前用380μl的洗涤液(
タカラバイオ
社)洗涤3次,充分除去水分之后,在各孔中各分注血浆试样(急性期kd患者来源、恢复期
元kd患者来源、通常对照者来源、和疾病对照者来源)各100μl。将板密封后,在室温孵育2小时。除去血浆试样之后,用380μl的洗涤液(
タカラバイオ
社)洗涤3次,充分除去水分。
[0172]
(lab的检测与定量)
[0173]
一边将(1)中制备的hrp标记化huc20抗体溶液以最终倍率成为420倍的方式用稀释液(0.4%block ace/pbs)稀释,一边在各孔中分注各100μl。将板密封,以1000rpm搅拌1分钟之后,在室温孵育1小时。接着除去抗体溶液,将各孔用380μl的洗涤液(
タカラバイオ
社)洗涤3次,充分除去水分。
[0174]
为了检测结合于lab的hrp标记化huc20抗体,作为发光液将supersignal
tm elisa pico chemiluminescent substrate(thermo fisher scientific社)所附带的peroxide solution与luminol/enhancer solution以1:1混合,然后在各孔中分注各100μl。用板振荡器以1000rpm搅拌1分钟之后,用酶标仪(infinite(注册商标)200pro:
テカンジャパン
株式会社)检测通过hrp活性而放出的发光,基于其光强度进行定量化。
[0175]
(结果)
[0176]
图1中显示结果。如该图所示,急性期的lab水平(acute)有意义地高于通常对照(control)和疾病对照(disease control)。另一方面,恢复期(convalescent)的lab水平没有确认到有意义性。将急性期的lab患者与通常对照的值通过roc进行比较,结果截止值为1.55。
[0177]
由上述结果表明,急性期中的kd患者的血液中,lab的量有意义地增加,而其在通过应用ivig疗法的kd的恢复中减少。即,这提示,血液中的lab能够成为kd罹患判定用的生物标志物。
[0178]
另外表明,检测血液中的lab时,slox-1蛋白质能够作为lab捕获体利用。
[0179]
本说明书中所引用的全部出版物、专利和专利申请均直接通过引用而纳入本说明书中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1