药物偶联的位点特异性定量的制作方法
药物偶联的位点特异性定量
发明领域
1.本发明一般涉及使用蛋白酶辅助药物解偶联和质谱分析对抗体-药物偶联物的药物偶联进行位点特异性定量或表征的方法。
背景技术:
2.抗体-药物偶联物(adc)包括具有生物活性药物附着物(通过连接子连接)的抗体,例如,药物有效载荷。因为抗体可以与靶细胞的特异性位点结合,从而将生物活性药物有效递送到靶细胞,所以adc的开发是提高药物疗效的一种策略。使用adc将化疗药物递送到靶向癌细胞已取得明显改善。
3.由于抗体的多价性质以及氨基酸与连接分子之间的非特异性亲电反应,adc的制备可能具有挑战性。adc的一般分布特征包括adc、非偶联抗体和非偶联药物有效载荷的混合物。由于非偶联抗体与药物偶联抗体竞争靶抗原,因此在存在非偶联抗体的情况下,可递送到靶细胞的药物量会减少。通常,衍生adc是包含各种adc的高度异质种类,其药物抗体比(dar)可变并且偶联位点繁杂,包括偶联的偶联位点和非偶联的偶联位点。由于存在不理想的adc种类,adc的异质性会对药物的安全性和疗效产生重大影响。理想的adc制剂应包括明确的dar和同质性程度。对dar可变的adc的位点特异性药物偶联进行定量和表征,例如药物偶联的位点特异性定量,是控制adc制剂质量属性的关键过程,这可能直接影响adc的疗效。
4.已经使用了质谱(ms)、液相色谱质谱联用(lc-ms)和成像毛细管等电聚焦(icief)对adc混合物进行表征(wagh等人,mabs,10:2,222-243,2018,抗体-药物偶联物分析表征的挑战与新前沿)。然而,由于adc异质性的复杂性,在对adc进行表征时,药物结合的位点特异性定量存在巨大挑战。
5.可以理解的是,需要对adc进行表征确保dar明确以及与药物安全性和疗效相关的同质性程度(特别是对于adc药物偶联物的位点特异性定量和/或表征)的方法。
技术实现要素:
6.本发明提供了一种对抗体-药物偶联物的药物偶联进行位点特异性量化和/或表征的方法,其中,偶联包括与样本中部分偶联肽或蛋白的特异性偶联位点连接的附着物。由于dar的广泛差异和抗体上的附着位置控制不良,用于药物-抗体偶联的连接化学反应可能存在一些问题。由此产生的adc可能是包含各种adc的高度异质混合物。量化不同位点的位点特异性药物偶联仍然是个挑战,理想的adc制剂应包括明确的dar和同质性程度。
7.本发明提供了一种对与样本中部分偶联肽或蛋白至少一个特异性偶联位点连接的至少一个附着物偶联进行量化或表征的方法,包括以下步骤:对部分所述至少一个附着物进行裂解,产生含有裂解连接子的肽或蛋白,其中,所述附着物包含裂解连接子;在所述部分偶联肽或蛋白的非偶联偶联位点增加修饰连接子;以及对样本进行质量分析,识别含有所述裂解连接子和/或所述修饰连接子的肽或蛋白。在某些方面,使用木瓜蛋白酶、组织蛋白酶b或纤溶酶对所述部分附着物进行裂解。
8.在某些方面,在本发明的所述方法中,所述至少一个附着物包含一个连接子和一个有效载荷,其中,所述附着物的裂解部分包含所述有效载荷,其中,所述连接子包含所述裂解连接子。在某些方面,本发明所述方法进一步包括根据对裂解连接子和修饰连接子的量化,对所述附着物的位点特异性偶联进行量化或表征。在某些方面,在本发明的所述方法中,使用质谱仪、电喷雾电离质谱仪、纳升电喷雾电离质谱仪或三重四极杆质谱仪进行所述质量分析,其中,所述质谱仪可与液相色谱系统连接,其中,所述质谱仪能够进行lc-ms(液相色谱-质谱法)、lc-mrm-ms(液相色谱-多反应监测-质谱法)或lc-ms/ms分析。
9.在某些方面,本发明所述方法进一步包括在对所述部分附着物进行裂解之前和/或在非偶联偶联位点增加修饰连接子之前,用酶处理肽或蛋白。在某些方面,本发明所述方法进一步包括在对所述样本进行质量分析之前,用酶处理样本。在某些方面,使用酶、蛋白酶、化学物质、酸、碱或还原剂对所述部分附着物进行裂解。在某些方面,在对所述部分附着物裂解步骤之前,在非偶联偶联位点增加修饰连接子。在某些方面,在增加修饰连接子步骤和对样本进行质量分析步骤之前,对部分附着物进行裂解。在某些方面,所述修饰连接子的分子量与裂解连接子的分子量不同。
10.在某些方面,本发明所述方法进一步包括在对所述部分附着物进行裂解之前和/或在非偶联偶联位点增加修饰连接子之前,用酶处理肽或蛋白,其中,所述酶为胰蛋白酶。在某些方面,本发明所述方法进一步包括在对所述样本进行质量分析之前,用酶处理样本,其中,所述酶为glu-c。在某些方面,所述特异性偶联位点或非偶联偶联位点位于肽或蛋白的半胱氨酸残基内。在某些方面,所述附着物通过马来酰亚胺附着基团与所述至少一个特异性偶联位点连接。在某些方面,所述肽或蛋白是一种抗体、抗体片段、抗体fab区、抗体fc区或融合蛋白。
11.在某些方面,所述连接子是一种酸敏连接子、蛋白酶可裂解连接子、含二硫化物连接子、焦磷酸酯连接子或腙连接子。在某些方面,所述连接子包含肽,其中包括缬氨酸-丙氨酸、苯基丙氨酸-赖氨酸、缬氨酸-瓜氨酸或其衍生物。在某些方面,所述连接子进一步包含对氨基苄氧基羰基(pabc)或对氨基苯甲醇(paba)。
12.在其他方面,所述修饰连接子包含聚乙二醇。在某些方面,通过马来酰亚胺附着基团将所述修饰连接子增加至非偶联偶联位点。
13.在其他方面,所述有效载荷是一种药物、化合物、毒素、细胞毒素剂、抗有丝分裂剂、微管抑制剂、dna损伤剂、拓扑异构酶抑制剂、rna聚合酶抑制剂、鹅膏蕈碱类似物、微管溶素类似物、化疗药物、微管阻聚剂或微管促聚剂。
14.在某些方面,所述部分偶联肽或蛋白选自含有式i中偶联肽或蛋白的基团,
[0015][0016]
其中,r为连接子,x为有效载荷。在某些方面,所述连接子包含聚乙二醇,并且所述有效载荷是一种药物、化合物、毒素、细胞毒素剂、抗有丝分裂剂、微管抑制剂、dna损伤剂、拓扑异构酶抑制剂、rna聚合酶抑制剂、鹅膏蕈碱类似物、微管溶素类似物、化疗药物、微管阻聚剂或微管促聚剂。
[0017]
在某些方面,所述部分偶联肽或蛋白选自含有式ii中偶联肽或蛋白的基团,
[0018][0019]
其中,r1为间隔子,r2为
–
h或
–
ch3,r3为
–
ch3或
–
(ch2)3nhc(o)nh2,x为有效载荷。在某些方面,所述间隔子包含聚乙二醇,并且所述有效载荷是一种药物、化合物、毒素、细胞毒素剂、抗有丝分裂剂、微管抑制剂、dna损伤剂、拓扑异构酶抑制剂、rna聚合酶抑制剂、鹅膏蕈碱类似物、微管溶素类似物、化疗药物、微管阻聚剂或微管促聚剂。
[0020]
在某些方面,所述部分偶联肽或蛋白选自含有式iii中偶联肽或蛋白的基团,
[0021][0022]
其中,r1为第一间隔子,r2为
–
h或
–
ch3,r3为
–
ch3或
–
(ch2)3nhc(o)nh2,r4为第二间隔子,x为有效载荷。在某些方面,所述第一间隔子包含聚乙二醇,所述第二间隔子包含对氨基苄氧基羰基(pabc)或对氨基苯甲醇(paba),并且所述有效载荷是一种药物、化合物、毒素、细胞毒素剂、抗有丝分裂剂、微管抑制剂、dna损伤剂、拓扑异构酶抑制剂、rna聚合酶抑制剂、鹅膏蕈碱类似物、微管溶素类似物、化疗药物、微管阻聚剂或微管促聚剂。
[0023]
本发明至少部分提供了一种对与样本中部分偶联的蛋白至少一个特异性偶联位点连接的至少一个附着物偶联进行量化或表征的方法。在某些实施例中,本发明所述方法包括以下步骤:使用第一酶对部分所述附着物进行裂解,产生含有裂解连接子的蛋白,其中,所述至少一个附着物包含所述连接子;然后在样本中加入第二酶,获得肽混合物;以及根据对含有所述裂解连接子的肽和/或不含有所述裂解连接子的肽进行量化,对肽混合物进行质量分析,从而对所述至少一个特异性偶联位点进行量化或表征。一方面,所述至少一个特异性偶联位点位于蛋白的赖氨酸残基内。
[0024]
一方面,所述至少一个附着物包含一个连接子和一个有效载荷,其中,所述至少一个附着物的裂解部分包含所述有效载荷,其中,所述连接子包含所述裂解连接子。一方面,使用质谱仪、电喷雾电离质谱仪、纳升电喷雾电离质谱仪或三重四极杆质谱仪进行所述质量分析,其中,所述质谱仪可与液相色谱系统连接,其中,所述质谱仪能够进行lc-ms(液相色谱-质谱法)、lc-mrm-ms(液相色谱-多反应监测-质谱法)或lc-ms/ms分析。一方面,本发明所述方法进一步包括在对肽混合物进行质量分析之前,用第三酶处理样本。一方面,所述第一酶为木瓜蛋白酶、组织蛋白酶b或纤溶酶;和/或其中,所述第二酶为glu-c或胰蛋白酶。一方面,所述第三酶为asp-n或glu-c。
[0025]
一方面,所述肽或蛋白是一种抗体、抗体片段、抗体fab区、抗体fc区或融合蛋白。一方面,所述连接子包含缬氨酸-丙氨酸、苯基丙氨酸-赖氨酸、缬氨酸-瓜氨酸或其衍生物。一方面,所述有效载荷是一种药物、化合物、毒素、细胞毒素剂、抗有丝分裂剂、微管抑制剂、dna损伤剂、拓扑异构酶抑制剂、rna聚合酶抑制剂、鹅膏蕈碱类似物、微管溶素类似物、化疗
药物、微管阻聚剂或微管促聚剂。
[0026]
结合以下说明和附图,将更好理解本发明的这些方面及其他方面。以下说明描述了各种实施例及其许多具体细节,但仅用于说明目的,不应视为限制。在本发明的范围内,可进行多种替换、修改、增加或重排。
附图说明
[0027]
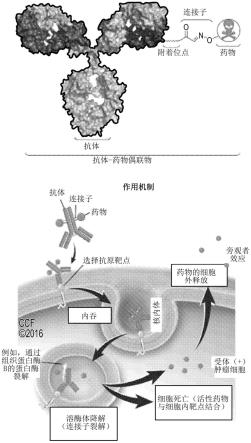
图1显示了抗体-药物偶联物(adc),其中,所述药物通过连接子与抗体偶联。adc的抗体成分与靶细胞的肿瘤抗原结合,随后adc-抗原复合物经历受体介导的内吞作用。可通过adc的溶酶体降解或连接子的裂解释放adc的药物成分。
[0028]
图2显示了和的化学结构。
[0029]
图3显示了通过马来酰亚胺烷基化将连接子与抗体偶联的半胱氨酸偶联。
[0030]
图4显示了通过巯基交换或逆反应实现的与半胱氨酸偶联adc的巯基-马来酰亚胺偶联相关的解偶联。
[0031]
图5a显示了某些方面所述的adc的化学结构。每种adc包含通过连接子连接的一个抗体和一个有效载荷,其中根据某些方面,使用马来酰亚胺附着基团将所述连接子附着到肽或蛋白半胱氨酸残基的巯基上。
[0032]
图5b显示了某些方面所述的adc的化学结构。每种adc包含通过连接子连接的一个抗体和一个有效载荷,其中根据某些方面,使用活化羧酸酯或nhs酯通过赖氨酸酰胺偶联将所述连接子附着在肽或蛋白的赖氨酸残基上。
[0033]
图6a显示了本发明的一个示例性方法,根据示例性实施例,其包括以下步骤:用胰蛋白酶消化adc,用木瓜蛋白酶消化胰蛋白酶肽混合物,去除有效载荷;将修饰连接子与非偶联巯基(例如标记)偶联;用glu-c消化肽混合物;以及对肽混合物进行lc-ms分析。
[0034]
图6b显示了本发明的一个示例性方法,根据示例性实施例,其包括以下步骤:用胰蛋白酶消化adc,将修饰连接子与非偶联巯基(例如标记)偶联;用木瓜蛋白酶消化肽混合物,去除有效载荷;用glu-c消化肽混合物;以及对肽混合物进行lc-ms分析。
[0035]
图6c显示了本发明的一个示例性方法,根据示例性实施例,其包括以下步骤:用木瓜蛋白酶消化adc样本,去除有效载荷,然后进行还原和变性,接着用胰蛋白酶消化adc样本,获得胰蛋白酶肽混合物,用glu-c消化胰蛋白酶肽混合物,将修饰连接子与非偶联巯基(例如标记)偶联,然后对肽混合物进行lc-ms分析。
[0036]
图7显示了本发明的一个示例性方法,根据示例性实施例,其包括以下步骤:用木瓜蛋白酶消化adc样本,去除有效载荷,然后进行还原和变性,接着对样本进行烷基化,随后用glu-c消化adc样本,获得glu-c消化的肽混合物,用asp-n消化肽混合物,然后对肽混合物进行lc-ms分析。
[0037]
图8a显示了示例性实施例所述的通过马来酰亚胺附着基团连接蛋白和有效载荷的连接子(例如lk1连接子)的附着物。将马来酰亚胺附着基团附着在肽或蛋白的巯基(-sh)上。lk1连接子(mal-酰胺-peg8-va-paba)的附着物包括peg8(聚乙二醇-8)、缬氨酸-丙氨酸二肽(va二肽)和paba。sg3199是一种药物有效载荷。
[0038]
图8b显示了示例性实施例所述的裂解连接子(mal-酰胺-peg8-va)的附着物,例如,裂解lk1的附着物,其中在lk1的蛋白酶消化通过去除paba和药物有效载荷释放有效载
荷后产生所述附着物。
[0039]
图8c显示了示例性实施例所述的lk1修饰连接子(mal-酰胺-peg8-cooh)的附着物,例如,lk2的附着物。
[0040]
图8d显示了示例性实施例所述的通过马来酰亚胺附着基团连接蛋白和有效载荷的连接子(例如lk3连接子)的附着物。将马来酰亚胺附着基团附着在肽或蛋白的巯基(-sh)上。lk3连接子(mal-酰胺-val-cit-paba)的附着物包括缬氨酸-瓜氨酸二肽(vcit二肽)和paba。美登素是一种药物有效载荷。
[0041]
图8e显示了示例性实施例所述的裂解连接子的附着物(mal-酰胺-val-cit),例如,裂解lk3的附着物,其中在lk3的蛋白酶消化通过去除paba和药物有效载荷释放有效载荷后产生所述附着物。
[0042]
图8f显示了示例性实施例所述的lk3修饰连接子(mal-酰胺-val-cit)的附着物,例如,lk4的附着物。
[0043]
图8g显示了示例性实施例所述的lk5连接子(例如adip-val-cit-pab-nme)的附着物,包括缬氨酸-瓜氨酸二肽,作为连接蛋白和有效载荷的酶裂解位点。根据示例性实施例,美登素(may),即一种细胞毒性化合物,是加载到lk5的药物有效载荷。
[0044]
图8h显示了示例性实施例所述的裂解lk5(例如adip-val-cit)的附着物,其中在lk5的蛋白酶消化释放有效载荷后产生所述附着物。
[0045]
图8i显示了示例性实施例所述的抗体的非偶联赖氨酸残基的化学结构。
[0046]
图9a显示了抗体的链间二硫键,还原所述链间二硫键可以得到巯基(
–
sh)。根据示例性实施例,然后将巯基用作制备adc的偶联位点。
[0047]
图9b显示了含有lk1连接子和有效载荷药物sg3199的adc。根据示例性实施例,adc(例如ab-mal-酰胺-peg8-va-paba-sg3199)具有释放药物有效载荷的裂解位点。
[0048]
图9c显示了含有lk3连接子和有效载荷药物美登素的adc。根据示例性实施例,adc(例如ab-mal-酰胺-val-cit-paba-maytansinoid)具有释放药物有效载荷的裂解位点。
[0049]
图10显示了示例性实施例所述的使用完整质量测定mab1-lk1 adc的药物抗体比。(x轴:强度/[计数];y轴:观察到的质量[m/z]1.45e5-1.58e5)。
[0050]
图11显示了示例性实施例所述的使用mab1-lk1 adc中的木瓜蛋白酶去除药物有效载荷。用胰蛋白酶消化mab1-lk1 adc,获得胰蛋白酶肽混合物。根据示例性实施例,使用lc-ms分析两种胰蛋白酶肽,例如scdk(丝氨酸-半胱氨酸-天冬氨酸-赖氨酸)和gec(甘氨酸-谷氨酸-半胱氨酸)。在质量分析中,lk1表示为+1495.7(包括有效载荷),裂解lk1表示为+762.2。
[0051]
图12a显示了木瓜蛋白酶是一种优先裂解靠近大疏水或芳香氨基酸位点的蛋白酶。
[0052]
图12b显示了最初位于抗体铰链区的胰蛋白酶肽的氨基酸序列。这种胰蛋白酶铰链区肽((thtcppcpapellggpsvflfppkpk(seq id no.:1)))含有多个木瓜蛋白酶裂解位点。木瓜蛋白酶裂解位点用箭头符号表示。
[0053]
图13a-13c显示了示例性实施例所述的用木瓜蛋白酶消化的胰蛋白酶铰链区肽的分析结果。图13a显示了示例性实施例所述的胰蛋白酶铰链区肽(thtcppcpapellggpsvflfppkpk(seq id no.:1))的分析结果。
[0054]
图13b显示了示例性实施例所述的氨基酸序列为cppcpape(seq id no.:2)(用木瓜蛋白酶消化的胰蛋白酶铰链区肽)的肽的分析结果。
[0055]
图13c显示了示例性实施例所述的氨基酸序列为cppcpapell(seq id no.:3)(用木瓜蛋白酶消化的胰蛋白酶铰链区肽)的肽的分析结果。这些肽可能含有lk1(表示为+1495.7,包括有效载荷)或裂解lk1(表示为+762.4)。
[0056]
图14显示了示例性实施例所述的铰链区肽的连接子标记效率。铰链区肽含有两个半胱氨酸残基。大多数铰链区肽具有双重标记。
[0057]
图15显示了示例性实施例所述的在进行lc-ms之前样本的glu-c消化的分析结果。铰链区肽的分布明显减少,这大大简化了用lc-ms进行的定量。
[0058]
图16显示了示例性实施例所述的mab1-lk1 adc的药物偶联的位点特异性定量。图中显示了两种肽的峰面积,例如,氨基酸序列为scdk或gec的肽。这些肽可能含有裂解lk1(表示为+762.4)和/或裂解lk2(表示为+592.3)。
[0059]
图17显示了示例性实施例所述的本发明方法中关于gec肽、scdk肽和铰链区肽dar分析结果的日内精密度。
[0060]
图18a和18b显示了示例性实施例所述的两种方法的比较结果。图18a显示了示例性实施例所述的按照图6a所示方法进行木瓜蛋白酶消化后lk2附着的结果。
[0061]
图18b显示了示例性实施例所述的按照图6b所示方法进行lk2附着后木瓜蛋白酶消化的结果。分析了高dar的mab1-lk1 adc样本。裂解lk1表示为+762.4。lk2表示为+592.3。(+592.3,+592.3)表示0偶联。(+762.4,+592.3)表示一个药物偶联。根据示例性实施例,(+762.4,+762.4)表示两个药物偶联。
[0062]
图19a显示了示例性实施例所述的含裂解lk1(mal-酰胺-peg8-val-ala)胰蛋白酶肽scdk的连接子二肽结构的密集片段的质量分析。
[0063]
图19b显示了示例性实施例所述的含裂解lk3(mal-酰胺-val-cit)胰蛋白酶肽scdk的连接子二肽结构的密集片段的质量分析。
[0064]
图20a显示了示例性实施例所述的针对mab1-lk1 adc样本识别的所有肽中特异性替代肽的百分比。
[0065]
图20b显示了示例性实施例所述的针对mab1-lk3 adc样本识别的所有肽中特异性替代肽的百分比。
[0066]
图21a显示了示例性实施例所述的分析mab1-lk1 adc样本时不同木瓜蛋白酶与底物比下替代肽的峰面积。
[0067]
图21b显示了示例性实施例所述的分析mab1-lk3 adc样本时不同木瓜蛋白酶与底物比下替代肽的峰面积。
[0068]
图22显示了示例性实施例所述的在不同培养时间含有lk1或lk3的替代肽(例如gec、scdk)或含有一个或两个完整lk1或lk3的铰链肽的峰面积。
[0069]
图23显示了示例性实施例所述的在不同培养时间含有lk1或lk3的替代肽(例如gec、scdk)或含有一个或两个裂解lk1或lk3的铰链肽的峰面积。根据示例性实施例,还检测了不含裂解连接子的铰链肽的峰面积。
[0070]
图24a显示了示例性实施例所述的通过分析gec、scdk和铰链区肽的偶联位点,对mab1-lk1 adc的lk1偶联进行位点特异性定量。
[0071]
图24b显示了示例性实施例所述的通过分析gec、scdk和铰链区肽的偶联位点,对mab1-lk3 adc的lk3偶联进行位点特异性定量。
[0072]
图25显示了示例性实施例所述的本发明方法中关于gec、scdk和铰链区肽的dar分析结果的日内和日间精密度。
[0073]
图26显示了示例性实施例所述的通过分析gec、scdk和铰链区肽上的偶联位点,mab1-lk1-l8和mab1-lk1-l22的药物偶联分布的批次间差异。
[0074]
图27显示了示例性实施例所述的通过在不同ph值条件下(包括ph 5.5、ph 6和ph 6.5)分析gec、scdk和铰链区肽,mab1-lk1 adc在40℃热应力下28天的lk1偶联的损失百分比。
[0075]
图28显示了示例性实施例所述的马来酰亚胺环水解的化学机制。
[0076]
图29a显示了示例性实施例所述的通过在不同ph值条件下(包括ph 5.5、ph 6和ph 6.5)分析gec、scdk和铰链区肽,马来酰亚胺环水解和偶联保留的百分比。
[0077]
图29b显示了示例性实施例所述的偶联保留和马来酰亚胺环水解之间的相关性分析。
[0078]
图30a-30c显示了示例性实施例所述的使用木瓜蛋白酶消化分析抗体轻链中赖氨酸208残基的药物偶联。
[0079]
图31a-31c显示了示例性实施例所述的使用木瓜蛋白酶消化分析抗体(hc lys393/hc
*
lys389)重链中赖氨酸393和赖氨酸389残基的药物偶联。
[0080]
图32a-32c显示了示例性实施例所述的使用木瓜蛋白酶消化分析抗体轻链中赖氨酸65残基的药物偶联。
[0081]
图33a-33c显示了示例性实施例所述的通过分析含有55氨基酸的肽,使用木瓜蛋白酶消化分析抗体轻链中赖氨酸39、42或45残基的药物偶联。
[0082]
图34a-34b显示了示例性实施例所述的使用木瓜蛋白酶消化分析用于双重偶联的抗体(hc
*
lys64和lys75)重链中赖氨酸64和75残基的药物偶联。
[0083]
图35a-35c显示了示例性实施例所述的使用木瓜蛋白酶消化分析抗体(hc lys151/hc
*
lys147)重链中赖氨酸151和147残基的药物偶联。
[0084]
图36显示了示例性实施例所述的mab2-lk5的各种赖氨酸残基上药物偶联的位点特异性定量。
具体实施方式
[0085]
抗体-药物偶联物(adc)是利用抗体的特异性选择性地将药物(例如,高效细胞毒性药物或化疗药物)递送至靶细胞的治疗剂。adc可以为癌症治疗提供细胞毒素剂的靶向给药。靶向特异性肿瘤表面抗原的抗体可通过连接子与药物偶联,从而产生adc,作为癌症治疗的有效治疗剂。如图1所示,adc的抗体成分与肿瘤抗原结合,随后adc-抗原复合物经历受体介导的内吞作用。由于溶酶体含有蛋白酶,例如组织蛋白酶b和纤溶酶,可通过adc的溶酶体降解或连接子的裂解释放adc的药物成分。(changshou gao。第7界世界adc峰会。2016,圣地亚哥,巯基/马来酰亚胺偶联的不稳定性及缓解策略;jagadeesh等人,抗体药物偶联物(adc):改变淋巴瘤的治疗格局,最新肿瘤学疗法,17,55,2016,https://doi.org/10.1007/s11864-016-0428-y)。优选的靶抗原应在肿瘤和正常组织之间显示出差异表达,在癌细胞
中表达水平增加。与传统的化疗癌症治疗相比,adc可通过向癌细胞选择性递送药物来提高疗效并降低毒性,从而降低最小有效剂量。由于抗体的靶向给药减少了到达非靶组织(例如正常组织)的药物,因此增加了最大耐受药物剂量。(panowski等人,癌症治疗的位点特异性抗体药物偶联物,mabs,6:1,34-45,doi:10.4161/mabs.27022)。与传统化疗相比,因为疗效提高、全身毒性降低、药代动力学良好、药效学良好以及生物分布良好,所以使用adc可改善治疗窗口。(tsuchikama等人,蛋白细胞,2018,9(1),第33页-第46页,抗体-药物偶联物:偶联和连接子化学的最新进展)。
[0086]
fda批准的adc包括2000年批准用于cd33阳性急性骨髓性白血病的吉妥单抗2011年批准用于cd30阳性复发性或难治性霍奇金氏淋巴瘤和全身性间变性大细胞淋巴瘤的本妥昔单抗2013年批准用于her2阳性乳腺癌的曲妥珠单抗2017年批准用于cd22阳性急性淋巴细胞白血病的奥英妥珠单抗2019年批准用于cd79b阳性弥漫性大b细胞淋巴瘤的泊洛妥珠单抗2019年批准用于nectin-4阳性膀胱癌的维汀恩弗妥单抗以及2019年批准用于her2阳性乳腺癌的曲妥珠单抗重组然而,由于与标准化疗相比缺少临床获益和致死率较高,于2010年退出市场。和的化学结构如图2所示。(tsuchikama等人)大多数活跃的adc临床试验均处于针对多种靶抗原的i期。adc靶抗原的示例包括her2、egfr、cd19、cd33、cd70、cmet、bcma、cd123、cd22、cd37、cd71、cd74、gc-c、fgfr、间皮素、enpp3、axl受体酪氨酸激酶、cdh6、ceacam4、dll3、flt3、叶酸受体1、psma、gpnmb、her3、igf-1r、slc44a4、taa等。adc的开发具有挑战性,据估计,约25%的adc开发在临床试验期间中止。
[0087]
adc由靶向特异性抗原的抗体、药物有效载荷以及连接药物有效载荷与抗体的连接子构成。开发adc常用的抗体同种型包括igg1、igg2和igg4。偶联可使用各种类型的连接子,包括蛋白酶可裂解连接子、不可裂解连接子、腙连接子和二硫键连接子。抗体中的偶联位点包括赖氨酸和半胱氨酸残基。此外,可在特异性位点增加非天然氨基酸或工程化改造的半胱氨酸残基。抗体的主要偶联位点包括赖氨酸残基的氨基。一个典型的抗体上大约有80个赖氨酸残基,其中大约有10个赖氨酸残基在化学上可接近。连接子与抗体的化学偶联包括使用活化羧酸酯的赖氨酸酰胺偶联。
[0088]
也可采用基于半胱氨酸的偶联构建adc。因为所有的半胱氨酸残基都形成二硫键,所以抗体中一般没有游离巯基。抗体(例如igg1)中存在4个链间和12个链内二硫键。链间二硫键对igg1的结构稳定性一般不重要。当抗体的链间二硫键选择性还原时,抗体半胱氨酸残基的巯基(
–
sh)可作为主要偶联位点。因此,半胱氨酸偶联可能局限于链间二硫键还原后暴露的八个巯基。每个抗体用于半胱氨酸偶联的连接子-药物范围为1-8,因此会产生100多种不同的adc种类。因为这些adc种类在载药量和偶联位点上有所不同,所以adc混合物的异质性多样性相对较高。(panowski等人)通过基因工程或其他技术可在抗体中引入其他半胱氨酸残基。
[0089]
通常,adc的结构异质性较高,包括各种dar、偶联位点和占位程度。根据溶剂可及性、局部电荷和立体效应,不同偶联位点的有效载荷占位可能会有所不同。特异性偶联位点的位置和占位可调节adc的稳定性和疗效。赖氨酸或半胱氨酸偶联的adc具有异质性,包括
尺寸变体和电荷变体。adc(例如赖氨酸或半胱氨酸偶联的adc)的质量属性包括dar、载药量分布、非偶联抗体的存在和残留药物的存在。偶联位点的选择可调节adc的稳定性和疗效。基于半胱氨酸的偶联方法依赖于抗体的半胱氨酸残基和巯基反应官能团之间的特异性反应。马来酰亚胺可通过马来酰亚胺烷基化将连接子与还原抗体半胱氨酸巯基偶联。图3显示了马来酰亚胺基团与抗体还原半胱氨酸残基反应(tsuchikama等人)。
[0090]
用于药物-抗体偶联的连接化学反应存在一些问题。如果产生的adc结构不稳定,则可能导致药物过早释放。其他问题与dar的广泛差异和抗体附着位置控制不良有关。adc的差异和不稳定性导致了药代动力学特征发生变化。由此产生的adc可能是含有各种adc的高度异质混合物。如图4所示,由于基于半胱氨酸偶联的巯基马来酰亚胺偶联的不稳定性,半胱氨酸偶联adc可能发生解偶联,例如发生巯基交换或逆反应。在adc偶联基于抗体ch2结构域中的赖氨酸残基时,ch2结构域可能会出现不稳定,从而触发转译后修饰(ptm)降解,这对抗体的半衰期产生负面影响。基于赖氨酸的偶联可能会损害adc的结合亲和力,例如直接改变结合表位或间接引起结构变化。例如,与非偶联抗体相比,adc中的蛋氨酸258残基更容易氧化。(luo等人,单克隆抗体-美登素免疫偶联物的结构表征,分析化学,2016年1月5日;88(1):695-702。doi:10.1021/acs.analchem.5b03709。epub 2015年12月14日;buecheler,j.w.等人,药物科学杂志,109(2020)161-168162)。有效载荷的解偶联会导致靶向疗效降低、脱靶毒性增加或药物分布不受控制。血清中adc的dar可能随时间变化。药物偶联的位点特异性定量和不同位点药物偶联损失的定量仍然是一个挑战。adc的分析表征包括分子完整性、异质性、降解、稳定性和dar变化。理想的adc制剂应包括明确的dar和同质性程度,通过减少不理想的adc种类来提高adc制剂的安全性和疗效。
[0091]
dar代表与抗体偶联的药物的平均数量,直接与adc的疗效和安全性有关。因为明确的dar可提供有关总载药量、载药量分布、非偶联抗体水平、残留非偶联药物水平和偶联位点的关键信息,所以dar的表征对于控制adc的关键质量属性至关重要。低dar代表降低adc效力的低载药量。高dar代表可以改变adc药代动力学和毒性的高载药量。adc的主要质量属性包括dar的表征、载药量分布、非偶联抗体水平、残留非偶联药物水平、adc尺寸变体和adc电荷变体。
[0092]
由于连接子和有效载荷的偶联会明显影响肽离子化,因此使用质谱分析方法对adc进行表征和定量可能会因批次间差异而具有挑战性。虽然基于质谱分析的肽图在表征治疗性蛋白方面非常强大,但由于野生型肽和偶联肽之间显著的分子量差异造成的电离差异,这种一般策略通常无法量化adc的位点特异性偶联。此外,adc的胰蛋白酶消化会产生含有偶联位点的短肽,例如重链和轻链之间的链间二硫键,这些短肽在反相液相色谱(rplc)上很难保留。进一步地,在样本制备过程中,例如在高温下和/或酸性条件下,药物偶联肽的转化会产生分析物稳定性和再现性的风险。在使用毛细管电泳-质谱(ce-ms)表征adc时,可保留短肽。然而,定量再现性仍存在问题。
[0093]
连接子的选择对于adc疗效来说至关重要,因为理想的连接子应在循环血液中稳定,允许在肿瘤细胞内快速释放活性游离药物。适用的连接子形式可以是不可裂解或可裂解的连接子。可裂解连接子通过对细胞外和细胞内环境的环境差异(例如ph值或氧化还原电势)作出反应或通过特异性溶酶体酶进行裂解。
[0094]
可裂解连接子的示例包括酸敏连接子、蛋白酶可裂解连接子、含二硫化物连接子
或焦磷酸酯连接子。腙连接子是酸敏连接子的一个示例。酸敏连接子在血液的ph值下稳定,但其在溶酶体的低ph值环境中可能变得不稳定并且可降解。当细胞内还原谷胱甘肽水平较高时,二硫化物连接子含有可在细胞内释放游离药物的二硫键。
[0095]
蛋白酶可裂解连接子在血液中稳定,但活性游离药物在通过溶酶体酶裂解后可在细胞的溶酶体内迅速释放。溶酶体内的蛋白酶活性相对较高。可由溶酶体蛋白酶识别并裂解某些特异性肽序列,例如可由组织蛋白酶b水解的二肽键。组织蛋白酶b可以识别某些二肽序列,例如缬氨酸-丙氨酸、苯基丙氨酸-赖氨酸和缬氨酸-瓜氨酸,并在此类序列的c端侧裂解肽键。一个间隔子,例如对氨基苄氧基羰基(pabc)或对氨基苯甲醇(paba),可与这些二肽偶联构建可裂解二肽连接子。在使用大有效载荷分子时,二肽基团与有效载荷之间存在间隔子可使组织蛋白酶b显示出其蛋白酶活性。(tsuchikama等人)
[0096]
药物有效载荷的选择对于adc的治疗效果至关重要。adc中的有效载荷最好是对癌细胞具有高效力、对正常细胞具有低脱靶细胞毒性的细胞毒性化学剂。在某些方面,所述有效载荷是一种细胞毒素剂或抗有丝分裂剂。在某些方面,所述有效载荷是一种微管抑制剂,例如美登素或奥瑞他汀。在某些示例性示例中,所述有效载荷是一种dna损伤剂,例如,蒽环类药物、卡利奇霉素或吡咯并苯并二氮杂卓二聚体(pbd)。dna损伤剂通过结合dna的小沟来引起dna链断裂、烷基化或交联作用。在某些方面,所述有效载荷是拓扑异构酶抑制剂或rna聚合酶抑制剂。在某些方面,所述有效载荷是鹅膏蕈碱或微管溶素类似物。在某些方面,所述有效载荷是一种化疗药物,包括叶酸和嘌呤类似物(甲氨蝶呤、6-巯嘌呤)、微管阻聚剂/促聚剂(长春花生物碱、紫杉烷)和dna损伤剂(蒽环类药物、氮芥)。
[0097]
在某些方面,adc包含一个抗体、一个有效载荷和一个连接子,其中,所述连接子装载有效载荷并附着到抗体上,其中,所述连接子包含一个裂解位点。在某些方面,所述裂解位点可通过对细胞外和细胞内环境的环境差异(例如ph值或氧化还原电势)作出反应或通过特异性溶酶体酶进行裂解。在某些方面,所述裂解位点是酸敏裂解位点、蛋白酶裂解位点、含二硫化物裂解位点或含焦磷酸酯裂解位点。
[0098]
在某些方面,adc包含一个抗体、一个有效载荷和一个连接子,其中,所述连接子装载有效载荷并附着到抗体上,其中,所述连接子包含一个间隔子和一个裂解位点,其中,所述间隔子为peg(聚乙二醇)或peg8。
[0099]
在其他方面,adc包含一个抗体、一个有效载荷和一个连接子,其中,所述连接子装载有效载荷并附着到抗体上,其中,所述连接子包含一个第一间隔子、一个裂解位点和一个第二间隔子,其中,所述第一间隔子为peg或peg8,所述第二间隔子为pabc或paba。
[0100]
在其他方面,adc包含一个抗体、一个有效载荷和一个连接基团连接子,其中,所述连接子使用马来酰亚胺附着基团附着在抗体半胱氨酸残基的巯基上,如图5a中的式i所示,其中,r为连接子,x为有效载荷。在某些实施例中,所述连接子包含peg,并且所述有效载荷是一种药物、化合物、毒素、细胞毒素剂、抗有丝分裂剂、微管抑制剂、dna损伤剂、拓扑异构酶抑制剂、rna聚合酶抑制剂、鹅膏蕈碱类似物、微管溶素类似物、化疗药物、微管阻聚剂或微管促聚剂。在某些方面,所述连接子进一步包括裂解位点。在某些方面,所述裂解位点可以是通过蛋白酶识别的二肽。在某些方面,所述二肽为缬氨酸-丙氨酸、苯基丙氨酸-赖氨酸、缬氨酸-瓜氨酸或其衍生物。
[0101]
在某些方面,adc包含一个抗体、一个有效载荷和一个连接子,其中,所述连接子使
用马来酰亚胺附着基团附着在抗体半胱氨酸残基的巯基上,如图5a中的式ii所示,其中,r1为间隔子(例如peg或peg8),r2为
–
h或
–
ch3,r3代表丙氨酸或瓜氨酸侧链的一般结构,例如
–
ch3或
–
(ch2)3nhc(o)nh2,x为有效载荷。在某些实施例中,所述有效载荷是一种药物、化合物、毒素、细胞毒素剂、抗有丝分裂剂、微管抑制剂、dna损伤剂、拓扑异构酶抑制剂、rna聚合酶抑制剂、鹅膏蕈碱类似物、微管溶素类似物、化疗药物、微管阻聚剂或微管促聚剂。
[0102]
在其他方面,adc包含一个抗体、一个有效载荷和一个连接子,其中,所述连接子使用马来酰亚胺附着基团附着在抗体半胱氨酸残基的巯基上,如图5a中的式iii所示,其中,r1为第一间隔子(例如peg或peg8),r2为
–
h或
–
ch3,r3代表丙氨酸或瓜氨酸侧链的一般结构,例如
–
ch3或
–
(ch2)3nhc(o)nh2,r4为第二间隔子(例如pabc或paba)。在某些实施例中,所述有效载荷是一种药物、化合物、毒素、细胞毒素剂、抗有丝分裂剂、微管抑制剂、dna损伤剂、拓扑异构酶抑制剂、rna聚合酶抑制剂、鹅膏蕈碱类似物、微管溶素类似物、化疗药物、微管阻聚剂或微管促聚剂。
[0103]
在其他方面,adc包含一个抗体、一个有效载荷和一个连接子,其中,所述连接子使用活化羧酸酯或nhs酯通过赖氨酸酰胺偶联附着在赖氨酸残基上,如图5b中的式iv所示,其中,r为连接子,x为有效载荷。在某些实施例中,所述连接子包含peg,并且所述有效载荷是一种药物、化合物、毒素、细胞毒素剂、抗有丝分裂剂、微管抑制剂、dna损伤剂、拓扑异构酶抑制剂、rna聚合酶抑制剂、鹅膏蕈碱类似物、微管溶素类似物、化疗药物、微管阻聚剂或微管促聚剂。在某些方面,所述连接子进一步包括裂解位点。在某些方面,所述裂解位点可以是通过蛋白酶识别的二肽。在某些方面,所述二肽为缬氨酸-丙氨酸、苯基丙氨酸-赖氨酸、缬氨酸-瓜氨酸或其衍生物。
[0104]
在某些方面,adc包含一个抗体、一个有效载荷和一个连接子,其中,所述连接子使用活化羧酸酯或nhs酯通过赖氨酸酰胺偶联附着在赖氨酸残基上,如图5b中的式v所示,其中,r1为间隔子(例如peg或peg8),r2为
–
h或
–
ch3,r3代表丙氨酸或瓜氨酸侧链的一般结构,例如
–
ch3或
–
(ch2)3nhc(o)nh2,x为有效载荷。在某些实施例中,所述有效载荷是一种药物、化合物、毒素、细胞毒素剂、抗有丝分裂剂、微管抑制剂、dna损伤剂、拓扑异构酶抑制剂、rna聚合酶抑制剂、鹅膏蕈碱类似物、微管溶素类似物、化疗药物、微管阻聚剂或微管促聚剂。
[0105]
在某些方面,adc包含一个抗体、一个有效载荷和一个连接子,其中,所述连接子使用活化羧酸酯或nhs酯通过赖氨酸酰胺偶联附着在赖氨酸残基上,如图5b中的式vi所示,其中,r1为第一间隔子(例如peg或peg8),r2为
–
h或
–
ch3,r3代表丙氨酸或瓜氨酸侧链的一般结构,例如
–
ch3或
–
(ch2)3nhc(o)nh2,r4为第二间隔子(例如pabc或paba)。在某些实施例中,所述有效载荷是一种药物、化合物、毒素、细胞毒素剂、抗有丝分裂剂、微管抑制剂、dna损伤剂、拓扑异构酶抑制剂、rna聚合酶抑制剂、鹅膏蕈碱类似物、微管溶素类似物、化疗药物、微管阻聚剂或微管促聚剂。
[0106]
本发明提供了一种对adc药物偶联进行位点特异性定量和/或表征的示例性方法,其中,所述adc包括偶联和非偶联偶联位点。本发明所述方法包括用蛋白酶消化adc产生肽混合物,其中,所述肽可含有偶联和/或非偶联的偶联位点。然后,可对所述肽混合物进行修饰或标记,获得偶联和非偶联的偶联位点之间的可检测分化。本发明提供了一种新的蛋白酶辅助药物解偶联和连接子标记(paddll)方法,从而对adc的偶联进行位点特异性量化。在某些方面,采用胰蛋白酶消化adc。在某些方面,采用lc-ms检测含有偶联和/或非偶联偶联
位点的肽之间的分化。
[0107]
在某些方面,本发明提供了一种对与样本中部分偶联肽或蛋白至少一个特异性偶联位点连接的至少一个附着物偶联进行量化或表征的方法,包括以下步骤:对部分所述至少一个附着物进行裂解,产生含有裂解连接子的肽或蛋白,其中,所述附着物包含裂解连接子;在所述部分偶联肽或蛋白的非偶联偶联位点增加修饰连接子;以及对样本进行质量分析,识别含有所述裂解连接子和/或所述修饰连接子的肽或蛋白;其中,所述至少一个附着物包含一个连接子和一个有效载荷,其中,所述附着物的裂解部分包含所述有效载荷,其中,所述连接子包含所述裂解连接子。在某些方面,所述方法进一步包括根据对裂解连接子和修饰连接子的量化,对所述附着物的位点特异性偶联进行量化或表征。在某些方面,所述质量分析为质谱分析或液相色谱质谱分析。根据裂解连接子和修饰连接子可以计算位点特异性有效载荷(例如药物)偶联,例如,位点特异性有效载荷(例如药物)偶联=(裂解连接子的数量)/(修饰连接子的数量+裂解连接子的数量)。
[0108]
在其他方面,可采用本发明所述方法来量化含有裂解连接子(例如蛋白酶可裂解二肽连接子)的各种adc,其中,所述adc可具有不同的抗体同种型、连接子结构和药物有效载荷,其中,所述adc可包括赖氨酸偶联和半胱氨酸偶联的adc。在某些方面,本发明所述方法包括在优化条件下用活化木瓜蛋白酶培养完整adc,以通过最小化非特异性裂解来完全解离药物有效载荷,然后进行还原肽图程序,包括还原、变性和酶消化。然后,用修饰连接子标记未占位偶联位点,从而提供相当的电离效率。然后,本发明所述方法包括对adc样本进行质量分析,例如lc-ms/ms(液相色谱质谱联用/质谱分析),识别含有裂解连接子和/或修饰连接子的肽或蛋白。在某些方面,adc的修饰连接子和可裂解连接子具有相似结构。在某些方面,根据裂解连接子和修饰连接子可以计算位点特异性有效载荷(例如药物)偶联。可以使用药物解偶联肽和连接子标记肽的前体离子的信号强度来估计位点特异性药物偶联的百分比,包括:
[0109][0110]
在某些优选方面,在部分所述附着物裂解步骤之前,在非偶联偶联位点增加修饰连接子。在某些优选方面,所述肽或蛋白是一种抗体、抗体片段、抗体fab区、抗体fc区或融合蛋白。在某些优选方面,所述修饰连接子的分子量与裂解连接子的分子量不同,其中,这些分子量在质量分析中是可区分的。
[0111]
如图6a所示,在某些方面,本发明所述方法包括以下步骤:用胰蛋白酶消化adc,用木瓜蛋白酶消化胰蛋白酶肽混合物,去除有效载荷;将修饰连接子与非偶联巯基(例如标记)偶联;然后用glu-c消化肽混合物;以及对肽混合物进行lc-ms分析。如图6b所示,在某些方面,某些步骤的顺序可颠倒。在通过用木瓜蛋白酶消化肽混合物去除有效载荷步骤之前,可进行将修饰连接子与肽的非偶联巯基偶联的步骤。关于将修饰连接子与肽的非偶联巯基偶联的步骤,通常只有游离巯基能够与修饰连接子偶联。如图6b所示,在某些方面,本发明所述方法包括以下步骤:用胰蛋白酶消化adc,产生肽混合物,将修饰连接子与肽混合物的非偶联巯基(例如标记)偶联;用木瓜蛋白酶消化肽混合物,去除有效载荷;用glu-c消化肽混合物;以及对肽混合物进行lc-ms分析。
[0112]
在其他方面,本发明所述方法中的步骤顺序可以按图6c所示重新排列。在通过用
木瓜蛋白酶消化肽混合物去除有效载荷的步骤之后以及在进行胰蛋白酶和glu-c消化步骤之后,可进行将修饰连接子与肽的非偶联巯基偶联的步骤。在某些方面,在胰蛋白酶消化之前进行木瓜蛋白酶消化,减少木瓜蛋白酶对胰蛋白酶肽的非特异性消化。在某些方面,在木瓜蛋白酶消化之后进行标记步骤,减少马来酰亚胺连接子对木瓜蛋白酶(半胱氨酸蛋白酶)活性的抑制。如图6c所示,在某些方面,本发明所述方法包括以下步骤:用木瓜蛋白酶消化adc,去除有效载荷,然后进行还原和变性,接着用胰蛋白酶消化adc,获得胰蛋白酶肽混合物,用glu-c消化胰蛋白酶肽混合物,然后将修饰连接子与非偶联巯基(例如标记)偶联,最后对肽混合物进行lc-ms分析。
[0113]
在某些优选方面,为了尽量减少木瓜蛋白酶的非特异性消化,在进行其他步骤之前,首先用木瓜蛋白酶消化adc,去除有效载荷。在某些方面,本发明所述方法包括以下步骤:用木瓜蛋白酶消化adc样本,去除有效载荷,然后用胰蛋白酶消化样本,接着用glu-c消化胰蛋白酶肽混合物,随后将修饰连接子与非偶联巯基(例如标记)偶联,最后对肽混合物进行lc-ms分析。
[0114]
在某些方面,本发明所述方法包括以下步骤:用胰蛋白酶消化adc,获得胰蛋白酶肽混合物,其中,所述adc包含一个抗体、至少一个药物有效载荷和至少一个含缬氨酸-丙氨酸二肽的可裂解连接子,其中,所述连接子附着在抗体半胱氨酸残基的巯基上;用木瓜蛋白酶消化胰蛋白酶肽混合物去除有效载荷,获得木瓜蛋白酶胰蛋白酶肽混合物;将修饰连接子与木瓜蛋白酶胰蛋白酶肽的非偶联巯基偶联;以及对肽混合物进行质量分析,例如lc-ms分析。可选地,在进行质量分析之前,肽混合物可进行glu-c蛋白酶消化,减少铰链区肽的数量,简化定量。
[0115]
在某些方面,本发明所述方法包括以下步骤:用第一酶消化adc混合物,获得第一肽混合物,其中,所述adc包含一个肽或蛋白、至少一个有效载荷以及至少一个连接子;用第二酶消化第一酶去除有效载荷,获得第二酶混合物,其中,所述第二酶也可消化第一肽混合物中的肽;将修饰连接子偶联到第二肽混合物中肽的非偶联偶联位点,获得第三肽混合物;以及使用lc-ms分析第三肽。可选地,在lc-ms分析之前,第三肽混合物可进行第三酶消化,减少肽的可变性,简化lc-ms的定量。在某些优选实施例中,所述第一酶为胰蛋白酶,所述第二酶为木瓜蛋白酶,所述第三酶为glu-c。
[0116]
如图7所示,在其他方面,本发明所述方法包括以下步骤:用木瓜蛋白酶消化赖氨酸连接adc,去除有效载荷,然后进行还原和变性,接着对样本进行烷基化,随后用glu-c消化adc样本,获得glu-c消化的肽混合物,用asp-n消化肽混合物,然后对肽混合物进行lc-ms分析。根据含有裂解连接子的肽和不含裂解连接子的天然肽的定量可以计算位点特异性有效载荷(例如药物),例如,位点特异性有效载荷(例如药物)偶联=(含有裂解连接子的肽的数量)/(含有裂解连接子的肽的数量+天然肽的数量)。
[0117]
在其他方面,本发明提供了一种对赖氨酸连接adc的药物偶联进行量化或表征的方法,所述方法包括以下步骤:使用第一酶裂解药物有效载荷,产生含有裂解连接子的抗体;然后在样本中加入第二酶,获得肽混合物;以及根据对含有裂解连接子和/或不含有裂解连接子的肽进行量化,对肽混合物进行质量分析,从而对特异性赖氨酸偶联位点进行量化或表征。
[0118]
由于存在不理想的adc种类,对adc异质性的担忧导致对adc位点特异性药物偶联
定量和表征(例如药物偶联的位点特异性定量)的需求不断增加,从而提高药物的安全性和疗效。本发明公开的示例性实施例满足上述需求。本发明提供了对与adc特异性偶联位点连接的附着物偶联进行量化或表征的方法来满足上述需求。这些方法满足了长期以来对adc药物偶联的位点特异性定量或量化的需求,确保明确的dar和与药物安全性和疗效相关的同质性程度。
[0119]
除非另有说明,否则本发明所用的所有技术和科学术语均具有本发明所属领域普通技术人员公知的相同含义。虽然在实践或测试中可使用与本发明所述方法和材料类似或等效的任何方法和材料,但在此仅描述特定方法和材料。本说明书引用了各种出版物,包括专利、专利申请、已发表的专利申请、技术文献和学术文献。所有参考文献和提及的出版物通过本发明的整体引用,成为本发明的一部分。
[0120]
术语“一个(a)”应理解为“至少一个”;术语“大约(about)”和“大约(approximately)”应理解为允许本领域普通技术人员理解的标准偏差;只要提供了范围,即包含端点。本发明使用的术语“包括(include)”、“包括(includes)”和“包括(including)”是非限制性的,并分别理解为“包括(comprise)”、“包括(comprises)”和“包括(comprising)”。
[0121]
在某些方面,本发明提供了一种对与样本中部分偶联肽或蛋白至少一个特异性偶联位点连接的至少一个附着位点特异性偶联进行量化或表征的方法,包括以下步骤:对部分附着物进行裂解,产生含有裂解连接子的肽或蛋白,其中,所述附着物包含裂解连接子;在所述部分偶联肽或蛋白的非偶联偶联位点增加修饰连接子;以及对样本进行质量分析,识别含有所述裂解连接子和/或所述修饰连接子的肽或蛋白。在某些方面,在本发明所述的方法中,所述肽或蛋白是一种抗体、抗体片段、抗体fab区、抗体fc区或融合蛋白。
[0122]
在本发明中,术语“偶联肽或蛋白”是指通过具有不稳定键的连接子连接到生物活性药物上的肽或蛋白,包括“抗体-药物偶联物”或“adc”。偶联肽、偶联蛋白、抗体-药物偶联物或adc可包含多个生物活性药物分子(或有效载荷),这些分子可以共价连接到偶联位点上,例如,偶联肽、偶联蛋白或抗体的氨基酸残基的侧链(siler panowski等人,用于癌症治疗的位点特异性抗体药物偶联物,6mabs 34
–
45(2013))。用于adc的抗体能够以足够的亲和力结合,在靶位点选择性积累并持久保留。大多数adc的kd值都在纳米摩尔范围内。有效载荷的效力可在纳米摩尔/皮摩尔范围内,并且可在adc分布到靶组织后达到可实现的细胞内浓度。在有效载荷和抗体之间形成连接的连接子能够在循环中保持充分稳定,以利用抗体基团的药代动力学特性(如长半衰期),并使有效载荷在分布到组织上时附着在抗体上,并且在adc被吸收到靶细胞后,可有效释放生物活性药物。连接子可包括在细胞加工中不可裂解的连接子以及adc到达靶位点后即可裂解的连接子。对于不可裂解的连接子,在细胞内释放的生物活性药物包括有效载荷和仍然附着在抗体氨基酸残基上的连接子的所有构件(一般为赖氨酸或半胱氨酸残基),随后adc在溶酶体内经过完全蛋白降解。可裂解连接子是指在有效载荷和抗体上胺基酸连接位点之间存在裂解位点的连接子。裂解机制可包括酸性细胞内区室中酸不稳定键的水解、通过细胞内蛋白酶或酯酶对酰胺键或酯键进行酶裂解、通过细胞内还原环境对二硫键进行还原裂解。
[0123]
本发明使用的“抗体”是指由四条多肽链、两条重链(h)和两条轻链(l)组成的免疫球蛋白分子。每个重链具有一个重链可变区(hcvr或vh)和一个重链恒定区。重链恒定区由
三个结构域(ch1、ch2和ch3)组成。每个轻链具有一个轻链可变区和一个轻链恒定区。轻链恒定区由一个结构域(cl)组成。vh和vl区域可进一步细分为高可变性区(称为互补性决定区(cdr))以及散布的更保守区域(称为框架区(fr))。每个vh和vl可由三个cdr和四个fr组成,从氨基末端到羧基末端的排列顺序如下:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4。术语“抗体”包括任何同种型或亚类的糖基化和非糖基化免疫球蛋白。术语“抗体”包括但不限于通过重组方法制备、表达、创造或分离的抗体,如从转染后表达抗体的宿主细胞中分离的抗体。igg包括一个亚群的抗体。
[0124]
在本发明中,术语“肽”或“蛋白”包括任何共价连接的酰胺键的氨基酸聚合物。蛋白包含一个或多个氨基酸聚合物链,在本领域通常称为“肽(peptide)”或“多肽(polypeptide)”。蛋白可含有一种或多种多肽,从而形成单一功能的生物分子。在某些方面,蛋白可以是抗体、多特异性抗体、抗体片段、单克隆抗体、宿主细胞蛋白或其组合。
[0125]
在本发明中,术语“抗体片段”包括完整抗体的一部分,例如,抗体的抗原结合区或可变区。抗体片段的示例包括但不限于fab片段、fab’片段、f(ab’)2片段、fc片段、scfv片段、fv片段、dsfv双特异性抗体、dab片段、fd’片段、fd片段和独立互补性决定区(cdr),以及三特异性抗体、四特异性抗体、线性抗体、单链抗体分子以及由抗体片段形成的多特异性抗体。fv片段是免疫球蛋白重链和轻链可变区的组合,scfv蛋白是重组单链多肽分子,其中免疫球蛋白轻链和重链可变区通过肽连接子连接。可通过不同方法产生抗体片段。例如,可通过完整抗体的片段化以酶促或化学方式产生抗体片段,和/或可由编码部分抗体序列的基因重组产生抗体片段。可替代地或另外,可完全或部分合成产生抗体片段。抗体片段可选包含单链抗体片段。可替代地或另外,抗体片段可包含多个例如通过二硫键连接在一起的链。抗体片段可选包含多分子复合物。
[0126]
在某些方面,在本发明所述的方法中,对样本进行质量分析,识别含有所述裂解连接子和/或所述修饰连接子的肽或蛋白。在某些方面,本发明所述方法进一步包括根据对裂解连接子和修饰连接子的量化,对所述附着物的位点特异性偶联进行量化或表征。在某些方面,本发明所述方法中的质量分析为质谱分析或液相色谱质谱分析。在某些方面,本发明所述方法中的质谱仪可以是电喷雾电离质谱仪、纳升电喷雾电离质谱仪或三重四极杆质谱仪,其中,所述质谱仪可与液相色谱系统连接,其中,所述质谱仪能够进行lc-ms(液相色谱-质谱法)、lc-mrm-ms(液相色谱-多反应监测-质谱法)或lc-ms/ms分析。
[0127]
在本发明中,“质谱仪”包括一种能够识别特异性分子种类并测量其准确质量的装置。此术语旨在包括任何分子检测器,其中,可对多肽或肽进行洗脱,从而进行检测和/或表征。质谱仪可包括三大部分:离子源、质量分析器和检测器。离子源的作用是产生气相离子。分析物原子、分子或团簇可转移到气相中,同时(与电喷雾电离一样)进行电离。离子源的选择主要取决于具体应用情况。
[0128]
在本发明中,术语液相“色谱法”是指一种工艺,其中,由于化学实体的分布不同,当它们在稳定液相或固相周围或上方流动时,液体或气体所携带的化学混合物可分离为各种组分。色谱法的非限制性示例包括传统的反相色谱法(rp)、离子交换色谱法(iex)、混合模式色谱法和正相色谱法(np)。
[0129]
在本发明中,术语“电喷雾电离”或“esi”是指喷雾电离工艺,其中溶液中的阳离子或阴离子通过在大气压下形成和去溶高电荷液滴流而转移到气相,而高电荷液滴流是在含
有溶液的电喷雾针尖和对电极之间施加电位差产生的。采用溶液中的电解离子产生气相离子一般有三个主要步骤,包括:(a)在es输注尖端产生带电液滴;(b)带电液滴通过溶剂蒸发和反复的液滴分解而收缩,形成能产生气相离子的高电荷小液滴;(c)从非常小的高电荷液滴产生气相离子的机制。通常在仪器的大气压力区进行阶段(a)-(c)。在某些方面,所述电喷雾电离质谱仪可以是纳升电喷雾电离质谱仪。
[0130]
在本发明中,术语“三重四极杆质谱仪”是指一个由两个串联四极杆质量分析器组成的串联质谱仪,其中,它们之间的(非质量解析)射频(rf)四极杆对细胞作用进行碰撞诱导解离。在三重四极杆质谱仪中,将肽样本注射到与ms仪器连接的lc中。第一个四极杆可用作质量过滤器,用于分离具有目标m/z的肽。第二个四极杆用作将肽分解成片段的碰撞池。第三个四极杆可以用作第二个质量过滤器,用于过滤来自初始亲本肽的特定m/z片段。在本发明中,术语“串联质谱法"包括一种可采用多个阶段的质量选择和质量分离获得样本分子结构信息的技术。一个先决条件是可将样本分子转移到气相中,并完好无损地电离,并且可在第一个质量选择步骤后以某种可预测和可控的方式将其诱导分离。只要可获得有意义的信息或碎片离子信号可检测,即可通过以下步骤执行多级ms/ms或msn:首先选择并分离前体离子(ms2),使其裂解,分离主要碎片离子(ms3),使其裂解,分离次要碎片(ms4)。已使用各种分析器组合成功执行串联ms。将哪种分析器组合用于某种应用可由多个不同的因素决定,如灵敏度、选择性和速度,以及尺寸、成本和可用性。两大类的串联ms法为空间串联和时间串联,但也可混合使用,即时间串联分析器在空间上连接或与空间串联分析器连接。空间串联质谱仪包括一个离子源、一个前体离子激活装置以及至少两个非捕获质量分析器。可设计特定的m/z分离功能,以便在仪器的一个部分中选择离子,在中间区解离,然后将产物离子传输到另一个分析器进行m/z分离和数据采集。在时间串联质谱仪中,可在相同的物理装置中对离子源中产生的离子进行捕获、分离、裂解和m/z分离。
[0131]
示例性实施例
[0132]
本发明所述实施例提供了对与样本中部分偶联肽或蛋白至少一个特异性偶联位点连接的至少一个附着物偶联进行量化或表征的方法。
[0133]
在某些方面,本发明提供了一种对与样本中部分偶联肽或蛋白至少一个特异性偶联位点连接的至少一个附着物偶联进行量化或表征的方法,包括以下步骤:对部分所述至少一个附着物进行裂解,产生含有裂解连接子的肽或蛋白,其中,所述附着物包含裂解连接子;在所述部分偶联肽或蛋白的非偶联偶联位点增加修饰连接子;以及对样本进行质量分析,识别含有所述裂解连接子和/或所述修饰连接子的肽或蛋白。
[0134]
在某些方面,使用酶(例如,木瓜蛋白酶、组织蛋白酶b或纤溶酶)对所述部分附着物进行裂解,其中,酶底比为约1:0.1-约1:100、约1:10-约1:300、约1:10-约1:250、优选约1:20、优选约1:200、约1:0.2、约1:0.5、约1:1、约1:1.5、约1:2、约1:3、约1:4、约1:5、约1:10、约1:15、约1:25、约1:30、约1:35、约1:40、约1:45、约1:50、约1:55、约1:60、约1:65、约1:70、约1:75、约1:80、约1:85、约1:90或约1:95。在约25-45℃下进行酶消化,时间约1分钟至隔夜;在约37℃下进行,时间约0.5小时,优选约1小时、约1.5小时、约2小时、约3小时或少于4小时。
[0135]
在其他方面,在所述部分偶联肽或蛋白的非偶联偶联位点增加修饰连接子。所述修饰连接子与肽在室温下培养约2小时,或在18-37℃下培养约1分钟至隔夜,其中,所述肽
与连接子摩尔比优选约1:500、约1:10-约1:2000、约1:20、约1:50、约1:100、约1:200、约1:300、约1:400、约1:600、约1:700、约1:800、约1:1000、约1:1200、约1:1500或约1:1800。
[0136]
应理解的是,所述方法不限于上述任何肽、蛋白、抗体、抗体-药物偶联物、抗原-抗体复合物、蛋白药品、色谱柱或质谱仪。
[0137]
本发明所述方法步骤的数字和/或字母连续标记并不意味着将所述方法或任何实施例限制为特定显示顺序。
[0138]
参考以下示例可更充分了解本发明,提供这些示例是为了更详细地描述本发明。这些示例旨在对本发明进行说明,不应视为限制本发明的范围。
[0139]
示例
[0140]
材料和方法
[0141]
1.可裂解和修饰连接子
[0142]
如图8a所示,lk1是连接蛋白和有效载荷的可裂解连接子。lk1含有一个特异性氨基酸序列作为通过蛋白酶(例如组织蛋白酶b或木瓜蛋白酶)识别的酶裂解位点,例如缬氨酸-丙氨酸二肽(va二肽)。lk1连接子可通过马来酰亚胺附着基团(mal-酰胺)与肽或蛋白半胱氨酸残基的巯基偶联。如图8a所示,lk1连接子(例如mal-酰胺-peg8-va-paba)的附着物包括一个peg8(聚乙二醇-8)作为第一间隔子、一个缬氨酸-丙氨酸二肽作为酶裂解位点以及一个paba作为第二间隔子。sg3199,即一种细胞毒性化合物,是加载到lk1的药物有效载荷。图8b显示了裂解lk1(例如mal-酰胺-peg8-va)的附着物,在lk1的蛋白酶消化释放有效载荷后产生所述附着物,其中,从偶联中去除paba和有效载荷。在质量分析中,包括有效载荷的lk1表示为+1495.7,裂解lk1表示为+762.2。lk2,例如lk1的修饰连接子(修饰lk1),是含有peg8的连接子。图8c显示了lk2连接子的附着物。lk2连接子可通过马来酰亚胺附着基团(mal-酰胺)与肽或蛋白半胱氨酸残基的巯基偶联。因为lk2不含缬氨酸-丙氨酸二肽,所以裂解lk1(图8b)和lk2(图8c)之间存在质量差异。lk2可通过马来酰亚胺附着基团与肽或蛋白半胱氨酸残基的巯基偶联,例如,mal-酰胺-peg8-cooh。在质量分析中,lk2表示为+592.3。在质量分析中,包括有效载荷的lk1表示为+1495.7,裂解lk1表示为+762.2。paba(对氨基苯甲醇)的分子量约为137.1da。sg3199(药物有效载荷)的分子量约为584.7da。
[0143]
如图8d所示,lk3是连接蛋白和有效载荷的可裂解连接子。lk3含有一个特异性氨基酸序列作为通过蛋白酶(例如组织蛋白酶b或木瓜蛋白酶)识别的酶裂解位点,例如缬氨酸-瓜氨酸二肽(val-cit二肽)。lk3连接子可通过马来酰亚胺附着基团(mal-酰胺)与肽或蛋白半胱氨酸残基的巯基偶联。如图8d所示,lk3连接子(例如mal-酰胺-val-cit-paba)的附着物包括作为酶裂解位点的缬氨酸-瓜氨酸二肽和作为间隔子的paba。美登素(may),即一种细胞毒性化合物,是加载到lk3的药物有效载荷。图8e显示了裂解lk3(例如mal-酰胺-val-cit)的附着物,在lk3的蛋白酶消化释放有效载荷后产生所述附着物,其中,从偶联中去除paba和有效载荷。在质量分析中,包括有效载荷的lk3表示为+1332.6,裂解lk3表示为+467.2。lk4,例如lk3的修饰连接子(修饰lk3),是含有缬氨酸-瓜氨酸二肽的连接子。图8f显示了lk4连接子的附着物。lk4连接子可通过马来酰亚胺附着基团(mal-酰胺)与肽或蛋白半胱氨酸残基的巯基偶联,例如,mal-酰胺-val-cit。在质量分析中,lk4表示为+453.2。在质量分析中,包括有效载荷美登素的lk3表示为+1332.6,裂解lk3表示为+467.2。
[0144]
如图8g所示,lk5是连接蛋白和有效载荷的可裂解连接子。lk5含有一个特异性氨
基酸序列作为通过蛋白酶(例如组织蛋白酶b或木瓜蛋白酶)识别的酶裂解位点,例如缬氨酸-瓜氨酸二肽(val-cit二肽)。lk5连接子可使用活化羧酸酯或nhs酯通过赖氨酸酰胺偶联与肽或蛋白的赖氨酸残基偶联。如图8g所示,lk5连接子(例如adip-val-cit-pab-nme)的附着物包括作为酶裂解位点的缬氨酸-瓜氨酸二肽。美登素(may),即一种细胞毒性化合物,是加载到lk5的药物有效载荷。图8h显示了裂解lk5(例如adip-val-cit)的附着物,在lk5的蛋白酶消化释放有效载荷后产生所述附着物。在质量分析中,包括有效载荷的lk5表示为+1249.6,裂解lk5表示为+384.2。图8i显示了抗体的非偶联赖氨酸残基的化学结构。
[0145]
2.制备抗体-药物偶联物(adc)
[0146]
使用mab1(例如,297残基(n297q)突变的单克隆抗体(igg1))制备adc。由于297残基的突变,mab1失去了糖基化位点。如图9a所示,还原抗体的链间二硫键,在抗体的半胱氨酸残基内衍生巯基(
–
sh)。然后将巯基用作制备adc的偶联位点。adc样本缓冲液含有5%甘油的pbs。如图9b所示,载有有效载荷药物sg3199的lk1连接子通过马来酰亚胺附着基团与mab1的半胱氨酸残基偶联,得到adc。衍生的mab1-lk1 adc(例如ab-mal-酰胺-peg8-va-paba-sg3199)具有释放药物有效载荷的裂解位点。mab1-lk1-sg3199 adc的dar约为3.6。包含有效载荷sg3199的lk1的分子量约为1495.7da。peg间隔臂(例如peg8)的长度约为mab1-lk1-sg3199 adc的蛋白酶可裂解位点是缬氨酸-丙氨酸二肽(val-ala或va)。
[0147]
如图9c所示,载有有效载荷药物美登素(may)的lk3连接子通过马来酰亚胺附着基团与mab1的半胱氨酸残基偶联,得到adc。衍生的mab1-lk3-may adc(例如ab-mal-酰胺-val-cit-paba-美登素(ab-mc-vcit-paba-nme-may))具有释放药物有效载荷的裂解位点。mab1-lk3-may adc的dar约为2.2。包含有效载荷美登素的lk3的分子量约为1332.6da.mab1-lk3-may adc的蛋白酶可裂解位点是缬氨酸-瓜氨酸二肽(val-cit或vcit)。l-瓜氨酸(cit)是一种天然存在的氨基酸,可转化为l-精氨酸和一氧化氮。
[0148]
使用mab2和lk5制备赖氨酸连接抗体偶联物。lk5连接子可使用活化羧酸酯或nhs酯通过赖氨酸酰胺偶联与mab2的赖氨酸残基偶联。每个重链上约有25个赖氨酸残基,每个轻链上约有10个赖氨酸残基。mab2是一种靶向两个不同表位的双特异性抗体。准备两个不同批次的mab2-lk5 adc,dar值分别约为2.9和2.7。
[0149]
3.glu-c消化
[0150]
glu-c是一种从金黄色葡萄球菌中分离出来的丝氨酸蛋白酶。glu-c(例如v-8蛋白酶)是一种内切蛋白酶,当在碳酸氢铵和乙酸铵缓冲液中进行反应时,glu-c能特异性裂解谷氨酸残基的羧基侧,从而产生数量有限的肽片段。在磷酸盐缓冲液中的谷氨酸和天冬氨酸残基处也可能发生glu-c裂解。glu-c是一种高度特异性胞内蛋白酶,用于提高质谱蛋白鉴定应用中的序列覆盖率。glu-c可单独使用或与胰蛋白酶或其他蛋白酶结合使用,以产生用于肽图和蛋白测序的互补蛋白消化物。glu-c可还原铰链区肽c端异质性(th
↑
t
↑
cppcpape
↑
l)。
[0151]
4.asp-n消化
[0152]
asp-n是一种可单独使用或与胰蛋白或其他蛋白酶同时使用产生用于肽图和蛋白测序的蛋白消化物的锌金属蛋白酶。asp-n是一种胞内蛋白酶,主要在半胱氨酸残基氧化产生的天冬氨酸残基和半胱磺酸残基的氨基侧裂解,产生数量有限的肽片段。在谷氨酸残基
处也可能发生asp-n裂解。asp-n可以在37℃下条件下在2-20个小时内有效消化蛋白。
[0153]
5.实验试剂制备
[0154]
4.1.用于质谱分析的流动相a(0.05%tfa milli-q水混合液):在2l pyrex玻璃瓶中,在2l milli-q水中加入1ml tfa(三氟乙酸)。将瓶子倒置3-4次进行混合。在室温下储存最多3个月。
[0155]
4.2.用于质谱分析的流动相b(0.045%tfa乙腈混合液):在1l pyrex玻璃瓶中,在1l乙腈中加入0.45ml tfa。将瓶子倒置3-4次进行混合。在室温下储存最多3个月。
[0156]
4.3.5mm乙酸溶液:用milli-q水将14.3μl冰醋酸稀释至50ml,并充分混合。在4℃下储存最多3个月。
[0157]
4.4.0.1m tcep储备液:在milli-q水中溶解28.7mg tcep-hcl(三(2-羧基乙基)磷盐酸盐),并将最终体积调整至1ml。制备50μl等分试样,并在-20℃下储存最多3个月。
[0158]
4.5.8m尿素100mm tris-hcl混合液:在640μl的100mm tris-hcl(ph 7.5)中溶解0.48g尿素,使最终体积达到1ml。搅拌直至完全溶解,并使用微型离心机在14,000g下离心3分钟。每次现用现制。实验称取0.4829g尿素。
[0159]
4.6.5%tfa溶液:用190ul milli-q水稀释10ul tfa,充分混合。
[0160]
4.7.0.1mg/ul新标记储备液:在100ul dmso(二甲亚砜)中溶解各标记10mg,使其成为0.1mg/ul储备液。制备2ul/ea等分试样
[0161]
4.8.木瓜蛋白酶激活缓冲液(1.1mm edta、0.067mm巯基乙醇和5.5mm半胱氨酸):在2ml水中加入4.4ul 0.5m edta、2.4ul 55mm巯基乙醇和1.73mg半胱氨酸,充分混合。
[0162]
6.新标记测试方法
[0163]
根据adc样本的浓度,将25μg每种样本转移到新的微量离心管中,加水至总体积10μl。用180ul木瓜蛋白酶消化缓冲液稀释20ul木瓜蛋白酶悬浮液(10mg/ml),在37℃下培养30分钟。用120ul激活缓冲液将30ul木瓜蛋白酶(标示浓度1mg/ml)稀释至标示浓度0.2mg/ml。用木瓜蛋白酶激活缓冲液作为空白缓冲液,在280nm和320nm处用uv(紫外线)测量木瓜蛋白酶的浓度。用木瓜蛋白酶激活缓冲液将活化木瓜蛋白酶稀释至最终浓度0.1mg/ml。在完整adc中加入1.25ul 0.1mg/ml木瓜蛋白酶溶液(酶:底物比为1:200),在37℃下培养1小时。在每个样本中加入0.5μl 0.1m tcep-hcl。搅拌样本3分钟,然后用微型离心机将样本离心3秒。样本在95℃下培养20分钟,同时在恒温混匀仪中以800rpm的速度振荡。培养后,将样本冷却至室温5分钟。使用微型离心机将冷凝物离心3秒。在1mtris-hcl(ph 7.5)中向每个样本添加6μl 8m尿素。在520μl的milli-q水中重构测序级修饰胰蛋白酶(20μg/瓶),最终浓度为0.038μg/μl。如果需要多瓶胰蛋白酶,将不同瓶的胰蛋白酶溶液混合。每个样本加入32.5μl 0.038μg/μl胰蛋白酶溶液。在37℃的黑暗环境下培养样本3小时,同时用恒温混匀仪以800rpm的速度振荡。用水将0.1m tcep稀释至0.05m tcep。每个样本加入0.8ul 0.05m tcep。在40ul milli-q水中重构测序级glu-c(10ug/瓶),最终浓度为0.25ug/ul。在每个样本中加入5ul 0.25ug/ul glu-c溶液。在37℃的黑暗环境下培养样本1.5小时,同时用恒温混匀仪以800rpm的速度振荡。用dmso或水稀释标记连接子,每个样本加入标记连接子(根据不同adc的连接子结构),使连接子与adc的游离巯基相比过量。在室温下培养2小时。用0.6ul 5%tfa酸化消化混合物。将10μl每种样本注入与thermo scientific q exactive或q exactive plus混合四极轨道阱质谱仪连接的waters acquity i-class uplc。将剩余的
消化样本储存在-80℃的冷冻箱中。将剩余溶液冷冻,用于酶标记优化实验。
[0164]
示例1.确定mab1-lk1 adc的药物抗体比
[0165]
使用完整质量确定mab1-lk1 adc的药物抗体比(dar)。如图10所示,计算并估计平均dar为2.34(x轴:强度/[计数];y轴:观察到的质量[m/z]1.45e5-1.58e5)。mab1-lk1 adc具有异质性和各种变体,例如尺寸变体和电荷变体。
[0166]
示例2.去除adc中的有效载荷
[0167]
使用木瓜蛋白酶去除mab1-lk1 adc中的有效载荷。将木瓜蛋白酶(1mg/ml)在37℃下在木瓜蛋白酶激活缓冲液(1.1mm edta、0.067mm巯基乙醇和5.5mm半胱氨酸)中活化30分钟。用胰蛋白酶消化mab1-lk1 adc,获得胰蛋白酶肽混合物。然后,使用活化木瓜蛋白酶在37℃下消化胰蛋白酶肽混合物4小时左右,去除有效载荷,例如sg3199。酶底比为1:20。对重链和轻链之间的链间二硫键进行还原。使用lc-ms分析两种胰蛋白酶肽,例如,scdk(丝氨酸-半胱氨酸-天冬氨酸-赖氨酸)和gec(甘氨酸-谷氨酸-半胱氨酸)。如图11所示,在1小时内完全去除有效载荷。木瓜蛋白酶可识别lk1连接子中的缬氨酸-丙氨酸二肽。如图9b所示,木瓜蛋白酶的裂解位点在缬氨酸-丙氨酸二肽和paba之间。木瓜蛋白酶消化后,从lk1连接子附着物中去除paba和sg3199,产生质量损失。含有lk1的胰蛋白酶肽在图11中标记为+1495.7(包括有效载荷)。含有lk1的胰蛋白酶肽在图11中标记为+762.4。
[0168]
在37℃下1小时通过1:20的酶底比实现了使用木瓜蛋白酶消化去除有效载荷的完全裂解。使用可逆的木瓜蛋白酶抑制剂(例如ggyr)或不可逆的木瓜蛋白酶抑制剂(例如胰凝乳蛋白酶抑制剂),在95℃下加热20分钟,淬灭木瓜酶活性,结束消化反应。
[0169]
示例3.使用木瓜蛋白酶消化胰蛋白酶铰链区肽
[0170]
用胰蛋白酶消化mab1-lk1 adc,然后用木瓜蛋白酶消化,获得用于lc-ms分析的肽。通过识别lk1中的缬氨酸-丙氨酸二肽,使用木瓜蛋白酶去除有效载荷。如图9b所示,木瓜蛋白酶裂解位点位于lk1连接子中的缬氨酸-丙氨酸二肽和paba之间。如图12a所示,木瓜蛋白酶是一种优选裂解靠近大疏水或芳香氨基酸位点的蛋白酶。因此,木瓜蛋白酶还能将胰蛋白酶肽消化成较小片段。当通过胰蛋白酶消化抗体产生胰蛋白酶肽时,会产生最初位于抗体铰链区的胰蛋白酶肽,其氨基酸序列为thtcppcpapellggpsvflfppkpk(seq id no.:1)。此胰蛋白酶铰链区肽包含两个半胱氨酸残基(c),这两个半胱氨酸残基是通过马来酰亚胺附着基团附着连接子-有效载荷的偶联位点。如图12b所示,这种胰蛋白酶铰链区肽还包含多个木瓜蛋白酶裂解位点。木瓜蛋白酶的裂解位点在图12b中用箭头符号表示。
[0171]
用胰蛋白酶消化mab1-lk1 adc,获得胰蛋白酶肽混合物。然后,使用活化木瓜蛋白酶消化胰蛋白酶肽混合物。如图13a-图13c所示,使用lc-ms分析通过木瓜蛋白酶消化的胰蛋白酶铰链区肽。在图13a中,含有lk1的肽表示为+1495.7(包括有效载荷)。在图13a-图13c中,含有lk1的肽表示为+762.4。图13a-图13c显示了胰蛋白酶铰链区肽(图13a,氨基酸序列为thtcppcpapellggpsvflfppkpk(seq id no.:1))、氨基酸序列为cppcpape(seq id no.:2)的肽(图13b,用木瓜蛋白酶消化的胰蛋白酶铰链区肽)以及氨基酸序列为cppcpapell(seq id no.:3)的肽(图13c,用木瓜蛋白酶消化的胰蛋白酶铰链区肽)的分析结果。这些肽可能含有lk1(表示为+1495.7,包括有效载荷)或裂解lk1(表示为+762.4)。
[0172]
示例4.将修饰连接子附着在非偶联半胱氨酸残基上
[0173]
用胰蛋白酶消化具有高或低dar的mab1-lk1 adc,产生胰蛋白酶肽混合物。通过识
别lk1中的缬氨酸-丙氨酸二肽,使用木瓜蛋白酶去除有效载荷。木瓜蛋白酶还能将胰蛋白酶肽消化成较小片段。通过木瓜蛋白酶消化胰蛋白酶肽混合物,然后使用修饰连接子标记木瓜蛋白酶胰蛋白酶肽。在室温下将含有peg8-cooh(如图8c所示)的修饰连接子与肽在2mm tcep(三(2-羧基乙基)磷盐酸盐中培养约2小时,肽与连接子的摩尔比为1:500。修饰连接子通过马来酰亚胺附着基团附着在非偶联半胱氨酸残基上,提高肽的质量。因此,与含有裂解lk1的偶联肽相比,含有非偶联半胱氨酸肽的质量补偿了质量差。图14显示了铰链区肽的连接子标记效率。铰链区肽含有两个半胱氨酸残基。如图14所示,大多数铰链区肽具有双重标记,这表明修饰连接子(lk2)完成在非偶联半胱氨酸残基上的附着。由于连接子完成了附着,连接子可以根据裂解lk1和lk2的标记定量来计算位点特异性药物偶联,例如,位点特异性药物偶联=(标记的裂解lk1)/(标记的lk2+标记的裂解lk1)。
[0174]
示例5.lc-ms分析前的glu-c消化
[0175]
用胰蛋白酶消化mab1-lk1 adc,产生胰蛋白酶肽混合物。通过识别lk1中的缬氨酸-丙氨酸二肽,使用木瓜蛋白酶去除有效载荷。木瓜蛋白酶还能将胰蛋白酶肽消化成较小片段。通过木瓜蛋白酶(约30分钟)消化胰蛋白酶肽混合物,然后使用修饰连接子(例如lk2)标记木瓜蛋白酶胰蛋白酶肽的非偶联偶联位点。在lc-ms分析前进行lk2标记后,使用glu-c消化肽混合物。在木瓜蛋白酶消化后,获得多于9个铰链区肽。如图15所示,由于使用了glu-c,铰链区肽的分布减少至三个肽(氨基酸序列为thtcppcpape(seq id no.:4)、tcppcpape(seq id no.:5)和cppcpape(seq id no.:6)),这明显简化了使用lc-ms的定量。对于glu-c消化,酶底比为1:20,在37℃下消化3小时。
[0176]
示例6.mab1-lk1 adc的药物偶联的位点特异性定量
[0177]
如图6a所示,通过本发明所述的方法分析两种mab1-lk1 adc样本,例如,一种样本具有低dar,另一种样本具有高dar,其中,在非偶联偶联位点上增加修饰连接子的步骤之前,进行使用木瓜蛋白酶去除有效载荷的步骤。通过胰蛋白酶消化两种mab1-lk1 adc样本,产生胰蛋白酶肽混合物,然后通过识别lk1中的缬氨酸-丙氨酸二肽使用木瓜蛋白酶消化,去除有效载荷。然后,使用修饰连接子(例如lk2)标记木瓜蛋白酶胰蛋白酶肽的非偶联偶联位点。lk2标记后,通过glu-c消化木瓜蛋白酶,然后进行lc-ms分析。具有低dar的mab1-lk1 adc样本(例如mab1-lk1-l19),估计dar为1.9(完整,esi)。具有高dar的mab1-lk1 adc样本(例如mab1-lk1-l8),估计dar为3.6(完整,esi)。每种mab1-lk1 adc样本制备三份(n=3)。图16显示了mab1-lk1 adc的药物偶联的位点特异性定量。图中显示了两种肽的峰面积,例如,氨基酸序列为scdk或gec的肽。这些肽可能含有裂解lk1(表示为+762.4)和/或裂解lk2(表示为+592.3)。含有lk2(+592.3)肽的峰面积表示对最初非偶联的偶联位点的定量。含有lk1(+762.4)肽的峰面积表示最初与一种药物有效载荷偶联的偶联位点的定量。此外,因为本发明所述方法的计算dar值与完整质量法相当,所以本发明所述方法(例如,图6a中的方法)显示出如图17所示的良好日内和日间精密度。图17显示了gec肽、scdk肽和铰链区肽的分析结果。
[0178]
示例7.去除有效载荷前用修饰连接子标记
[0179]
并排比较了两种方法,例如图6a和图6b中所示的两种方法。进行图6a所示的一种方法来分析mab1-lk1 adc样本,其中,在进行用修饰连接子(lk2)标记步骤之前,进行用木瓜蛋白酶去除有效载荷的步骤。用胰蛋白酶消化具有高dar的mab1-lk1 adc样本,产生胰蛋
白酶肽。然后,通过识别lk1中的缬氨酸-丙氨酸二肽,使用木瓜蛋白酶消化胰蛋白酶肽,去除有效载荷。然后,使用修饰连接子(例如lk2)标记肽的非偶联偶联位点。通过glu-c消化肽,然后进行lc-ms分析。分析结果如图18a所示。
[0180]
进行图6b所示的其他方法分析mab1-lk1 adc样本,其中,在使用目标蛋白酶去除有效载荷之前,进行用修饰连接子(lk2)标记的步骤。用胰蛋白酶消化具有高dar的mab1-lk1 adc样本,产生胰蛋白酶肽。然后,使用修饰连接子(例如lk2)标记胰蛋白酶肽的非偶联偶联位点。然后,通过识别lk1中的缬氨酸-丙氨酸二肽,使用木瓜蛋白酶消化肽,去除有效载荷。通过glu-c消化肽,然后进行lc-ms分析。分析结果如图18b所示。
[0181]
比较结果如图18a和图18b所示。图18a显示了按照图6a所示方法进行木瓜蛋白酶消化后lk2附着的结果。图18b显示了示例性实施例所述的按照图6b所示方法进行lk2附着后木瓜蛋白酶消化的结果。分析了高dar的mab1-lk1 adc样本。(+592.3,+592.3)表示0偶联。(+762.4,+592.3)表示一个药物偶联。(+762.4,+762.4)表示两个药物偶联。存在偶联药物有效载荷可能导致在铰链区肽内出现优选木瓜蛋白酶位点。优选木瓜蛋白酶裂解可能导致位阻效应,例如旁观者效应。在进行使用木瓜蛋白酶去除有效载荷的步骤之前,进行了通过修饰连接子(lk2)标记的步骤,减少了优选木瓜蛋白酶裂解。
[0182]
示例8.木瓜蛋白酶消化作为初始步骤
[0183]
考虑到adc的木瓜蛋白酶非特异性消化,对各种顺序的多个步骤进行了测试,以尽量减少非特异性消化。在进行其他步骤之前,例如用胰蛋白酶消化样本、用glu-c消化样本或将修饰连接子与非偶联巯基(例如标记)偶联之前,先用木瓜蛋白酶消化几种adc去除有效载荷。
[0184]
如图6c所示,测试发现,多个步骤的优选顺序是首先用木瓜蛋白酶消化adc样本,去除有效载荷,然后进行还原和变性,接着用胰蛋白酶消化样本,随后用glu-c消化胰蛋白酶肽混合物,然后将修饰连接子与非偶联巯基(例如标记)偶联,最后对肽混合物进行lc-ms分析。
[0185]
进一步研究了从adc分析获取的胰蛋白酶肽的片段化。通过连接子二肽结构上的密集碎片化,对某种肽鉴定(id)进行了修饰。对含有裂解lk1(mal-酰胺-peg8-val-ala)或裂解lk3(mal-酰胺-val-cit)的胰蛋白酶肽scdk进行分析,观察产生小成分的密集片段化。图19a显示了含裂解lk1(mal-酰胺-peg8-val-ala)胰蛋白酶肽scdk的连接子二肽结构的密集片段化的质量分析。图19b显示了含裂解lk3(mal-酰胺-val-cit)胰蛋白酶肽scdk的连接子二肽结构的密集片段化的质量分析。
[0186]
选择一些含有偶联位点的肽作为替代肽。如表1所示,选择一些含有裂解lk1或lk3的肽作为替代肽,包括gec肽、scdk肽和铰链区肽。这些替代肽包含95%以上的相关肽。图20a显示了针对mab1-lk1 adc样本识别的所有肽中特异性替代肽的百分比。图20b显示了针对mab1-lk3 adc样本识别的所有肽中特异性替代肽的百分比。
[0187]
表1.替代肽
[0188][0189]
通过监测替代肽的峰面积,优化木瓜蛋白酶消化条件。对不同木瓜蛋白酶与底物比(例如1:20、1:50、1:100和1:200)进行了测试,用于分析mab1-lk1和mab1-lk3 adc样本。随着木瓜蛋白酶浓度的增加,替代肽的总峰面积减少。图21a显示了分析mab1-lk1 adc样本时不同木瓜蛋白酶与底物比下替代肽的峰面积。图21b显示了分析mab1-lk3 adc样本时不同木瓜蛋白酶与底物比下替代肽的峰面积。结果表明,mab1-lk1 adc与mab1-lk3 adc的优选木瓜蛋白酶与底物比为1:200。
[0190]
进一步优化木瓜蛋白酶消化条件,选择优选消化时间段。在木瓜蛋白酶消化期间,通过检测含有完整lk1或lk3的肽的峰面积,在不同培养时间检测到存在完整连接子有效载荷。图22显示了在不同培养时间含有lk1或lk3的替代肽(例如gec、scdk)或含有一个或两个完整lk1或lk3的铰链肽的峰面积。关于mab1-lk1的木瓜蛋白酶消化,在木瓜蛋白酶消化一小时后检测不到lk1(含有val-ala二肽)的完整连接子有效载荷。关于mab1-lk3的木瓜蛋白酶消化,在木瓜蛋白酶消化五分钟后检测不到lk3(含有val-cit二肽)的完整连接子有效载荷。结果表明,优选木瓜蛋白酶消化时间为一小时。与lk1(例如含有val-cit二肽的底物)相比,lk3(例如含有val-ala二肽的底物)完成木瓜蛋白酶消化去除有效载荷的时间更短。
[0191]
进一步优化木瓜蛋白酶消化条件,通过监测裂解连接子有效载荷选择优选消化时间段。在木瓜蛋白酶消化期间,通过检测含有裂解lk1或lk3的肽的峰面积,在不同培养时间检测到存在裂解连接子有效载荷。图23显示了在不同培养时间含有lk1或lk3的替代肽(例如gec、scdk)或含有一个或两个裂解lk1或lk3的铰链肽的峰面积。还检测了不含有裂解连接子的铰链肽的峰面积。在培养一小时内,完成木瓜蛋白酶消化,去除了lk1和lk3的药物有效载荷。结果表明,在木瓜蛋白酶与底物比为1:200的条件下,优选木瓜蛋白酶消化时间为一小时。
[0192]
如图24a所示,通过分析gec、scdk和铰链区肽的偶联位点,估计mab1-lk1 adc的lk1偶联的位点特异性定量。如图24b所示,通过分析gec、scdk和铰链区肽的偶联位点,估计mab1-lk3 adc的lk3偶联的位点特异性定量。根据特异性肽上的偶联药物估计偶联百分比。
[0193]
例如,根据以下公式可以估计铰链区的偶联百分比:
[0194]
偶联百分比(铰链区)=0
×
(0个药物的百分比)+1
×
(1个药物的百分比)+2
×
(2个药物的百分比)
[0195]
此外,因为本发明所述方法的计算dar值与完整质量法相当,所以本发明所述方法(例如,图6c中的方法)显示了良好的日内和日间精密度。图25显示了本发明所述方法中关于gec、肽、scdk肽和铰链区肽的dar分析结果的日内和日间精密度。由于计算的总dar值与
完整质量法相当,在分析mab1-lk1 adc和mab1-lk3 adc的连接子-药物偶联的位点特异性定量中证明了良好的日内和日间精密度。根据以下公式计算dar值:
[0196]
dar=[偶联比(铰链区)+偶联比(gec)+偶联比(scdk)]
×
2。
[0197]
如表2所示,对mab1-lk1 adc在不同偶联位点的批次间差异和偶联稳定性方面进行了测试。对两个不同批次的mab1-lk1 adc(例如mab1-lk1-l8和mab1-lk1-l22)进行了测试,观察药物偶联的分布。mab1-lk1-l8的dar值为3.6。mab1-lk1-l22的dar值为3.65。图26显示了通过分析gec、scdk和铰链区肽上的偶联位点,mab1-lk1-l8和mab1-lk1-l22的药物偶联分布的批次间差异。
[0198]
表2.批次间差异和偶联稳定性
[0199][0200]
示例9.scdk肽的偶联稳定性
[0201]
由于sanderson等人发现抗cd30半胱氨酸连接adc在抗体重链上的偶联稳定性较差,对半胱氨酸连接adc的偶联稳定性进行了分析(sanderson等人,抗cd30二肽连接奥瑞他汀免疫偶联物的体内药物-连接子的稳定性,临床癌症研究,2005年1月15日;11:843-852)。通过分析lk1偶联损失,在热应力条件下分析mab1-lk1 adc。图27显示了通过在不同ph值条件下(例如ph5.5、ph6和ph6.5)分析gec、scdk和铰链区肽,mab1-lk1 adc在40℃热应力下28天的lk1偶联的损失百分比。结果表明,在scdk肽中观察到lk1偶联损失超过20%。在较低ph值条件下,损失百分比增加。
[0202]
对偶联保留与马来酰亚胺环水解的关联性进行了研究。马来酰亚胺环水解的化学机制如图28所示。图29a显示了通过在不同ph值条件下(包括ph5.5、ph6和ph6.5)分析gec、scdk和铰链区肽,马来酰亚胺环水解和偶联保留的百分比。图29b显示了偶联保留和马来酰亚胺环水解之间的相关性分析。结果表明,在重链的scdk(c位于225残基处)处马来酰亚胺环水解的趋势较低,这可能是由于偶联稳定性较差。
[0203]
示例10.赖氨酸连接adc的药物偶联的位点特异性定量
[0204]
对mab2-lk5 adc(例如赖氨酸连接adc)进行分析,对位点特异性药物偶联进行量化。如图7所示,用木瓜蛋白酶消化mab2-lk5 adc,去除有效载荷,然后进行还原和变性,接着对样本进行烷基化,随后用glu-c消化adc样本,获得glu-c消化的肽混合物,用asp-n消化肽混合物,然后对肽混合物进行lc-ms分析。根据含有裂解连接子的肽和不含裂解连接子的
天然肽的定量可以估计位点特异性药物偶联,例如,位点特异性药物偶联=(含有裂解连接子的肽的数量)/(含有裂解连接子的肽的数量+天然肽的数量)。
[0205]
如图30a、图30b和图30c所示,使用木瓜蛋白酶消化分析抗体轻链中赖氨酸208残基上的药物偶联。结果表明,在完成药物解偶联的过程中,出现了轻微的非特异性裂解。如图31a、图31b和图31c所示,使用木瓜蛋白酶消化分析抗体(hc lys393/hc
*
lys389)重链中赖氨酸393和赖氨酸389残基上的药物偶联。结果表明,在完成药物解偶联的过程中,出现了轻微的非特异性裂解。如图32a、图32b和图32c所示,使用木瓜蛋白酶消化分析抗体轻链中赖氨酸65残基上的药物偶联。结果表明,在完成药物解偶联的过程中,出现了轻微的非特异性裂解。如图33a、图33b和图33c所示,通过分析含有55氨基酸的肽,使用木瓜蛋白酶消化分析抗体轻链中赖氨酸39、42或45残基的药物偶联。结果表明,在完成药物解偶联的过程中,出现了轻微的非特异性裂解。如图34a和图34b所示,使用木瓜蛋白酶消化分析用于双重偶联的抗体(hc
*
lys64和lys75)重链中赖氨酸64和75残基上的药物偶联。结果表明,药物解偶联可提高低丰度肽种类的敏感性。低丰度肽种类的峰面积增加了20倍以上。如图35a、图35b和图35c所示,使用木瓜蛋白酶消化分析抗体(hc lys151/hc
*
lys147)重链中赖氨酸151和147残基上的药物偶联。结果表明,一种肽的药物偶联没有完成。
[0206]
在四个链的73/79个赖氨酸残基上对药物偶联进行量化。73/79个赖氨酸残基的定量结果约为92.4%。如图36所示,对mab2-lk5的各种赖氨酸残基上的药物偶联进行位点特异性定量。本发明的蛋白酶辅助药物解偶联(padd)方法允许对赖氨酸连接adc的各种赖氨酸残基上的药物偶联进行有效和可靠的位点特异性定量。平均dar=总[hc中唯一肽的偶联%]+总[hc
*
中唯一肽的偶联%]+2
×
总[lc中偶联%+hc和hc
*
中常数肽的偶联%]。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1