一种蜜蜂微观摄食动力学机制观测方法
1.本发明属于生物观测领域。更具体地,涉及一种用于观测蜜蜂微观摄食动力学机制的方法。
背景技术:
2.蜜蜂作为最重要的传粉昆虫之一,具有非常重要的生态学价值。蜜蜂在给植物授粉过程中,其停留时间主要受摄食花蜜的效率影响,相比于蝴蝶、飞蛾等具备细长吸食口器的传粉昆虫,蜜蜂具有很显著的高粘性花蜜摄食能力,这使得他们可以获得更高能量密度的液体食物。
3.食蜜昆虫在数万年的高度进化后发展出了高度适应各类摄食条件的口器结构和摄食机理。对蜜蜂饮蜜机理的深入研究,既能提高人们对蜜蜂口器机能的认知,通过合理的应用提高生态修复水平;亦能致力于仿生领域,将蜜蜂饮蜜动力学机理应用于微流体输运系统中,在仪器精度和观测方法的不断进步下,观测蜜蜂摄食过程中口器的动态调整与周围流体的相互作用成为了可能。
4.当前,研究蜜蜂微观饮蜜机理的常规观测方法是:将昆虫样本限制在1.5ml小离心管中,小离心管端部做一开口,在离心管底部充填棉花使得昆虫样本头部露于开口,利用玻璃饲喂器引导昆虫样本进行摄食,再通过高速摄像机观察样本的摄食机理。
5.这种观测蜜蜂饮蜜的方法存在以下几个缺点:1、蜜蜂无法处于自由活动状态,在狭小的限制空间中腹部会受到压迫,这种被动的饮蜜行为难以精准重现蜜蜂在自然状态下的吸食动作,并且摄食能力会受到极大影响,导致数据出现偏差,而且狭小的离心管会限制蜜蜂除口器外的其他肢体调节行为,无法对样本摄食过程中的诸多结构协同调整机制进行更深入的观察与研究;2、蜜蜂在被固定器限制的状态下,会非条件反射地做出挣脱动作,在尝试挣脱状态中的蜜蜂主动摄食蔗糖溶液(人工花蜜)的概率下降,从而极大降低实验效率;3、在限制过程中有很大的几率会对蜜蜂腹部或头部触角的重要感受器官产生损伤,这不仅会影响实验数据,并且会增大实验蜜蜂的损耗,违反了动物实验的3r原则;4、离心管的体积固定,如果实验中使用的样本体型有变化,或者被夹持的昆虫种类变了,身体形态发生了变化,那么将会出现离心管空间过小或形状不合适导致无法有效固定样本活动的结果。除了用离心管限制样本活动外,还有其他方法通过使用固定器夹紧昆虫样本的身体来达到限制昆虫行动的目的等等,这些方法同样有着以上缺点。
6.中国专利cn 105145410 a公开了一种蜜蜂行为观察器及蜜蜂观测系统,利用摄像机观察蜜蜂生活行为,虽然可以有效的全方位观测蜜蜂在蜂箱内真实的生活状态,但是无法观察蜜蜂微观摄食行为,目前还未见关于蜜蜂微观摄食动力学观测方法的报道。
技术实现要素:
7.本发明要解决的技术问题是为克服上述蜜蜂摄食机制观测方法中的不足,提供一种高精度动态观测方案,能探索蜜蜂摄食过程中食窦泵的驱动动态、喙部器官的配合形态、
中唇舌的弹出机制与刚毛的同步展开过程的相互配合机理,分析蜜蜂吸食与舔食的力学机理差异,为分析蜜蜂在食蜜昆虫中具有的独特的转运高粘度微流体能力提供实验支撑。
8.本发明的目的是提供一种蜜蜂摄食微观动力学机制观测方法。
9.本发明上述目的通过以下技术方案实现:
10.一种蜜蜂微观摄食动力学机制观测方法,包括以下步骤:
11.s1.准备高速显微观测装置及蜜蜂昆虫样本容器,所述高速显微观测装置包括彩色高速摄像机、光学显微镜、转接口和特殊光源;高速摄像机需通过转接口安装在光学显微镜上;高速摄像机连通电源和信号传输线,信号传输线连接电脑终端;所述蜜蜂昆虫样本容器为内部体积能保证蜜蜂肢体自由伸展的管状结构,管状结构一端设有与管内径相匹配的活塞组件,用于调节管状结构内部剩余体积,限制蜜蜂自由活动区域,另一端开口,开口大小与饲喂器相匹配,用于置入饲喂器;
12.s2.准备蜜蜂昆虫样本,饥饿预处理后置于蜜蜂昆虫样本容器中;
13.s3.通过固定器将装载蔗糖溶液的饲喂器和蜜蜂昆虫样本容器在光学显微镜载物台上进行固定,打开光学显微镜光源和外加光源,调焦保证焦距对准在饲喂器内部,在高速成像软件系统上设置帧率和曝光时间,将饲喂器置入蜜蜂昆虫样本容器开口,诱导蜜蜂进行摄食,观测到蜜蜂喙部器官展开并摄食后开始录制,在录制过程中实时控制蜜蜂口器位于视野中央;
14.s4.通过观测视频判断蜜蜂是进行吸食还是舔食,进行微米粒子示踪流场分析、统计流量与蜜蜂舔食频率分析。
15.优选地,蜜蜂昆虫样本容器可以是注射器,注射器头部截断,使得饲喂器开口可以置入,注射器活塞可以调节注射器内部剩余体积,限制蜜蜂自由活动区域。
16.更优选地,昆虫样本为意大利蜂或中华蜂时,可以使用量程为5ml的注射器(横截面直径14mm),用2ml的体积限制蜜蜂;对于体积较大的熊蜂,则可以使用量程为10ml的注射器(横截面直径20mm),用4ml的体积限制熊蜂。
17.优选地,蜜蜂饥饿处理的时间为2小时。
18.准备蜜蜂昆虫样本时,获取的蜜蜂样本可先用15ml离心管限制样本活动并进行饥饿处理,若不预先进行饥饿处理,蜜蜂则有较大几率不会发生摄食动作,降低实验效率。
19.优选地,固定器包括底座,及设于底座中部与底座一体成型的凹槽,凹槽用于固定蜜蜂昆虫样本容器,底座长度尺寸与载玻片相同,可嵌入载物台上的载玻片卡口。
20.由于实验观测的是活体昆虫样本,而显微镜的视野范围较为狭窄,当为获得精细的显微图像,需要加大显微放大倍数时,视野范围将会进一步缩窄,这时候样本容器的固定装置须能通过载物台的位移调节旋钮,同步进行位置调整,以便在录制过程中实时控制蜜蜂口器位于视野中央。
21.优选地,饲喂器为透明玻璃毛细圆管,毛细圆管一端封口,另外一端用于注入实验溶液。
22.更优选地,饲喂器所用透明玻璃毛细管的直径d=2mm。
23.优选地,蔗糖溶液中添加有增稠粉末以调整溶液粘度变量,探讨液体粘度变量对蜜蜂摄食力学特征影响。
24.更优选地,所述增稠粉末为泰勒素(tylose)粉末。
25.优选地,通过向蔗糖溶液中添加微米示踪粒子,通过微米粒子示踪流场分析,进行蜜蜂摄食微观动力学观察。
26.更优选地,微米示踪粒子直径范围为1μm~10μm。
27.更优选地,微米示踪粒子选用dantec dynamics的psp(polyamid seeding particles)。
28.优选地,高速成像软件系统上设置帧率为500
‑
2000fps。
29.更优选地,高速成像软件系统上设置帧率为1000fps。
30.在高速成像软件系统上设置帧率时需注意,过高的帧率可能导致录制视频亮度较低,并且受硬盘容量的限制,录制时间也会减少,极高的帧率(>5000frame per second)还会导致录制视野减小,需要谨慎选择,而过低的帧率则会使得观测流场流动过快,无法清晰捕捉观测细节。
31.优选地,实验时外加强光源照射每只蜜蜂样本的时间不应超过10min。
32.因为蜜蜂具有趋光性,如果让蜜蜂长期处于高光强的照射下,会使得蜜蜂变得躁动,而且高光强光源也会有较大的热辐射,长时间照射会明显影响蜜蜂的活性。
33.优选地,所述微米粒子示踪流场分析使用matlab内置的开源工具箱pivlab对高速图像进行处理;若蜜蜂展现出吸食行为,则可以通过速度场的时间变化数据,利用快速傅里叶分析,得到速度变化的频域曲线,曲线中的第一个峰值便是对应蜜蜂吸食的频率fs;若蜜蜂展现出舔食方式,则可以通过微米粒子的运动轨迹观测中唇舌通过毛细作用蘸水的速度与方向,并观测这一过程中食窦泵是如何配合口器协同运作的。
34.优选地,所述统计流量与意蜂舔食频率的分析,使用adobe premiere进行处理。将项目导入软件之后,在“源”播放窗口可以对视频的每一帧进行预览,将时间坐标调整至蜜蜂开始摄食的对应帧,记录时间结点t1,再将时间坐标调整至蜜蜂摄食结束的对应帧,记录时间结点t2,从而可以求出蜜蜂摄食总时长t=t2
‑
t1,在摄食的前后时间结点,可以利用电子量尺可以对饲喂器圆管中的液面移动的长度h进行测量,即摄食体积为,从而求得流量;若蜜蜂展现出吸食行为,则可以通过流量数据与食窦泵频率数据得到蜜蜂单次吸食的流量体积,;若蜜蜂展现出舔食行为,则在舔食的时常段t内,通过直接观测蜜蜂舌头来回收缩运动的次数n,可以得到蜜蜂中唇舌的舔食频率fl=n/t,通过流量数据与中唇舌的频率可以计算得到每次蜜蜂蘸取液体的体积,通过比较不同方式的机构驱动频率(食窦泵/中唇舌)和单次摄食体积可以分析蜜蜂通过何种策略摄食不同浓粘度的花蜜,以提高摄食效率。
35.本发明方法集成了粒子图像测速法、流体粒子示踪技术、高速摄像技术、液体粘度增强技术等多个方法,对蜜蜂微观口器结构和饮蜜动力学机制进行了详细观测,其中:
36.(1)piv流体粒子示踪方法
37.piv流体粒子示踪方法是一种在图像互相关分析基础上,用于测量流场的技术。它的原理是将示踪粒子在流体中均匀地散布,然后用强光光源照射流场,使流体中的示踪粒子反射或荧光显示;接着在与流场相垂直的方向设置相机来捕捉粒子图像,并储存到计算机中;最后在计算机中经过软件处理得出流场的速度分布。
38.(2)高速摄像技术
39.高速摄像技术是一种以高帧率捕捉外界动态变化的摄像技术,本项目设计的相关设备主要包括高速摄像机、特殊高光强光源、光学显微镜以及高速视频处理软件。每秒最多
可达20亿帧,拍摄后可根据操作者设定速度播放。高速运动的目标会因受到光的照射而产生反射光、或者运动目标本身自发发光。来自摄像目标的光线会透过显微镜头聚焦于高速摄像系统内部的图像传感器。目前的高速摄像系统的图像传感器主流为cmos传感器,cmos传感器可将光信号直接转换成电信号,该信号经过处理后将以模拟信号或数字信号输出,最终存储于硬盘中。
40.(3)流体粘性调整技术
41.流体粘性调整技术是通过向目标液体加入不同粘度流体或可调节粘度粉末,通过粘度计精确测量,达到调节流体粘度功能的方法。在本方法中我们主要使用tylose增稠剂和旋转粘度计实现流体粘性的调整。
42.(4)tylose增稠剂
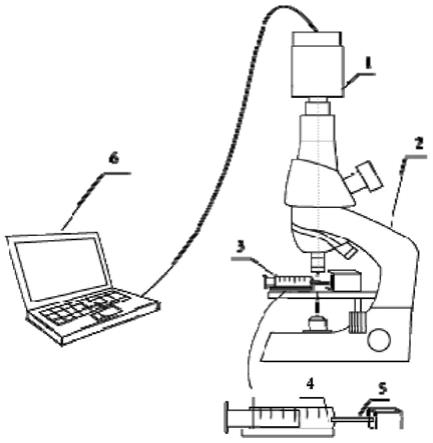
43.tylose增稠剂为白色均匀粉末,其主要成分是水溶性非离子型纤维素醚,常见的为甲基纤维素和羟乙基纤维素,可用于调整液体的粘度。在80~90℃的热水中,甲基纤维素会迅速分散、溶胀,降温后会迅速溶解,其水溶液在常温下稳定,20℃下2%的甲基纤维素水溶液的粘度为15
‑
4000mpa.s。羟乙基纤维素可溶于冷水和热水,其水溶液在140℃下热稳定性好,20℃下2%的羟乙基纤维素水溶液的粘度为5
‑
60000mpa.s,粘度在ph值为2
‑
12的范围内变化较小,在此范围之外会下降。由于在一般的液体中(如水)加入少量的tylose粉末即可达到很高的粘度增强效应,故在很多领域都有广泛应用。
44.(5)旋转粘度计
45.我们在本方法中使用的是数字式旋转粘度计。数字式旋转粘度计是一种结合了先进的计算机技术的测量液体粘度的仪器,具有测量灵敏度高、操作简便等优点。启动后,它的转子在液体中作恒速旋转,液体粘度越大,作用在转子上的粘性阻力也越大;反之,液体粘度越小,作用在转子上的粘性阻力也越小。通过传感器测出作用在转子上的粘性阻力,并由经计算机处理得出液体的粘度。
46.本发明具有以下有益效果:
47.(1)与常规蜜蜂摄食观测方法相比,本发明的蜜蜂昆虫样本容器容器不会对蜜蜂造成挤压,影响其自然进食,方便观察蜜蜂摄食过程中诸多结构协同调整机制,且样本容器的空间可调,可适用于不同体型大小的蜜蜂样本,减小对实验蜜蜂的损耗。
48.(2)本发明为研究传粉昆虫的摄食方法提供微观分析方法。研究传粉昆虫摄食方式可以帮助人们深入理解昆虫的摄食偏好,设计保护传粉昆虫措施,从而更好地保护生态环境;
49.(3)本方法从蜜蜂摄食行为学角度设计微观观测实验,仿照被子植物花朵的形态结构和花蜜,控制粘度或糖分变量,测试蜜蜂的摄食主动调控反应,为同类的膜翅目昆虫与被子植物的协同进化提供不同角度的分析手段;
50.(4)本发明为微流体输运结构设计提供仿生学思路。相比于其他食蜜昆虫,蜜蜂具有十分优越的跨粘度采蜜能力,例如蝴蝶、飞蛾等昆虫一般吸食的花蜜浓度不高于30%,而蜜蜂却可以摄食浓度高达70%以上的花蜜。本方法设计的高速显微成像观测系统可以对蜜蜂摄食过程中的中唇舌刚毛动态伸展过程进行细致观测,本方法设计的piv高速图像分析方法也可以对蜜蜂吸食过程中的周围流场速度进行可视化表达,为同类高粘度微流体输运器设计提供仿生学思路。
附图说明
51.图1为高速显微观测实验装置图,其中,1为高速摄像机,2为光学显微镜,3为样本容器,4为容器开口,5为仿花冠透明圆管,6为计算机终端。
52.图2为利用泰勒素粉末和旋转粘度计调节蔗糖溶液粘稠度,其中,1为泰勒素粉末,2为蔗糖溶液,3为旋转粘度计,4为调整好粘度的蔗糖溶液。
53.图3为样本容器固定器,其中,1为固定器底座,2为固定样本容器卡位。
54.图4为蜜蜂摄食观察装置细节图,其中,1为显微镜头,2为带有微米颗粒的蔗糖溶液,3为仿花冠透明圆管,4为蜜蜂观测口器区域,5为白光光源,6为蜜蜂口器基部。
具体实施方式
55.以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
56.除非特别说明,以下实施例所用试剂和材料均为市购。
57.实施例1意大利蜂摄食微观动力学机制观测
58.一、搭建实验装置
59.1、将彩色高速摄像机(phantom veo
‑
e 310)通过转接口安装在光学显微镜(olympus cx33)上,安装时需确保卡口稳定扣住,不能发生晃动,将高速摄像机与电源和信号传输线进行连通,确保数字信号稳定传输至电脑终端,如附图1。
60.2、制作仿生花冠饲喂器,使用直径d=2mm的透明玻璃毛细圆管作为放置蔗糖溶液的饲喂器,毛细圆管一端使用热熔胶进行封口处理,另外一端通过注射器细针注入实验溶液。
61.3、制作蜜蜂昆虫样本容器,选用5ml的医疗注射器为本实验的样本容器,将注射器的头部使用剪刀截断,留下约2.5mm的开口,使得饲喂器可以从开口置入,通过调节注射器活塞限制蜜蜂的活动区域。
62.4、制作蜜蜂昆虫样本容器固定器,所述固定器包括底座,及设于底座中部与底座一体成型的凹槽,凹槽用于固定蜜蜂昆虫样本容器,底座长度尺寸与载玻片相同,可嵌入载物台上的载玻片卡口;固定器通过通过3d打印技术制备而成,如附图3。
63.二、准备实验材料
64.1、提前准备蜜蜂昆虫样本。蜂种为意大利蜂,取自中山大学东校园谷河旁花园处,14天日龄,用离心管取样。在获取样本过程中确保进行实验防护,若对意蜂蛰刺存在过敏现象则不建议亲自进行取样操作。取样后用15ml离心管限制样本活动,饥饿处理蜜蜂约两小时后,开始摄食观测实验。
65.2、准备不同浓度的蔗糖溶液。电子天平称取干燥白砂糖,并与水调和,获得10%~50%的蔗糖溶液。
66.3、调节蔗糖溶液粘稠度。向配制好的蔗糖溶液中少量添加泰勒素(tylose)增稠粉末,不停搅拌溶液并等待其完全溶解,再使用旋转粘度计进行测量,根据实时溶液粘度进行动态调整,如附图2。
67.4、添加微米示踪粒子。向蔗糖溶液中加入微米示踪粒子(diameter 5μm,psp
‑
5,
polyamid seeding particles,dantec dynamics),来动态反应流场实际流动情况。使用前需充分搅拌混合溶液3min以上,使微米粒子在溶液中均匀分布。
68.三、高速摄像实验
69.高速摄像实验是观测实验的主体部分,主要分为以下几个步骤:
70.1、将盛有蔗糖溶液的饲喂器和装载蜜蜂的样本容器在显微镜载物台上通过固定器进行固定。
71.2、打开显微镜光源和外加光源(visico,permanent,led 150t)。有足够光线成像后,通过粗准焦螺旋进行预调焦,保证焦距对准在饲喂器内部,使得后续精准调焦更加快捷。
72.3、在高速成像软件系统上设置1000fps帧率和对应曝光时间为990ms。
73.4、将玻璃圆管饲喂器置入样本容器开口,诱导蜜蜂进行摄食。
74.5、当观测到蜜蜂喙部器官展开并摄食后,点击录制选项进行高速视频录制,过程中通过不断控制旋钮调节载物台观测位置,保证口器居中,如附图4;不断控制细准焦螺旋调整焦距,保证对焦清晰。
75.6、及时储存录制好的视频。
76.四、实验结束处理
77.1、撤除光源,断开高速相机电源。
78.2、处理实验样本。在实验结束后判断意蜂的活性,活性高的统一放置于空旷无人的地方放生,活性低的则将其困在密闭环境中进行饥饿处理,让其自由死亡,尽可能地减少人为因素对意蜂原有行为特性的干扰。
79.3、清洗容器与实验台。及时清洗实验中所使用过的容器与实验台,保证实验仪器的可重复利用性。
80.五、实验数据分析
81.1、通过观测视频,判断蜜蜂是进行吸食方式还是舔食方式,进而根据不同饲喂液体的浓粘度可以判断蜜蜂在不同粘度/浓度液体下的摄食方式偏好。
82.2、统计流量与意蜂舔食频率分析。将高速视频导入至电脑后,通过adobe premiere视频处理软件对视频利用比例尺进行直接测量。通过软件对视频的单帧进行分析,精确地得到意蜂摄食的前后时间点,求出意蜂摄食时长t。在摄食的前后时间结点,利用电子量尺对饲喂器圆管中的液面下降的高度h进行测量,即摄食体积为求得流量q=v/t。若意蜂展现出舔食行为,则在舔食的时常段t内,通过计数意蜂中唇舌来回收缩运动的次数n,得到意蜂中唇舌的舔食频率f=n/t。
83.3、流体速度场分析。为获得意蜂摄食过程中口器周围流场数据,将高速视频中捕捉微米示踪粒子最清晰的图像逐帧导出,根据需求设定导出的帧数,使用matlab内置工具箱pivlab对高速图像进行处理,具体操作步骤如下:
84.s1、在matlab中打开pivllab工具箱,在开始界面通过“load image”导入拍摄的一系列意蜂摄食高速摄像图片。
85.s2、在image setting菜单中的exclusions界面中框选蜜蜂摄食的舌头周围流场部分。
86.s3、在image setting菜单中的image pre
‑
processing界面增强图片中所选部分的对比度,便于程序对粒子进行发现和分析。
87.s4、在analyze菜单中的piv setting选项中设置查询区域的大小和查询次数,控制能获取到的速度信息的密集程度。这里使用四次查询,其中第一次查询的区域应当较大,以便获得速度较高的流动信息,后面的区域逐步减小。
88.s5、在analyze菜单中analyze选项中开始对所有意蜂摄食图像进行流体特征的逐帧分析。
89.s6、在calibration菜单中的calibration using current or external image选项对时间和距离进行校准,标定时间间隔和图像跨度。
90.s7、在post
‑
processing菜单中的vector validation选项中对粒子的速度进行约束,去除纵向速度过大的粒子数据,使保留的流线图像便于进行研究分析。
91.s8、最终在plot菜单中的modify plot appearance选项中设置箭头的大小、颜色和密集程度,使整个流场图看起来更加清晰。
92.上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1