同时检测PSA和SAR的生物传感器及制备方法和应用
同时检测psa和sar的生物传感器及制备方法和应用
技术领域
1.本发明属于新型功能材料及生物传感检测技术领域,涉及一种同时检测psa和sar的生物传感器及其制备方法和应用,特别涉及一种基于纳米信号放大的超灵敏同时检测psa和sar的生物传感器及其制备方法和应用。
背景技术:
2.psa(prostate specific antigen,前列腺特异抗原)是由前列腺上皮细胞直接分泌到前列腺导管系统中的一种糖蛋白。正常人的血清中psa含量一般是不高于4ng/ml的,而当前列腺发生癌变时,血清中的psa含量则会急剧上升。因此,psa成了前列腺癌的生物标志物,同时也被认为是肿瘤标志物中器官特异性最强的标志物。此外,肌氨酸(n
‑
甲基甘氨酸)是甘氨酸代谢的中间体。近年来,肌氨酸主要被认为是一种前列腺癌生物标志物。它被认为是转移过程中差异性增加的代谢物,肌氨酸在转移性前列腺癌细胞中的作用已被揭示。越来越多的证据表明,肌氨酸可以用来监测前列腺癌的进展。
3.目前评估前列腺癌风险,通常会通过检测血液中肌氨酸(sar)和前列腺特异性抗原(psa)水平来进行。
4.目前测定前列腺特异性抗原psa及肌氨酸(sar)的方法较多,如放射免疫分析法、酶免疫分析法、化学发光免疫法、电化学免疫分析方法以及核磁共振波谱检查法。有的方法需要昂贵的仪器,有的方法需要专业训练的操作人员,有的方法灵敏度有待提高。而电化学免疫分析方法所需仪器设备简易、操作方便、成本低廉、特异性强,是目前检测psa/sar的首选方法。
5.但目前困扰psa/sar检测电化学免疫分析方法发展的一个核心难点在于信号标志物的信号强度有限,这导致电化学传感器灵敏度较低,从而极大地限制了电化学传感器的性能的进一步提升。
6.电极作为电化学传感器的核心,应用纳米材料或者是复合材料等来制备修饰电极,使得电极更为功能化,一定程度上能够提高psa电化学传感器的灵敏度,但同样也存在一定的不足,如其特异性有待增强。
7.此外,目前需要分别对psa及sar进行检测,这也大大影响了检测效率。
8.因此,开发一种灵敏度高且特异性好的同时检测psa和sar的电化学传感器极具现实意义。
技术实现要素:
9.本发明的目的在于克服现有psa/sar电化学免疫传感器灵敏度低、特异性较差且无法同时对对psa及sar进行检测的缺陷,提供一种灵敏度高且特异性好的同时检测psa和sar的电化学传感器。本发明的生物传感器通过硅粒子信号放大以达到增强标志物信号强度,进而提升传感器灵敏度,同时其具有良好的特异性,极具应用前景。
10.为实现上述目的,本发明提供如下技术方案:
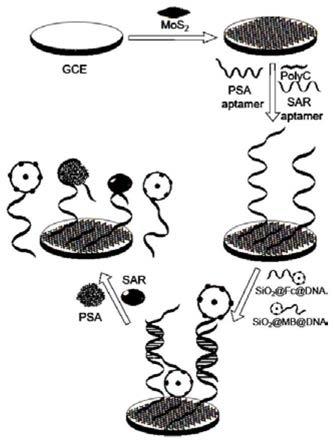
11.一种同时检测psa和sar的生物传感器,所述工作电极包括玻碳电极表面包覆有mos2(二硫化钼)层、信号标志段i、信号标志段ii、与psa特异性结合的捕获探针ssdna1(ssdna即单链dna)和与sar特异性结合的捕获探针ssdna2;
12.所述捕获探针ssdna1和捕获探针ssdna2固定在mos2层上,所述信号标志段i为含修饰ssdna1’且标记有亚甲基蓝的sio2粒子(sio2@mb@修饰ssdna1’),所述信号标志段ii为含修饰ssdna2’且标记有二茂铁的sio2粒子(sio2@fc@修饰ssdna2’),所述信号标志段i通过修饰ssdna1’与捕获探针ssdna1连接,所述信号标志段ii通过修饰ssdna2’与捕获探针ssdna2连接;
13.所述捕获探针ssdna1含有如下所示的核苷酸序列(seq id no.1):
[0014]5’‑
attaaagctcgccatcaaatagctgcttttttccccccccccccccc
‑3’
;
[0015]
所述捕获探针ssdna2含有如下所示的核苷酸序列(seq id no.2):
[0016]5’‑
cccccccccccccccttttttcgggacgaccacgcaaatacgaatagtgtgaacgcgggagtcccg
‑3’
。
[0017]
具体地,捕获探针ssdna1的核苷酸序列为:
[0018]5’‑
attaaagctcgccatcaaatagctgcttttttccccccccccccccc
‑3’
;
[0019]
捕获探针ssdna2的核苷酸序列为:
[0020]5’‑
cccccccccccccccttttttcgggacgaccacgcaaatacgaatagtgtgaacgcgggagtcccg
‑3’
。
[0021]
捕获探针ssdna1的序列是psa的特异性识别基因序列,捕获探针ssdna2的序列是肌氨酸(sar)的特异性识别基因序列,使用该序列制备的dna传感器对psa及肌氨酸(sar)的检测具有高灵敏度和精确度的优点。
[0022]
本发明的一种同时检测psa和sar的生物传感器,是基于硅纳米粒子信号放大一步法实现对psa和sar的检测,其具体是利用油包水法制得二氧化硅颗粒吸附亚甲基蓝形成的sio2@mb粒子实现对mb的信号放大,利用油包水法制得二氧化硅颗粒吸附二茂铁形成的sio2@fc粒子实现对fc的信号放大,有效提高检测灵敏度,同时通过合成psa特异性识别基因序列作为捕获探针ssdna1,与互补修饰ssdna1’片段形成杂交体系,以亚甲基蓝作为杂交指示剂,通过合成肌氨酸特异性识别基因序列作为捕获探针ssdna2,与互补修饰ssdna2’片段形成杂交体系,以二茂铁作为杂交指示剂,构建同时检测psa和sar的dna传感器,实现了对前列腺特异性抗原psa和肌氨酸的灵敏检测,此外,选用mos2(二硫化钼)层作为吸附单链dna的材料,一方面其解吸附的dna更多,能够增强传感器的灵敏度,另一方面其稳定性更佳。
[0023]
作为优选的技术方案:
[0024]
如上所述的一种同时检测psa和sar的生物传感器,所述sio2(二氧化硅)粒子的粒径为100~150nm。
[0025]
如上所述的一种同时检测psa和sar的生物传感器,所述修饰ssdna1’含有如下所示的核苷酸序列(seq id no.3):
[0026]5’‑
cooh(羧基)
‑
ttttttttttgcagctattt
‑3’
;
[0027]
所述修饰ssdna2’含有如下所示的核苷酸序列(seq id no.4):
[0028]5’‑
cooh(羧基)
‑
ttttttttttcgggactccc
‑3’
。
[0029]
具体地,修饰ssdna1’的核苷酸序列为:
[0030]5’‑
cooh(羧基)
‑
ttttttttttgcagctattt
‑3’
;
[0031]
修饰ssdna2’的核苷酸序列为:
[0032]5’‑
cooh(羧基)
‑
ttttttttttcgggactccc
‑3’
。
[0033]
其中修饰ssdna1’是为了将sio2@mb连上捕获探针ssdna1,其中修饰ssdna1’可与捕获ssdna1形成双螺旋结构;修饰ssdna2’是为了将sio2@fc连上捕获探针ssdna2,其中修饰ssdna2’可与捕获ssdna2形成双螺旋结构。
[0034]
本发明还提供制备如上所述的一种同时检测psa和sar的生物传感器的方法,先将mos2修饰到清洁的玻碳电极表面,而后将捕获探针ssdna1、捕获探针ssdna2和polyc(多聚胞嘧啶核苷酸)滴加到修饰好的电极上孵育,最后将含修饰ssdna1’且标记有亚甲基蓝的sio2粒子和含修饰ssdna2’且标记有二茂铁的sio2粒子滴加到电极上孵育,即得所述同时检测psa和sar的生物传感器。
[0035]
作为优选的技术方案:
[0036]
如上所述的方法,所述polyc含有如下所示的核苷酸序列(seq id no.5):
[0037]5’‑
ccccccccccccccc
‑3’
。
[0038]
具体地,polyc的核苷酸序列为:
[0039]5’‑
ccccccccccccccc
‑3’
。捕获探针ssdna1和捕获探针ssdna2与polyc结合后因polyc与mos2存在的相互作用即吸附在包覆有mos2(二硫化钼)层的玻碳电极上,完成捕获探针ssdna1和捕获探针ssdna2在电极上的固定,同时单独的polyc短链封闭电极上的活性位点。
[0040]
所述清洁的玻碳电极,具体是指经如下处理的玻碳电极:将玻碳电极(φ=2mm)依次用0.3μm、0.05μm的al2o3(三氧化二铝)抛光粉将电极表面抛成镜面,再用无水乙醇、去离子水超声清洗5min,氮气吹干备用。
[0041]
如上所述的方法,具体包括如下步骤:
[0042]
(1)将10~14μl的浓度为20μg/ml的mos2悬浊液(将20μg mos2分散在1ml的去离子水中,超声分散5min,得到mos2悬浊液)滴加到清洁的直径为2mm的玻碳电极表面,孵育30~40min;
[0043]
(2)将10~14μl捕获探针ssdna1、捕获探针ssdna2和polyc的混合溶液滴加到修饰好的电极表面,孵育10h;
[0044]
(3)将10~14μl含修饰ssdna1’且标记有亚甲基蓝的sio2粒子和含修饰ssdna2’且标记有二茂铁的sio2粒子的悬浊液滴加到电极表面,孵育2h,即得同时检测psa和sar的生物传感器。
[0045]
步骤(1)~(3)中,所述孵育的温度为25~40℃,具体温度本领域技术人员可根据实际需求进行设定。
[0046]
如上所述的方法,所述含修饰ssdna1’且标记有亚甲基蓝的sio2粒子的制备方法如下:
[0047]
取标记有亚甲基蓝的sio2粒子(sio2@mb)1mg,分散在1ml浓度为0.01m且ph为7.4的磷酸盐缓冲液(即1ml ph=7.4的1
×
pbs溶液)中,再加入2μm修饰ssdna1’,超声15s,随后加入1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐(1
‑
(3
‑
dimethylaminopropyl)
‑3‑
ethylcarbodiimide hydrochloride edc)和n
‑
羟基琥珀酰亚胺(n
‑
hydroxysuccinimide,nhs)使得此时混合液中1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐及n
‑
羟基琥珀酰亚胺的浓度分别为0.2mm和0.01mm,超声15s,而后在37℃条件下振荡3~4.5h,最后离心并使用磷酸盐(pbs)缓冲液多次洗涤即得含修饰ssdna1’且标记有亚甲基蓝的sio2粒子(制得的含修饰ssdna1’且标记有亚甲基蓝的sio2粒子储存在磷酸盐(pbs)缓冲液中);
[0048]
所述含修饰ssdna2’且标记有二茂铁的sio2粒子的制备方法如下:
[0049]
取sio2粒子1mg,分散在1ml浓度为0.01m且ph为7.4的磷酸盐缓冲液(即1ml ph=7.4的1
×
pbs溶液)中,再加入2μm修饰ssdna2’及2mg二茂铁甲酸,超声15s,随后加入1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐(1
‑
(3
‑
dimethylaminopropyl)
‑3‑
ethylcarbodiimide hydrochloride edc)和n
‑
羟基琥珀酰亚胺(n
‑
hydroxysuccinimide,nhs)使得此时混合液中1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐及n
‑
羟基琥珀酰亚胺的浓度分别为0.2mm和0.01mm,超声15s,而后在37℃条件下振荡3~4.5h,最后离心并使用磷酸盐(pbs)缓冲液多次洗涤即得含修饰ssdna2’且标记有二茂铁的sio2粒子(制得的含修饰ssdna2’且标记有二茂铁的sio2粒子储存在磷酸盐(pbs)缓冲液中)。
[0050]
如上所述的方法,步骤(1)中,所述孵育的温度为37℃,时间为40min;
[0051]
步骤(2)中,所述孵育的温度为室温,所述捕获探针ssdna1、捕获探针ssdna2和polyc的混合溶液中捕获探针ssdna1、捕获探针ssdna2及polyc的浓度分别为1μm、1μm及1μm;
[0052]
步骤(3)中,所述孵育的温度为室温,所述悬浊液中含修饰ssdna1’且标记有亚甲基蓝的sio2粒子的浓度为150μg/ml,含修饰ssdna2’且标记有二茂铁的sio2粒子的浓度为250μg/ml。
[0053]
如上所述的一种同时检测psa和sar的生物传感器在psa及sar同时检测方面的应用。
[0054]
本发明还提供如上所述的一种同时检测psa和sar的生物传感器的应用方法,将待检测的试样滴加到同时检测psa和sar的生物传感器上在室温下孵育2h后清洗,以浓度为10mm的磷酸盐缓冲液作为电解液测定电流变化得到待检测的试样的swv曲线,通过与已知浓度的psa及sar测得的swv曲线比较,得到待检测的试样中psa浓度和sar浓度。
[0055]
已知浓度的psa及sar测得的swv曲线是通过以下手段获取的:滴加不同浓度的psa、sar(12μl不同浓度的psa与sar混合溶液)到制备好的dna生物传感器上,室温下孵育2h后清洗,用pbs溶液作为电解液,再采用方波伏安法测定电流变化,得到psa、sar的swv曲线,swv扫描中,扫描的pbs溶液的ph=7.4,浓度为10mm,扫描电压范围
‑
0.6v~0.6v。
[0056]
所述待检测的试样具体为前列腺癌患者的血清样品。
[0057]
有益效果:
[0058]
(1)本发明的同时检测psa和sar的生物传感器,在玻碳电极上覆盖mos2并通过polyc来固定更多的捕获ssdna1(进而固定含修饰ssdna1’且标记有亚甲基蓝的sio2粒子)和捕获ssdna2(进而固定含修饰ssdna2’且标记有二茂铁的sio2粒子),有效增加传感器灵敏度;
[0059]
(2)本发明的同时检测psa和sar的生物传感器,利用酰胺化反应,将fc与sio2粒子连接有效的放大了fc的电化学信号;利用油包水法制得二氧化硅颗粒吸附亚甲基蓝形成的
sio2@mb粒子,实现对mb的信号放大,从而有效提高了传感器的灵敏度,极大的降低检测限,用于同时检测sar和psa;
[0060]
(3)本发明的同时检测psa和sar的生物传感器,检测方便,灵敏度高,特异性好,应用前景好;
[0061]
(4)本发明的同时检测psa和sar的生物传感器的制备方法,工艺简单,条件温和,成本较低。
附图说明
[0062]
图1为本发明的同时检测psa和sar的生物传感器的制备及进行psa及sar检测的流程示意图;
[0063]
图2为本发明的同时检测psa和sar的生物传感器在存在目标物及不存在目标物条件下的cv信号变化示意图;
[0064]
图3为本发明的同时检测psa和sar的生物传感器检测四种模拟血清(0psa,0sar;0psa,+sar;+psa,0sar;+psa,+sar)得到的swv图;
[0065]
图4为本发明的同时检测psa和sar的生物传感器用于检测不同浓度psa、sar的swv图;
[0066]
图5为本发明的同时检测psa和sar的生物传感器检测健康与患病者血清样品得到的psa检测结果柱状图;
[0067]
图6为同时检测psa和sar的生物传感器检测健康与患病者血清样品得到的sar检测结果柱状图;(图5及图6中h1~h6即为健康人士的血清样品,p1~p6即为患病者的血清样品)
[0068]
图7为同时检测psa和sar的生物传感器检测真实样品得到的分组数据图。
具体实施方式
[0069]
下面结合附图,对本发明的具体实施方式做进一步阐述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。
[0070]
以下实施例中,捕获探针ssdna1的核苷酸序列为:
[0071]5’‑
attaaagctcgccatcaaatagctgcttttttcccccccccccccc c
‑3’
;
[0072]
捕获探针ssdna2的核苷酸序列为:
[0073]5’‑
cccccccccccccccttttttcgggacgaccacgcaaatacgaat agtgtgaacgcgggagtcccg
‑3’
;
[0074]
修饰ssdna1’的核苷酸序列为:
[0075]5’‑
cooh
‑
ttttttttttgcagctattt
‑3’
;
[0076]
修饰ssdna2’的核苷酸序列为:
[0077]5’‑
cooh
‑
ttttttttttcgggactccc
‑3’
;
[0078]
polyc的核苷酸序列为:
[0079]5’‑
ccccccccccccccc
‑3’
。
[0080]
实施例1
[0081]
一种同时检测psa和sar的生物传感器的制备方法,其步骤如下,流程示意图如图1
所示:
[0082]
(1)清洁玻碳电极:
[0083]
将玻碳电极(φ=2mm)依次用0.3μm、0.05μm的al2o3抛光粉将电极表面抛成镜面,再用无水乙醇、去离子水超声清洗5min,氮气吹干备用;
[0084]
(2)将12μl的浓度为20μg/ml的mos2悬浊液滴加到清洁后的玻碳电极表面,在37℃下孵育40min;
[0085]
(3)将12μl的捕获探针ssdna1、捕获探针ssdna2和polyc的混合溶液滴加到修饰好的电极表面,在室温下孵育10h,捕获探针ssdna1、捕获探针ssdna2和polyc的混合溶液中捕获探针ssdna及polyc的浓度分别为1μm、1μm及1μm:
[0086]
(4)将12μl含修饰ssdna1’且标记有亚甲基蓝的sio2粒子和含修饰ssdna2’且标记有二茂铁的sio2粒子的悬浊液滴加到电极表面,在室温下孵育2h,即得同时检测psa和sar的生物传感器,悬浊液中含修饰ssdna1’且标记有亚甲基蓝的sio2粒子的浓度为150μg/ml,含修饰ssdna2’且标记有二茂铁的sio2粒子的浓度为250μg/ml;
[0087]
其中含修饰ssdna1’且标记有亚甲基蓝的sio2粒子的制备方法如下:
[0088]
取标记有亚甲基蓝的sio2粒子(粒径为100~150nm)1mg,分散在1ml浓度为0.01m且ph为7.4的磷酸盐缓冲液中,再加入2μm修饰ssdna1’,超声15s,随后加入1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐和n
‑
羟基琥珀酰亚胺使得此时混合液中1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐及n
‑
羟基琥珀酰亚胺的浓度分别为0.2mm和0.01mm,超声15s,而后在37℃条件下振荡3~4.5h,最后离心并使用磷酸盐缓冲液多次洗涤即得含修饰ssdna1’且标记有亚甲基蓝的sio2粒子;
[0089]
含修饰ssdna2’且标记有二茂铁的sio2粒子的制备方法如下:
[0090]
取粒径为100~150nm的sio2粒子1mg,分散在1ml浓度为0.01m且ph为7.4的磷酸盐缓冲液中,再加入2μm修饰ssdna2’及2mg二茂铁甲酸,超声15s,随后加入1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐和n
‑
羟基琥珀酰亚胺使得此时混合液中1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐及n
‑
羟基琥珀酰亚胺的浓度分别为0.2mm和0.01mm,超声15s,而后在37℃条件下振荡3~4.5h,最后离心并使用磷酸盐缓冲液多次洗涤即得含修饰ssdna2’且标记有二茂铁的sio2粒子。
[0091]
实施例2~5
[0092]
一种同时检测psa和sar的生物传感器的制备方法,与实施例1基本相同,不同在于,步骤(2)~(4)中分散液(即对应mos2悬浊液、捕获探针ssdna1、捕获探针ssdna2和polyc的混合溶液及含修饰ssdna1’且标记有亚甲基蓝的sio2粒子和含修饰ssdna2’且标记有二茂铁的sio2粒子的悬浊液)的添加量、孵育的温度及时间,不同具体如下表所示,表中,a为mos2悬浊液的添加量,单位为μl,b、c为步骤(2)中孵育的温度及时间,单位分别为℃、min,d为捕获探针ssdna1、捕获探针ssdna2和polyc的混合溶液的添加量,单位为μl,e为步骤(3)中孵育的温度,单位为℃,f为含修饰ssdna1’且标记有亚甲基蓝的sio2粒子和含修饰ssdna2’且标记有二茂铁的sio2粒子的悬浊液的添加量,单位为μl,g为步骤(4)中孵育的温度,单位为℃;
[0093] abcdefg实施例210403011301225
实施例314254010281129实施例412303514401032实施例513363013361440
[0094]
实施例6
[0095]
同时检测psa和sar的生物传感器的应用,其步骤如下:
[0096]
建立用于检测的标准曲线:
[0097]
取出实施例1制得的同时检测psa和sar的生物传感器,依次滴加12μl不同浓度的psa和sar的混合液(混合液中psa和sar浓度相同),在室温下孵育2h,随后用pbs溶液洗涤,氮气吹干,在pbs溶液中采用方波伏安法考察电流的变化,以此作为检测结果,可用于检测的标准曲线制作,其中,swv扫描中,扫描的pbs溶液的ph=7.4,浓度为10mm,扫描电压范围
‑
0.6~0.6v。
[0098]
其传感器检测目标物(psa和sar)的cv图信号变化如图2所示,用于检测不同浓度梯度的psa和sar的混合溶液得到的swv信号图如图4所示,psa浓度从a~g分别为0fg/ml、1fg/ml、10fg/ml、100fg/ml、1pg/ml、10pg/ml和100pg/ml。
[0099]
取出实施例1制得的同时检测psa和sar的生物传感器分别对四种模拟血清(a:0psa,0sar;b:0psa,+sar;c:+psa,0sar;d:+psa,+sar)进行检测,得到的swv图如图3所示,由图3可知,本发明的同时检测psa和sar的生物传感器能够敏感地实现对psa和sar的同时检测。
[0100]
取出实施例1制得的同时检测psa和sar的生物传感器对健康与患病者血清样品进行检测,其psa检测结果柱状图如图5所示,由图5可知,健康人与患者的血清检测结果有明显的分界线,健康人血清检测的电流大于550na,患者血清检测的电流小于550na;其sar检测结果柱状图如图6所示,由图6可知,健康人与患者的血清检测结果有明显的分界线,健康人血清检测的电流大于360na,患者血清检测的电流小于360na;其分组数据图如图7所示,由图7可以看出,本发明的同时检测psa和sar的生物传感器能够很好的区分了健康人与患者的真实样品。
[0101]
经验证,本发明的同时检测psa和sar的生物传感器,在玻碳电极上覆盖mos2并通过polyc来固定更多的捕获ssdna1(进而固定含修饰ssdna1’且标记有亚甲基蓝的sio2粒子)和捕获ssdna2(进而固定含修饰ssdna2’且标记有二茂铁的sio2粒子),有效增加传感器灵敏度;利用酰胺化反应,将fc与sio2粒子连接有效的放大了fc的电化学信号;利用油包水法制得二氧化硅颗粒吸附亚甲基蓝形成的sio2@mb粒子,实现对mb的信号放大,从而有效提高了传感器的灵敏度,极大的降低检测限,用于同时检测sar和psa;检测方便,灵敏度高,特异性好,应用前景好;工艺简单,条件温和,成本较低。
[0102]
虽然以上描述了本发明的具体实施方式,但是本领域的技术人员应该理解,这些仅是举例说明,在不违背本发明的原理和实质的前提下,可以对这些实施方式做出多种变更或修改。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1