抗体组合物及其筛查移植后淋巴细胞增殖性疾病的应用的制作方法
本发明涉及一种抗体组合物及其在筛查移植后淋巴细胞增殖性疾病中的应用,属于生物技术领域。
背景技术:
长期以来各种肿瘤都是危及人类健康、人类生命的重大疾病,并且随着环境污染、压力等各种问题的逐渐加重,以及人口寿命延长,检测手段更加先进,各种肿瘤的发病率和检出率明显升高。由于肿瘤的恶性度高,相当比例的患者不能通过常规手术、放疗、化疗缓解,尤其是淋巴造血系统肿瘤,造血干细胞移植和各种器官移植成为这些患者存活的唯一希望。目前每年全世界有5-6万患者因为各种恶性和非恶性疾病进行造血干细胞移植,中国每年造血干细胞移植病例数1万例左右,器官移植的数量1-2万。移植对于国家和每个患者都是重大医疗事件,但是移植后并发症的发生与及时处理,是衡量移植成败、患者生存的关键。移植后淋巴细胞增殖性疾病(post-transplantlymphoproliferativedisorders,ptld)是最严重、致死率最高的移植后并发症,在不同种类的移植中发生率0.5%-17%,高发的是心脏、肺、小肠和多器官移植,最高达到25%。其中绝大多数是eb病毒(epstein-barrvirus,ebv)相关ptld,因为ebv在一般人群中感染率很高,儿童感染率50-89%,成人感染率高达90%,正常人都是隐性感染,移植后免疫力下降,引起ebv相关ptld发生。该病移植后进展极快、致死率极高,器官移植后致死率50%-70%,造血干细胞移植后死亡率高达70%-90%。ptld是早期发现、早期处理有可能逆转的疾病,从而引起临床极大关注。从临床和病理学角度,根据世界卫生组织的分类,ptld可分为4大类:早期病变ptld、多形性ptld、单形性ptld和经典霍奇金淋巴瘤ptld。其中单形性ptld最符合淋巴瘤的组织学特点,其表现为常见的b细胞淋巴瘤的特征,少数也可为t细胞淋巴瘤。但是典型病例发现后很难逆转,而如果在早期病变的时候发现,绝大多数可以通过药物和淋巴细胞输注、减低免疫抑制剂等方法逆转。
如何早发现早诊断ptld,是困扰临床专家的难题。ptld的诊断一直以来都以病理为金标准,但是存在以下问题:①ptld发生急、部分患者症状重,不便于手术采集淋巴结做病理;②或者有些淋巴结很小很深,无法取材;③病理检测报告时间相对较长;④手术切除后病情随访问题。因此发现一种取材方便、快速、灵敏度高、特异性好的诊断ptld的方法,是当务之急。
流式细胞术(flowcytometry,fcm)是一种能够对单个细胞实现定量分析的检测手段,具有快速、高精度、多参数等优点,是目前最先进的细胞定量分析方法之一,已经成为多种恶性疾病的诊断金标准,尤其是在白血病、淋巴瘤的诊断以及随访等领域,起到不可替代的作用。流式细胞术检测各种肿瘤,灵敏度10-3~10-4,覆盖率90%以上。
迄今为止,只有2004年华盛顿大学医学院和本案发明人团队2010年发表过利用fcm帮助诊断ptld的文章,但是都是临床表现和其他实验室检测明确诊断的病例,把fcm作为帮助诊断的技术,且方案简单且个体化,也没有提出完整的规范性方案,更没有把fcm检测外周血作为早期筛查手段。
技术实现要素:
本发明的一个目的在于提供一种新的用于ptld的筛查的技术。
本发明中,除明确说明外,所述的ptld的筛查包含ptld的早期筛查和/或ptld的疗效观察检测。
本发明的一个方面提供了一种抗体组合物,所述抗体组合物包括第一组抗体和第二组抗体,其中:
第一组抗体包括:抗cd19抗体、抗cd38抗体、抗cd20抗体、抗cd56抗体和抗cd45抗体;
第二组抗体包括:抗胞浆kappa抗体和抗胞浆lambda抗体。
根据本发明的具体实施方案,本发明的抗体组合物中,抗cd19抗体、抗cd38抗体、抗cd20抗体、抗cd56抗体和抗cd45抗体均为单克隆抗体。
根据本发明的具体实施方案,本发明的抗体组合物中,抗胞浆kappa抗体和抗胞浆lambda抗体均为多克隆抗体。
根据本发明的具体实施方案,本发明的抗体组合物中,各抗体均为荧光素标记的抗体。优选地,抗cd19抗体、抗cd38抗体、抗cd20抗体、抗cd56抗体、抗cd45抗体的荧光素标记按顺序分别为:pe-cy7、apc、apc-cy7、bv421、v500。优选地,抗胞浆kappa抗体、抗胞浆lambda抗体的荧光素标记按顺序分别为fitc、pe。本发明中通过对不同抗体搭配特定的荧光素,可以使得本发明的抗体组合物应用于流式细胞术筛查ptld时,各通道的所有荧光素都能达到优异的染色效果。
根据本发明的具体实施方案,本发明的抗体组合物中,各抗体组分均可商购获得。各抗体应符合相关行业标准要求。
根据本发明的具体实施方案,本发明的抗体组合物中,第一组抗体为抗cd19抗体、抗cd38抗体、抗cd20抗体、抗cd56抗体和抗cd45抗体按照3:3:2:3:3的体积比混合(在效价基本相当的情况下)的混合物。
根据本发明的具体实施方案,本发明的抗体组合物中,第二组抗体为抗胞浆kappa抗体和抗胞浆lambda抗体按照1:1的体积比混合(在效价基本相当的情况下)的混合物。
本发明的另一方面提供了一种用于移植后淋巴细胞增殖性疾病筛查的试剂盒,其包括第一容器和第二容器,其中,第一容器容置本发明所述的抗体组合物的第一组抗体,第二容器容置本发明所述的抗体组合物的第二组抗体。
根据本发明的具体实施方案,本发明的试剂盒还可以包括其他用于ptld筛查和疗效随访的试剂和耗材,例如还可包括:红细胞裂解液,破膜剂,缓冲液、与流式细胞仪配套使用的流式管中的一种或多种。这些试剂和耗材均可商购获得。其中所述破膜剂优选为包括a液、b液的破膜剂。优选本发明所提供的试剂盒还包括第三容器、第四容器、第五容器和第六容器,其中,第三容器包括红细胞裂解液,第四容器包括破膜剂a液,第五容器包括破膜剂b液,第六容器包括缓冲液。优选本发明所提供的试剂盒还包括与流式细胞仪配套使用的流式管等耗材。
本发明的另一方面还提供了本发明所提供的抗体组合物在制备筛查移植后淋巴细胞增殖性疾病的试剂盒中的应用。其中所述的筛查移植后淋巴细胞增殖性疾病包括ptld的早期筛查和/或ptld疗效随访。
优选在本发明的应用中,筛查ptld的过程包括:
(1)将外周血,加入到流式管中,使呈单个细胞悬液状态,并保证细胞数在1×106/管-1×107/管,体积不超过160μl(如果患者外周血细胞量少,根据需要可先加入体积超过160μl,离心去上清浓缩;如果需要加入的体积超过500μl,建议采用先溶红细胞再进行下述操作的方法);
(2)将步骤(1)处理得到的样本,加入磷酸盐缓冲液(pbs)混匀,37度孵育,离心去除上清;
(3)根据需要,可选择性地重复步骤(2);
(4)步骤(3)所得样本,加入pbs混匀,离心去除上清;
(5)步骤(4)所得样本与所述抗体组合物的第一组抗体组分混匀后,室温避光孵育;
(6)向步骤(5)孵育后的流式管中加入破膜剂a液,室温避光孵育;
(7)向步骤(6)孵育后的流式管中加入1×溶血素,室温避光孵育;
(8)将步骤(7)孵育后的流式管中离心去上清,然后加入破膜剂b液和所述抗体组合物的第二组抗体组分,室温避光孵育;
(9)向步骤(8)孵育后的流式管中加入pbs缓冲液洗涤,离心后去上清,用pbs缓冲液重悬细胞;
(10)对步骤(9)重悬细胞进行流式细胞上机检测,分别选择cd45弱表达(dim)/cd38强表达(bright,bri)设门选出浆细胞,cd19/侧向角光散射(sidescatter,ssc)和cd20/ssc抗体设门选出b细胞,分析结果。
根据本发明的具体实施方案,除本发明的抗体组合物外,其余各试剂的用量可参照本领域现有技术的常规用量或是按照商家的推荐剂量。
根据本发明的具体实施方案,本发明的抗体组合物,第一组抗体的加入量为5-20μl/管,第二组抗体的加入量为2-5μl/管。
根据本发明的具体实施方案,步骤(2)中,样本加入pbs后37度孵育5-20分钟;具体地,pbs的加入量可为2-3ml/管;其中所述离心条件可为300-450g离心5-10分钟。
根据本发明的具体实施方案,步骤(4)中,pbs的加入量可为2-3ml/管;其中所述离心条件可为300-450g离心5-10分钟。
根据本发明的具体实施方案,步骤(5)中,通常需孵育5-30分钟左右。
根据本发明的具体实施方案,步骤(6)中,破膜剂a液的加入量按照商家的推荐剂量即可,通常为100μl/管,孵育时间为5-10分钟。
根据本发明的具体实施方案,步骤(7)中,1×溶血素的加入量为2-3ml/管,孵育时间为5-20分钟。
根据本发明的具体实施方案,步骤(8)中,离心条件为300-450g离心5-10分钟;破膜剂b液的加入量按照商家的推荐剂量即可,通常为50μl/管,孵育时间为5-30分钟。
根据本发明的具体实施方案,步骤(9)中,洗涤用pbs缓冲液的加入量为2-3ml/管,重悬用pbs缓冲液的加入量为0.5-1ml/管。
本发明的另一方面还提供了一种筛查移植后淋巴细胞增殖性疾病的装置,该装置包括检测单元和分析单元,其中:
所述检测单元包括用于检测待测个体外周血样本中试剂材料,获得样本中浆细胞和b细胞的检测结果;所述试剂材料包括本发明所述的抗体组合物;
所述分析单元用于分析检测单元的检测结果。
根据本发明的具体实施方案,本发明的筛查移植后淋巴细胞增殖性疾病的装置中,所述检测单元包括利用本发明所述的抗体组合物对待测样本进行处理后制备流式细胞上机样品(具体处理过程可参照前述记载);进行流式细胞上机检测。其中,进行流式细胞上机检测时,分别选择cd45弱表达(dim)/cd38强表达(bright,bri)设门选出浆细胞,cd19/侧向角光散射(sidescatter,ssc)和cd20/ssc抗体设门选出b细胞。
根据本发明的具体实施方案,本发明的筛查移植后淋巴细胞增殖性疾病的装置中,所述分析单元分析检测单元的检测结果时,按照以下方式的至少一种进行判断:
首先判断b细胞门设置时,cd19/ssc或者cd20/ssc细胞是否一致;
单克隆b细胞的判断:如果b细胞或者b细胞的一部分出现胞浆kappa/胞浆lambda比值>3或者<1/3,或者成熟b细胞不表达胞浆kappa、胞浆lambda,则判断为异常单克隆b细胞;
单克隆浆细胞的判断:如果浆细胞或者b细胞的一部分出现胞浆kappa/胞浆lambda比值>4或者<1/4,或者不表达胞浆kappa、胞浆lambda,则判断为异常单克隆浆细胞。
本发明中涉及的fcm筛查ptld过程中,使用胞浆kappa/胞浆lambda/cd19/cd20来检测b细胞,胞浆kappa/胞浆lambda/cd19/cd38/cd56/cd45来检测浆细胞,综合为胞浆kappa/胞浆lambda/cd19/cd38/cd20/cd56/cd45。
具体而言,本发明中涉及的fcm筛查ptld中单克隆b细胞和浆细胞评价标准中,使用cd19/ssc和cd20/ssc同时进行b细胞验证。cd19/ssc或者cd20/ssc细胞如果不一致需要注意三种情况:①b细胞门内细胞的判断:cd19+可能除了b细胞以外,还包括cd20-/cd38bri的浆细胞和cd20-/cd38+的早期b细胞(外周血出现早期b细胞概率极低,出现此种情况注意原发病)。②肿瘤细胞只表达cd19或者cd20。③使用针对cd19或者cd20的靶向治疗后,b细胞丢失cd19或者cd20。
本发明中,单克隆b细胞的判断时,正常情况下cd19/ssc和cd20/ssc的全部b细胞,以及不同cd19、cd20表达强度的b细胞任何一部分,都应该是多克隆细胞,即胞浆kappa/胞浆lambda均有表达,而且表达比例为1/3-3的范围内。因此,本发明中,如果b细胞或者b细胞的一部分出现胞浆kappa/胞浆lambda比值>3或者<1/3,或者成熟b细胞不表达胞浆kappa、胞浆lambda(排除技术因素),则判断为异常单克隆b细胞。
本发明中,单克隆浆细胞的判断时,正常浆细胞(cd45dim/cd38bri)表达cd45、cd19,不表达cd56、cd20,胞浆kappa/胞浆lambda均有表达,而且表达比例为1/4-4的范围内。因此,本发明中,如果浆细胞或者b细胞的一部分出现胞浆kappa/胞浆lambda比值>4或者<1/4,或者不表达胞浆kappa、胞浆lambda(排除技术因素),则判断为异常单克隆浆细胞。
本发明中涉及的fcm筛查ptld中单克隆b细胞和浆细胞判断时,应注意细胞数量和比例的影响。因为在细胞数极少(少于10个),或者比例极低(<0.1%)的情况下,可能会因为统计学差异,导致假的单克隆性,出现这些情况,需要提示临床,因为比例极低或者细胞数极少,结果仅供参考,建议随访。
在本发明的一些具体实施方案中,本发明对2018年1月至2019年12月期间,在河北燕达陆道培医院接受allo-hsct的患者1470例,其中477例(32.45%)于移植后早期出现发热、淋巴结肿大,抽取外周血采用本发明的抗体组合物进行流式检测。最后确诊ptld44人,ptld发生概率为2.99%。该方法经临床验证,敏感性为90.91%,特异性为98.38%,阳性预测值85.17%,阴性预测值99.08%。并且临床根据本发明检测结果,进行对症处理,并使用本发明进行随访,24例(54.55%)治疗有效并长期存活,10例虽然治疗有效,但是其他移植并发症。使用本发明方法筛查ptld,确实做到了早诊断、早治疗,可将中位诊断时间提前到66天,最早33天,将死亡率由文献报道的70-90%,降低到45%。
本发明优势在于:(1)利用本发明的抗体组合物对可疑病例的外周血标本进行处理,可以在移植后早期发热的患者中进行筛查,这些患者往往是ptld的早期,还没有出现典型的肿大的淋巴结,实验证明,本发明的技术可以高度灵敏地发现早期病例,将中位诊断时间提前到66天,最早33天,而文献报道的中位检出时间是4-6个月;(2)本发明的技术可同时筛查b细胞和浆细胞,尤其是移植后早期,绝大多数患者外周血细胞数极低,本发明同时观察b细胞和浆细胞的改变,便于准确计算比例,减少样本损耗,提高检测适用性和灵敏度;本发明研究表明,在所研究的流式检测真阳性案例中,b细胞型57.5%(23/40例),浆细胞型患者7.5%(3/40例),同时含有b细胞与浆细胞的35%(14/40例),本发明的抗体组合覆盖率广,性价比高,可以筛查出几乎所有早期病例,不会漏掉浆细胞型ptld;(3)本发明的技术,不受手术和治疗后淋巴结变小等因素影响,便于治疗后随访;由于早期诊断,早期采取措施,可以大幅度降低死亡率;(4)本发明适用于所有的有活细胞的标本。
附图说明
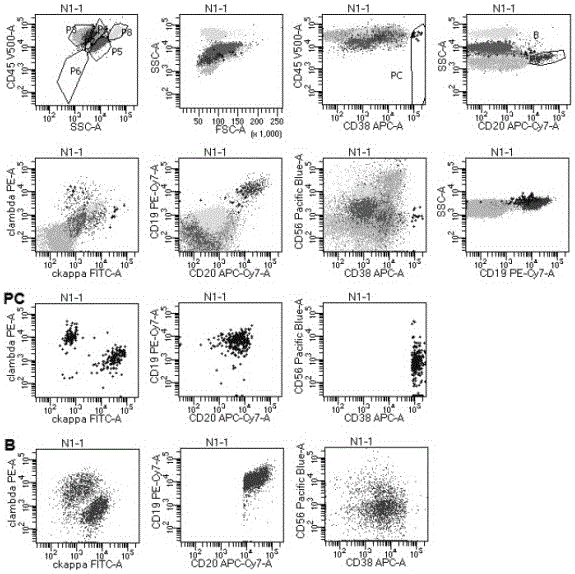
图1显示一例ptld筛查结果为阴性的标本的流式检测结果。其中:分别cd20/ssc、cd19/ssc设门取cd20、cd19阳性的b细胞;cd45/cd38设门取cd45dim/cd38bri的浆细胞。
图2显示一例ptld筛查结果为阳性的标本的流式检测结果。其中:分别cd20/ssc、cd19/ssc设门取cd20、cd19阳性的b细胞;cd45/cd38设门取cd45dim/cd38bri的浆细胞。
图3显示对成熟小b细胞淋巴瘤病例的同一标本分别进行胞膜和胞浆染色的差别。其中,图片a、图片b为同一管不同设门分析图片,图片c、图片d为同一管不同设门分析图片。图片a为胞膜kappa、胞膜lambda染色全图,图片b为胞膜kappa、胞膜lambda染色肿瘤细胞图。图片c为胞浆kappa、胞浆lambda染色全图,图片d为胞浆kappa、胞浆lambda染色肿瘤细胞图。
图4显示不同的处理方法对于成熟小b细胞淋巴瘤病例同一标本分析cd19+肿瘤细胞的kappa、lambda染色的影响。其中:图片a为同型对照,图片b为未经孵育洗涤过程,直接染色的标本,图片c为按照本发明方法,37度孵育2次外加洗涤一次的标本。
图5显示不同克隆kappa、lambda对于检测的影响。正常对照同一标本,图片a、图片b为同一管不同设门分析图片,图片c、图片d为同一管不同设门分析图片。图片a为商购kappa、lambda单克隆抗体,胞膜染色全图,图片b为cd19+细胞图。图片c为本发明的商购kappa、lambda多克隆抗体,胞膜染色全图,图片d为cd19+细胞图。
图6显示不同克隆kappa、lambda对于检测的影响。正常对照同一标本,分析cd19+细胞的kappa、lambda表达情况。图片a为商购kappa、lambda单克隆抗体,胞膜染色。图片b为本发明的商购kappa、lambda多克隆抗体,胞膜染色。图片c为本发明的商购kappa、lambda多克隆抗体,胞浆染色。
具体实施方式
为了对本发明的技术特征、目的和有益效果有更加清楚的理解,现对本发明的技术方案进行以下详细说明,但不能理解为对本发明的可实施范围的限定。各实施例中未详细注明的方法条件,按照所属领域的常规操作或试剂仪器厂商建议的操作条件进行。
实施例1试剂的配制
本实施例使用的抗体组合为:
a1组分为:cd19-pe-cy7、cd38-apc、cd20-apc-cy7、cd56bv421、cd45v500,取以上五种单克隆抗体试剂按体积比3:3:2:3:3混合装于第一容器中;
a2组分为:胞浆kappa-fitc、胞浆lambda-pe,两种单克隆抗体按照体积比2:2装于第二容器中;
本实施例中的抗体为可商购获得,其中,胞浆kappa-fitc、胞浆lambda-pe为丹麦dako公司产品,其余荧光素直接标记抗体均为美国bectondickinson公司产品。
任选再配红细胞裂解液装于第三容器中,破膜剂a液与b液分装于第四容器和第五容器中,pbs缓冲液装于第六容器中,红细胞裂解液、破膜剂、pbs缓冲液为可商购获得,其中,细胞裂解液、破膜剂均为美国bectondickinson公司产品,pbs缓冲液为beckmancoulter公司产品。
实施例2标本的处理
按照细胞计数结果,将肝素或edta抗凝的外周血样本,加入到流式管中,保证加入的细胞量约为2×106(1×106-1×107)个,体积不超过160μl;先加入3mlpbs37度孵育5分钟,300-450g离心5分钟去上清,重复孵育离心一次,再加入3mlpbs洗涤一次(混匀,300-450g离心5分钟,去除上清),然后按表1向流式管中加入14μl不同荧光素标记的五种胞膜单克隆抗体试剂(即实施例1的a1组分),与细胞悬液充分混匀后常温避光孵育15分钟,加入100μl破膜剂a液,室温避光孵育5分钟,加入3ml1×溶血素,避光孵育10分钟裂解红细胞,300-450g离心5分钟去上清后加入50μl破膜剂b液和胞浆多克隆抗体试剂2μl胞浆kappa-fitc、2μl胞浆lambda-pe(即实施例1的a2组分),室温避光孵育15分钟,最后加入3mlpbs缓冲液洗涤,离心后去上清,用0.5mlpbs缓冲液重悬细胞,即为处理好的标本,可供上机检测。
表1检测方案
实施例3标本的检测
将按照实施例2的方法处理好的标本,在美国bectondickinson公司3激光8色facscantoii流式细胞仪上机检测,获取每管50万细胞后,使用diva2.8软件分析数据。其中,分别选择cd45弱表达(dim)/cd38强表达(bright,bri)设门选出浆细胞,cd19/侧向角光散射(sidescatter,ssc)和cd20/ssc抗体设门选出b细胞。
其中涉及的fcm筛查ptld中单克隆b细胞和浆细胞评价标准如下:
(1)使用cd19/ssc和cd20/ssc同时进行b细胞验证。
(2)单克隆b细胞的判断:正常情况下cd19/ssc和cd20/ssc的全部b细胞,以及不同cd19、cd20表达强度的b细胞任何一部分,都应该是多克隆细胞,即胞浆kappa/胞浆lambda均有表达,而且表达比例为1/3-3的范围内。如果b细胞或者b细胞的一部分出现胞浆kappa/胞浆lambda比值>3或者<1/3,或者成熟b细胞不表达胞浆kappa、胞浆lambda(排除技术因素),则判断为异常单克隆b细胞。
(3)单克隆浆细胞的判断:正常浆细胞(cd45dim/cd38bri)表达cd45、cd19,不表达cd56、cd20,胞浆kappa/胞浆lambda均有表达,而且表达比例为0.4-4的范围内。如果浆细胞或者b细胞的一部分出现胞浆kappa/胞浆lambda比值>4或者<1/4,或者不表达胞浆kappa、胞浆lambda(排除技术因素),则判断为异常单克隆浆细胞。
(4)注意细胞数量和比例的影响。因为在细胞数极少(少于10个),或者比例极低(<0.1%)的情况下,可能会因为统计学差异,导致假的单克隆性,出现这些情况,需要提示临床,因为比例极低或者细胞数极少,结果仅供参考,建议随访。
图1-图6显示了本实施例的方法检测标本的部分示例与对照示例。
图1:cd45/ssc设门分析血细胞,p3为成熟淋巴细胞门,p4为单核细胞门,p5为粒细胞门,p6为有核细胞门,p8为嗜酸性粒细胞门。未见明显肿瘤细胞群。使用ssc/cd20设b细胞门(b),并注意cd19表达是否吻合。正常外周血中,cd19+比cd20+细胞略多,主要是除了cd20+b细胞以外,还包括cd19+/cd20-浆细胞。外周血中极少有幼稚b细胞。本例患者cd20+与cd19+b细胞基本吻合。观察b细胞门(b)内的细胞,表型为:表达cd45、cd19、cd20,不表达cd56、cd38,胞浆kappa/胞浆lambda=1.2,为正常多克隆b细胞;cd45dim/cd38bri设浆细胞门(pc),表型为:表达cd19、cd38bri,不表达cd20、cd56,胞浆kappa/胞浆lambda=1.1,为正常多克隆浆细胞。因此本标本的ptld筛查结果为阴性。
图2:使用cd45/ssc观察各群血细胞,分别设置淋巴细胞门(lym)、单核细胞门(mono)、粒细胞门(gra)、有核红细胞门(p6)、嗜酸性粒细胞门。分别使用ssc/cd20、ssc/cd19设门取cd20、cd19阳性的b细胞(分别为cd19+b门和cd20+b门),胞浆kappa/胞浆lambda=0.15,属于单克隆表达胞浆lambda的b细胞,ssc/cd20设门得到相似结果;cd45dim/cd38bri设浆细胞门(pc),表达cd38、cd19,不表达cd20、cd56,单克隆表达胞浆lambda,不表达胞浆kappa,为单克隆浆细胞。按照前述评价标准,该标本中存在异常单克隆b细胞和异常单克隆浆细胞。故标本的ptld筛查结果为阳性,高度疑诊ptld。
图3:胞浆染色会增强小b淋巴瘤单克隆性判断的敏感性。成熟小b细胞淋巴瘤病例,对同一标本分别进行胞膜和胞浆染色。其中,图片a、图片b为同一管不同设门分析图片,图片c、图片d为同一管不同设门分析图片。图片a为胞膜kappa、胞膜lambda染色全图,图片b为胞膜kappa、胞膜lambda染色肿瘤细胞图。图片c为胞浆kappa、胞浆lambda染色全图,图片d为胞浆kappa、胞浆lambda染色肿瘤细胞图。可见,图片a、图片b中肿瘤细胞胞膜kappa、lambda染色极弱,很难判断,图片c、图片d图中胞浆kappa、lambda染色增强,可以清楚判断肿瘤细胞为胞浆lambda阳性,胞浆kappa阴性。
图4:处理方法对于kappa、lambda染色的影响。成熟小b细胞淋巴瘤病例,同一标本不同处理方法分析cd19+肿瘤细胞。图片a为同型对照,图片b为未经孵育洗涤过程,直接染色的标本,图片c为按照本发明方法,37度孵育2次外加洗涤一次的标本。可见图片b的lambda为阴性,图片c的lambda阳性。
图5:不同克隆kappa、lambda对于检测的影响。正常对照同一标本,图片a、图片b为同一管不同设门分析图片,图片c、图片d为同一管不同设门分析图片。图片a为商购kappa、lambda单克隆抗体,胞膜染色全图,图片b为cd19+细胞图。图片c为本发明使用的kappa、lambda多克隆抗体,胞膜染色全图,图片d为cd19+细胞图。可见单克隆抗体染色因kappa、lambda染色过弱(图片a、图片b)皆容易误判为阴性,图片c、图片d可明显看出为正常多克隆b细胞,kappa/lambda=1.1。
图6:不同克隆kappa、lambda对于检测的影响。正常对照同一标本,分析cd19+细胞的kappa、lambda表达情况。图片a为商购kappa、lambda单克隆抗体,胞膜染色,图片b为本发明使用的kappa、lambda多克隆抗体,胞膜染色,图片c为本发明使用的kappa、lambda多克隆抗体,胞浆染色。可见单克隆抗体染色(图片a)因kappa表达过弱,容易误判为部分单克隆表达lambda的b淋巴瘤,图片b、图片c可明显看出为正常多克隆b细胞,kappa/lambda=1.1,胞浆kappa/胞浆lambda=1.1。
为了进一步验证本发明的实用性,2018年1月至2019年12月期间,在河北燕达陆道培医院接受allo-hsct的患者1470例(入组患者的临床特征参见表2),移植类型包括亲缘全相合移植、亲缘半相合移植、脐血移植、非血缘移植。原发病类型包括了all、aml、mds、cml、其他血液恶性肿瘤(淋巴瘤、混合白血病及未分型、mds/mpn、mpn、mm、bpdcn、t细胞大颗粒细胞白血病)和血液良性疾病(再生障碍性贫血、范可尼贫血、先天性角化不良、地中海贫血、pnh、联合免疫缺陷病、先天性粒细胞缺乏症、hlh、慢活eb感染)。其中477例(32.45%)于移植后早期出现发热、淋巴结肿大,使用本发明实施例的该方案对这477例疑诊病例抽取外周血进行流式细胞术检测,其他检测还包括ebv病毒检测,对其中发生ptld的病例和同期未发生ptld的病例进行ebv病毒载量和流式细胞术单克隆细胞的相关性研究。条件允许的情况下,3例患者同时做了手术取淋巴结做病理,2例结果阳性,考虑存在单克隆b细胞增殖,与按照本发明的抗体组合物应用于流式细胞术进行外周血ptld筛查结果一致。流式检测477名患者中,40例为真阳性,7例为假阳性,4例为假阴性。其中7例假阳性,流式发现单克隆细胞>0.1%,但是结合ebv病毒拷贝数升高及临床(未见明显淋巴结肿大,发热等症状),并未临床诊断为ptld(该7例减低免疫抑制剂治疗后好转)。最后临床加实验室确诊ptld44人,ptld发生概率为2.99%。该方法经临床验证,敏感性为90.91%,特异性为98.38%,阳性预测值85.17%,阴性预测值99.08%。
表2入组患者的临床特征
本实施例的研究表明,在所研究的流式检测真阳性案例中,其中b细胞型57.5%(23/40例),浆细胞型患者7.5%(3/40例),同时含有b细胞与浆细胞的35%(14/40例)。使用本发明方法筛查ptld,可将中位诊断时间提前到66天,最早33天。
所有患者中位随访6个月,使用该方案检测外周血b/浆细胞进行随访,治疗有效率为77.27%,存活率为54.55%。本发明检测结果与临床表现和ebv病毒检测结果符合,可以准确反映治疗效果,与临床一致率极高。44例患者中,治疗有效并持续随访24例(54.55%),死亡20例。10例(22.73%)死于疾病进展,复查ebv未转阴,外周血中持续性单克隆b和/或浆细胞。10例(22.73%)虽然治疗有效,ebv转阴,使用本发明方法检测外周血,单克隆细胞消失,但是患者死于其他严重的感染、移植物抗宿主病等。
使用本发明,确实做到了早诊断、早治疗,将死亡率由文献报道的70-90%,降低到43%。
- 还没有人留言评论。精彩留言会获得点赞!