基于无酶级联循环信号放大的血清中循环miRNA的电化学检测方法
基于无酶级联循环信号放大的血清中循环mirna的电化学检测方法
技术领域
1.本发明涉及dna电化学传感器,具体涉及基于无酶级联循环信号放大的血清中循环mirna的电化学检测方法。
背景技术:
2.microrna(mirna)是约18
‑
25个核苷酸碱基,非编码的短rna分子,它在绝大多数真核生物中的基因表达和调控中发挥着重要作用。虽然mirna分子容易降解,但循环mirna在血液等体液中表现出高度的稳定性。研究表明循环mirna的表达与多种疾病相关,包括肿瘤转移、糖尿病、病毒感染和组织损伤等。因此,循环mirna可以用作诊断人类疾病的微创生物标志物。
3.然而,由于mirna的低丰度以及序列相似性,使得循环mirna的检测仍然面临着很大的挑战,亟需构建简单、灵敏的mirna检测体系。金属离子依赖性dnazyme呈现出与蛋白质酶相似的催化特性,具有高的催化活性、选择性和稳定性。而且dnazyme多次循环后也不会导致催化活性的损失。此外,将dnazyme的催化核心序列分割为两个片段,两个片段的末端通过与目标物杂交而结合,这一变构的dnazyme称之为多组分核酸酶(mnazymes),其具备与dnazyme相似的催化活性、选择性和稳定性。这些优势使得dnazyme/mnazymes成为一种简便的信号放大策略,可用于检测传染性病原体、蛋白质、小分子、mirna和dna等物质。虽然这些方法为检测mirna提供了有用的传感平台,但其复杂的操作或有限的灵敏度限制了其实际应用的可能性。因此,仍然迫切需要开发一种简便、无酶、多步扩增循环的mirna检测方法。
4.将dnazyme/mnazymes技术和哑铃型探针(dsp)整合起来,可以设计一种新的级联循环扩增体系。目标序列循环mirna引发mnazymes结构的形成,使得dsp结构中的底物链被周期性地剪切,并释放dnazyme中心片段和二级目标物片段。随后,dnazyme中心片段和二级目标物片段将交替引发级联的循环剪切,最终导致大量的信号探针发生构象变化,从而实现对循环mirna的灵敏检测。由此构建无酶的级联循环信号放大方法实现血清中循环mirna的电化学检测。
技术实现要素:
5.本发明的目的是提供一种灵敏且简便的电化学检测血清中循环mirna的无酶级联循环信号放大方法。
6.为实现上述发明目的,本发明的技术方案如下:
7.基于无酶级联循环信号放大的血清中循环mirna的电化学检测方法,包括步骤:
8.s1:在玻碳电极(gce)上电沉积金纳米颗粒(aunps),得到纳米金修饰的玻碳电极aunps/gce;
9.s2:设计信号探针sh
‑
sp和基底链sub,制备哑铃型复合探针dsp,其中所述sh
‑
sp探针的序列为ac acc att ttt ttt t(sh)tta ggt ctt gga ttt cga cc
‑
mb(seq id no:1),
所述sub的序列为tgg agt gtg aca atg gtg ttt gca at ra g atg cat tcc gag ccg gtc gaa att gca(seq id no:2);
10.s3:将dsp复合探针固定到aunps/gce表面,并用巯基己醇mch进行封闭,得到mch/dsp/aunps/gce;
11.s4:取含有循环mirna的血清样品加入辅助链ap1、ap2,于mch/dsp/aunps/gce界面上进行反应,其中所述ap1的序列为atg cat tcc gag ctc aca ctc ca(seq id no:3),所述ap2的序列为caa aca cca ttg cgg tcg aaa ttg ca(seq id no:4);
12.s5:将反应后的传感界面作为工作电极,与ag/agcl参比电极电极和铂丝对电极构成三电极体系,置于磷酸盐缓冲溶液和氮气氛围中进行电化学检测。
13.优选的,所述步骤s1具体包括:首先在gce表面沉积一层氯化胆碱,接着将电极置于haucl4溶液中进行循环伏安扫描,从而将aunps电沉积到电极表面得到aunps/gce。
14.优选的,所述步骤s2具体包括:将信号探针sh
‑
sp和基底链sub(浓度比为1:1.3)于室温下进行杂交,得到哑铃型复合探针dsp,其中所述sh
‑
sp探针的序列为ac acc att ttt ttt t(sh)tta ggt ctt gga ttt cga cc
‑
mb,所述sub的序列为tgg agt gtg aca atg gtg ttt gca at ra g atg cat tcc gag ccg gtc gaa att gca。
15.优选的,所述步骤s3具体包括:将步骤s2得到的dsp探针与三(2
‑
羧乙基)膦反应60分钟以打开双硫键,随后滴加到aunps/gce表面避光下孵育12小时,冲洗过后再将巯基己醇mch滴加到传感界面上封闭2小时,从而得到mch/dsp/aunps/gce。
16.优选的,所述步骤s4具体包括:用缓冲溶液将血清样品稀释10倍并在95℃加热15分钟,随后加入等浓度的辅助链ap1、ap2,并滴加到mch/dsp/aunps/gce表面反应80分钟,其中所述ap1的序列为atg cat tcc gag ctc aca ctc ca,所述ap2的序列为caa aca cca ttg cgg tcg aaa ttg ca。
17.与现有技术相比,本发明的有益效果:
18.本发明中基于无酶级联循环信号放大的血清中循环mirna的电化学检测方法,利用哑铃型复合探针的巧妙设计,结合dnazyme/mnazyme高的催化性、特异性和稳定性,构建了简便且灵敏的血清中循环mirna的电化学传感平台,该方法具有成为不同核酸类疾病标志物通用检测平台的巨大潜力。
附图说明
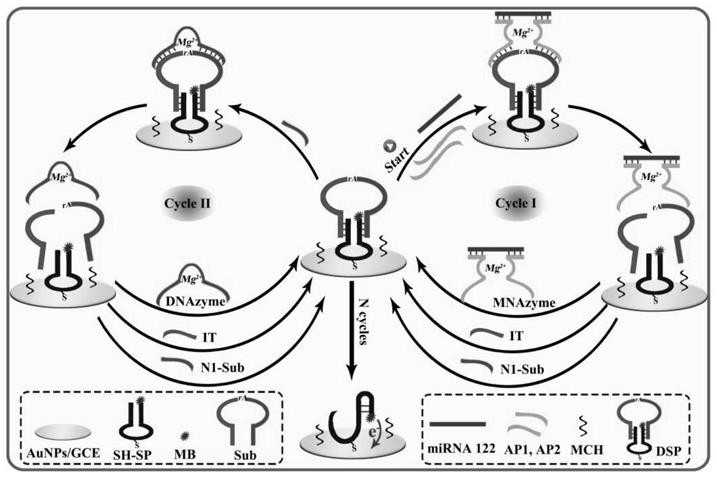
19.图1是基于无酶级联循环信号放大的血清中循环mirna的电化学检测方法的构建示意图;
20.图2是传感界面制备过程的循环伏安表征图和aunps/gce的扫描电镜图;
21.图3是传感界面对不同溶液的电化学响应图,其中曲线a是缓冲溶液;曲线b是辅助探针ap1和ap2;曲线c是辅助探针ap1,ap2和mirna 122的混合溶液;
22.图4是缓冲溶液中不同浓度的mirna 122引起的电化学响应信号及其线性关系图,其中,浓度从a到g依次为:0fm,1fm,10fm,100fm,1pm,10pm,100pm;
23.图5是传感界面对不同mirna的选择性响应图;
24.图6是传感界面检测不同血清样品的电流响应图,浓度从a到d依次为:0fm,10fm,1pm,100pm。
具体实施方式:
25.实施例
26.下面以检测mirna 122致病基因为例对本发明做进一步的解释说明。
27.图1所示是基于无酶级联循环信号放大的血清中循环mirna的电化学检测方法的原理示意图。首先在玻碳电极上电沉积纳米金,并将事先制备好的哑铃型复合探针自组装到aunps/gce表面,接着用mch进行封闭,得到传感界面mch/dsp/aunps/gce。当目标mirna存在时,mirna同时与辅助链ap1、ap2两条链杂交,从而激活mnazyme,该mnazyme催化剪切sub链,使其分裂为两个片段,即dnazyme序列(n1
‑
sub)和目标dna序列(it),该剪切过程中除了mnazyme自身的循环利用,及目标dna序列引发进一步的mnazyme剪切循环(cycle i)之外,释放出的n1
‑
sub片段可以引发新的剪切循环(cycle ii),从而释放出更多的n1
‑
sub和it。随后cycle i和cycle ii之间相互引发和促进,实现级联的信号放大。因此,低含量的循环mirna即可实现多步的级联循环,使大量信号探针从哑铃型结构中释放出来,并形成发夹型结构,继而使得电活性物质亚甲基蓝mb靠近传感基底,获得显著增强的电流信号,实现对循环mirna的灵敏检测。
28.传感界面的制备过程包括以下步骤:
29.首先将玻碳电极用氧化铝打磨,并分别在蒸馏水和乙醇中超声处理。之后将电极置于2.0mm的氯化胆碱溶液中在
‑
1.7v和1.8v范围内扫描6圈,随后用蒸馏水洗去非共价键合的氯化胆碱。接着将电极置于haucl4溶液中(0.25mg ml
‑1)在0.2v至
‑
1.0v的范围内以50mv s
‑1的扫速循环伏安扫描12圈进行电沉积,以得到aunps/gce。此外,将信号探针sh
‑
sp和基底链sub(浓度比为1:1.3)于室温下进行杂交,得到哑铃型复合探针dsp,将其与三(2
‑
羧乙基)膦反应60分钟以打开双硫键,随后滴加到aunps/gce表面,在避光下孵育12小时,冲洗过后再将巯基己醇mch滴加到传感界面上封闭2小时,从而得到mch/dsp/aunps/gce。从图2a所示的循环伏安曲线可以看出,在gce表面上沉积aunps后,[fe(cn)6]3‑
/4
‑
的峰电流值增加(曲线b vs.a),这是由于aunps良好的导电性能促进了[fe(cn)6]3‑
/4
‑
在传感界面上的电子转移。在哑铃型探针固定到电极表面及mch封闭后,峰电流值急剧下降,峰电位差值明显增加(曲线c vs.b)。这一现象可归因于哑铃型探针造成的空间位阻和其所带负电荷的磷酸骨架引起的静电排斥,从而证明了哑铃型探针已成功组装到电极表面。此外,mch/dsp/aunps/gce与含有ap1,ap2和mirna122混合溶液进行孵育,使得电流响应明显恢复(曲线d vs.c),说明了sub链从哑铃型结构中解离出来,进一步表明了该传感界面的构建是成功的。图2b是aunps/gce的扫描电镜图,从图中可以看出,金纳米粒子(平均直径约为15nm)均匀地分布在gce表面,这有助于增加电极的比表面积并促进电子转移。
[0030]
该方法的可行性检验:利用方波脉冲伏安法(swv)检测传感界面对不同溶液的电化学响应以检验该传感平台的可行性。结果如图3所示,mch/dsp/aunps/gce在0.22v左右呈现出一个较小的swv峰(曲线a),表明哑铃形探针已成功固定在传感界面上。由于mirna 122不存在时mnazyme不具备剪切活性,所以ap1和ap2与mch/dsp/aunps/gce孵育引起的电流变化可忽略不计(曲线b)。而当mirna 122存在时,mch/dsp/aunps/gce与ap1和ap2一起反应,swv电流信号显著增加,这归因于mirna 122引起了级联的循环放大并使得信号探针发生结构重排。以上实验结果表明,该方法呈现出出色的信号放大能力,可应用于mirna 122的灵敏检测。
[0031]
该方法在缓冲溶液中的检测性能:首先考察了传感界面对不同浓度mirna 122的响应,从图4a可以观察到电流响应随着mirna 122的浓度的增加而增加,同时根据图4b所示的mirna 122的定量检测校准曲线,可以得到swv响应与mirna 122浓度(1fm to 100pm)的对数值呈现出良好的线性关系,且根据3σ运算规则得到检测限为0.34fm。此外,我们选择了四种不同的mirna序列(包括单碱基错配序列srna,完全错配序列nrna,mirna 26a和mirna 141)用于对照实验,进一步评估了该方法的特异性。实验结果如图5所示,从中可以清楚地看到,当传感界面与高浓度(过量20倍)的srna(20pm),mirna 26a(20pm),nrna(20pm)和mirna 141(20pm)孵育后,电流增加可忽略不计。相反,当传感界面与低含量的mirna 122(1pm)孵育时,swv电流响应显著增强,表明该检测方法具备良好的选择性。
[0032]
该方法对不同血清样品的灵敏检测:将该传感界面对事先加入了mirna 122的人血清样品进行了测试,以模拟实际样品体系的检测。从图6中可以看出,含有目标物mirna 122的血清样品使swv电流值明显高于背景响应值(不存在mirna 122时)。尽管由于复杂血清中蛋白质的非特异性吸附,血清样品中的背景响应值比缓冲溶液中的背景响应值略有增加,但随着血清中mirna122浓度的升高,电流响应值逐渐线性增加,表明在复杂的血清样品中,该方法也具备良好的定量检测能力。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1