一种聚山梨酯80含量的检测方法与流程
1.本发明涉及聚山梨酯含量检测技术领域,具体而言,涉及一种聚山梨酯80含量的检测方法。
背景技术:
2.聚山梨酯80即聚氧乙烯脱水山梨醇单油酸酯,主要成分的化学式为 c
24
h
44
o6(c2h4o)n。易溶于水,溶于乙醇、植物油、乙酸乙酯、甲醇、甲苯,不溶于矿物油。低温时成胶状,受热后复原。有特臭,味微苦。是一种在中药、化药和生物制药中常用的制剂辅料,主要在各种药物制剂过程中起到乳化剂、增溶剂、湿润剂、分散剂和稳定剂等作用。
3.聚山梨酯80由油酸、失水山梨醇、环氧乙烷经酯化、聚合生成,《中国药典》定义其系油酸山梨坦与环氧乙烷聚合合成的聚氧乙烯20油酸山梨坦。但实际上1mol油酸山梨坦与20mol聚氧乙烯的合成只是总投料比,具体到每个分子上聚合的聚氧乙烯数目并不相同,所以聚山梨酯80是一个聚氧乙烯聚合数目不同的混合物。由于原料来源、生产工艺的不同,使得不同厂家产品的化学组分及比例可能存在较大差异。经过多位学者研究,确认聚山梨酯80主要由聚氧乙烯山梨醇酐ps、聚氧乙烯山梨醇酐一油酸酯 psm、聚氧乙烯山梨醇酐二油酸酯psd、聚氧乙烯山梨醇酐三油酸酯pstri、聚氧乙烯山梨醇酐四油酸酯pstetra、聚氧乙烯异山梨醇酐pi、聚氧乙烯异山梨醇酐一油酸酯pim和乙烯异山梨醇酐二油酸酯pid等8中化学物质组成。
4.聚山梨酯80并非单一化学成分,且不同来源样品的主成分和杂质差异较大,现实情况对该辅料的质量控制提出了挑战。制剂中聚山梨酯80的含量和残留量测定是当下关注的热点和难点。
5.有鉴于此,特提出本发明。
技术实现要素:
6.本发明的一个目的在于提供一种聚山梨酯80含量的检测方法,能够简便、准确、高效地评价药剂中聚山梨酯80的含量,满足方法验证过程中对专属性、准确度、精密度等方面的要求,该方法对于聚山梨酯80用量、质量控制乃至临床应用都具有重要的意义。
7.为了实现本发明的上述目的,特采用以下技术方案:
8.一种聚山梨酯80含量的检测方法,包括以下步骤:
9.预处理后的聚山梨酯80标准品的稀释液和预处理后的供试品的稀释液分别进行高效液相色谱检测,根据所述标准品的检测峰面积、所述供试品的检测峰面积计算所述供试品中聚山梨酯80的含量;
10.所述聚山梨酯80标准品的预处理包括:将聚山梨酯80标准品溶液进行第一水解反应,再进行第一甲酯化反应;
11.所述供试品的预处理包括:将供试品溶液进行第二水解反应,再进行第二甲酯化反应。
12.优选地,所述第一水解反应包括:所述聚山梨酯80标准品溶液和碱液的混合液进行加热处理;
13.优选地,所述聚山梨酯80标准品溶液和碱液的混合液进行加热处理的温度为65~75℃,时间为2.5~3.5h;
14.优选地,所述碱包括氢氧化钾;
15.优选地,所述第一水解反应后采用酸进行中和处理。
16.优选地,所述第一甲酯化反应包括:所述水解反应后的上清液与硫酸
‑ꢀ
甲醇溶液的混合液进行加热处理;
17.优选地,所述水解反应后的上清液与硫酸
‑
甲醇溶液的混合液进行加热处理的温度为65~75℃,时间为0.8~1.2h;
18.优选地,所述第一甲酯化反应后采用碱调至ph为5~9;
19.优选地,采用0.45μm的滤膜对调至ph为5~9的混合物进行过滤。
20.优选地,所述第二水解反应包括:所述供试品溶液和碱液的混合液进行加热处理;
21.优选地,所述供试品溶液和碱液的混合液进行加热处理的温度为 65~75℃,时间为2.5~3.5h;
22.优选地,所述碱包括氢氧化钾;
23.优选地,所述第二水解反应后采用酸进行中和处理。
24.优选地,所述第二甲酯化反应包括:所述水解反应后的上清液与硫酸
‑ꢀ
甲醇溶液的混合液进行加热处理;
25.优选地,所述水解反应后的上清液与硫酸
‑
甲醇溶液的混合液进行加热处理的温度为65~75℃,时间为0.8~1.2h;
26.优选地,所述第二甲酯化反应后采用碱调至ph为5~9;
27.优选地,采用0.45μm的滤膜对调至ph为5~9的混合物进行过滤。
28.优选地,所述供试品包括纤维蛋白原;
29.优选地,所述纤维蛋白原在所述预处理前进行如下浓缩处理:
30.纤维蛋白原溶液和乙醇
‑
氯化钠饱和溶液的混合液于离心管中进行第一离心处理,第一固液分离,并采用乙醇
‑
氯化钠饱和溶液清洗所述离心管;再进行第二离心处理,第二固液分离,并采用乙醇
‑
氯化钠饱和溶液清洗所述离心管;合并所述第一固液分离后的上清液、第二固液分离后的上清液及乙醇
‑
氯化钠饱和溶液清洗所述离心管后得到的洗液,进行第三离心处理;将所述第三离心处理后的上清液进行于50~60℃进行浓缩。
31.优选地,所述第一离心处理的转速为2900~3100r/min,时间为8~12min;
32.优选地,所述第二离心处理的转速为2900~3100r/min,时间为3~5min;
33.优选地,所述第三离心处理的转速为2900~3100r/min,时间为20~30min。
34.优选地,所述高效液相色谱的检测条件包括:c8色谱柱;流动相为 18~22mm磷酸二氢钾
‑
乙腈溶液;检测波长为235~242nm;流速为 0.8~1.2ml/min。
35.优选地,所述流动相为20mm磷酸二氢钾
‑
乙腈溶液;所述检测波长为 240nm;所述流速为1.0ml/min。
36.优选地,检测高效液相色谱的仪器包括安捷伦1260ii高效液相色谱仪。
37.与现有技术相比,本发明的有益效果为:
38.本发明的聚山梨酯80含量的检测方法,稳定专属性好,特异性强,准确度高,最低可检测溶液浓度为0.5ppm;精密度高,重复性、准确度误差 rsd均小于8%,参考品线性范围内r2大于0.998。因此,采用本发明提供的方法能够简便,准确,高效地评价溶液中聚山梨酯80含量,这对于药物制剂开发中聚山梨酯80用量,产品质量控制乃至临床应用都具有重要的意义。
具体实施方式
39.下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
40.一种聚山梨酯80含量的检测方法,包括以下步骤:
41.预处理后的聚山梨酯80标准品的稀释液和预处理后的供试品的稀释液分别进行高效液相色谱检测,根据所述标准品的检测峰面积、所述供试品的检测峰面积数计算所述供试品中聚山梨酯80的含量;
42.所述聚山梨酯80标准品的预处理包括:将聚山梨酯80标准品溶液进行第一水解反应,再进行第一甲酯化反应;
43.所述供试品的预处理包括:将供试品溶液进行第二水解反应,再进行第二甲酯化反应。
44.本发明的方法稳定专属性好,特异性强,准确度高,最低可检测溶液浓度为0.5ppm;精密度高,重复性、准确度误差rsd均小于8%,参考品线性范围内r2大于0.998。因此,采用本发明提供的方法能够简便,准确,高效地评价溶液中聚山梨酯80含量,这对于药物制剂开发中聚山梨酯80 用量,产品质量控制乃至临床应用都具有重要的意义。
45.本发明的聚山梨酯80标准品购自sigma公司。
46.优选地,所述第一水解反应包括:所述聚山梨酯80标准品溶液和碱液的混合液进行加热处理。
47.优选地,所述聚山梨酯80标准品溶液和碱液的混合液进行加热处理的温度为65~75℃,时间为2.5~3.5h。
48.在一种实施方式中,所述聚山梨酯80标准品溶液和碱液的混合液进行水浴加热处理的温度为65~75℃,还可以选择65℃、66℃、67℃、68℃、 69℃、70℃、71℃、72℃、73℃、74℃或75℃。
49.在一种实施方式中,所述聚山梨酯80标准品溶液和碱液的混合液进行水浴加热处理的时间为2.5~3.5h,还可以选择2.5h、2.6h、2.7h、2.8h、2.9h、 3h、3.1h、3.2h、3.3h、3.4h或3.5h。
50.优选地,所述碱包括氢氧化钾。
51.优选地,所述聚山梨酯80标准品溶液和所述碱液的体积比为(1.1~1.5): (1.8~2.2),所述碱的浓度为0.8~1.5mol/l。
52.优选地,所述聚山梨酯80标准品溶液的浓度为250~350μg/ml。
53.聚山梨酯80的主要成分
‑
聚氧乙烯脱水山梨醇单油酸酯及其它衍生物不容易被普
通检测器检测到,因此本发明中先将大分子有机物用碱消化成分子量较小的脂肪酸盐,方便甲酯化后被检测器检测。
54.优选地,所述第一水解反应后采用酸进行中和处理。
55.优选地,所述第一甲酯化反应包括:所述水解反应后的上清液与硫酸
‑ꢀ
甲醇溶液的混合液进行水浴加热处理。
56.优选地,所述水解反应后的上清液与硫酸
‑
甲醇溶液的混合液进行水浴加热处理的温度为65~75℃,时间为0.8~1.2h。
57.在一种实施方式中,所述水解反应后的上清液与硫酸
‑
甲醇溶液的混合液进行水浴加热处理的温度为65~75℃。
58.本发明的甲酯化反应可增强样品稳定性,方便检测。特定的温度、时间设置更有利于增强样品稳定性。
59.在一种实施方式中,所述水解反应后的上清液与硫酸
‑
甲醇溶液的混合液进行水浴加热处理的温度为65~75℃,还可以选择65℃、66℃、67℃、 68℃、69℃、70℃、71℃、72℃、73℃、74℃或75℃。
60.在一种实施方式中,所述水解反应后的上清液与硫酸
‑
甲醇溶液的混合液进行水浴加热处理的时间为0.8~1.2h,还可以选择0.8h、0.9h、1h、1.1h、或1.2h。
61.优选地,所述上清液与所述硫酸
‑
甲醇溶液的体积比为1:(1.8~2.5),所述硫酸
‑
甲醇中的硫酸质量含量为9%~11%。
62.优选地,所述第一甲酯化反应后采用碱调至ph为5~9。
63.采用1m氢氧化钾调至ph为5~9,还可以选择调至ph为6、7或8。
64.优选地,采用0.45μm的滤膜对调至ph为5~9的混合物进行过滤。
65.优选地,所述第二水解反应包括:所述供试品溶液和碱的混合液进行水浴加热处理。
66.优选地,所述供试品溶液和碱的混合液进行水浴加热处理的温度为 65~75℃,时间为2.5~3.5h。
67.在一种实施方式中,所述供试品溶液和碱的混合液进行水浴加热处理的温度为65~75℃,还可以选择还可以选择65℃、66℃、67℃、68℃、69℃、 70℃、71℃、72℃、73℃、74℃或75℃。
68.在一种实施方式中,所述供试品溶液和碱的混合液进行水浴加热处理的时间为2.5~3.5h,还可以选择2.5h、2.6h、2.7h、2.8h、2.9h、3h、3.1h、 3.2h、3.3h、3.4h或3.5h。
69.优选地,所述碱包括氢氧化钾。
70.优选地,所述供试品溶液和所述碱液的体积比为(1.1~1.5):(1.8~2.2),所述碱的浓度为0.8~1.5mol/l。
71.优选地,所述第二水解反应后采用酸进行中和处理。
72.优选地,所述第二甲酯化反应包括:所述水解反应后的上清液与硫酸
‑ꢀ
甲醇溶液的混合液进行水浴加热处理。
73.优选地,所述水解反应后的上清液与硫酸
‑
甲醇溶液的混合液进行水浴加热处理的温度为65~75℃,时间为0.8~1.2h。
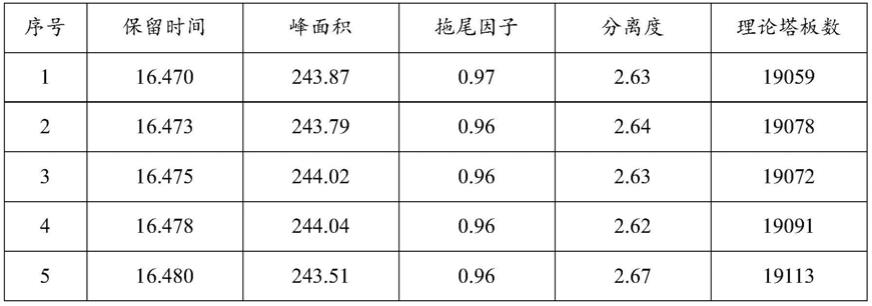
74.在一种实施方式中,所述水解反应后的上清液与硫酸
‑
甲醇溶液的混合液进行水
浴加热处理的温度为65~75℃,还可以选择65℃、66℃、67℃、 68℃、69℃、70℃、71℃、72℃、73℃、74℃或75℃。
75.优选地,所述上清液与所述硫酸
‑
甲醇溶液的体积比为1:(1.8~2.5),所述硫酸
‑
甲醇中的硫酸质量含量为9%~11%。
76.优选地,所述第二甲酯化反应后采用碱调至ph为5~9。
77.采用1m氢氧化钾调至ph为5~9,还可以选择调至ph为6、7或8。
78.优选地,采用0.45μm的滤膜对调至ph为5~9的混合物进行过滤。
79.优选地,所述供试品包括纤维蛋白原。
80.优选地,所述纤维蛋白原在所述预处理前进行如下浓缩处理:
81.纤维蛋白原溶液和乙醇
‑
氯化钠饱和溶液的混合液于离心管中进行第一离心处理,第一固液分离,并采用乙醇
‑
氯化钠饱和溶液清洗所述离心管;再进行第二离心处理,第二固液分离,并采用乙醇
‑
氯化钠饱和溶液清洗所述离心管;合并所述第一固液分离后的上清液、第二固液分离后的上清液及乙醇
‑
氯化钠饱和溶液清洗所述离心管后得到的洗液,进行第三离心处理;将所述第三离心处理后的上清液进行于50~60℃进行浓缩。
82.优选地,所述第一离心处理的转速为2900~3100r/min,时间为8~12min。
83.在一种实施方式中,所述第一离心处理的转速为2900~3100r/min,还可以选择2900r/min、2950r/min、3000r/min、3050r/min或3100r/min。
84.在一种实施方式中,所述第一离心处理的时间为8~12min,还可以选择 8min、9min、10min、11min或12min。
85.优选地,所述第二离心处理的转速为2900~3100r/min,时间为3~5min。
86.在一种实施方式中,所述第二离心处理的转速为2900~3100r/min,还可以选择2900r/min、2950r/min、3000r/min、3050r/min或3100r/min。
87.在一种实施方式中,所述第二离心处理的时间为3~5min,还可以选择 3min、3.5min、4min、4.5min或5min。
88.优选地,所述第三离心处理的转速为2900~3100r/min,时间为20~30min。
89.在一种实施方式中,所述第三离心处理的转速为2900~3100r/min,还可以选择2900r/min、2950r/min、3000r/min、3050r/min或3100r/min。
90.在一种实施方式中,所述第三离心处理的时间为20~30min,还可以选择20min、21min、22min、23min、24min、25min、26min、27min、28min、 29min或30min。
91.在一种实施方式中,取2.0ml规格冻干纤维蛋白原成品1支,加入 2.0ml水溶解,量取供试品1.0ml至离心管中,加乙醇
‑
氯化钠饱和溶液 5.0ml,摇匀,以每分钟2900~3100转离心8~12分钟,取上清液,再用乙醇
‑
氯化钠饱和溶液1.0ml小心冲洗管壁,以每分钟2900~3100转离心3~5 分钟重复清洗离心2~3次,洗液与上清液合并,以每分钟2900~3100转离心20~30分钟,上清液置50~60℃条件下,用空气吹扫法将浓缩至约 0.1~0.5ml,加1ml水溶解。
92.优选地,所述高效液相色谱的检测条件包括:c8色谱柱;流动相为 18~22mm磷酸二氢钾
‑
乙腈溶液;检测波长为235~242nm;流速为 0.8~1.2ml/min。
93.c8色谱柱的参数为:4.6x150mm,4μm。
94.在一种实施方式中,流动相为18~22mm磷酸二氢钾
‑
乙腈溶液,还可以选择18mm、
19mm、20mm、21mm或22mm。
95.在一种实施方式中,检测波长为235~242nm,还可以选择235nm、236nm、 237nm、238nm、239nm、240nm、241nm或242nm。
96.优选地,所述流动相为20mm磷酸二氢钾
‑
乙腈溶液;所述检测波长为 240nm;所述流速为1.0ml/min。
97.优选地,检测高效液相色谱的仪器包括安捷伦1260ii高效液相色谱仪。
98.下面将结合具体的实施例对本发明作进一步的解释说明。
99.实施例1
100.一种聚山梨酯80含量的检测方法,包括以下步骤:
101.1.供试品溶液的配置
102.(a)取2.0ml规格冻干纤维蛋白原成品1支,加入2.0ml水溶解,量取供试品1.0ml至离心管中,加乙醇
‑
氯化钠饱和溶液5.0ml,摇匀,以每分钟3000转离心10分钟,取上清液,再用乙醇
‑
氯化钠饱和溶液1.0ml小心冲洗管壁,以每分钟3000转离心4分钟重复清洗离心2
‑
3次,洗液与上清液合并,以每分钟3000转离心25分钟,上清液置55℃条件下,用空气吹扫法将浓缩至约0.1
‑
0.5ml,加1ml水溶解;
103.(b)将浓步骤(a)缩溶解后的样品中加入1mol/l koh溶液2ml,涡旋混匀,置70℃水浴3h,用盐酸中和备用;
104.(c)取步骤(b)中1ml上层溶液,加入10%硫酸
‑
甲醇溶液2ml,70℃水浴1小时,用1m氢氧化钾中和至ph值为7,0.45μm滤膜过滤后作为供试品溶液;
105.2.对照品溶液的配置
106.精密称取聚山梨酯80对照品溶液(30mg精密称定)适量,置100ml 容量瓶中,加水定容至刻度,摇匀,配制成浓度为300μg/ml的聚山梨酯 80水溶液,按照供试品水解和酯化方法处理对照品溶液;
107.3.样品检验
108.选用安捷伦1260ii高效液相色谱仪搭配c8(4.6x150mm,4μm)色谱柱进行检测,色谱缓冲液为20mm磷酸二氢钾
‑
乙腈溶液,检测波长240nm,流速1ml/min进行上样检测;
109.4.含量计算
110.根据对照品峰面积计算含量。
111.实验例
112.一、聚山梨酯80标准品线性关系及样品检验重复性
113.以冻干纤维蛋白原参考品和供试品为材料,采用上述检测方法检测考察供试品相对参考品的生物学活性。纤维蛋白原冻干产物中聚山梨酯80含量检测结果如表1所示,以标准品配置的不同浓度标准样品检验结果曲线拟合情况良好,曲线拟合常数r2均满足>0.998,样品含量检验重复性rsd 为0.185%。
114.表1聚山梨酯80标准品线性关系及样品检验重复性
115.序号峰面积1峰面积2峰面积3样品(μg/ml)110.1842.4441.62720.12220.5661.4161.23721.11341.12119.54119.22719.94
482.24235.47235.07719.885102.80291.08290.54722.01r20.99840.99860.9986rsd:0.185%
116.二、聚山梨酯80含量检测方法的方法验证
117.1.衍生处理:
118.1)标准品处理
119.取1ml标准品加入3m氢氧化钾溶液1ml,70℃水解1小时,冷却至室温后用盐酸调节ph至9以下,5000rpm离心5min,取上层液体1ml加入10%硫酸甲醇溶液2ml,70℃水浴2小时,0.45μm过滤后进行检测;
120.2)样品处理
121.取5ml样品,以25ml乙醇
‑
饱和氯化钠溶液沉淀,3000rpm离心10 分钟后将上清液和沉淀分开,用5ml乙醇
‑
饱和氯化钠溶液小心清洗离心管壁和沉淀,3000rpm离心5分钟,重复此操作2次,合并清洗液和上清液, 55℃吹扫蒸发至0.5
‑
2.5ml左右,转移至5ml容量瓶中以水定容,取其中 1ml以标准品衍生法进行柱前衍生检测。
122.2.系统适用性:
123.1)实验方法
124.取1000μg/ml的聚山梨酯80对照品溶液,按规定的实验条件处理,按规定的色谱条件进行检测,平行进样6次,计算保留时间和峰面积的rsd;
125.2)结果判定
126.保留时间的rsd小于1%,峰面积的rsd小于4%,分离度大于1.5,拖尾因子和理论板数合适;
127.3)实验结果
128.保留时间的rsd为0.03%,峰面积的rsd为0.08%,分离度为2.6,拖尾因子为0.96,理论板数为19071,可判定为系统适用性合格。
129.表2系统适用性结果
[0130][0131][0132]
3.定量限
[0133]
3.1定量限
[0134]
1)实验方法
[0135]
量取聚山梨酯80对照品适量,配制成浓度为1000μg/ml的对照品储液,用水分别稀释得到浓度为10μg/ml、8μg/ml、5μg/ml的聚山梨酯80对照品溶液,按规定的实验方法处理,得到浓度为1μg/ml、0.8μg/ml、0.5μg/ml 的聚山梨酯80溶液,按规定的色谱条件进行检测;
[0136]
2)结果判定
[0137]
选取信噪比最接近10的浓度,作为实验的定量限;
[0138]
3)实验结果
[0139]
浓度为1.027μg/ml时,信噪比为19.13,浓度为0.8216μg/ml时,信噪比为25.32,浓度为0.5315μg/ml时,信噪比为13.46,所以将浓度为 0.5μg/ml作为实验的定量限;
[0140]
3.2定量限重复性:
[0141]
1)实验方法
[0142]
取聚山梨酯80对照品适量,制成浓度为1000μg/ml的聚山梨酯80对照品储液,用水稀释成浓度为5μg/ml的对照品溶液,按规定的实验方法处理对照品溶液,得到浓度为0.5μg/ml的聚山梨酯80溶液,平行制备6个样品,在规定的色谱条件下检测;
[0143]
2)结果判定
[0144]
6个样品峰面积的rsd应小于8%;
[0145]
3)实验结果
[0146]
6个样品峰面积的rsd为7.86%,小于8%,所以判定定量限的重复性合格。
[0147]
4.标准曲线
[0148]
1)实验方法
[0149]
取聚山梨酯80对照品,配置成约1mg/ml的溶液,再以此溶液用水分别稀释至100μg/ml、200μg/ml、400μg/ml、800μg/ml、1000μg/ml的溶液,取1ml上述溶液以标准品处理方式进行处理,重复处理3个平行样品,按确定的方法进行检测;
[0150]
取聚山梨酯80对照品,配置成约1mg/ml的溶液,再以此溶液用水分别稀释至20μg/ml、50μg/ml、100μg/ml、150μg/ml、200μg/ml的溶液,取1ml上述溶液以标准品处理方式进行处理,重复处理3个平行样品,按确定的方法进行检测;
[0151]
2)结果判定
[0152]
每次实验以峰面积及含量进行线性拟合,r2应大于0.998;
[0153]
3)实验结果
[0154]
表3低浓度条件下线性关系
[0155]
[0156]
表4中浓度条件下线性关系
[0157][0158]
由表3和表4可知,该方法在2~20μg/ml或10~100μg/ml间,对应的标准品含量约为20.1μg/ml~0.201mg/ml或51.4μg/ml~1.028mg/ml之间均能成良好的线性关系。
[0159]
5.重复性
[0160]
1)实验方法
[0161]
精密称取聚山梨酯80对照品溶液(30mg精密称定)适量,置100ml 容量瓶中,加水定容至刻度,摇匀,配制成浓度为300μg/ml的聚山梨酯 80水溶液,按照供试品水解方法处理对照品溶液,平行制备两份对照品溶液进行检测,配制6份相同浓度的供试品溶液,由一个分析人员在尽可能相同的条件下进样检测,以标准品峰面积计算供试品含量;
[0162]
2)结果判定
[0163]
供试品浓度rsd应<4.0%;
[0164]
3)实验结果如表5所示;
[0165]
表5重复性结果
[0166][0167]
由表5可知,样品含量检测重复性rsd小于4%,符合方法要求。
[0168]
6.中间精密度
[0169]
1)实验方法
[0170]
由2名实验人员(a,b)在不同时间,重复平行制备6份样品溶液,共计12份样品溶液,由2名实验人员(a,b)分别进样6次,按重复性实验中含量计算公式计算供试品的含量;
[0171]
2)结果判定
[0172]
12次检测含量结果的rsd应<8.0%;
[0173]
3)实验结果如表6所示
[0174]
表6中间精密度结果
[0175]
[0176][0177]
由表6可知,样品含量检测中间精密度rsd小于8%,符合方法要求。
[0178]
7.准确度
[0179]
1)实验方法
[0180]
精密称取聚山梨酯80对照品适量,置100ml容量瓶中,以空白基质稀释至刻度,摇匀,配制成聚山梨酯80加标空白基质储液。
[0181]
精密量取适量加标空白基质储液置于10ml容量瓶中,用空白基质储液稀释至刻度,即为(1:0.8)加标空白基质溶液e1;
[0182]
精密量取适量加标空白基质储液置于10ml容量瓶中,用空白基质储液稀释至刻度,即为(1:1)加标空白基质溶液e2;
[0183]
精密量取适量加标空白基质储液置于10ml容量瓶中,用空白基质储液稀释至刻度,即为(1:1.2)加标空白基质溶液e3;
[0184]
取加标空白基质溶液e1、e2、e3,按照供试品水解方法处理对照品溶液,按照上述确定的色谱条件进行检测,此实验重复三次,9次实验的结果用计算回收率。
[0185]
2)结果判定
[0186]
9次检测回收率均应在85%
‑
110%之间。
[0187]
3)实验结果表7所示;
[0188]
表7回收率结果
[0189][0190][0191]
由表7可知,样品检测回收率均在85%
‑
110%之间,符合方法要求。三、本发明的检测方法与紫外法的对比研究
[0192]
1.样品检测的对比研究
[0193]
取不同批次冻干纤维蛋白原样品作为供试品,分别采用液相法和紫外法进行对比
研究。
[0194]
液相法操作同实例2中样品检测方法,紫外法同药典三部3023聚山梨醋80残留量测定法,测定结果如表8所示:
[0195]
表8不同检测方法的检测结果
[0196]
批号理论添加量液相法检测结果紫外法检测结果bc201909003800μg/ml788.97μg/ml467.16μg/mlbc201910005800μg/ml789.98μg/ml482.78μg/mlbc201910006800μg/ml783.64μg/ml507.51μg/mlbc201912007800μg/ml788.29μg/ml477.92μg/mlbc201912008800μg/ml794.31μg/ml523.77μg/mlbc201912009800μg/ml788.73μg/ml548.76μg/ml
[0197]
2.样品稳定性的对比研究
[0198]
取统一批次冻干纤维蛋白原样品,稀释后暂存于冰箱中。在1、4、8、 12、24小时取适量样品分别用液相法和紫外法进行检测,结果如表9所示:
[0199]
表9样品稳定性的对比结果
[0200][0201][0202]
结果表明,液相法检测聚山梨酯80能够真实准确反映溶液中聚山梨酯 80的含量,经酯化后样品稳定不易降解,样品配制保存24小时后仍能够准确检测含量。结果稳定重复性好,准确度、重复性、稳定性等均优于药典方法。
[0203]
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,但本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1