一种简易电化学微型传感器的制备方法及其产品与应用
1.本发明属于分析化学、生命科学以及医学等技术领域,具体涉及一种简易电化学微型传感器的制备方法及其产品与应用。
背景技术:
2.氯离子(cl
‑
)是维持大脑正常功能的重要阴离子之一,细胞外cl
‑
水平的失调与某些精神和神经疾病密切相关。pd是世界第二常见的神经退行性疾病,以多巴胺能神经元的大量死亡为病理特征,但具体的发病机制尚不完全明确。已有报道表明多巴胺能神经元的死亡过程与次氯酸盐依赖性转化介导的氧化应激过程有关,cl
‑
通道在该过程中起到了不容忽视的作用。从定量分析的角度,对活体脑内cl
‑
浓度与pd的相关性进行阐述,有助于更好地探究cl
‑
参与的多巴胺能神经元死亡事件。因此,开发一种简便、可靠的cl
‑
分析方法实现pd模型活体脑内cl
‑
的原位检测,对于阐述与cl
‑
相关的多巴胺能神经元死亡过程,突破与其相关的pd发病机制具有重要的意义。
3.目前,常见的检测cl
‑
的分析方法有液相色谱法、荧光光谱法、比色法等。然而这些方法不适用于活体原位检测。电化学传感技术,由于具有制备成本低、高时空分辨率检测的优势,被认为是最有前景的分析技术之一。为此,从早期的离子选择电极发展到近年来开发的全固态电极,cl
‑
电化学传感器表现出了高灵敏和高选择性检测的优点。其中,对于全固态电极的构建,利用ag与cl
‑
在特定的电位下形成电活性的agcl发展电位型cl
‑
电化学传感器是较为常用的检测原理。根据这一原理,在工作电极上组装尺寸均匀且小至纳米级的粗糙ag纳米表面可有效地提高cl
‑
检测的性能。然而,已报道的电化学传感器涉及导电材料的修饰、ag纳米材料的合成及其组装等多个步骤,制备过程复杂,使传感器的重现性大大下降,且由单一ag形成的电位漂移信号易受环境的影响,易出现假信号。因此,目前鲜有有效的cl
‑
电化学传感器适用于活体分析。通过简易的过程制备自带内校正信号的高性能电化学微传感器,使其兼具制备简单、重现性好、高检测性能及微电极小尺寸的优势,对于实现活体脑内cl
‑
的检测是十分必要的。
技术实现要素:
4.针对现有技术的缺陷,本发明的目的是提供一种制备方法简单,灵敏度高,选择性高、重现性好、且具有内参比信号、可实现活体脑内cl
‑
水平原位检测简易电化学微型传感器的制备方法及其产品与应用。
5.本发明这种简易电化学微型传感器的制备方法,包括以下步骤:
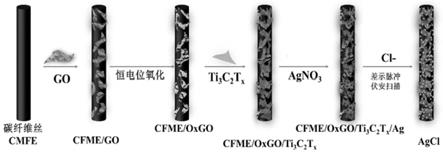
6.1)制备cmfe/oxgo电极:首先制备裸碳纤维丝微电极,接着通过电沉积法将go沉积于碳纤维丝微电极表面,然后将电极进行电氧化处理后形成内置校正信号,即得到cmfe/oxgo电极;
7.2)制备cfme/oxgo/ti3c2t
x
/ag电极:将ti3c2t
x
修饰到步骤1)获得的cmfe/oxgo电极,然后将修饰后的电极置于硝酸银溶液进行还原自组装,得到cfme/oxgo/ti3c2t
x
/ag电
极,即为简易电化学微型传感器。
8.所述步骤1)中裸碳纤维丝微电极,包括以下步骤:
[0009]1‑
1裸电极的制备:将碳纤维丝进行裁剪后,用导电银胶将碳纤维丝一端粘于铜导线一端,置于烘箱中烘干,得到裸电极;
[0010]1‑
2碳纤维丝微电极制作:玻璃毛细管在拉制仪上拉好尖端,将步骤1
‑
1中的裸电极的碳纤维丝小心地穿过毛细管尖端,使碳纤维丝露出数毫米;然后微量注射器向玻璃毛细管中注入环氧树脂并进行干燥,使毛细管内裸露的铜丝与碳纤维丝的固定;然后用刀片将露出的碳纤维丝裁剪至适宜的长度,并将露出的碳纤维丝依次置于丙酮、硝酸、氢氧化钠和蒸馏水进行超声清洗,得到裸碳纤维丝微电极。
[0011]
所述步骤1
‑
1中,碳纤维丝的直径5~10μm,裁剪至长度为0.5~1.5cm。
[0012]
所述步骤1
‑
2中,适宜的长度为0.5mm,硝酸浓度为2~4m,氢氧化钠浓度为0.5~1.5m,每次超声清洗时间为4~6min。
[0013]
所述步骤1)中,电沉积法的具体步骤为:裸碳纤维丝微电极置于氧化石墨烯悬浮液施加恒电位电沉积氧化石墨,沉积完毕后,进行洗涤,得到沉积了氧化石墨烯的裸碳纤维丝微电极;其中:氧化石墨烯悬浮液的浓度为0.5~1.5mg/ml,恒电压1.5~1.7v;沉积时间为500~700s。
[0014]
所述步骤1)中,电氧化处理的具体步骤为:将沉积了氧化石墨烯的裸碳纤维丝微电极置于nacl溶液中,进行恒电位氧化处理,得到cmfe/oxgo电极;其中:nacl溶液的浓度为130~150mm;氧化处理电压为1.8~2.0v,氧化处理时间150~250s。
[0015]
所述步骤2)中,ti3c2t
x
修饰方法:是将cmfe/oxgo电极放入到ti3c2t
x
悬浮液进行浸泡,然后干燥,通过浸泡+干燥的循环修饰方法,将ti3c2t
x
修饰到电极上;其中:每次浸泡时间为1~3min,循环次数为4~6次。
[0016]
所述步骤2)中,还原自组装的具体步骤为:将修饰有ti3c2t
x
的cmfe/oxgo电极置于硝酸银溶液进行浸泡,利用ti3c2t
x
的还原特性,将ag
+
离子还原成ag单质,无需加入额外的还原剂,得到cfme/oxgo/ti3c2t
x
/ag电极;
[0017]
其中:浸泡时间为30~90min。
[0018]
根据上述的方法制备得到简易电化学微型传感器。
[0019]
所述的简易电化学微型传感器在检测cl
‑
中的应用。
[0020]
本发明这种简易电化学微型传感器检测cl
‑
的方法,包括以下步骤:
[0021]
s1、将cfme/oxgo/ti3c2t
x
/ag电极置于空白的磷酸缓冲溶液中,采用dpv方法进行扫描,扫描要求为
‑
0.75v至0.4v;于
‑
500mv和112mv两外分别获得一个氧化峰,再将电极置于含有100mm cl
‑
的磷酸缓冲溶液中,
‑
500mv处的氧化峰保持峰电位不变,112mv处的氧化峰负移至
‑
52mv;
[0022]
s2、将cfme/oxgo/ti3c2t
x
/ag电极依次置于含有一系列浓度cl
‑
(0至700mm,具体为0,1,5,10,20,40,60,80,100,150,200,250,300,400,500,600,700mm)的磷酸缓冲溶液中,112mv处的e
p
(ag/agcl)峰电位随着cl
‑
浓度的增加而逐渐负移,
‑
500mv处的e
p
(oxgo)峰电位保持不变;通过计算两处氧化峰电位差δe
p
(oxgo/agcl)与cl
‑
浓度的对数成正比,由此可得出,可以得出浓度与电位差的标准曲线;
[0023]
s2、将cfme/oxgo/ti3c2t
x
/ag电极置于未知浓度的cl
‑
的溶液或脑微透析液或大脑
皮层或纹状体或海马区中,采用dpv方法进行扫描,可以获得δe
p
(oxgo/agcl),然后通过标准曲线,即可得知氯离子浓度。
[0024]
本发明的有益效果:1)本发明采用ti3c2t
x
还原具有均一纳米尺寸的ag nps自组装于碳纤维丝微电极表面作为识别单元特异性识别和检测cl
‑
,采用电氧化处理的氧化石墨烯作为内参比单元提供内置校正信号提高cl
‑
检测的准确性,制备了cl
‑
电化学微传感器。该制备过程简单、高效,重现性高,体外电化学行为结果表明该传感器对cl
‑
检测具有良好的灵敏度、选择性、稳定性和重现性。2)本发明利用该传感器对大鼠海马区cl
‑
的原位检测结果证明该传感器对活体内cl
‑
浓度的实时变化敏感,与传统的伏尔哈德法测定结果具有可比性,是活体分析的可靠平台。进一步将该电化学微传感器应用于正常和帕金森模型小鼠脑内三个亚区(大脑皮层、纹状体和海马区)cl
‑
的原位检测,并进行统计学分析表明帕金森小鼠大脑皮层中cl
‑
水平升高而海马区下降,说明cl
‑
与帕金森疾病的发生与发展有密切的关系。3)本发明不仅提供了一种简易的原位自组装策略来构建电位型cl
‑
电化学微传感器,拓展了对其他阴离子的高性能电化学微传感器的设计和开发,而且为活体脑内cl
‑
的原位检测提供了一个可靠的分析平台,有助于促进与各种阴离子相关的脑疾病研究。
附图说明
[0025]
图1本发明cfme/oxgo/ti3c2t
x
/ag电极的制备以及检测的流程图;
[0026]
图2实施例1制备的各种电极的微观形貌图,其中,(a
‑
b)裸cfme电极,(c
‑
d)cfme/go电极,(e
‑
f)cfme/oxgo/ti3c2t
x
电极,(g
‑
l)cfme/oxgo/ti3c2t
x
/ag电极,ag nps还原时间:(g
‑
h)30分钟,(i
‑
j)60分钟,(k
‑
l)90分钟。
[0027]
图3实施例1中不同修饰微电极的x
‑
射线光电子能谱图。其中,(a)为x
‑
光电子能谱总谱图,(b)、(c)和(d)分别是ti 2p、f 1s和ag 3d的典型的x
‑
光电子能谱分析,电极分别为(a)裸cfme电极,(b)cfme/go电极,(c)cfme/oxgo电极,(d)cfme/oxgo/ti3c2t
x
电极,(e)cfme/oxgo/ti3c2t
x
/ag电极。
[0028]
图4实施例1制备的cfme/oxgo/ti3c2t
x
电极(60分钟)的x
‑
射线能谱分析和能量色散x射线光谱分析;(a~e)x
‑
射线能谱分析,(f)能量色散x射线光谱分析。
[0029]
图5实施例2中cfme/oxgo/ti3c2t
x
电极在浸泡于0.5mg/mlagno3水溶液中5,30,60,90,120分钟后在空白pbs中测试的dpv图。
[0030]
图6实施例2中不同电极浸泡于0.5mg/ml agno3水溶液中60分钟后在空白和含100mm cl
‑
的磷酸缓冲溶液中测试的差示脉冲伏安图;其中,(a)为空白磷酸缓冲溶液,(b)为含100mm cl
‑
的磷酸缓冲溶液,电极分别为(a)裸cfme电极,(b)cfme/go电极,(c)cfme/oxgo电极,(d)cfme/oxgo/ti3c2t
x
电极。
[0031]
图7实施例2中不同修饰微电极在空白和含100mm cl
‑
的磷酸缓冲溶液中扫描得到的差示脉冲伏安图。其中,(a)为空白磷酸缓冲溶液,(b)为含100mm cl
‑
的磷酸缓冲溶液,电极分别为(a)裸cfme电极,(b)cfme/go电极,(c)cfme/oxgo电极,(d)cfme/oxgo/ti3c2t
x
电极,(e)cfme/oxgo/ti3c2t
x
/ag电极。
[0032]
图8实施例2中不同修饰微电极的x
‑
射线光电子能谱图。(a)cfme/go电极,(b)cfme/oxgo电极,(c)cfme/oxgo/ti3c2t
x
电极。
[0033]
图9实施例2中cfme/oxgo/ti3c2t
x
/ag电极对cl
‑
检测的选择性和干扰性研究图,干
扰物质为各种氨基酸(酪氨酸,甘氨酸,组氨酸,丝氨酸,异亮氨酸,精氨酸,苏氨酸,赖氨酸,半胱氨酸,色氨酸,谷氨酸,缬氨酸)。
[0034]
图10实施例2中cfme/oxgo/ti3c2t
x
/ag电极对cl
‑
检测的选择性和干扰性研究图,干扰物质为各种阳离子(na
+
,k
+
,mg
2+
,cr
3+
,cd
2+
,fe
2+
,fe
3+
,co
2+
,cu
2+
,zn
2+
,ca
2+
,ni
2+
)。
[0035]
图11实施例2中cfme/oxgo/ti3c2t
x
/ag电极对cl
‑
检测的选择性和干扰性研究图,干扰物质为各种阴离子(no2‑
,ac
‑
,f
‑
,co
32
‑
,oh
‑
,so
42
‑
,no3‑
,s2‑
,hco3‑
,clo4‑
)。
[0036]
图12实施例2中cfme/oxgo/ti3c2t
x
/ag电极对cl
‑
检测的选择性和干扰性研究图,干扰物质为典型的生物活性物质(乳酸,葡萄糖,多巴胺,抗坏血酸,尿酸,3,4
‑
二羟苯乙酸,过氧化氢,
·
oh,clo
‑
,onoo
‑
,o2·
‑
,o2,1o2)。
[0037]
图13实施例2中cfme/oxgo/ti3c2t
x
/ag电极在空白和含1mm i
‑
,1mm br
‑
和1mm cl
‑
的磷酸缓冲溶液中测得的差示脉冲伏安响应图;其中i—空白磷酸缓冲溶液,ii—含1mm i
‑
,1mm br
‑
和1mm cl
‑
的磷酸缓冲溶液。
[0038]
图14实施例2中cfme/oxgo/ti3c2t
x
/ag电极在系列浓度的cl
‑
溶液中扫描得到的差示脉冲伏安图,a至q分别为0,1,5,10,20,40,60,80,100,150,200,250,300,400,500,600,700mm。
[0039]
图15实施例2中六根cfme/oxgo/ti3c2t
x
/ag电极在空白和含100mm cl
‑
磷酸缓冲溶液中扫描得到的差示脉冲伏安图;其中,(a)为空白磷酸缓冲溶液,(b)为含100mm cl
‑
的磷酸缓冲溶液。
[0040]
图16实施例2中为所述五根电化学微传感器在系列浓度的cl
‑
溶液中扫描测得的两处氧化峰电位差(δe
p
(oxgo/agcl))与cl
‑
浓度的对数的相关线性关系。
[0041]
图17实施例2中cfme/oxgo/ti3c2t
x
/ag电极在含100mm cl
‑
的磷酸缓冲溶液中连续扫描150个循环得到的循环伏安图。
[0042]
图18实施例2中cfme/oxgo/ti3c2t
x
/ag电极在4℃下保存20天前后,在系列浓度的cl
‑
溶液中测得的两处氧化峰电位差(δe
p
(oxgo/agcl))与cl
‑
浓度的对数的相关线性关系。
[0043]
图19实施例3中cfme/oxgo/ti3c2t
x
/ag电极(60分钟)用于鼠脑内cl
‑
原位检测的示意图。
[0044]
图20实施例3中六根cfme/oxgo/ti3c2t
x
/ag电极(60分钟)对大鼠脑内海马区cl
‑
水平原位检测得到的(a)差示脉冲伏安图以及(b)两处氧化峰电位差(δe
p
(oxgo/agcl))响应。
[0045]
图21实施例3中cfme/oxgo/ti3c2t
x
/ag电极与毛细管平行组装结构照片。
[0046]
图22实施例3中cfme/oxgo/ti3c2t
x
/ag电极对大鼠脑内海马区传感器附近注射人工脑脊液(ph 7.4,含140mm cl
‑
)前后原位检测cl
‑
得到的差示脉冲伏安图;其中i—注射前,ii—注射后。
[0047]
图23实施例3中cfme/oxgo/ti3c2t
x
/ag电极原位测定正常和帕金森小鼠大脑皮层区域测得的差示脉冲伏安响应图;其中i—为正常小鼠,ii—为帕金森小鼠。
[0048]
图24实施例3中cfme/oxgo/ti3c2t
x
/ag电极在原位测定正常和帕金森小鼠脑内纹状体区域测得的差示脉冲伏安响应图;其中i—为正常小鼠,ii—为帕金森小鼠。
[0049]
图25实施例3中cfme/oxgo/ti3c2t
x
/ag电极在原位测定正常和帕金森小鼠脑内海马区域测得的差示脉冲伏安响应图;其中i—为正常小鼠,ii—为帕金森小鼠。
[0050]
图26实施例3中cfme/oxgo/ti3c2t
x
/ag电极在分别测定8只正常和帕金森小鼠大脑内三个亚区(大脑皮层,纹状体和海马区)氯离子浓度的统计学结果。
具体实施方式
[0051]
实施例1简易电化学微型传感器的制备
[0052]
简易电化学微型传感器的制备流程图,如图1所示,具体包括以下步骤:
[0053]
1、制备裸碳纤维丝微电极(cmfe):将碳纤维丝(直径5~10μm)切成1cm长度,用导电银胶将碳纤维丝一端粘于铜导线一端,置于烘箱中烘干;接着用玻璃毛细管在拉制仪(p100)上拉好毛细管尖端,将上述裸电极的碳纤维丝小心地穿过毛细管尖端(可在显微镜下操作),碳纤维丝露出4
‑
7毫米;然后用微量注射器将环氧树脂注入毛细管尖端并干燥,实现毛细管内裸露的铜丝与碳纤维丝的固定、密封与绝缘;最后用刀片在显微镜下将露出的碳纤维丝剪裁至0.5毫米,并依次置于丙酮、硝酸(3m)、氢氧化钠(1m)和蒸馏水依次超声5分钟,得到裸cfme电极。
[0054]
2、沉积氧化石墨烯:将步骤(1)中制备的电极裸碳纤维丝微电极置于氧化石墨烯悬浮液(1mg/ml)施加恒电位电沉积氧化石墨烯,恒电压1.6v,时间600s,用蒸馏水清洗。
[0055]
3、cmfe/oxgo电极的制备:将步骤(2)中沉积了氧化石墨烯的电极置于140mm的氯化钠溶液进行恒电位氧化处理,恒电压1.9v,时间200s,用蒸馏水清洗,得到cmfe/oxgo电极。
[0056]
4、修饰ti3c2t
x
:将步骤3)中的cmfe/oxgo电极置于ti3c2t
x
悬浮液(4mg/ml)中浸泡2min,干燥2min,重复五个循环,用蒸馏水清洗,得到cfme/oxgo/ti3c2t
x
电极。
[0057]
5、制备cfme/oxgo/ti3c2t
x
/ag电极:将多根步骤(4)中修饰了的cfme/oxgo/ti3c2t
x
电极置于硝酸银溶液(0.5mg/ml)中分别浸泡30min、60min以及90min,用蒸馏水清洗,得到3种cfme/oxgo/ti3c2t
x
/ag电极,即为简易电化学微型传感器。
[0058]
对本实施例制备的裸cfme电极,cfme/go电极,cfme/oxgo/ti3c2t
x
电极,3种cfme/oxgo/ti3c2t
x
/ag电极进行sem测试,其结果如图2所示,从图2中可明显观察到cfme电极表面光滑干净,cfme/go电极表面有石墨烯特有的褶皱,cfme/oxgo/ti3c2t
x
电极表面负载的呈现ti3c2t
x
刚性片层,未有石墨烯特有的褶皱,cfme/oxgo/ti3c2t
x
/ag电极表面负载有明显的银纳米颗粒,还原时间为30分钟的银纳米颗粒刚刚成形,且数量较少,还原时间为60分钟的银纳米颗粒尺寸均匀且密集,还原时间为90分钟的银纳米颗粒出现团聚现象。
[0059]
对本实施例制备的裸cfme电极,cfme/go电极,cfme/oxgo/ti3c2t
x
电极,cfme/oxgo/ti3c2t
x
/ag电极(60分钟),进行x
‑
射线光电子能谱图分析,其结果如图3所示,从图3可以看出:cfme/oxgo/ti3c2t
x
修饰电极中ti和f组分的存在证实了ti3c2t
x
的成功修饰,而cfme/oxgo/ti3c2t
x
/ag修饰电极ag组分的存在证实了银纳米颗粒的制备;从ti元素的价态来看,ti元素从原来的高价态(+4价),还原银后,降为低价态(+2)价,说明ti3c2t
x
浸泡银离子溶液后,发生了氧化还原反应,银离子在这个过程中还原成了银单质。
[0060]
对本实施制备的cfme/oxgo/ti3c2t
x
/ag电极(60分钟)在扫描电子显微镜下进行x
‑
射线光电子能谱和x
‑
射线能谱分析,如图4所示,由图可知:ag、f、ti元素均匀地负载在碳纤维丝上,所还原的银纳米颗粒的含量高达40.77%。
[0061]
实施例2制备工艺和性能研究
[0062]
1、银的还原自组装时间对性能的影响
[0063]
在实施例1的基础上,将步骤5中的制备浸泡时间改为5和120分钟的cfme/oxgo/ti3c2t
x
/ag电极,然后将实施例1和实施例2制备的不同还原时间(5,30,60,90,120分钟)cfme/oxgo/ti3c2t
x
/ag电极置于空白磷酸缓冲溶液中进行差示脉冲伏安扫描如图3。扫描参数:电势阶跃为4mv,脉冲宽度为0.05s,脉冲周期为0.3s,脉冲振幅为50mv。
[0064]
从图3可以很明显看出,还原时间为60分钟得到的cfme/oxgo/ti3c2t
x
/ag电极,呈现尖且窄的银氧化峰,明显优于其它还原时间得到的银氧化峰,因此还原时间为60分钟制备的cfme/oxgo/ti3c2t
x
/ag电极是最优的。(图5要标注一下)
[0065]
2、实施例1制备的裸cfme电极,cfme/go电极,cfme/oxgo电极,cfme/oxgo/ti3c2t
x
电极分别在0.5mg/ml agno3水溶液中浸泡60分钟后的进行电化学性能测试
[0066]
将实施例1制备裸cfme电极,cfme/go电极,cfme/oxgo电极,cfme/oxgo/ti3c2t
x
电极,在0.5mg/ml agno3水溶液中浸泡60分钟后,然后在空白和含100mm cl
‑
的磷酸缓冲溶液中进行差示脉冲伏安扫描如图6。从图6可以看出:cfme/oxgo电极得到一个位于
‑
500mv的氧化峰,在空白和含100mm cl
‑
的磷酸缓冲溶液中扫描差示脉冲伏安曲线,氧化峰电位不变。而cfme/oxgo/ti3c2t
x
电极具有还原性能,可将银离子还原为银单质,呈现一个位于112mv的尖而窄的银氧化峰,在含氯离子的溶液中扫描后,银的氧化峰电位负移,负移至
‑
52mv。而裸cfme电极,cfme/go电极,cfme/oxgo电极,均不具备还原功能,所呈现的银氧化峰系施加负电位电还原少量ag单质后氧化而得。
[0067]
3、实施例1制备的各种电极的电化学性能测试
[0068]
将实施例1制备裸cfme电极,cfme/go电极,cfme/oxgo电极,cfme/oxgo/ti3c2t
x
电极,cfme/oxgo/ti3c2t
x
/ag电极(60分钟),分别置于空白和含100mm cl
‑
的磷酸缓冲溶液中进行差示脉冲伏安扫描如图7。
[0069]
从图7可以得出,
‑
500mv的氧化峰系氧化石墨烯经过电氧化处理后而呈现,而112mv处的氧化峰系cfme/oxgo/ti3c2t
x
电极还原银后而呈现,对比在空白和含100mm cl
‑
的磷酸缓冲溶液中扫描差示脉冲伏安曲线,
‑
500mv处的氧化与氯离子不相关,而112mv处的氧化峰在加入氯离子后发生电位负移。这说明所制备的电化学微传感器具有内置参比信号,且对cl
‑
具有良好的电位响应。
[0070]
4、电极的制备过程中化学反应的研究
[0071]
实施例1制备的cfme/go电极,cfme/oxgo电极和cfme/oxgo/ti3c2t
x
电极在x
‑
射线光电子能谱仪上表征,分析数据后如图8和表1所示。很明显,在氧化石墨烯经过电氧化处理后,c
‑
c(sp3)和c=o的含量明显上升,而修饰了ti3c2t
x
后,增加了ti
‑
c键,而其他化学键的含量略呈现物理比例性的下降,这说明,位于
‑
500mv处的氧化峰是由于c=o键氧化而来,对应于oxgo中的醌类基团。
[0072]
表1
[0073][0074]
5、电极选择性的研究
[0075]
将实施例1制备的cfme/oxgo/ti3c2t
x
/ag电极(60分钟)置于含各单一氨基酸(酪氨酸,甘氨酸,组氨酸,丝氨酸,异亮氨酸,精氨酸,苏氨酸,赖氨酸,半胱氨酸,色氨酸,谷氨酸,缬氨酸)或各氨基酸与cl
‑
共存的磷酸缓冲溶液中进行差示脉冲伏安扫描(各氨基酸的浓度均为10μm),总结结果如图9所示,纵坐标是各干扰氨基酸存在下两处氧化峰电位差(δe
p
(oxgo/agcl))响应与原始响应比值,这说明该传感器可对抗生理浓度的各种氨基酸,具有对cl
‑
分析的专属性。
[0076]
将实施例1制备的cfme/oxgo/ti3c2t
x
/ag电极(60分钟)置于含各单一阳离子(na
+
,k
+
,mg
2+
,cr
3+
,cd
2+
,fe
2+
,fe
3+
,co
2+
,cu
2+
,zn
2+
,ca
2+
,ni
2+
)或各阳离子与cl
‑
共存的磷酸缓冲溶液中进行差示脉冲伏安扫描各阳离子的浓度为:na
+
100mm,k
+
5mm,mg
2+
和ca
2+
1mm,其余均为10μm),总结结果如图10所示,纵坐标是各阳离子存在下两处氧化峰电位差(δe
p
(oxgo/agcl))响应与原始响应比值,这说明该传感器可对抗生理浓度的阳离子,具有对cl
‑
分析的专属性。
[0077]
将实施例1制备的cfme/oxgo/ti3c2t
x
/ag电极(60分钟)置于含各单一阴离子(no2‑
,ac
‑
,f
‑
,co
32
‑
,oh
‑
,so
42
‑
,no3‑
,s2‑
,hco3‑
,clo4‑
)各阴离子与cl
‑
共存的磷酸缓冲溶液中进行差示脉冲伏安扫描(各阴离子的浓度为:co
32
‑
和hco3‑
1 mm,其余均为10μm),总结结果如图11所示,纵坐标是各阴离子存在下两处氧化峰电位差(δe
p
(oxgo/agcl))响应与原始响应比值,这说明该传感器可对抗生理浓度的阴离子,具有对cl
‑
分析的专属性。
[0078]
将实施例1制备的cfme/oxgo/ti3c2t
x
/ag电极(60分钟)置于含各单一生物活性物质(乳酸,葡萄糖,多巴胺,抗坏血酸,尿酸,3,4
‑
二羟苯乙酸,过氧化氢,
·
oh,clo
‑
,onoo
‑
,o2·
‑
,o2,1o2)各生物活性物质与cl
‑
共存的磷酸缓冲溶液中进行差示脉冲伏安扫描(各活性物质的浓度为多巴胺:10μm,抗坏血酸:100μm,尿酸:10μm,氧气:0.25mm,乳酸:1mm,葡萄糖:1mm,过氧化氢:1μm),总结结果如图12所示,纵坐标是各生物活性物质存在下两处氧化峰电位差(δe
p
(oxgo/agcl))响应与原始响应比值,这说明该传感器可对抗生理浓度的生物活性物质,具有对cl
‑
分析的专属性。
[0079]
将实施例1制备的cfme/oxgo/ti3c2t
x
/ag电极(60分钟)置于空白和含1mm i
‑
,1mm br
‑
和1mm cl
‑
磷酸缓冲溶液中进行差示脉冲伏安扫描,其结果如13所示:500mv处的氧化峰电位保持不变,而112mv处的原始银氧化峰发生负移,并呈现三个分裂峰,分别为52mv,
‑
44mv和
‑
188mv,归属于agcl,agbr和agi,这说明该传感器对抗同族卤素离子,具有对cl
‑
分析的专属性。
[0080]
6、标准曲线的建立
[0081]
将实施例1制备的cfme/oxgo/ti3c2t
x
/ag电极(60分钟)置于系列浓度(a~q分别对
应0,1,5,10,20,40,60,80,100,150,200,250,300,400,500,600,700mm)的cl
‑
的磷酸缓冲溶液中,进行差示脉冲伏安扫描,结果如图14所示:
‑
500mv处的峰电位随着cl
‑
浓度的升高不发生移动,而112mv处的银氧化峰电位随着cl
‑
浓度的升高呈现逐渐负移,通过计算处氧化峰电位差(δe
p
(oxgo/agcl)),cl
‑
浓度的对数值与δe
p
(oxgo/agcl)呈良好的线性相关,以此作为定量计算cl
‑
浓度的基础,拟合出计算公式为y=
‑
0.05375x+0.3964。
[0082]
7、稳定性的研究
[0083]
按照实施例1中cfme/oxgo/ti3c2t
x
/ag电极(60分钟)制备多根电极,然后将六根cfme/oxgo/ti3c2t
x
/ag电极置于空白和含100mm cl
‑
磷酸缓冲溶液中进行差示脉冲伏安扫描如图15。六根电极在空白磷酸缓冲溶液中均呈现
‑
500mv处的参比氧化峰和112mv处的原始银氧化峰,在含100mm cl
‑
磷酸缓冲溶液中均呈现
‑
500mv处的参比氧化峰和
‑
52mv处的agcl氧化峰,信号稳定。这说明该传感器具有良好的制备重现性。
[0084]
将所述五根cfme/oxgo/ti3c2t
x
/ag电极置于系列浓度的cl
‑
溶液中进行差示脉冲伏安扫描后测得的两处氧化峰电位差(δe
p
(oxgo/agcl))与cl
‑
浓度的对数的相关线性关系如图16。五根微传感器系列浓度的cl
‑
检测信号稳定。这说明该传感器具有良好的制备重现性。
[0085]
将cfme/oxgo/ti3c2t
x
/ag电极置于空白磷酸缓冲溶液中连续进行循环伏安扫描150次如图17,112mv处的原始银氧化峰未发生偏移,信号稳定。这说明该传感器具有良好的扫描重现性。
[0086]
所述cfme/oxgo/ti3c2t
x
/ag电极在4℃下保存20天前后,置于系列浓度的cl
‑
溶液中进行差示脉冲伏安扫描后测得的两处氧化峰电位差(δe
p
(oxgo/agcl))与cl
‑
浓度的对数的相关线性关系如图18。该微传感器保存20天后对系列浓度的cl
‑
检测信号稳定。这说明该传感器具有良好的保存稳定性。
[0087]
实施例3动物脑内的cl
‑
浓度的检测
[0088]
本实施例中采用的cfme/oxgo/ti3c2t
x
/ag电极均为是实施例1制备的cfme/oxgo/ti3c2t
x
/ag电极(硝酸银中浸泡60分钟)。
[0089]
本实施例中采用cfme/oxgo/ti3c2t
x
/ag电极鼠脑内cl
‑
的原位检测的示意图如图19所示,具体步骤如下:参照大鼠脑立体定位图,将电化学微传感器通过脑立体定位仪植入大鼠海马区(前囱点:前5.0mm,中线左侧5.0mm,硬脑膜下2.5mm)内,甘汞参比电极和对电极放置于带有自制kno3盐桥的塑料套管(尖端大小:2毫米),套管置入大脑硬脑膜。通过电化学工作站进行采集原位信号,电脑端输出信号。
[0090]
1、重现性表征:用实施例1制备的六根cfme/oxgo/ti3c2t
x
/ag电极(60分钟)依次植入同一只大鼠的海马区内,进行原位差示脉冲伏安扫描如,记录cl
‑
原位检测的信号,结果如图20所示:比较两处氧化峰电位差(δe
p
(oxgo/agcl)),未发生电位差漂移,该电化学微传感器应用于活体cl
‑
检测具有优异的重现性。
[0091]
2、敏感性检测:将cfme/oxgo/ti3c2t
x
/ag电极(60分钟)与一根毛细管(内径:75μm,外径:150μm)组装在一起,尖端保持齐平,平行共同植入海马(具体操作可见图21),然后采用装有气密性注射器的可编程注射泵以0.6μl/min的流速微量注射对人工脑脊液(ph 7.4,含140 cl
‑
mm)10min,记录cl
‑
原位检测的信号,结果如图22所示:agcl的氧化峰电位发生明显负移,通过注射前后两处氧化峰电位差(δe
p
(oxgo/agcl))的变化,计算cl
‑
的浓度上升至
118.7mm。该电化学微传感器对活体内cl
‑
浓度的变化具有良好的敏感性。
[0092]
3、准确性评价:另取三只大鼠脑内海马区微透析液,采用传统的伏尔哈德法测定其中cl
‑
的浓度,并与本发明的cfme/oxgo/ti3c2t
x
/ag电极原位检测结果对比,其结果如表2所示,两者结果高度相近的,说明本发明中的电化学微传感器可实现活体内cl
‑
浓度的准确检测。
[0093]
表2
[0094][0095]
实施例4帕金森与小鼠脑内cl
‑
浓度关系的研究
[0096]
本实施例中采用的cfme/oxgo/ti3c2t
x
/ag电极均为是实施例1制备的cfme/oxgo/ti3c2t
x
/ag电极(硝酸银中浸泡60分钟)。
[0097]
测试:制备的cfme/oxgo/ti3c2t
x
/ag电极(60分钟)应用于正常和帕金森模型小鼠脑内三个亚区(大脑皮层、纹状体和海马区)cl
‑
的原位检测,并进行统计学分析,具体包括以下步骤:
[0098]
1、参照图19鼠脑内cl
‑
原位检测的示意图,将电化学微传感器通过脑立体定位仪分别植入正常和帕金森模型小鼠大脑皮层区(前囱点:后2.0mm,中线左侧0.25mm,硬脑膜下1.2mm),纹状体区(前囱点:前0.5mm,中线左侧1.5mm,硬脑膜下3.0mm),海马区(前囱点:后1.5mm,中线左侧1.5mm,硬脑膜下1.8mm),甘汞参比电极和对电极放置于带有自制kno3盐桥的塑料套管(尖端大小:2毫米),套管置入大脑硬脑膜。通过电化学工作站进行采集原位信号,电脑端输出信号。根据两处氧化峰电位差值(δe
p
(oxgo/agcl)),计算正常和帕金森模型小鼠脑内各亚区cl
‑
的浓度。
[0099]
2、分别原位测定8只正常和帕金森模型小鼠脑内各亚区cl
‑
的浓度,计算并进行统计学分析。
[0100]
3、结果分析:
[0101]
将所述cfme/oxgo/ti3c2t
x
/ag电极植入正常和帕金森小鼠大脑皮层,进行原位差示脉冲伏安扫描如图23,分别重复测试八只正常小鼠和八只帕金森小鼠,依据测得的两处氧化峰电位差(δe
p
(oxgo/agcl))计算,得到正常小鼠大脑皮层的cl
‑
浓度为62.0
±
5.0mm,而帕金森小鼠大脑皮层的cl
‑
浓度为103.7
±
8.4mm,呈现上升趋势。
[0102]
将所述cfme/oxgo/ti3c2t
x
/ag电极植入正常和帕金森小鼠纹状体区,进行原位差示脉冲伏安扫描如图24,分别重复测试八只正常小鼠和八只帕金森小鼠,依据测得的两处氧化峰电位差(δe
p
(oxgo/agcl))计算,得到正常小鼠大脑皮层的cl
‑
浓度为66.5
±
6.1mm,而帕金森小鼠大脑皮层的cl
‑
浓度为76.3
±
7.3mm,不具备统计学变化。
[0103]
将所述cfme/oxgo/ti3c2t
x
/ag电极植入正常和帕金森小鼠海马区,进行原位差示脉冲伏安扫描如图25。分别重复测试八只正常小鼠和八只帕金森小鼠,依据测得的两处氧化峰电位差(δe
p
(oxgo/agcl))计算,得到正常小鼠大脑皮层的cl
‑
浓度为90.6
±
8.6mm,而
帕金森小鼠大脑皮层的cl
‑
浓度为64.6
±
9.3mm,呈现下降趋势。
[0104]
正常小鼠和八只帕金森小鼠三个脑区(大脑皮层、纹状体和海马区)的cl
‑
浓度统计学结果,如图26所示;这表明cl
‑
与帕金森疾病有密切的关系。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1