含氨基或羧基基团物质标记的IgG抗体、人IgG磁微粒化学检测试剂盒及其制备方法与流程
含氨基或羧基基团物质标记的igg抗体、人igg磁微粒化学检测试剂盒及其制备方法
技术领域
1.本发明属于体外诊断领域,具体涉及一种含氨基或羧基基团物质标记的igg抗体、人igg磁微粒化学检测试剂盒及其制备方法。
背景技术:
2.常用的检测用抗体为单克隆抗体或多克隆抗体,是一种igg。当抗体结合抗原后,补体与抗体fc段的补体结合位点结合,对检测试剂造成干扰。此外,fc段的存在也可能使检测试剂存在假性干扰。
3.另外,当前的抗体偶联技术多采用共价偶联。由于抗体表面含有丰富的氨基和羧基,这两类基团也是抗体偶联中使用最多的官能团。通常采用的策略是将固相如磁性微球,聚苯乙烯微球或者酶类等表面的羧基用edc/nhs活化,再与抗体表面氨基形成稳定的酰胺键。极少会采用edc/nhs对抗体表面的羧基进行活化,因为抗体表面本身带有氨基,容易产生自交联的情况。由于氨基和羧基在抗体表面是普遍存在的,因此这种偶联方法也是随机的。当标记于抗体的互补决定区时,会使抗体失活。即使标记位于fc段也会因空间位阻的存在造成免疫活性的降低。
4.人免疫球蛋白g(human immunoglobulin g,人igg)主要由脾、淋巴结中的浆细胞合成和分泌,以单体形式存在。免疫球蛋白g是血清中主要的抗体成分,约占血清总ig的75%。免疫球蛋白g是唯一能通过胎盘的ig,在自然被动免疫中起重要作用。此外免疫球蛋白g还具有调理吞噬、adcc和结合spa等作用。由于免疫球蛋白g上述特点,免疫球蛋白g在机体免疫防护中起着主要的作用,大多数抗菌、抗病毒、抗毒素抗体都属于免疫球蛋白g类抗体。应用对麻疹、甲型肝炎等有免疫力的产妇或正常人丙种或胎盘球蛋白可进行人工被动免疫,能有郊地预防相应的传染性疾病。不少自身抗体如抗甲状腺球蛋白抗体、系统性红斑狼疮的le因子(抗核抗体)以及引起ⅲ型变态反应免疫复合物中的抗体大都也属于免疫球蛋白g。
技术实现要素:
5.有鉴于此,本发明的主要目的在于提供一种含氨基或羧基基团物质标记的igg抗体、人igg磁微粒化学检测试剂盒及其制备方法。
6.为了实现上述目的,本发明提供了一种含氨基或羧基基团物质标记的igg抗体的制备方法,包括以下步骤:
7.1)将igg单克隆抗体溶于酸性缓冲液中,之后加入胃蛋白酶进行酶切反应;
8.2)将步骤1)酶切后的混合溶液使用中性缓冲液透析过夜;
9.3)将步骤2)得到的液体通过protein a亲和纯化,deae纤维素阴离子交换层析法纯化获得igg
‑
f(ab’)2;
10.4)将步骤3)得到的igg
‑
f(ab’)2与hooc
‑
(chcho)n
‑
nh2共价偶联,形成抗体中间
体;
11.5)将步骤4)得到的抗体中间体与含氨基或羧基基团的物质共价结合,得到含氨基或羧基基团物质标记的抗体。
12.在本发明的一个具体方案中,其中步骤1)中,所述igg抗体、胃蛋白酶与酸性缓冲液与的质量比例为(0.5
‑
1):(0.5
‑
1):10000,优选为1:1:10000。所述igg抗体为能与抗原特异性结合的单克隆抗体,能被胃蛋白酶切成f(ab’)2段,且保留结合抗原的活性。
13.在本发明的一个具体方案中,其中步骤1)中,所述酶切反应的温度为37℃
‑
55℃,优选为37℃,这是酶在37℃时的活性较好;所述酶切反应的时间为0.5
‑
2小时。优选时间为30min,优选时间下,反应程度达到最高,时间再往后,趋于平稳,30min既能充分反应,又能节约试验时间。
14.在本发明的一个具体方案中,其中步骤1)中,所述酸性缓冲液为ph值在1~7之间的缓冲液,优选为ph3.0,优选后能使胃蛋白酶保留酶切活性,包括但不限于柠檬酸缓冲液、醋酸缓冲液、磷酸缓冲液、tris
‑
磷酸盐缓冲液、有机酸缓冲液、氨基酸缓冲液、mes缓冲液,优选为柠檬酸缓冲液,这样优选后胃蛋白酶保留酶切活性可以达到最大。
15.在本发明的一个具体方案中,其中步骤2)中,所述中性透析缓冲液为ph在6~8之间的缓冲液,包括但不限于磷酸缓冲液、tris
‑
盐酸缓冲液、巴比妥钠
‑
盐酸缓冲液、硼酸
‑
硼砂缓冲液、mes缓冲液,优选为0.1m的磷酸盐缓冲液ph7.0,这样优选后可以能够保持透析物质的活性。
16.在本发明的一个具体方案中,其中步骤2)中,所述透析的截留分子量为7000
‑
50000d。
17.在本发明的一个具体方案中,其中步骤4)中,所述hooc
‑
(chcho)n
‑
nh2中的n为3~100000之间,优选为hooc
‑
(ch ch o)12
‑
nh2,这样优选后能够使偶联效率更高。
18.在本发明的一个具体方案中,其中步骤4)中,所述igg
‑
f(ab’)2与hooc
‑
(chcho)n
‑
nh2的质量比例为(0.5
‑
1):1。优选比例为1:1,优选后,抗体与hooc
‑
(chcho)n
‑
nh2能够充分反应,反应程度最佳;既不会浪费原料又能达到最佳结合效果。
19.在本发明的一个具体方案中,其中步骤5)中,所述抗体中间体与含氨基或羧基基团的物质的质量比例为1:(5
‑
10),优选为1:6,当达到1:6,反应达到最高点,往后趋于平稳,因此1:6时既能节约原料,又能使反应程度达到顶峰。
20.在本发明的一个具体方案中,其中步骤5)中,所述含氨基或羧基基团的物质为蛋白、抗体、抗原、酶类、氨基酸、聚苯乙烯微球、量子点、磁性颗粒、金属颗粒或胶体金,选择不局限,不受原材料太多限制,优选为金属颗粒,能够使获得的标记物质具有更好的分散性,分离能力。
21.为了实现上述目的,本发明还提供了一种含氨基或羧基基团物质标记的抗体,所述抗体是通过上述的方法制得;所述含氨基或羧基基团的物质为蛋白、抗体、抗原、酶类(例如碱性磷酸酶)、氨基酸、聚苯乙烯微球、量子点、磁性颗粒、金属颗粒、胶体金。
22.为了实现上述目的,本发明还提供了一种人igg磁微粒化学检测试剂盒,其包括生物素标记的igg抗体、链霉亲和素标记的磁珠和上述的含氨基或羧基基团物质标记的igg抗体,三者的重量比例为(0.5
‑
1):(0.5
‑
1):(0.5
‑
1),优选为1:1:1,这样优选后能够更好地结合待测物质。
23.在本发明的一个具体方案中,其中所述人igg磁微粒化学检测试剂盒包括温育液、标记物试剂、磁珠试剂、底物、洗涤液、校准品及质控品,其体积比为(0.5
‑
1):(0.5
‑
1):(0.5
‑
1):(2
‑
4):(2
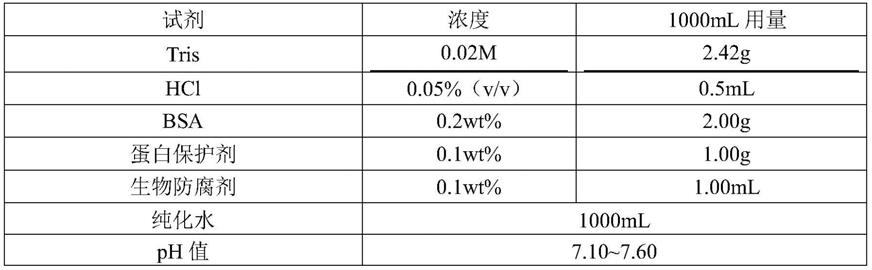
‑
4):(0.1
‑
0.2):(0.1
‑
0.2),优选为0.5:0.5:0.5:2:2:0.1:0.1。优选后反应效果最优,结合最充分,原材料使用最少,最大程度的节约成本。
24.在本发明的一个具体方案中,其中所述温育液为含有生物素标记的人igg包被抗体及0.5wt%牛血清白蛋白的0.05mol/l,ph7.0的tris缓冲液;所述生物素标记的人igg包被抗体与tris缓冲液的重量比例为1:(1000
‑
3000),优选为1:1000。优选后,生物素标记的人igg包被抗体能够充分的溶于缓冲液,不会出现被标记抗体不溶的情况而影响后续试验结果。
25.在本发明的一个具体方案中,其中所述标记物试剂为含有含氨基或羧基基团物质标记的igg抗体及0.5wt%牛血清白蛋白的0.05mol/l,ph7.0的tris缓冲液;所述含氨基或羧基基团物质标记的igg抗体与tris缓冲液的重量比例为1:(1000
‑
3000),优选为1:1000。优选后,含氨基或羧基基团物质标记的igg抗体能够充分的溶于缓冲液,不会出现被标记抗体不溶的情况而影响后续试验结果。
26.在本发明的一个具体方案中,其中所述磁珠试剂为含有链霉亲和素标记的磁珠及0.5wt%牛血清白蛋白的0.05mol/l,ph7.0的tris缓冲液,所述链霉亲和素标记的磁珠与tris缓冲液的比例为0.5
‑
1mg/ml,优选为0.5mg/ml,这样优选后与其他参数协同能够使试剂盒线性更好。
27.在本发明的一个具体方案中,其中所述底物为含有0.2wt%光泽精的0.05mol/l,ph7.0的tris缓冲液。
28.在本发明的一个具体方案中,其中所述洗涤液为含有0.1wt%吐温
‑
20、8wt%nacl的的0.05mol/l,ph7.0的tris缓冲液。
29.在本发明的一个具体方案中,其中所述校准品为含有人igg抗原及0.5wt%牛血清白蛋白的0.05mol/l,ph7.0的tris缓冲液,所述校准品包括五种人igg抗原浓度分别为10ng/ml、100ng/ml、500ng/ml、2000ng/ml、10000ng/ml的液体校准品。
30.在本发明的一个具体方案中,其中所述质控品为含有人igg抗原及0.5wt%牛血清白蛋白的0.05mol/l,ph7.0的tris缓冲液,所述质控品包括两种人igg抗原浓度分别为100ng/ml、2000ng/ml的液体质控品。
31.在本发明的一个具体方案中,其中所述人igg磁微粒化学检测试剂盒的线性范围在10
‑
10000ng/ml。
32.为了实现上述目的,本发明还提供了一种人igg磁微粒化学检测试剂盒的制备方法,包括以下步骤:
33.1a)温育液的制备:将生物素标记的人igg包被抗体溶解于含0.5wt%牛血清白蛋白的0.05mol/l,ph7.0的tris缓冲液,得到温育液;
34.2a)标记物试剂的制备:将上述含氨基或羧基基团物质标记的igg抗体溶解于含0.5wt%牛血清白蛋白的0.05mol/l,ph7.0的tris缓冲液,得到标记物试剂;
35.3a)磁珠试剂的制备:将链霉亲和素标记的磁珠溶解于含0.5wt%牛血清白蛋白的0.05mol/l,ph7.0的tris缓冲液,得到磁珠试剂;
36.4a)底物的制备:配制含有0.2wt%光泽精的0.05mol/l ph7.0的tris缓冲液;
37.5a)洗涤液的制备:配制含有0.1wt%的吐温
‑
20、8wt%的nacl的0.05mol/l ph7.0的tris缓冲液;
38.6a)校准品和质控品的制备:将人lgg抗原分别按照一定的浓度溶解在0.5wt%牛血清白蛋白的0.05mol/l ph7.0的tris缓冲液中,依次配成浓度10、100、500、2000、10000ng/ml和100ng/ml、2000ng/ml的校准品和质控品。
39.在本发明的一个具体方案中,其中步骤1a)中,所述生物素标记的人igg包被抗体与tris缓冲液的重量比例为1:1000
‑
3000;步骤2a)中,所述含氨基或羧基基团物质标记的igg抗体与tris缓冲液的重量比例为1:1000
‑
3000;步骤3a)中,所述链霉亲和素标记的磁珠与tris缓冲液的比例为0.5
‑
1mg/ml。
40.为了实现上述目的,本发明还提供了一种人igg磁微粒化学检测试剂盒的使用方法,所述方法所用的样本为选自人血清、血浆。
41.本发明所述的含氨基或羧基基团物质标记的抗体、含有该抗体的人igg磁微粒化学检测试剂盒及其制备方法具有如下有益效果:
42.1、本发明通过定向偶联可减少补体对检测试剂的影响,降低非特异性结合带来的干扰。
43.2、本发明通过定向偶联技术可降低标记抗体的空间位阻,提高标记抗体的活性。
44.3、本发明通过定向偶联可提高原有抗体的检测灵敏度和特异性。
45.4、本发明通过定向偶联可使得抗体用量减少,节约了成本。
附图说明
46.图1为本发明的人igg标准曲线图;
47.图2为本发明实施例2得到的试剂盒对40例不同样本(其中20例正常人,20例为阳性患者)进行人igg检测的roc曲线界面;
48.图3是本发明对比例1得到的试剂盒对40例不同样本(其中20例正常人,20例为阳性患者)进行人igg检测的roc曲线界面。
具体实施方式
49.下面结合说明书附图对本发明进行进一步说明。
50.以下材料或试剂,除非特别说明,均为市售。
51.实施例1:
52.1.人igg磁微粒化学检测试剂的制备
53.1)制备igg
‑
f(ab’)2
54.取10mg人igg单克隆抗体(购自南京开尔泰),以0.1m,ph3
‑
5柠檬酸缓冲液稀释至2mg/ml。随后在0.1m,ph3
‑
5柠檬酸缓冲液中搅拌(截留分子量7000d)透析6小时后取出置于西林瓶中。
55.取胃蛋白酶0.5mg加入西林瓶中,搅拌混匀,随后37℃温育3小时。然后将其用0.1m,ph8.0的pbs透析24小时(截留分子量为5万d)。
56.用0.1m的pb(ph7.0)缓冲液平衡protein a亲和层析柱,流速1ml/min,体积应>20ml,平衡至od280<0.01。将透析后的样品液以1ml/min的流速上样,收集流穿液,并记录体
积。再以0.1m的pb(ph7.0)的缓冲液洗涤上样后的层析柱,流速2ml/min,体积>50ml,洗涤至od280<0.01,保留液体待测。然后以0.1m的柠檬酸(ph3.0)的缓冲液洗脱上样后的层析柱,流速1ml/min,体积不限,分管收集洗脱液,同时调节ph至7.0左右,洗脱至od280<0.01,保留洗脱液,最后使用分光光度计测od280,计算初步产量,将获得的样品置于透析袋中,使用0.01m pbs(ph7.0
‑
7.5)中透析24h,充分透析,期间换液2
‑
3次,将透析后的样品收集。再将样品与deae按照100mg/100mg的比例,称取所需量的deae经蒸馏水浸泡过夜并换水3次去除小颗粒,然后抽干,再经0.5ml/l的naoh浸泡1
‑
2小时后抽干,用双蒸水洗涤2
‑
3次,调节ph至8.0左右,再用0.5ml/l的hcl浸泡1
‑
2小时后抽干,用双蒸水洗涤2
‑
3次,调节ph至6.0左右。将处理好的deae
‑
纤维素用0.01mol/l,ph6的磷酸盐缓冲液浸泡处理1
‑
3小时,并其间换液1
‑
2次,最后搅拌均匀灌入层析柱中直至柱床高约17cm左右为止。柱床做成后,使用0.01mol/l的磷酸盐缓冲液进行空洗,直至流出液体的ph值与磷酸盐缓冲液ph完全相同为止。平衡完毕后,关闭下口,吸取柱内多于柱下口的液体,控制流速使样品缓慢进入柱内,待样品完全进入后,在柱床上面加一层0.1mol/l,ph6的磷酸盐缓冲液。上样结束后打开柱下口洗脱,控制流速0.5ml/min,按照每管10滴收集洗脱液,从每管中取1滴收集液刚入黑色比色孔中,加入1滴20wt%的黄基水杨酸检查是否产生白色沉淀,在此条件下收集液中首次出现白色沉淀则为纯化的lgg,收集液直至无白色沉淀出现为止。
57.样本经protein a/g抗体纯化柱(10倍柱体积)亲和纯化,每次上样1ml,收集穿透样品,再经deae纤维素阴离子交换层析法纯化获得igg
‑
f(ab’)2。将获得的igg
‑
f(ab’)2样品经3wt%凝胶电泳分析,所得igg
‑
f(ab’)2样品的分子量在110kd左右,纯度≥90%以上。
58.2)制备抗体中间体
59.将25mg hooc
‑
(chccho)12
‑
nh2加入1ml的dmso混合均匀,随后取21.42μl之前得到的混合溶液,将其加入1ml,1mg/ml的上述igg
‑
f(ab’)2中,并加入碳化二亚胺5mg,常温下搅拌反应1小时,最后在0.01m,ph7.2的pbs透析24小时(截留分子量为7000d),即得1mg/ml的抗体中间体溶液。
60.3)制备碱性磷酸酶标记的igg抗体
61.取浓度为1mg/ml的碱性磷酸酶1ml,加入1mg碳化二亚胺(edc),1mg n
‑
羟基琥珀酰亚胺(nhs)室温30r/min搅拌3h,然后加入到上述的1ml,1mg/ml抗体中间体溶液中,室温下30r/min搅拌1h,随后再加入10mg bsa封闭,继续搅拌1h。
62.最后在0.01m,ph7.2的pbs透析24小时(截留分子量10万d),放在西林瓶中并加入5μl的proclin300,加入1wt%的bsa及1ml的丙三醇,混匀后
‑
20℃保存。
63.4)制备生物素标记的igg包被抗体
64.取人igg包被抗体1mg,放入0.01m,ph7.2的pbs的标记缓冲液(0.01m的pbs)透析30min;取酯化生物素1mg溶解于0.1ml纯化水中;将二者混匀后室温反应1小时。
65.将反应1小时后的溶液转入透析袋(截留分子量7000d)中,用0.01m,ph7.2pbs缓冲液透析24小时,中间换液1次。
66.将透析好的溶液转入瓶中,加入1wt%的bsa及1ml的丙三醇,混匀后
‑
20℃保存。
67.5)制备链霉亲和素标记的磁微粒
68.取链霉亲和素300mg,加入30ml纯化水,配制成10mg/ml;取购自赛默飞的10mg/ml的磁微粒300mg,用0.02m的pbs缓冲液将其反复洗涤5次,随后取3ml,0.02m的pbs缓冲液将
其稀释成100mg/ml;最后将两者混合,并加入30mg碳化二亚胺,再次混匀后室温反应1小时。
69.反应结束后,使用0.02m的pbs缓冲液反复洗涤5次,最后用1wt%的牛血清白蛋白的ph7.0,0.02m的tris缓冲液将其再次稀释成100mg/ml。
70.实施例2:
71.1.人igg磁微粒化学检测试剂盒的制备
72.1)igg
‑
f(ab’)2的制备
73.取10mg人igg单克隆抗体(购自南京开尔泰),以0.1m,ph3
‑
5柠檬酸缓冲液稀释至2mg/ml。随后在0.1m,ph3
‑
5柠檬酸缓冲液中搅拌(截留分子量为7000d)透析6小时后取出置于西林瓶中。
74.取胃蛋白酶0.5mg加入西林瓶中,搅拌混匀,随后37℃温育3小时。然后将其用0.1m,ph8.0pbs透析24小时(截留分子量为5万d)。
75.用0.1m的pb(ph7.0)缓冲液平衡protein a亲和层析柱,流速1ml/min,体积应>20ml,平衡至od280<0.01。将透析后的样品液以1ml/min的流速上样,收集流穿液,并记录体积。再以0.1m的pb(ph7.0)的缓冲液洗涤上样后的层析柱,流速2ml/min,体积>50ml,洗涤至od280<0.01,保留液体待测。然后以0.1m的柠檬酸(ph3.0)的缓冲液洗脱上样后的层析柱,流速1ml/min,体积不限,分管收集洗脱液,同时调节ph至7.0左右,洗脱至od280<0.01,保留洗脱液,最后使用分光光度计测od280,计算初步产量,将获得的样品置于透析袋中,使用0.01m pbs(ph7.0)中透析20
‑
24小时,期间换液2
‑
3次,将透析后的样品收集。再将样品与deae按照75
‑
122mg/100mg的比例,称取所需量的deae经蒸馏水浸泡过夜并换水2
‑
3次去除小颗粒,然后抽干,再经0.5ml/l的naoh浸泡1
‑
2小时后抽干,用双蒸水洗涤2
‑
3次,调节ph值至8.0左右,再用0.5ml/l的hcl浸泡1
‑
2小时后抽干,用双蒸水洗涤3次,调节ph值至6.0左右。将处理好的deae
‑
纤维素用0.01mol/l,ph7的磷酸盐缓冲液浸泡处理1
‑
3小时,并其间换液1
‑
2次,最后搅拌均匀灌入层析柱中直至柱床高约17cm左右为止。柱床做成后,使用0.01mol/l的磷酸盐缓冲液进行空洗,直至流出液体的ph值与磷酸盐缓冲液的ph值完全相同为止。平衡完毕后,关闭下口,吸取柱内多于柱下口的液体,控制流速使样品缓慢进入柱内,待样品完全进入后,在柱床上面加一层0.1mol/l,ph值为7的磷酸盐缓冲液。上样结束后打开柱下口洗脱,控制流速0.5ml/min,按照每管10滴收集洗脱液,从每管中取1滴收集液刚入黑色比色孔中,加入1滴20wt%的黄基水杨酸检查是否产生白色沉淀,在此条件下收集液中首次出现白色沉淀则为纯化的lgg,收集液直至无白色沉淀出现为止。
76.样本经protein a/g抗体纯化柱(10倍柱体积)亲和纯化,每次上样1ml,收集穿透样品,再经deae纤维素阴离子交换层析法纯化获得igg
‑
f(ab’)2。将获得的样品经5wt%的凝胶电泳分析,所得样本分子量在110kd左右,纯度≥90%以上。
77.2)制备抗体中间体
78.将25mg hooc
‑
(chccho)16
‑
nh2加入1ml的dmso混合均匀,随后从之前的混合溶液中取21.42μl加入1ml的1mg/ml的igg
‑
f(ab’)2中,并加入碳化二亚胺5mg,常温下搅拌反应1小时,最后在0.01m,ph7.2的pbs透析24小时(截留分子量7000d),即得抗体中间体溶液。
79.3)制备碱性磷酸酶标记的igg抗体
80.取浓度为1mg/ml的碱性磷酸酶1ml,加入1mg碳化二亚胺(edc),1mg n
‑
羟基琥珀酰亚胺(nhs)室温30r/min搅拌3h,然后加入到1mg/ml,1ml的抗体中间体溶液中,室温下30r/
min搅拌1h,随后再加入10mg bsa封闭,继续搅拌1h。
81.最后在0.01m,ph7.2的pbs透析24小时(截留分子量为10万d),放在西林瓶中并加入5μl的proclin300,加入1wt%的bsa及1ml的丙三醇,混匀后
‑
20℃保存。
82.4)制备生物素标记的igg抗体
83.取人igg包被抗体1mg,放入0.01m,ph7.2的pbs透析30min;取酯化生物素1mg溶解于0.1ml纯化水中;将二者混匀后室温反应1小时。
84.将反应1小时后的溶液转入透析袋(截留分子量为7000d)中,用0.01m,ph7.2的pbs缓冲液透析24小时,中间换液1次。
85.将透析好的溶液转入瓶中,加入10g,1wt%的bsa及1ml丙三醇,混匀后
‑
20℃保存。
86.5)制备链霉亲和素标记的磁微粒
87.取链霉亲和素300mg,加入30ml纯化水,配制成10mg/ml;取购自赛默飞的10mg/ml的磁微粒300mg,用0.02m pbs缓冲液将其反复洗涤5次,随后取3ml,0.02m的pbs缓冲液将其稀释成100mg/ml;最后将两者混合,并加入30mg碳化二亚胺,再次混匀后室温反应1小时。
88.反应结束后,使用0.02m的pbs缓冲液反复洗涤5次,最后用1wt%的牛血清白蛋白的ph7.0,0.02m的tris缓冲液将其再次稀释成100mg/ml。
89.2.检测
90.将实施例1得到的生物素标记的包被抗体以及碱性磷酸酶标记的抗体分别按照1:1000以及1:3000的体积比例加入到标记物稀释液中;取浓度为100mg/ml的0.1ml链霉亲和素标记的磁微粒溶液,加入19.9ml磁微粒稀释液,配制工作浓度为0.5mg/ml。
91.标记物稀释液配制如下表1所示。
92.表1 标记物稀释液的配方
[0093][0094]
(2)按照加样方式:10μl校准品预稀释500倍后,取10μl+50μl温育液+50μl标记物
→
温育15min,+50μl磁微粒试剂
→
温育5min,洗涤5次;
→
+200μl发光液,检测。
[0095]
将待测样本(采血管取样本之后在3000转/min下离心3min,分离得血清即为待测样本)放入试管架,放入全自动化学发光测定仪,将试剂盒的磁珠试剂,温育液和标记物试剂同时放入所述全自动化学发光测定仪,布置好程序选择项目即可检测30分钟后得到检测结果,在检测记录页面获取检测结果。
[0096]
3.标准曲线的建立
[0097]
配置不同浓度的人igg标准品(0、10、100、500、2000、10000ng/ml),用本发明实施例2中制备的人igg试剂盒进行检测,检测结果如表2所示,采用检测范围为10~5000ng/ml,四参数进行曲线拟合,标准曲线为:y=(8011604.0000
‑
1532.0400)/(1+(x/16443.3800)^
‑
1.0467)+1532.0400,相关系数r=1.0000,如图1所示。从表2及图1可以看出,随着浓度的增加,信号值(发光值)也随之增大,s2比s0高出一个数量级,证明信噪比较好,拟合曲线拟合的较好,数据可靠。
[0098]
表2 检测数据
[0099][0100]
4.性能评估
[0101]
使用实施例2得到的试剂盒分别对40例不同样本(其中20例正常人,20例为阳性患者)进行检测,然后通过medcalc制作roc曲线分析发现所述试剂盒的特异性为100%,敏感性为100%,临界值cutoff为65.67ng/ml,auc为1.0000,见图2。具体数据见表3。说明该试剂盒敏感度高,测值准确误差小。
[0102]
表3
[0103]
样本类型正常人(ng/ml)阳性病人(ng/ml)血清40.81334.72血清62.34739.43血清52.06107.45血清59.22796.11血清49.69873.98血清56.25814.38血清37.4278.34血清40.33729.61血清51.91961.18血清54.62211.07血清32.17101.64血清65.67710.97血清60.79621.71血清54.06430.6血清29.14171.41血清29.64941.18血清47.58905.15血清34.47796.85血清42.28693.36血清44.06539.92
[0104]
使用实施例2得到的试剂盒与对比例1的非定向偶联技术制备的试剂盒(其与实施例2的试剂盒制备的区别在于:无抗体中间体的制备步骤,其余步骤相同)分别对40例不同样本(其中20例正常人,20例为阳性患者)进行检测,通过medcalc分析非定向偶联标记之前临床样本和正常人之间未有明显的区分,对比例1的试剂盒的敏感性为55%,特异性为100%,临界值cutoff为25.26,auc为0.783,然而定向偶联标记之后临床样本和正常人之间有明显的区分,实施例2的试剂盒的敏感性为100%,特异性为100%,临界值cutoff为65.97,auc为1.000,如图2、图3所示,具体数据见表4。对比两组分析结果发现,对比例1的非定向偶联由于空间位阻使得检测结果不准确,无法满足试剂盒的基本性能。
[0105]
表4
[0106]
[0107][0108]
以上所述实施例仅是为充分说明本发明而所举的实施例,本发明的保护范围不限于此。本技术领域的技术人员在本发明基础上所作的等同替代或变换,均在本发明的保护
范围之内。本发明的保护范围以权利要求书为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1