一种快速生物组织标记的方法
1.本发明涉及生物装置领域,具体涉及一种快速生物组织标记的方法。
背景技术:
2.近年来,生物组织透明化技术方面的进展使得人们能直接通过荧光显微镜获取完整组织在单细胞尺度的3d空间结构。组织透明化与最新的成像技术结合彻底改变了人们在生理和病理生理条件下获取这些复杂的生物组织的结构和功能信息的能力,革命性改变了组织学和病理学的研究方式,具有极大的潜在科学价值和临床应用价值。
3.但是新技术带来新问题,这些技术的常规应用往往受阻于免疫荧光标记的漫长过程。因为这些技术通常依赖于抗体的自由扩散,而透明化后的的组织本质上是交联的大分子凝胶的密集基质,即使在中等厚度(~2.5mm)和/或在高抗体浓度下,抗体分子的自由扩散也必然缓慢,通常需要数周才能完成一次免疫标记。例如,以 clarity技术为例,最早的文献报道中提到,采用间接免疫荧光标记技术(一抗+ 荧光二抗)标记clarity透明后的小鼠全脑的需要6周。
4.已有的文献报道表明,通过电场加速分子探针(特别是抗体分子)是解决这个瓶颈问题的有效方法。然而,目前的技术方法都使用了相对较高的电场 (>1000v/m),会产生明显的抗体在组织界面聚集的边界效应。边界效应会导致组织表面的孔隙被抗体分子大量的填充,严重阻止后续抗体分子进入组织内部,使得组织内外抗体标记严重不均匀,难以实现透明化组织的高质量免疫荧光标记。同时,强电场对应的高电流会导致样品明显的升温,以及由于局部电场的变化和/或温度的升高导致最终的样品损伤或永久变形。
5.因此,本领域迫切需要开发一种对厚的组织(>1mm)实现高效和快速免疫标记的方法。
技术实现要素:
6.本发明的目的在于提供一种对厚的组织(>1mm)实现高效和快速免疫标记的方法。
7.本发明的另一目的在于提供低电场辅助抗体扩散进入样品的方法。
8.本发明第一方面提供了一种对组织样本进行免疫标记的方法,包括步骤:
9.(a)提供一标记体系,所述标记体系含有待进行免疫标记的组织样本、用于对所述组织样本进行标记的探针和缓冲液;和
10.(b)将所述的标记体系置于电场作用下进行标记处理,从而使得所述的探针进入所述组织样本内部,从而对所述组织样本进行免疫标记,获得经免疫标记的组织样本,所述的电场具有以下特征:电流密度的变化范围为0.1
‑
0.3ma/mm2。
11.在另一优选例中,所述电场强度还具有选自下组的一种或多种特征:
12.(i)电场强度为107
‑
710v/m;
13.(ii)电极距离为2-15cm,较佳地,3-5cm,更佳地,3.3cm。
14.在另一优选例中,所述电流密度的变化范围为0.1
‑
0.2ma/mm2,更佳地, 0.2
±
0.02ma/mm2。
15.在另一优选例中,在步骤(b)中,所述标记处理(即染色时间)的时间为9
‑
15h,较佳地,9-11h,更佳地,10-11h。
16.在另一优选例中,所述标记处理的时间包括一抗染色时间,一抗洗脱时间,二抗染色时间,二抗洗涤(洗脱)时间。
17.在另一优选例中,所述的方法还包括:(c)对所述经免疫标记的组织样本进行检测。
18.在另一优选例中,在步骤(c)中,所述的检测包括荧光强度检测。
19.在另一优选例中,所述缓冲液选自下组:硼酸、triton x
‑
100、hepes等缓冲液、或其组合。
20.在另一优选例中,所述缓冲液含有表面活性剂。
21.在另一优选例中,所述表面活性剂包括triton x
‑
100、吐温20、chaps。
22.在另一优选例中,所述表面活性剂的浓度为0.1
‑
10%,较佳地,10%,以所述缓冲液的总体积计。
23.在另一优选例中,所述缓冲液的浓度为0.05
‑
1m,较佳地,0.1m。
24.在另一优选例中,所述的探针包括:抗体、核酸探针。
25.在另一优选例中,所述的探针带有可检测标志物。
26.在另一优选例中,所述的可检测标志物包括:荧光团、生色团、化学发光团。
27.在另一优选例中,当所述的探针为抗体时,所述标记体系的ph为5
‑
11。
28.在另一优选例中,所述抗体为单克隆抗体。
29.在另一优选例中,所述抗体包括一个或多个抗体。
30.在另一优选例中,所述抗体包括一个或两个抗体。
31.在另一优选例中,所述抗体包括一抗和二抗。
32.在另一优选例中,所述探针的浓度为0.25
‑
2.5μg/ml,较佳地,0.5
‑
2μg/ml,更佳地,1μg/ml。
33.在另一优选例中,所述抗体的浓度为0.25
‑
2.5μg/ml,较佳地,0.5
‑
2μg/ml,更佳地,1μg/ml。
34.在另一优选例中,所述的组织样本是动物或者植物样品。
35.在另一优选例中,所述组织样本选自下组:脑组织、胃组织、肝组织、肺组织、或其组合。
36.在另一优选例中,所述组织样本来源于哺乳动物、人、或其组合。
37.在另一优选例中,所述组织样本来源于小鼠、大鼠、人、或其组合。
38.在另一优选例中,所述的组织样本为经透明化处理的样本。
39.在另一优选例中,所述样本为片状样本,具有第一主表面和第二主表面。
40.在另一优选例中,所述的组织样本(片状样本)的厚度为2
‑
20mm,较佳地, 2-5mm。
41.在另一优选例中,所述的组织样本(片状样本)的截面积为1
‑
100cm2。
42.在另一优选例中,所述的电场通过位于所述样本左右两侧或上下两侧的电极施加。
43.在另一优选例中,所述的电场通过位于所述样本的第一主表面和第二主表面外侧
的电极施加。
44.在另一优选例中,所述探针进入组织样本内部的时间为2h
‑
3h。
45.在另一优选例中,所述的免疫标记为免疫荧光标记。
46.在另一优选例中,所述的方法为非诊断性和非治疗性的体外方法。
47.本发明第二方面提供了一种对组织样本进行免疫标记的装置,所述装置包括:
48.用于放置所述组织样本的容器;其中,所述容器用于盛放一标记体系,所述标记体系含有待进行免疫标记的组织样本、用于对所述组织样本进行标记的探针和缓冲液;
49.用于产生电场的电极对,其中,所述电极对位于所述组织样本的左右两侧或上下两侧,从而产生驱动所述探针进入所述的组织样本内部的电场;和
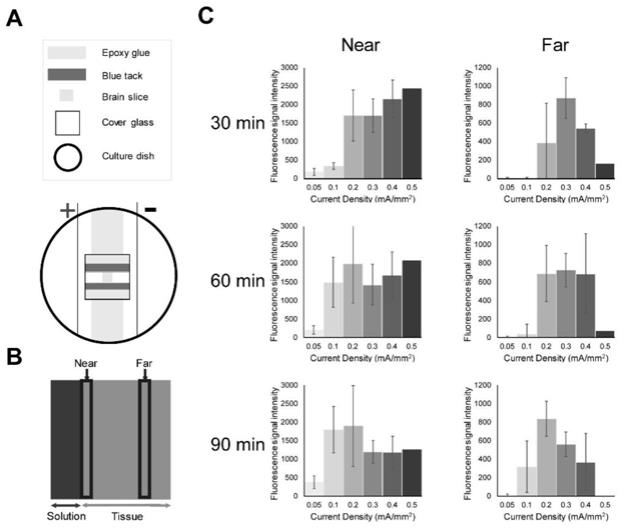
50.电源,所述电源与所述电极对电连接;
51.其中,所述的电场具有以下特征:电流密度的变化范围为0.1
‑
0.3ma/mm2。
52.在另一优选例中,所述容器为圆形。
53.在另一优选例中,所述容器的直径为1
‑
10cm,较佳地,3
‑
4cm,更佳地,3.5cm。
54.在另一优选例中,所述电极直径为0.1
‑
1mm,较佳地,0.2
‑
0.8mm,更佳地,0.3
‑
0.6mm。
55.在另一优选例中,所述电极的长度为2
‑
15cm,较佳地,4
‑
10cm,更佳地,5
‑
9cm。
56.本发明第三方面提供了一种对组织样本进行免疫标记的试剂盒,所述试剂盒含有:
57.第一容器,所述容器中含有待进行免疫标记的组织样本;
58.第二容器,所述容器中含有对所述组织样本进行标记的探针;
59.第三容器,所述容器中含有缓冲液;
60.第四容器,所述容器中含有电极板、电源插头,形成一个电场,所述的电场具有以下特征:电流密度的变化范围为0.1
‑
0.3ma/mm2;
61.标签或说明书,所述标签或说明书注明所述试剂盒用于对组织样本进行免疫标记。
62.本发明第四方面提供了一种对组织样本进行免疫标记的装置,所述的装置包括:
63.染色室(labeling chamber);
64.电泳室(electrophoresis chamber);
65.样品室(sample chamber);
66.电源;和
67.电极,所述电极与电源正负极连接,用于产生电场,所述电场中的电流密度的变化范围为0.1
‑
0.3ma/mm2;
68.其中,所述样品室位于染色室内部,并且染色室内部还含有抗体稀释液,所述样品室用于固定样品,并且所述样品室含有样品(sample),固定样品的琼脂糖(agrose);
69.所述的电泳室含有电极、染色室、样品室;并且,所述电泳室具有正负电极接口。
70.在另一优选例中,所述琼脂糖的含量为5-10%w/v,较佳地,7-9%w/v。
71.在另一优选例中,所述的电极的材料为导电材料,所述的电极的材料选自下组:铂、金、银、导电玻璃、碳、石墨烯或其组合。
72.在另一优选例中,所述电极的材料是金属铂。
73.在另一优选例中,所述电极包括一对或多对铂丝电极。
74.在另一优选例中,所述的装置还具有控制系统,所述的控制系统包括选自下组的一种或多种:温度控制系统,自动液体循环系统,定时系统,电流控制系统。
75.在另一优选例中,所述电极包括正极电极和负极电极。
76.在另一优选例中,所述的正极电极距离电泳室壁0.01
‑
0.5cm、所述的负极电极距离电泳室壁0.01
‑
0.5cm。
77.在另一优选例中,所述的正极电极包括电极材料以及固定电极材料:
78.所述的固定电极的材料为绝缘材料,所述的固定电极材料选自下组:玻璃板、塑料板、陶瓷板或其组合;
79.所述的电极材料为导电材料,所述的电极材料选自下组:铂、金、银、导电玻璃、碳、石墨烯或其组合。
80.在另一优选例中,所述的负极电极包括电极材料以及固定电极的材料;
81.所述的固定电极材料为绝缘材料,所述的固定电极材料选自下组:玻璃板、塑料板、陶瓷板或其组合;
82.所述的电极材料为导电材料,所述的电极材料选自下组:铂、金、银、导电玻璃、碳、石墨烯或其组合。
83.在另一优选例中,所述染色室的两侧含有透析膜。
84.在另一优选例中,所述透析膜阻挡抗体分子流出染色室。
85.在另一优选例中,所述透析膜能通过电流。
86.应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例) 中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
87.图1显示了在外电场的驱动下,监测抗体进入小鼠大脑组织的输运过程的实验。(a)实验装置的示意图;(b)测量平均荧光强度的组织边缘附近和远离组织边缘的确切位置的示意图;(c)在30、60或90min后,在不同电流密度下(0.05,0.1,0.2,0.3,0.4,0.5ma/mm2),接近和远离组织边缘处测量的平均荧光强度。
88.图2显示了定量测量组织在不同电流密度条件下变形情况。a)组织在不同电流密度(0.05,0.1,0.2,0.3,0.4,0.5ma/mm2)作用之前和和之后(90mins) 的照片(黄色线为边界);b)测量a)中的组织周长得到的柱状图;c)组织在电流密度0.2ma/mm2下作用90mins后组织在细胞尺度的荧光图像(用dapi标记了细胞核),显示没有变形;d)组织在电流密度0.5ma/mm2下作用90mins后组织在细胞尺度的荧光图像(用dapi标记了细胞核)显示有明显组织变形。
89.图3显示了基于专利所提出的新原理所设计的快速免疫荧光标记装置,称为 electro
‑
enhanced rapid staining或者eers装置。a)eer装置的照片和主要组成部分的示意图。主要组成部分包括染色室(labeling chamber)、电泳室(electrophoresischamber)和一对铂丝电极。b)样品室固定样品的示意图,包括样品(sample),固定样品的琼脂糖(agrose),样品室(sample chamber)。c)样品室与染色室相对关系示意图,固定好样品的样
品室插入染色室中,然后将抗体分别加入染色室中样品室的两侧。染色室的两侧有透析膜会阻挡抗体分子流出染色室,但是电流可以通过透析膜。d)eers装置的横截面图,展示各个组成部分的相对位置关系。
90.图4显示了使用电场增强快速免疫荧光标记(electro
‑
enhanced rapid staining, eers)装置标记2mm厚的clarity脑片。(a)b
‑
e图中显示的2mm脑片的表面和横截面的位置示意图。(b)使用荧光标记的anti
‑
histone 3抗体染色的脑切片图像,显示组织切片的染色均匀。(c)使用anti
‑
lamin b1一抗和荧光标记的二抗染色的脑切片图像,显示组织切片的染色均匀。标尺=200μm(d,e)用dapi染色(蓝色)且和h3、lamin b1(红色)共定位的c和d图中的黄框位置的放大视图。标尺= 20μm。
具体实施方式
91.本发明人经过广泛而深入的研究,首次意外地发现,通过将电流密度调节为0.1
‑
0.3ma/mm2,能够显著减少抗体在组织与溶液界面聚集的边界效应,大量探针能够快速进入到组织样本内部,对组织样本进行免疫标记,显著减少完整透明化组织免疫标记的时间(标记时间可以减至10小时或小于10小时),并且组织的宏观和微观结构都不会被破坏,保持组织的完整性,并且,探针(比如抗体)的使用量相比传统的免疫应该标记也会减少至3倍以上。在此基础上,本发明人完成了本发明。
92.对组织样本进行免疫标记
93.如本文所用,所述“对组织样本进行免疫标记”通常指用一个或多个抗体(比如一个或两个抗体)去特异性结合抗原的一种标记方法,其利用特定抗体的特异性结合性质来分离抗原、导向抗原、以及/或定量抗原。
94.在本发明中,所述“对组织样本进行免疫标记”是指在外加电场(比如电流密度为0.1
‑
0.3ma/mm2)的作用下,用探针对组织样本内部进行免疫标记,与传统的方法相比,该方法不仅能够加速探针进入组织样本内部,显著减少完整透明化组织免疫标记的时间(标记时间可以减至10小时或小于10小时,以2mm的样品(比如脑组织)为例),并且组织的宏观和微观结构都不会被破坏,保持组织的完整性。具体地,在外加电场(比如电流密度为0.1
‑
0.3ma/mm2)的作用下,探针在2-3h内即可进入组织样本内部,极大的缩短了完整透明化组织免疫标记的时间,并且,本发明探针(比如抗体)的使用量相比传统的免疫应该标记也会减少至3倍以上。
95.本发明提供的对组织样本进行免疫标记的方法,包括如下步骤:
96.(a)提供一标记体系,所述标记体系含有待进行免疫标记的组织样本、用于对所述组织样本进行标记的探针和缓冲液;和
97.(b)将所述的标记体系置于电场作用下进行标记处理,从而使得所述的探针进入所述组织样本内部,从而对所述组织样本进行免疫标记,获得经免疫标记的组织样本,所述的电场具有以下特征:电流密度的变化范围为0.1
‑
0.3ma/mm2。
98.对组织样本进行免疫标记的装置
99.如本文所用,所述“对组织样本进行免疫标记的装置”包括:
100.用于放置所述组织样本的容器;其中,所述容器用于盛放一标记体系,所述标记体系含有待进行免疫标记的组织样本、用于对所述组织样本进行标记的探针和缓冲液;
101.用于产生电场的电极对,其中,所述电极对位于所述组织样本的左右两侧或上下两侧,从而产生驱动所述探针进入所述的组织样本内部的电场;和
102.电源,所述电源与所述电极对电连接;
103.其中,所述的电场具有以下特征:电流密度的变化范围为0.1
‑
0.3ma/mm2。
104.在一具体实施方式中,本发明的对组织样本进行免疫标记的装置包括:
105.染色室(labeling chamber);
106.电泳室(electrophoresis chamber);
107.样品室(sample chamber);
108.电源;和
109.电极,所述电极与电源正负极连接,用于产生电场,所述电场中的电流密度的变化范围为0.1
‑
0.3ma/mm2;
110.其中,所述样品室位于染色室内部,并且染色室内部还含有抗体稀释液,所述样品室用于固定样品,并且所述样品室含有样品(sample),固定样品的琼脂糖(agrose);
111.所述的电泳室含有电极、染色室、样品室;并且,所述电泳室具有正负电极接口。
112.用本发明所述的“对组织样本进行免疫标记的装置”对组织样本进行免疫标记,不仅能够加速探针进入组织样本内部,显著减少完整透明化组织免疫标记的时间(标记时间可以减至10小时或小于10小时),并且组织的宏观和微观结构都不会被破坏,保持组织的完整性。
113.在本发明的一优选实施方式中,本发明发现利用强电场驱动抗体主动加速进入组织的过程中,会产生一种现象,称之为边缘效应。该现象会导致抗体积存在组织边缘,从而导致后续的抗体因为拥堵而难以进入更深的地方。进一步研究发现,采用弱电流密度的外加电场,可以辅助抗体更好更均匀的扩散进入组织内部,好于使用强电流密度的外力作用。在达到快速染色目的的同时可以更好的保护组织,产热也更少。基于此理论的装置也可以在实验室中用低成本快速实现。
114.因此,本发明的基本原理是通过提供弱电流密度的外加恒定电场来辅助驱动标记探针(包括抗体分子等)在组织中的快速运动,从而大幅减少探针穿透完整厚组织的时间,最终实现对透明化组织的快速免疫荧光标记。
115.采用如图1和图3所示的实验装置,本发明系统性的研究了外加电场的电流密度与组织内部抗体分子数量的定量关系。电流密度的定义为外加电流与样品面积 (与电场方向垂直的截面)的比值。本实验中的电流密度的变化范围为0.05
‑
0.5 ma/mm2(等效的电场强度为107to 710v/m)。实验结果如图1所示,随着电流密度从0.05增加到0.3ma/mm2,在相同的时间内(~30mins)组织内部(far)的抗体的数量同步增加。但是,随着电流密度的增加,进入组织内部(far)的抗体分子的数量却在减少。从30
‑
90分钟,对于电流密度0.1和0.2ma/mm2,进入组织内部的抗体数量稳步增加。而对于电流密度高于0.2ma/mm2,进入组织内部(far)的抗体数量却是在逐渐减少。但是,对于电流密度0.05ma/mm2,在90分钟的时间内,进入组织内部的抗体分子的数量几乎没有变化,说明该电流密度太小,不能加速抗体分子进入组织内部。
116.除了考虑抗体分子快速进入组织内部,本发明也要避免组织在外加电场作用下而被破坏(例如撕裂等)。本发明也系统性的研究了组织在不同电流密度条件下的变形情况。
首先,本发明比较了在不同电流密度条件下,组织外周长的变化情况。实验结果如图2b所示,结果表明,在0.2ma/mm2及以下的电流密度,组织的外周长几乎不变化,显示组织无明显变形。而对于电流密度大于0.2ma/mm2的情况,组织的外周长则有明显的变化,显示组织有明显变形。
117.因此,本发明的实验结果证明在一定的条件下(组织密度、缓冲液和抗体类型、密度等条件固定的情况下),存在一个最优的低电流密度(在本实验中为0.2 ma/mm2),既能保证抗体分子能快速进入组织内部,实现厚组织的快速免疫荧光标记,又能保证组织结构不收到破坏。该电流密度所对应的电场强度,远低于之前报道的技术所采用的电场强度,因此是一种电场辅助抗体分子扩散的新原理。
118.对组织样本进行免疫标记的试剂盒
119.如本文所用,所述“对组织样本进行免疫标记的试剂盒”包括:
120.第一容器,所述容器中含有一个待进行免疫标记的组织样本;
121.第二容器,所述容器中含有探针;
122.第三容器,所述容器中含有缓冲液;
123.第四容器,所述容器中含有电极板、电源插头,形成一个电场,所述的电场具有以下特征:电流密度的变化范围为0.1
‑
0.3ma/mm2;
124.标签或说明书,所述标签或说明书注明所述试剂盒用于对组织样本进行免疫标记。
125.本发明所述的“对组织样本进行免疫标记的试剂盒”不仅能够快速的对组织样本内部进行免疫标记,还携带方便。
126.本发明的主要优点包括:
127.(1)本发明首次发现,通过将电流密度调节为0.1
‑
0.3ma/mm2,探针能够快速进入到组织样本内部,对组织样本进行免疫标记,显著减少完整透明化组织免疫标记的时间(标记时间可以减至10小时或小于10小时),并且组织的宏观和微观结构都不会被破坏,保持组织的完整性,并且,探针(比如抗体)的使用量相比传统的免疫应该标记也会减少至3倍以上。
128.(2)本发明首次发现,在低电流密度下,进入组织内部的抗体分子的数量随着电流密度的增加而增加,在高电流密度下,进入组织内部的抗体分子的数量随着电流密度的增加而减少。
129.(3)本发明首次发现,采用弱电流密度的外加电场,可以辅助抗体更好更均匀的进入组织内部,好于使用强电流密度的外力作用。在达到快速染色目的的同时可以更好的保护组织,产热也更少。基于此理论的装置也可以在实验室中用低成本快速实现。
130.(4)本发明的方法可显著减少完整透明化组织免疫标记的时间,完成一个2 mm厚透明化小鼠脑片的单次免疫荧光(一抗+二抗)标记的时间仅需10小时,而基于抗体分子被动扩散的免疫标记,相同的样品需要至少2周时间。
131.(5)本发明的免疫标记均匀,2mm脑片的边缘和内部的信号可比,非常均匀。
132.(6)本发明的方法不会对生物组织的结构造成破坏:由于采用低电流密度方式,组织的宏观和微观结构都不会被破坏,保持组织的完整性。
133.(7)本发明的方法的温度变化小:在3个小时的免疫染色(一抗)时间内,免疫标记
缓冲液的温度仅上升了2℃,因此,不需要温控装置。
134.(8)本发明的系统实现简单:低电场设计,无需温控装置等,都降低了系统的实现的难度和成本。
135.下面结合具体实施,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(new york:cold springharbor laboratory press,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。
136.除非特别说明,否则本发明实施例中所用材料和试剂均为市售产品。
137.实施例1对脑组织进行电场参数优化的实验
138.如图1,a所示,500μm已进行clarity透明化后的脑片夹在两块盖玻片之间,两边用蓝丁胶封住后再用环氧树脂固定住后,在脑片的一边加入1: 200(电泳液稀释)浓度的anti
‑
gfp 555抗体溶液,安装在玻璃皿中。封片两边用环氧树脂筑坝并固定,在两侧电极处各加入适量的电泳液,直到液体刚刚能没过电极丝,但不没过封片。采用0.05ma/mm2、0.1ma/mm2、0.2ma/mm2、 0.3ma/mm2、0.4ma/mm2和0.5ma/mm2的电流密度进行了实验。电泳液配制为0.1m硼酸溶液(含0.1%triton x
‑
100,ph=8.6)。结果如图1,b所示,来进行结果的量化。
139.实验结果如下图(图1,c所示),从图中看出,0.05ma/mm2电流密度太小,电流作用90min也难以进入组织;0.1ma/mm2电流密度略微好一些,但还是需要比较久的时间(90min,相同位置的抗体进入量只能是0.2ma/mm2条件下的一半)才能进入组织;0.2ma/mm2的电流密度更好,随着时间的作用,能够稳定进入组织,从0.3ma/mm2电流密度开始,边缘效应的影响就逐渐增大了,0.3ma/mm2电流密度边缘效应还没有那么大,在进行电泳30min到60min 时,减少的不是很多,但90min比60min减少的多很多。0.4ma/mm2随着时间的增加,减少的就更多了。直到0.5ma/mm2抗体直接阻挡在组织外面,难以进入组织。因此,这是本发明为何用弱电场辅助的第一个重要原因,强电场会引起抗体在样品边缘的堆积,从而难以进入样品内部进行染色,本发明称为边缘效应。因此,电流密度在0.2
±
0.02ma/mm2时效果很好,在0.2ma/mm2时效果最好。
140.如图2,a,对每个电流密度下的样品实验前后轮廓进行勾选,统计前后的周长差,结果如图2,b所示,可以看出0.05
‑
0.2ma/mm2时,电场对样品是几乎没有破坏的,0.3就有点引起样品的形变,0.4和0.5以上就会造成样品的破碎。由此,这是本发明为何用弱电场辅助的第二个重要原因,强电场会造成样品的破坏。本发明还使用4
‘
,6
‑
二氨基
‑2‑
苯基吲哚(dapi)染色后的500μm 的透明化脑片进行不同电流密度下的实验,来观察局部细胞结构在不同电流密度下是否存在任何可观察到的形变。电流密度设置为0.2和0.5ma/mm2,时间为90min,结果如图2c和2d所示,图2d是图2c的局部放大图。0.2ma/mm2处理后的组织细胞结构与未处理的细胞组织结构无明显差别,而0.5ma/mm2处理后的组织细胞出现明显的细胞(不可逆)畸变。因此,这些结果表明,在抗体穿透最有效的低场强(0.2ma/mm2)下,无论是在组织还是细胞水平上,都没有检测到组织的损伤或变形。
141.实施例2对2mm厚度脑组织切片染histone 3(h3)
142.样品的安装方式如图3b,将组织包埋在两个8%的琼脂糖凝胶环中,放在样品室
里。再将样品室插入图3c中的抗体室,检漏后,在抗体室的两个槽中加入抗体稀释液。最后如图3a,将抗体室插入电泳室中,在电泳室的两个槽中加入电泳液。最后的整个装置安装完后的侧面剖面图如图3d所示。
143.如图4a进行共聚焦成像。电泳缓冲液为0.1m硼酸,ph值8.6(用naoh调节),含0.1%triton x
‑
100。抗体稀释液是由抗体(histone h3 xp rabbit mab, alexa
‑
647偶联物,12230s,cell signaling technology)用电泳缓冲液配制的5% bsa稀释到1:200的浓度,用4ml的总容量进行染色。染色在0.18ma/mm2电流密度下进行。染色的总时间为3h,运行1.5h后切换电场方向。染色完成后,关闭电源,将样品留在样品箱内孵育30min。为了去除抗体,将样品室中的抗体溶液完全替换为新鲜的染色缓冲液。在0.22ma/mm2的电流密度下进行清洗,总时间为2h,电场方向每30min反转一次,每小时更换一次电泳缓冲液。结果如图4b和d所示,从图中可以看出,抗体全部进入样品之中,并且分布的十分均匀。
144.实施例3对2mm厚度脑组织切片染lamin b1
145.样品的安装方式如图3b,将组织包埋在两个8%的琼脂糖凝胶环中,放在样品室里。再将样品室插入图3c中的抗体室,检漏后,在抗体室的两个槽中加入抗体稀释液。最后如图3a,将抗体室插入电泳室中,在电泳室的两个槽中加入电泳液。最后的整个装置安装完后的侧面剖面图如图3d所示。
146.如图4a进行共聚焦成像。电泳缓冲液为0.1m硼酸,ph值8.6(用naoh调节),含0.1%triton x
‑
100。抗体稀释液是由一抗(anti
‑
lamin b1 antibody,ab16048, abcam)用电泳缓冲液配制的5%bsa稀释到1:200的浓度,用4ml的总容量进行染色。染色在0.18ma/mm2电流密度下进行。染色的总时间为3h,运行1.5h后切换电场方向。染色完成后,关闭电源,将样品留在样品箱内孵育30min。为了去除抗体,将样品室中的抗体溶液完全替换为新鲜的染色缓冲液。在0.2 ma/mm2的电流密度下进行清洗,总时间为2h,电场方向每30min反转一次,每小时更换一次电泳缓冲液。二抗(山羊抗兔igg(h+l)高交联二抗,alexa fluorplus 647,a32733,thermo fisher)染色与一抗染色的条件完全相同。结果如图4c 和e所示,从图中可以看出,抗体全部进入样品之中,并且分布的十分均匀。
147.在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1