一种利用程序性细胞死亡直观检测小麦籽粒发育早期内部细胞形态动态变化的方法
1.本发明属于植物学领域,涉及一种利用程序性细胞死亡直观检测小麦籽粒发育早期内部细胞形态动态变化的方法。
背景技术:
2.小麦籽粒结构由外到内分为果皮、皮层、糊粉层和胚乳,其中果皮细胞在发育早期通过程序性细胞死亡为后期胚乳的扩容提供充足的空间,因此程序性细胞死亡是决定小麦产量的重要因素。程序性细胞死亡(programmed celldeath,pcd)是一种主动的、有序的细胞降解过程,对生物适应外界环境以及自身的生长发育具有重要意义。目前,对小麦籽粒果皮程序性细胞死亡的检测主要通过tunel染色法,但该法只对死亡的细胞核进行染色,不能直观反映细胞的形态变化,且容易出现假阳性。
3.因此,如何克服现有tunel染色法存在的缺陷,提供一种更好的直观反映细胞的形态变化的检测方法成为本领域亟待解决的问题。
技术实现要素:
4.针对现有技术中的上述情况,本发明的发明人提供了一种利用程序性细胞死亡直观检测小麦籽粒发育早期内部细胞形态动态变化的方法,该方法采用pas染色法指示小麦籽粒果皮程序性细胞死亡,较之现有技术其突出的优点是形象、直观、清楚、准确的反映果皮细胞层数、果皮细胞膜有无破裂以及果皮细胞与皮层细胞间的间隙,为深入研究小麦籽粒果皮程序性细胞死亡的分子机理及培育高产小麦新品种(系)提供方法学基础。
5.本领域中,pas染色主要用于观察细胞大小、分裂、分化等现象;但是用于检测小麦籽粒程序性细胞死亡现象在本领域还未见报道,本发明的发明人首次将其应用于检测小麦籽粒程序性细胞死亡现象。
6.本发明的具体技术方案如下:
7.一种利用程序性细胞死亡直观检测小麦籽粒发育早期内部细胞形态动态变化的方法,具体操作步骤如下:
8.(1)取开花后3天、5天、7天和9天的小麦种子的籽粒进行石蜡包埋;
9.(2)对石蜡包埋的籽粒在中部进行横切;
10.(3)将石蜡切片依次放入二甲苯中20min,无水乙醇中5min,75%酒精中5min,最后用自来水洗3次,每次30s;
11.(4)将自来水洗过的石蜡切片放入高碘酸染液中染色10min,用自来水冲洗1次,再用蒸馏水洗1次;
12.(5)放于雪弗染液中避光染色20min,用流水冲洗5min;
13.(6)放于苏木素染液中染色3
‑
5min,用自来水冲洗;
14.(7)放于1%盐酸酒精分化液中分化30s,然后用自来水冲洗;
15.(8)放于返蓝液中返蓝,用流水冲洗5min;
16.(9)放入无水乙醇中5min,二甲苯中5min,最后用中性树胶封片;
17.(10)利用显微镜对切片进行镜检,采集相关图像,并对细胞结构进行分析。
18.其中步骤(1)中的小麦选自济麦22;
19.上述步骤中高碘酸染液染色,雪弗染液染色,苏木素染液染色均采用市场上直接购买的常规染液,染色过程均按照其产品说明书直接操作;
20.分化和返蓝过程只需按照上述步骤和时间完成即可;
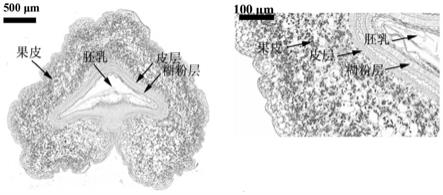
21.其中步骤(7)中所述的酒精分化液由1毫升浓盐酸加入99毫升70%酒精中制备而成;
22.步骤(8)中所述的返蓝液由0.5毫升氢氧化氨加入蒸馏水99.5毫升配制而成;
23.与tunel染色法相比,本发明所采用的pas染色法可以形象、直观、清楚、准确的反映果皮细胞层数、果皮细胞膜有无破裂以及果皮细胞与皮层细胞间的间隙;将其应用到检测小麦籽粒程序性细胞死亡现象属于本领域的首次应用;
24.采用上述的pas染色法指示小麦籽粒果皮程序性细胞死亡会出现3个明显的特征:
①
果皮细胞层数减少;
②
最内层果皮细胞膜破裂;
③
最内层果皮细胞与皮层细胞间出现间隙。通过显微照片可以看出,采用本发明的pas染色法,在小麦开花后3天时,籽粒果皮细胞的层数最多,果皮细胞与皮层细胞间没有间隙出现;5天时,果皮细胞层数减少,最内层细胞出现细胞膜破裂现象,果皮细胞与皮层细胞间开始出现间隙;7天和9天时,果皮细胞层数最少,果皮细胞与皮层细胞间的间隙最大,通过上述显微镜观察可以表明本发明的技术方案可以清楚的观察到小麦籽粒发育早期内部细胞形态的动态变化,填补了本领域的空白。
附图说明
25.图1为实施例1中小麦籽粒发育3天后的pas染色结果,左图为横切面图,右图为局部放大图;
26.图2为实施例1中小麦籽粒发育5天后的pas染色结果,左图为横切面图,右图为局部放大图;
27.图3为实施例1中小麦籽粒发育7天后的pas染色结果,左图为横切面图,右图为局部放大图;
28.图4为实施例1中小麦籽粒发育9天后的pas染色结果,左图为横切面图,右图为局部放大图;
29.图5为实施例2中小麦籽粒发育3天后的tunel染色效果,亮点和暗点表示染色的细胞核;左图为tunel的染色效果图,右图为tunel和dapi(可染死、活细胞核)的混合染色效果图;
30.图6为实施例2中小麦籽粒发育5天后的tunel染色效果,亮点和暗点表示染色的细胞核;左图为tunel的染色效果图,右图为tunel和dapi(可染死、活细胞核)的混合染色效果图;
31.图7为实施例2中小麦籽粒发育7天后的tunel染色效果,亮点和暗点表示染色的细胞核;左图为tunel的染色效果图,右图为tunel和dapi(可染死、活细胞核)的混合染色效果图;
32.图8为实施例2中小麦籽粒发育9天后的tunel染色效果,亮点和暗点表示染色的细胞核;左图为tunel的染色效果图,右图为tunel和dapi(可染死、活细胞核)的混合染色效果图;
33.由图可知,本发明所提供的方法可以清楚的观察到小麦籽粒发育早期内部细胞形态的动态变化。
具体实施方式
34.下面将结合本发明的附图,对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明的一部分实施例,而不是全部的实施例。基于本发明下述的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
35.实施例1
36.一种利用程序性细胞死亡直观检测小麦籽粒发育早期内部细胞形态动态变化的方法,具体操作步骤如下:
37.(1)取开花后3天、5天、7天和9天的小麦品种济麦22的籽粒进行石蜡包埋;
38.石蜡包埋方法采用常规技术,具体步骤为:取新鲜组织固定于4%多聚甲醛24h以上,将组织从固定液取出,在通风橱内用手术刀将目的部位组织修平整,将修切好的组织和对应的标签放于脱水盒内;将脱水盒置于脱水机内依次进行梯度酒精脱水:75%酒精4h,85%酒精2h,90%酒精2h,95%酒精1h,无水乙醇i 30min,无水乙醇ii 30min,甲苯5
‑
10min,二甲苯i 5
‑
10min,二甲苯ii 5
‑
10min,蜡i1h,蜡ii 1h,蜡iii 1h;
39.将浸好蜡的组织于包埋机内进行包埋,先将融化的蜡放入包埋框,待蜡凝固之前,将组织从脱水盒内取出,按照包埋面的要求放入包埋框,并贴上对应的标签;于
‑
20℃冻台冷却,蜡凝固后将蜡块从包埋框中取出,并修整蜡块;将修整好的蜡块置于石蜡切片机上切片,切片厚度4μm,切片漂浮于摊片机40℃温水上将组织展平,用载玻片将组织捞起,并放进60℃烘箱内烤片;待水烤干、蜡烤化后取出,常温保存备用;
40.上述方法为本领域的常规方法;
41.(2)对石蜡包埋的籽粒在中部进行横切;
42.(3)将石蜡切片依次放入二甲苯中20min,无水乙醇中5min,75%酒精中5min,最后用自来水洗3次,每次30s;
43.(4)将自来水洗过的石蜡切片放入高碘酸染液中染色10min,用自来水冲洗1次,再用蒸馏水洗1次;
44.(5)放于雪弗染液中避光染色20min,用流水冲洗5min;
45.(6)放于苏木素染液中染色3
‑
5min,用自来水冲洗;
46.(7)放于1%盐酸酒精分化液中分化30s,然后用自来水冲洗;
47.(8)放于返蓝液中返蓝,用流水冲洗5min;
48.(9)放入无水乙醇中5min,二甲苯中5min,最后用中性树胶封片;
49.(10)利用显微镜对切片进行镜检,采集相关图像,并对细胞结构进行分析;
50.结果如下:
51.在小麦开花后3天时,籽粒果皮细胞的层数最多,果皮细胞与皮层细胞间没有间隙
出现(图1);5天时,果皮细胞层数减少,最内层细胞出现细胞膜破裂现象,果皮细胞与皮层细胞间开始出现间隙(图2);7天和9天时,果皮细胞层数最少,果皮细胞与皮层细胞间的间隙最大(图3、图4),证明本上述方法可以清楚的观察到小麦籽粒发育早期内部细胞形态的动态变化。
52.实施例2
53.一种利用tunel染色检测小麦籽粒发育早期内部细胞形态动态变化的方法,具体操作步骤如下:该方法为本领域常规的tunel染色法;
54.(1)取开花后3天、5天、7天和9天的小麦种子进行石蜡切片,依次将切片放入二甲苯ⅰ10min,二甲苯ⅱ10min,无水乙醇ⅰ5min,无水乙醇ⅱ5min,无水乙醇iii 5min,蒸馏水冲洗;冬天应该适当延长脱蜡时间;
55.(2)切片稍甩干后,用组化笔在组织周围画圈(防止液体流走),在圈内滴加蛋白酶k工作液覆盖组织,37℃温箱孵育22min;将载玻片置于pbs(ph7.4)中,在脱色摇床上摇动洗涤3次,每次5min;(蛋白酶k工作液配置方法为原液:pbs体积比=1:9)
56.(3)切片稍甩干后,在圈内滴加破膜工作液覆盖组织,常温下孵育20min,将载玻片置于pbs(ph7.4)中,在脱色摇床上摇动洗涤3次,每次5min;(破膜液为0.1%triton。配置方法为triron原液:pbs体积比=1:1000)
57.(4)切片稍甩干后,在圈内滴加pbs(ph7.4)覆盖组织,常温孵育10min;
58.(5)按片子数量和组织大小,取tunel试剂盒内适量tdt酶,dutp,pbs(ph7.4)按1:5:50比例混合,加到圈内覆盖组织,切片平放于湿盒内,37℃恒温箱孵育2h,湿盒内加少量水保持湿度;
59.(6)dapi复染细胞核:切片用pbs(ph7.4)洗涤3次,每次5min,去除pbs后在圈内滴加dapi染液,室温避光孵育10min;
60.(7)载玻片置于pbs(ph7.4)中,在脱色摇床上摇动洗涤3次,每次5min。切片稍甩干,用抗荧光淬灭封片剂封片;
61.(8)切片于荧光显微镜下观察,并采集图像,(dapi紫外激发波长330
‑
380nm,发射波长420nm,发蓝光(在图中为暗点);fitc激发波长465
‑
495nm,发射波长515
‑
555nm,发绿光(在图中为亮点)。
62.结果如下:
63.从tunel染色的小麦发育籽粒细胞显微照片看,由于染色的是死亡细胞的细胞核,在小麦开花后3天(图5)和5天(图6)时只能看到大量亮点和暗点,而在7天(图7)和9天(图8)时因降解的细胞碎片被吸收,则几乎看不到亮点和暗点的存在,因而无法直观的显示小麦籽粒发育早期内部细胞形态的动态变化。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1