一种鲎试剂冻干微球及其制备方法和应用与流程
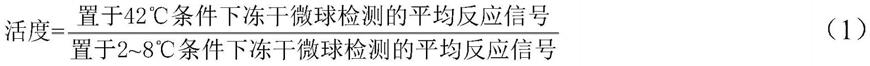
1.本发明属于生物制品冷冻技术领域,涉及一种鲎试剂冻干微球及其制备方法和应用。
背景技术:
2.鲎试剂是由海洋生物鲎的血液阿米巴细胞的提取物制成的生物监测试剂,鲎试剂含有能被细菌内毒素(脂多糖)和真菌葡聚糖激活的c因子、b因子、g因子、凝固酶原和凝固蛋白原等,能够准确、快速地定性或定量检测样品中是否含有细菌内毒素和(1,3)
‑
β
‑
d
‑
葡聚糖。
3.目前,鲎试剂广泛用于制药、临床以及科研等领域,用于细菌内毒素和真菌葡聚糖检测,但鲎试剂在液体状态下不稳定、易污染,目前市面上的鲎试剂均采用常规的真空冷冻干燥处理后进行保存和运输,如cn102901726a公开了血液细菌内毒素检测试剂盒的制备和应用,其中涉及一种特异性鲎试剂及其制备方法,所述制备方法包括采血、分离细胞、裂解细胞、分离细胞壁、加促活剂和g因子抑制剂配制半成品,再经灌装、冷冻干燥和封口,制得特异性鲎试剂成品;cn1621841公开了一种抗干扰鲎试剂的制备工艺,所述工艺包括(1)制取p型抗干扰鲎试剂半成品,(2)采用除热原凝胶,过柱洗脱除去脂肪族二元醇类的热原,(3)用无热原水将制备好的脂肪族二元醇类溶解配成100mg/ml的溶液,取若干p型抗干扰鲎试剂半成品,加入若干配好的脂肪族二元醇类,加入1%~10%增活剂,将其分装到安瓿或西林瓶中后,放入冷冻干燥机冻干,封口或压盖制成品。
4.由上可知,常规的真空冷冻干燥方法将鲎试剂在西林瓶或者安瓿瓶中进行冻干,获得粉末状的鲎试剂,但粉末状的鲎试剂难以实现精准分装或者简化操作,从而难以集成于检测卡或者芯片等即时检验(point
‑
of
‑
care testing,poct)产品,此外,操作时需破碎容器封口,存在割伤等风险。
5.综上所述,提供便于分装和精确称量的鲎试剂,对于简化检验科人员的操作时间和提高poct产品的便携性和准确性具有重要意义。
技术实现要素:
6.针对现有技术的不足和实际需求,本发明提供一种鲎试剂冻干微球及其制备方法和应用,所述冻干微球的硬度高、不易破碎掉屑,且稳定性高,便于后续进行自动化或者手动分装、保存,所述制备方法简单,能够制备低含水量且活性高度均一的冻干微球。
7.为达上述目的,本发明采用以下技术方案:
8.第一方面,本发明提供一种鲎试剂冻干微球,所述鲎试剂冻干微球包括鲎的阿米巴细胞提取物和活性剂;
9.所述活性剂包括聚乙烯吡咯烷酮、乳糖、甘露醇、棉子糖、聚乙二醇和甘氨酸。
10.本发明的鲎试剂冻干微球中,聚乙烯吡咯烷酮具有较高的玻璃化温度,能优先从蛋白质表面析出,使蛋白质溶液黏度升高从而阻止其他小分子(如糖及多羟基化合物)的结
晶,具备促进鲎试剂成型以及保护活性的作用;乳糖能够阻止蛋白质二级结构改变,对冻干处理过程中及储存期内蛋白质的伸展和聚集具有显著作用;甘露醇作为骨架剂,促进鲎试剂成型,还具备保护蛋白质活性的作用;棉子糖具备较高的玻璃化温度、更低的引湿性且不具有还原性,能够有效保护蛋白质活性;聚乙二醇能够降低离子强度并抑制冷冻过程中ph值的剧烈变化,有效保护蛋白质活性;甘氨酸能够抑制冷冻过程中ph值的剧烈变化并升高蛋白质塌陷温度,同时提高冷冻期和储存期蛋白质活性。
11.综上所述,本发明中同时采用聚乙烯吡咯烷酮、乳糖、甘露醇、棉子糖、聚乙二醇和甘氨酸,不干扰鲎试剂的检测功能,且各组分间相互配合,促进鲎试剂成型,并提高成型后硬度,同时保护预冷期、冻干期以及储存期鲎试剂的活性,从而使得鲎试剂冻干微球硬度高、表面光滑不易破碎掉屑,且稳定性高,便于后续进行自动化或者手动分装、保存。
12.优选地,所述聚乙烯吡咯烷酮的平均分子量可以为3000、15000或360000。
13.优选地,所述活性剂还包括鲎三肽。
14.优选地,所述鲎三肽为boc
‑
leu
‑
gly
‑
arg
‑
pna。
15.优选地,所述鲎三肽可以为鲎三肽的醋酸盐或盐酸盐。
16.第二方面,本发明提供一种如第一方面所述的鲎试剂冻干微球的制备方法,所述方法包括以下步骤:
17.(1)将鲎的阿米巴细胞进行破碎处理,随后离心并萃取,得到阿米巴细胞提取物;
18.在水中将聚乙烯吡咯烷酮、乳糖、甘露醇、棉子糖、聚乙二醇、甘氨酸、任选地鲎三肽混合,得到活性剂溶液;
19.(2)将所述阿米巴细胞提取物和所述活性剂溶液混合,得到混合液;
20.(3)利用滴珠机将所述混合液滴入液氮中,冷冻成微球,随后进行预冻和冷冻干燥,得到所述鲎试剂冻干微球。
21.优选地,步骤(1)所述活性剂溶液包括5%~10%聚乙烯吡咯烷酮(例如可以是6%、7%、8%或9%)、2%~5%乳糖(例如可以是2.3%、2.5%、2.7%、3%、3.5%、4%或4.5%)、5%~10%甘露醇(例如可以是6%、7%、8%或9%,优选为5%~7%)、1%~5%棉子糖(例如可以是1.1%、1.2%、1.5%、1.8%、2%、3%、3.2%、3.8%、4%、4.2%、4.4%、4.6%或4.8%)、0.2%~1%聚乙二醇(例如可以是0.3%、0.4%、0.5%、0.6%、0.7%、0.8%或0.9%)、0.5~1mg/ml甘氨酸(例如可以是0.55mg/ml、0.6mg/ml、0.65mg/ml、0.7mg/ml、0.8mg/ml或0.9mg/ml)和0~0.8mg/ml鲎三肽(例如可以是0.1mg/ml、0.2mg/ml、0.3mg/ml、0.4mg/ml、0.5mg/ml、0.6mg/ml或0.7mg/ml,优选为0.1~0.8mg/ml),上述百分比均为质量百分比。
22.本发明中,当使用鲎试剂冻干微球通过显色法进行检测细菌内毒素或真菌葡聚糖时,需在微球中添加显色剂鲎三肽,控制鲎三肽浓度为0.1~0.8mg/ml,既能够有效显色,又能有效控制添加成本。
23.优选地,所述活性剂溶液经过超滤进行灭菌和去除热原。
24.优选地,步骤(2)所述混合液中阿米巴细胞提取物和活性剂溶液的体积比为(1~5):1,包括但不限于1.2:1、1.4:1、1.6:1、1.8:1、2:1、3:1、4:1、4.2:1、4.4:1、4.6:1或4.8:1。
25.优选地,步骤(3)所述预冻的温度为
‑
60~
‑
45℃,包括但不限于
‑
59℃、
‑
58℃、
‑
57
℃、
‑
56℃、
‑
52℃、
‑
50℃、
‑
48℃、
‑
47℃或
‑
46℃,优选为
‑
50~
‑
45℃,步骤(3)所述预冻的时间大于4h,包括但不限于5h、6h、7h、9h、12h、16h、18h或20h。
26.优选地,步骤(3)所述冷冻干燥包括以下步骤:
27.(1’)于
‑
45~
‑
25℃(例如可以是
‑
44℃、
‑
43℃、
‑
42℃、
‑
41℃、
‑
40℃、
‑
35℃、
‑
30℃、
‑
28℃、
‑
27℃或
‑
26℃)、真空度为160~200ubar(例如可以是162ubar、164ubar、166ubar、168ubar、175ubar、180ubar、190ubar、191ubar、193ubar、195ubar、196ubar或198ubar),将预冻后的微球保存8~12h(例如可以是8.2h、8.5h、9h、10h、11h、11.5h或11.8h);
28.(2’)于
‑
25~
‑
10℃(例如可以是
‑
24℃、
‑
23℃、
‑
22℃、
‑
21℃、
‑
20℃、
‑
15℃、
‑
14℃、
‑
13℃、
‑
12℃或
‑
11℃)、真空度为160~200ubar(例如可以是162ubar、164ubar、166ubar、168ubar、175ubar、180ubar、190ubar、191ubar、193ubar、195ubar、196ubar或198ubar),将所述微球进行主干燥6~10h(例如可以是6.2h、6.5h、7h、8h、9h、9.5h或9.8h);
29.(3’)于20~30℃(例如可以是21℃、22℃、23℃、24℃、25℃、26℃或28℃)、真空度为10~150ubar(例如可以是11ubar、12ubar、13ubar、15ubar、20ubar、30ubar、40ubar、50ubar、80ubar、100ubar、120ubar、130ubar、140ubar、142ubar、144ubar、146ubar或148ubar),将所述微球进行解析干燥8~12h(例如可以是8.2h、8.5h、9h、10h、11h、11.5h或11.8h)。
30.本发明的制备方法中,对预冻、冷冻干燥过程的温度、真空度和时间进行控制,能够高效除去鲎试剂冻干微球中的水分,包括通过范德华力、氢键等弱分子力吸附的结合水,显著降低冻干微球的含水量。
31.此外,本发明的制备方法操作简单,可控性高,所制备的鲎试剂冻干微球的活性高度均一。
32.作为优选的技术方案,所述鲎试剂冻干微球的制备方法包括以下步骤:
33.(1)将鲎的阿米巴细胞进行破碎处理,随后离心并萃取,制备阿米巴细胞提取物;
34.在水中将聚乙烯吡咯烷酮、乳糖、甘露醇、棉子糖、聚乙二醇、甘氨酸、任选地鲎三肽混合,制备含有5%~10%聚乙烯吡咯烷酮、2~5%乳糖、5~10%甘露醇、1~5%棉子糖、0.2~1%聚乙二醇、0.5~1mg/ml甘氨酸和0~0.8mg/ml鲎三肽的活性剂溶液;
35.(2)按体积比为(1~5):1将所述阿米巴细胞提取物和所述活性剂溶液混合,得到混合液;
36.(3)利用滴珠机将所述混合液滴入液氮中,冷冻成微球,随后于
‑
60~
‑
45℃进行预冻4h以上;
37.(4)于
‑
45~
‑
25℃、真空度为160~200ubar下将预冻后的微球保存8~12h,使所述微球内的水分部分升华;
38.(5)于
‑
25~
‑
10℃、真空度为160~200ubar将所述微球进行主干燥6~10h;
39.(6)于20~30℃、真空度为10~150ubar将所述微球进行解析干燥8~12h,得到所述鲎试剂冻干微球。
40.第三方面,本发明提供如第一方面所述的鲎试剂冻干微球在制备细菌内毒素检测试剂和/或真菌葡聚糖检测试剂中的应用。
41.与现有技术相比,本发明至少具有以下有益效果:
42.(1)本发明中同时采用聚乙烯吡咯烷酮、乳糖、甘露醇、棉子糖、聚乙二醇和甘氨酸,不干扰鲎试剂的检测功能,且各组分间相互配合,促进鲎试剂成型,并提高成型后硬度,同时保护预冷期、冻干期以及储存期鲎试剂的活性,从而使得鲎试剂冻干微球硬度高、表面光滑不易破碎掉屑,且稳定性高,便于后续进行自动化或者手动分装、保存;
43.(2)本发明的制备方法中,对预冻、冷冻干燥过程的温度、真空度和时间进行控制,能够高效除去鲎试剂冻干微球中的水分,包括通过范德华力、氢键等弱分子力吸附的结合水,显著降低冻干微球的含水量;
44.(3)本发明的鲎试剂冻干微球硬度高、表面光滑不易破碎掉屑,含水量低于1.35%,活性高度均一,批内偏差低于3.25%。
具体实施方式
45.为便于理解本发明,本发明列举实施例如下。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。
46.实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可通过正规渠道商购获得的常规产品。
47.本发明实施例中,聚乙烯吡咯烷酮(pvp 15000)和聚乙二醇购买于西格玛奥德里奇(上海)贸易有限公司,鲎三肽(boc
‑
leu
‑
gly
‑
arg
‑
pna)购买于上海科肽生物科技有限公司;滴珠机(lc200,厦门武门自动化科技有限公司),真空冷冻干燥机(lyo
‑
0.5,上海东富龙科技股份有限公司)。
48.实施例1
49.本实施例提供一种鲎试剂冻干微球,所述鲎试剂冻干微球的制备方法包括以下步骤:
50.(1)将鲎阿米巴细胞原料从低温冻存(
‑
20℃)的冰柜中取出,放置于室温缓慢融化,防止融化速度过快导致装原料的输液瓶破裂;
51.(2)将融化完全的鲎阿米巴细胞原料进行高速匀浆破碎,于4℃、8000rpm的低温高速离心机中离心收集上清,舍弃细胞碎片等物质,按照重量比为1~2加入三氯甲烷(色谱纯)进行萃取,磁力搅拌20min,并于4℃、12000rpm的低温高速离心机中离心收集上清,得到鲎阿米巴细胞提取物;
52.(3)在细菌内毒素检查用水中将聚乙烯吡咯烷酮、乳糖、甘露醇、棉子糖、聚乙二醇、甘氨酸、任选地鲎三肽混合,制备含有7%聚乙烯吡咯烷酮、3%乳糖、7%甘露醇、3%棉子糖、0.6%聚乙二醇、0.75mg/ml甘氨酸和0.4mg/ml鲎三肽的活性剂溶液,并超滤进行灭菌和去除热原;
53.(4)按体积比为2:1将所述阿米巴细胞提取物和所述活性剂溶液混合,得到混合液;
54.(5)取所述混合溶液,利用滴珠机将混合溶液滴入液氮中,冷冻成微球,然后于
‑
60℃进行预冻5h;
55.(6)将预冻后的微球置于真空冷冻干燥机中,在
‑
30℃、真空度为200ubar保存10h进行定型,使小球内的水分部分升华,以保证在主干燥期间的持续升温阶段小球不变形;
56.(7)再将微球于
‑
20℃、真空度为160uba进行主干燥10h;
57.(8)将主干燥后的小球于30℃、真空度为80uba进行解析干燥10h,得到所述鲎试剂冻干微球。
58.实施例2
59.本实施例提供一种鲎试剂冻干微球,所述鲎试剂冻干微球的制备方法包括以下步骤:
60.(1)将鲎阿米巴细胞原料从低温冻存的冰柜中取出,放置于室温缓慢融化,防止融化速度过快导致装原料的输液瓶破裂;
61.(2)将融化完全的鲎阿米巴细胞原料进行高速匀浆破碎,于4℃、8000rpm的低温高速离心机中离心收集上清,舍弃细胞碎片等物质,按照重量比为1~2加入三氯甲烷(色谱纯)进行萃取,磁力搅拌20min,并于4℃、12000rpm的低温高速离心机中离心收集上清,得到鲎阿米巴细胞提取物;
62.(3)在细菌内毒素检查用水中将聚乙烯吡咯烷酮、乳糖、甘露醇、棉子糖、聚乙二醇、甘氨酸、任选地鲎三肽混合,制备含有5%聚乙烯吡咯烷酮、2%乳糖、5%甘露醇、5%棉子糖、0.2%聚乙二醇、0.5mg/ml甘氨酸的活性剂溶液,并超滤进行灭菌和去除热原;
63.(4)按体积比为5:1将所述阿米巴细胞提取物和所述活性剂溶液混合,得到混合液;
64.(5)取所述混合溶液,利用滴珠机将混合溶液滴入液氮中,冷冻成微球,然后于
‑
45℃进行预冻8h;
65.(6)将预冻后的微球置于真空冷冻干燥机中,在
‑
45℃、真空度为160ubar保存8h进行定型,使小球内的水分部分升华,以保证在主干燥期间的持续升温阶段小球不变形;
66.(7)再将微球于
‑
25℃、真空度为160uba进行主干燥6h;
67.(8)将主干燥后的小球于20℃、真空度为150uba进行解析干燥8h,得到所述鲎试剂冻干微球。
68.实施例3
69.本实施例提供一种鲎试剂冻干微球,所述鲎试剂冻干微球的制备方法包括以下步骤:
70.(1)将鲎阿米巴细胞原料从低温冻存的冰柜中取出,放置于室温缓慢融化,防止融化速度过快导致装原料的输液瓶破裂;
71.(2)将融化完全的鲎阿米巴细胞原料进行高速匀浆破碎,于4℃、8000rpm的低温高速离心机中离心收集上清,舍弃细胞碎片等物质,按照重量比为1~2加入三氯甲烷(色谱纯)进行萃取,磁力搅拌20min,并于4℃、12000rpm的低温高速离心机中离心收集上清,得到鲎阿米巴细胞提取物;
72.(3)在细菌内毒素检查用水中将聚乙烯吡咯烷酮、乳糖、甘露醇、棉子糖、聚乙二醇、甘氨酸、任选地鲎三肽混合,制备含有10%聚乙烯吡咯烷酮、5%乳糖、10%甘露醇、1%棉子糖、1%聚乙二醇、1mg/ml甘氨酸和0.8mg/ml鲎三肽的活性剂溶液,并超滤进行灭菌和去除热原;
73.(4)按体积比为1:1将所述阿米巴细胞提取物和所述活性剂溶液混合,得到混合液;
74.(5)取所述混合溶液,利用滴珠机将混合溶液滴入液氮中,冷冻成微球,然后于
‑
60℃进行预冻10h;
75.(6)将预冻后的微球置于真空冷冻干燥机中,在
‑
25℃、真空度为200ubar保存12h进行定型,使小球内的水分部分升华,以保证在主干燥期间的持续升温阶段小球不变形;
76.(7)再将微球于
‑
10℃、真空度为200uba进行主干燥10h;
77.(8)将主干燥后的小球于30℃、真空度为10uba进行解析干燥12h,得到所述鲎试剂冻干微球。
78.实施例4
79.与实施例1相比本实施例提供一种鲎试剂冻干微球,所述鲎试剂冻干微球的制备方法包括以下步骤:
80.(1)将鲎阿米巴细胞原料从低温冻存的冰柜中取出,放置于室温缓慢融化,防止融化速度过快导致装原料的输液瓶破裂;
81.(2)将融化完全的鲎阿米巴细胞原料进行高速匀浆破碎,于4℃、8000rpm的低温高速离心机中离心收集上清,舍弃细胞碎片等物质,按照重量比为1~2加入三氯甲烷(色谱纯)进行萃取,磁力搅拌20min,并于4℃、12000rpm的低温高速离心机中离心收集上清,得到鲎阿米巴细胞提取物;
82.(3)在细菌内毒素检查用水中将聚乙烯吡咯烷酮、乳糖、甘露醇、棉子糖、聚乙二醇、甘氨酸、任选地鲎三肽混合,制备含有10%聚乙烯吡咯烷酮、5%乳糖、2%甘露醇、1%棉子糖、1%聚乙二醇、1mg/ml甘氨酸和0.3mg/ml鲎三肽的活性剂溶液,并超滤进行灭菌和去除热原;
83.(4)按体积比为3:1将所述阿米巴细胞提取物和所述活性剂溶液混合,得到混合液;
84.(5)取所述混合溶液,利用滴珠机将混合溶液滴入液氮中,冷冻成微球,然后于
‑
55℃进行预冻10h;
85.(6)将预冻后的微球置于真空冷冻干燥机中,在
‑
33℃、真空度为190ubar保存11h进行定型,使小球内的水分部分升华,以保证在主干燥期间的持续升温阶段小球不变形;
86.(7)再将微球于
‑
19℃、真空度为185uba进行主干燥9h;
87.(8)将主干燥后的小球于26℃、真空度为90uba进行解析干燥10h,得到所述鲎试剂冻干微球。
88.对比例1
89.与实施例1相比,区别仅在于步骤(3)所述活性剂溶液中含有3%乳糖、8%甘露醇、3%棉子糖、0.6%聚乙二醇、0.75mg/ml甘氨酸和0.4mg/ml鲎三肽的活性剂溶液,其它实施例1相同。
90.对比例2
91.与实施例1相比,区别仅在于步骤(3)所述活性剂溶液中含有7%聚乙烯吡咯烷酮、8%甘露醇、3%棉子糖、0.6%聚乙二醇、0.75mg/ml甘氨酸和0.4mg/ml鲎三肽的活性剂溶液,其它实施例1相同。
92.对比例3
93.与实施例1相比,区别仅在于步骤(3)所述活性剂溶液中含有7%聚乙烯吡咯烷酮、
3%乳糖、8%棉子糖、0.6%聚乙二醇、0.75mg/ml甘氨酸和0.4mg/ml鲎三肽的活性剂溶液,其它实施例1相同。
94.对比例4
95.与实施例1相比,区别仅在于步骤(3)所述活性剂溶液中含有7%聚乙烯吡咯烷酮、3%乳糖、8%甘露醇、0.6%聚乙二醇、0.75mg/ml甘氨酸和0.4mg/ml鲎三肽的活性剂溶液,其它实施例1相同。
96.对比例5
97.与实施例1相比,区别仅在于步骤(3)所述活性剂溶液中含有7%聚乙烯吡咯烷酮、3%乳糖、8%甘露醇、3%棉子糖、0.75mg/ml甘氨酸和0.4mg/ml鲎三肽的活性剂溶液,其它实施例1相同。
98.对比例6
99.与实施例1相比,区别仅在于步骤(3)所述活性剂溶液中含有7%聚乙烯吡咯烷酮、3%乳糖、8%甘露醇、3%棉子糖、0.6%聚乙二醇和0.4mg/ml鲎三肽的活性剂溶液,其它实施例1相同。
100.试验例1鲎试剂冻干微球的成型效果及稳定性分析
101.本试验例对实施例1
‑
3和对比例1
‑
6制备的鲎试剂冻干微球的成型效果包括硬度和光滑程度以及稳定性进行分析。
102.稳定性测试方案:
103.(1)分别将微球置于42℃和低温(2~8℃)保存,每天取置于不同条件下的鲎试剂微球,室温放置30min;按照2粒/孔的标准分装到96孔微孔板中;
104.(2)然后向每个微球孔中加入100μl 0.2m tris
‑
hcl(ph 7.2)进行微球复溶;
105.(3)微球复溶后向每孔中加入60μl同一浓度的葡聚糖标准品溶液,随后置于酶标仪中,在37℃恒温条件下,405nm、490nm双波长条件下进行动力学采集,采集间隔为45s,检测40min;
106.(4)检测结束后输出动力学反应的平均反应信号,根据式(1)计算活度;
[0107][0108]
(5)标准为活度降低10%即认为稳定性折点,结果如表1所示。
[0109]
表1
[0110][0111]
成型效果和稳定性结果如表2所示。
[0112]
表2
[0113]
[0114][0115]
由表2可知,实施例1
‑
3中同时采用聚乙烯吡咯烷酮、乳糖、甘露醇、棉子糖、聚乙二醇和甘氨酸作为活性剂制备鲎试剂冻干微球,所述冻干微球硬度高、表面光滑,且稳定性高,42℃条件下微球可保存7天,与之相比,对比例1
‑
6中未同时采用上述活性剂,所制备的冻干微球硬度低、表面粗糙且易破碎,或者稳定性较差、活性低,此外,控制甘露醇的含量为5%~7%,能够进一步改善冻干微球的成型效果,因此,本发明同时采用聚乙烯吡咯烷酮、乳糖、甘露醇、棉子糖、聚乙二醇和甘氨酸作为活性剂,能够有效促进鲎试剂冻干微球成型,所述冻干微球硬度高、表面光滑,易于进行分装和精确称量,并提高稳定性。
[0116]
试验例2精密度(批内球间差)和含水量的测定
[0117]
本实施例对实施例1
‑
3制备的鲎试剂冻干微球的精密度(批内球间差)和含水量进行测定,测定方法包括以下步骤:
[0118]
(1)取冻干后的鲎试剂微球,按照2粒/孔的标准分装到96孔微孔板中;
[0119]
(2)然后向每个微球孔中加入100μl 0.2m tris
‑
hcl(ph7.2)进行微球复溶;
[0120]
(3)微球复溶后向每孔中加入60μl同一浓度的葡聚糖标准品溶液,随后置于酶标仪中,在37℃恒温条件下,405nm、490nm双波长条件下进行动力学采集,采集间隔为45s,检测40min;
[0121]
(4)检测结束后输出动力学反应的平均反应信号,根据式(2)计算变异系数(cv),
该结果即为精密度(批内球间差);
[0122][0123]
其中,cv为变异系数,s为标准差,检测值的平均值;
[0124]
(5)使用卡尔费休水分测定仪进行含水量测定。
[0125]
结果如表3所示。
[0126]
表3
[0127][0128][0129]
由表3可知,本发明的制备方法中,对预冻、冷冻干燥过程的温度、真空度和时间进行控制,能够高效除去鲎试剂冻干微球中的水分,包括通过范德华力、氢键等弱分子力吸附的结合水,显著降低鲎试剂冻干微球的含水量,冻干微球的含水量低于1.35%,此外,本发明的制备方法操作简单,可控性高,所制备的鲎试剂冻干微球的活性高度均一,批内球间差低于3.52%,而对比例1
‑
6制备的鲎试剂冻干微球的均一性和干燥性均较差,表明本发明同时采用聚乙烯吡咯烷酮、乳糖、甘露醇、棉子糖、聚乙二醇和甘氨酸作为活性剂,能够制备高度均一且含水量低的鲎试剂冻干微球。
[0130]
试验例3活性剂对鲎试剂干扰性分析
[0131]
活性剂的选择过程中还需要考虑其与鲎试剂的兼容性,以保证不干扰鲎试剂用于样品的检测并且不与鲎试剂发生反应,本试验例分析本发明所采用的活性剂对鲎试剂的干扰性。
[0132]
测试方法包括以下步骤:
[0133]
(1)辅料的配制:
[0134]
1)配制20%甘油溶液:20ml甘油+80ml细菌内毒素检查用水,过膜抽滤;
[0135]
2)配制20%聚乙二醇(peg)溶液:准确称取20g聚乙二醇,加入100ml细菌内毒素检查用水进行充分溶解,超滤;
[0136]
3)配制20%乳糖溶液:准确称取20g乳糖,加入100ml细菌内毒素检查用水进行充分溶解,超滤;
[0137]
4)配制20%蔗糖溶液:准确称取20g蔗糖,加入100ml细菌内毒素检查用水进行充分溶解,超滤;
[0138]
5)配制20%棉子糖溶液:准确称取20g棉子糖,加入100ml细菌内毒素检查用水进行充分溶解,超滤;
[0139]
6)配制20%甘露醇溶液:准确称取20g甘露醇,加入100ml细菌内毒素检查用水进行充分溶解,超滤;
[0140]
7)配制20%右旋糖酐溶液:准确称取20g右旋糖酐,加入100ml细菌内毒素检查用水进行充分溶解,超滤;
[0141]
8)配制20%聚乙烯吡咯烷酮(pvp):准确称取20g聚乙烯吡咯烷酮,加入100ml细菌内毒素检查用水进行充分溶解,超滤;
[0142]
9)配制100mg/ml甘氨酸:准确称取10g甘氨酸,加入100ml细菌内毒素检查用水进行充分溶解,超滤;
[0143]
(2)称取葡聚糖标准品30mg,加入15ml纯化水,10倍梯度稀释,最终得浓度为200pg/ml的葡聚糖溶液,对半稀释,分别配制成100pg/ml、50pg/ml、25pg/ml、12.5pg/ml、6.25pg/ml、3.125pg/ml标准品溶液;
[0144]
(3)按照体积比1:1将鲎阿米巴细胞提取物与0.2m tris
‑
hcl(ph7.2)复溶液进行充分混合即为反应主剂;
[0145]
(4)用细菌内毒素检查用水分别将甘油、聚乙二醇、乳糖、蔗糖、棉子糖、甘露醇、右旋糖酐、聚乙烯吡咯烷酮稀释为10%、5%、2%、0.2%,甘氨酸浓度为1mg/ml、0.5mg/ml、0.25mg/ml、0.1mg/ml;
[0146]
(5)取上述标准品溶液60μl加入到无热原微孔板中,再向含标准品的孔中各加入100μl反应主剂,立即放入37℃预热的酶标仪中在405nm波长下动力学检测40min,进行两次平行试验(速率1和速率2),以加入等量水作为空白对照(blank)结果如表4所示,并对数据进行线性拟合,r2为拟合优度;
[0147]
(6)取上述将甘油、聚乙二醇、乳糖、蔗糖、棉子糖、甘露醇、右旋糖酐、聚乙烯吡咯烷酮溶液60μl加入到无热原微孔板中,再向孔中各加入100μl反应主剂,立即放入37℃预热的酶标仪中在405nm波长下动力学检测40min,进行两次平行试验,结果如表5所示。
[0148]
表4
[0149][0150]
表5
[0151]
[0152][0153]
由表4可知,鲎试剂检测葡聚糖标准品(100pg/ml、50pg/ml、25pg/ml、12.5pg/ml标准品溶液)信号值为1.128~10.398,由表5可知,甘油、蔗糖、右旋糖酐与鲎试剂反应的信号值均较高,因此会产生较为明显的正干扰效应,无法使用;而peg、乳糖、棉子糖、甘露醇、pvp、甘氨酸在一定浓度范围内信号值较低,不干扰检测,满足作为活性剂的必要条件。
[0154]
试验例4
[0155]
根据是否加入鲎三肽,鲎试剂检测可分为显色法和浊度法,本试验例分析鲎试剂浓度对显色法效果的影响,试验方法包括以下步骤:
[0156]
(1)将融化完全的鲎阿米巴细胞原料进行高速匀浆破碎,于4℃、8000rpm的低温高速离心机中收集上清,舍弃细胞碎片等物质,按质量比为1:2加入三氯甲烷进行萃取,磁力搅拌10~30min,于4℃、12000rpm的低温高速离心机中收集上清,得到鲎阿米巴细胞提取物;
[0157]
(2)称取0.15g鲎三肽于无热原离心管中,加入30ml内毒素检查用水,混匀,完全溶解后,用0.1μm的滤膜过滤,得到5mg/ml鲎三肽溶液,置于4℃待用;
[0158]
(3)采用无热原吸头吸取2ml鲎阿米巴细胞提取物于无热原离心管中,分别加入1.6ml、0.5ml、0.2ml、0.1ml浓度为5mg/ml的鲎三肽溶液,再对应加入1.4ml、2.5ml、2.8ml、2.9ml纯化水,并分别加入5ml 0.2m tris
‑
hcl(ph为7.4)混合,混匀,即为主剂,主剂中鲎三肽的终浓度分别为0.8mg/ml、0.25mg/ml、0.1mg/ml、0.05mg/ml;
[0159]
(4)称取葡聚糖标准品30mg,加入纯化水依次配制成浓度为200pg/ml、100pg/ml、50pg/ml、25pg/ml、12.5pg/ml、6.25pg/ml、3.125pg/ml的标准品溶液,分别取60μl上述标准品溶液和细菌内毒素检查用水,加入至微孔板中;
[0160]
(5)向微孔板中加入100μl步骤(3)中配制的主剂,置于酶标仪中,在37℃及405nm、490nm双波长条件下进行动力学采集,采集间隔为45s,检测40min,进行两次平行实验(速率1和速率2),以加等量水为空白对照(blank),读取速率值,结果如表6所示,并对数据进行线性拟合,r2为拟合优度。
[0161]
表6
[0162][0163]
由表6可知,鲎三肽浓度为0.05mg/ml时,r2<0.99不符合要求,且空白与检测下限无法区分达不到要求;鲎三肽浓度为0.1~0.8mg/ml时,r2>0.99,且信噪比高,可达到要求,
因此,控制鲎三肽浓度为0.1~0.8mg/ml,既能够有效显色,又能有效控制添加成本。
[0164]
综上所述,本发明中同时采用聚乙烯吡咯烷酮、乳糖、甘露醇、棉子糖、聚乙二醇和甘氨酸,不干扰鲎试剂的检测功能,且各组分间相互配合,促进鲎试剂成型,并提高成型后硬度,同时保护预冷期、冻干期以及储存期鲎试剂的活性,从而使得鲎试剂冻干微球硬度高、表面光滑不易破碎掉屑,且稳定性高,便于后续进行自动化或者手动分装、保存。
[0165]
申请人声明,本发明通过上述实施例来说明本发明的详细工艺设备和工艺流程,但本发明并不局限于上述详细工艺设备和工艺流程,即不意味着本发明必须依赖上述详细工艺设备和工艺流程才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1