一种用于辅助诊断IgA肾病的标志物组合、其检测试剂盒及肾损伤无创检测方法
49%和89%-91%。北大医院肾内科通过超过1000例iga肾病病人的测定,发现gd-iga1的诊断的敏感性和特异性仅分别为50.5%和89.5%。而且,gd-iga1水平在患者和正常人之间存在很大的重叠,显示其临床价值的局限性。此外,该检测还有一个重要技术缺陷,那就是目前采用的凝集素方法来测定gd-iga1的操作表现不稳定,尤其在不同批次的凝集素试剂在测定时存在明显差异,这严重制约了该方法的临床的广泛应用。目前测定gd-iga1的方法并未得到kdigo的推荐。
7.(2)km-55:2015年日本学者制备了针对糖肽的单克隆抗体km-55用于测定gd-iga1水平,结果显示与凝集素haa测定具有很好的一致性,并且克服了haa测定的不稳定性。但是以此为方法测定gd-iga1相比于传统的凝集素haa方法,患者和健康对照之间的gd-iga1水平的重合部分仍然很大,并没有优于传统凝集素方法。这种用km-55直接检测gd-iga1的方法存在的问题包括其检测的糖型过于单一,而无法覆盖iga糖型的多样性。这也提示gd-iga1的临床应用前景具有相当的局限性。
8.(3)抗糖抗体:2009年美国实验室的suzuki et al发现针对gd-iga1的内源性抗糖抗体(在这里gd-iga1作为抗原与其内源产生的抗糖抗体结合),并认为该抗糖抗体是iga肾病的致病性抗体。从而建议内源性抗糖抗体有可能成为iga肾病特异性诊断标志物。该组学者在2014年的一项研究中检测了针对gd-iga1特异性的igg型抗糖抗体,其作为诊断指标的敏感性为89%,特异性为92%。然而到目前为止这个结论还缺乏其他实验室的独立验证。发明人在中国人群中开展的研究显示,在iga肾病和正常人血清中均发现抗糖抗体。尽管病人抗糖抗体平均水平高于正常对照,但如果以正常人90%上限为阈值,只有不足50%的中国iga肾病患者抗糖抗体水平升高。因此抗糖抗体作为iga肾病诊断的临床价值仍然非常有限。
9.(4)iga/补体c3比值:早期有日本学者提出采用血iga或iga/c3比值来进行iga肾病诊断,研究表明其对于疾病诊断的敏感性和特异性均低,临床价值有限。
10.(5)scd89-iga复合物:既往法国学者在cd89转基因小鼠中检测到可溶性cd89与iga形成的复合物,并且可以沉积在小鼠肾组织上,同时在iga肾病患者以及酒精性肝硬化患者的循环中也检测到可溶性cd89与iga形成的复合物;有学者也将可溶性cd89与iga复合物作为一种iga肾病肾移植复发的预测标志物,发现这种复合物在iga肾病患者中要高于健康对照,但与无复发组相比,复发患者的iga-scd89复合物的值显着降低。韩国学者的研究发现循环cd89-iga复合物并不能预测韩国iga肾病患者肾功能的恶化。最近一项中国学者的研究发现在没有应用免疫抑制剂治疗的iga肾病患者循环中iga-scd89复合物水平升高。但是目前关于cd89和iga形成复合物的研究还存在很大争议。同时现有技术中还没有将此种复合物作为iga肾病诊断标志物的研究。
11.对于iga肾病的临床诊断来说,用于辅助诊断的标志物不仅应该具有高敏感性、高特异性以及患者与正常人之间的低重叠性,而且应该满足检测及预测结果的稳定性以及可重复性(指不受试剂变化的影响)、检测操作简便等更多的要求,这样才能够适应临床大规模、无创、快速检测和诊断的需要,才能具有产业化和临床推广应用的价值。然而如上所述,现有技术中的各种标志物都无法全面满足上述iga肾病临床诊断的要求,因此正如最新kdigo国际肾小球肾炎共识会所总结的,到目前为止仍缺乏可用于临床的iga肾病血清学诊断方法。
技术实现要素:
12.鉴于上述背景,本发明提出的目的在于:提供一种可用于临床的iga肾病血清学诊断方法,不仅具有无创的优势,相比现有的肾穿活检风险更低、更易操作;而且相比依赖现有生物标志物的诊断方法具有更高的敏感度、更高的特异度和更高的稳定性。
13.本发明的上述目的通过以下技术方案实现:
14.首先,本发明第一个方面提供用于iga肾病无创诊断的生物标志物组合,包括:iga-igg免疫复合物、igg-iga1免疫复合物、以及和cd89结合的iga免疫复合物。
15.本发明第二个方面提供免疫复合物的组合在制备用于辅助诊断iga肾病的产品中的应用;所述的免疫复合物的组合包括:iga-igg免疫复合物、igg-iga1免疫复合物、以及和cd89结合的iga免疫复合物。
16.本发明所述的iga-igg免疫复合物是指循环中已经结合在一起的iga-igg免疫复合物,而不论iga与igg的结合形式;该免疫复合物可利用elisa双抗体夹心法、利用抗人iga抗体作为捕获抗体、利用抗人igg抗体作为检测抗体检测。
17.本发明所述的igg-iga1免疫复合物是指循环中已经结合在一起的igg-iga1免疫复合物,而不论iga1与igg的结合形式;该免疫复合物可利用elisa双抗体夹心法、利用抗人igg抗体作为捕获抗体、利用抗人iga1抗体作为检测抗体检测。
18.本发明所述的和cd89结合的iga免疫复合物是指血浆中可以与cd89结合的iga免疫复合物,即以复合物形式而非单体形式存在于血浆中的iga。
19.在此基础上,本发明第三个方面提供一种肾组织病理损伤无创评估方法,包括:
20.1)同步检测采集自人体或动物体的样本中的iga-igg免疫复合物水平、igg-iga1免疫复合物水平、以及和cd89结合的iga免疫复合物的水平,得到实测值a-g ics、g-a1 ics和cd89-aics;
21.2)基于1)得到的a-g ics、g-a1 ics和cd89-a ics,利用以下公式(i)计算多指标预测分数:
22.0.127
×
(cd89-a ics)+(-0.529)
×
(a-g ics)+0.547
×
(g-a1 ics)(i)
23.3)设置评估阈值为2.2456,将2)计算得到的多指标预测分数与所述评估阈值比较,大于或等于所述评估阈值的,判定为有95%的预测概率有肾小球损伤;反之判定为非肾小球损伤。
24.本发明所述的评估方法中,1)所述的采集自人体或动物体的样本优选为人体或动物体的外周血样本;更优选外周血血清样本。
25.本发明所述的评估方法中,1)所述的检测优选采用酶联免疫吸附测定法。
26.本发明第四个方面提供一种用于辅助诊断iga肾病的酶联免疫试剂盒,其中至少包含酶联免疫吸附板、包板蛋白、抗体试剂和标准品蛋白;所述的抗体试剂包括用于同时检测样本中所述iga-igg免疫复合物水平、igg-iga1免疫复合物水平、以及和cd89结合的iga免疫复合物水平所需要的抗体试剂。
27.本发明优选的所述酶联免疫试剂盒中,所述的包板蛋白包括重组cd89蛋白、兔抗人igg多克隆抗体和山羊抗人iga多克隆抗体fab段。
28.本发明进一步优选的所述酶联免疫试剂盒中,所述的重组cd89蛋白是由以下方法得到的:采用氨基酸序列如序列表seq id no.1所示的重组蛋白序列得到重组表达载体
pcdna-cd89-flag;运用重组表达载体pcdna-cd89-flag稳定转染hek293细胞(atcc)之后,筛选可以持续分泌cd89的细胞克隆,运用特异性连接有抗flag标签抗体琼脂糖凝胶从细胞培养上清中提纯重组蛋白cd89。
29.本发明优选的所述酶联免疫试剂盒中,所述的抗体试剂包括:小鼠抗人iga-辣根过氧化物酶标记抗体、生物素标记的小鼠抗人iga1重链单克隆抗体、extra-avidin-辣根过氧化物酶标记抗体、小鼠抗人igg重链单克隆抗体和山羊抗小鼠igg-辣根过氧化酶标记抗体。
30.本发明优选的所述酶联免疫试剂盒中,所述的标准品蛋白包括:人iga蛋白、生物素标记的人iga蛋白和链霉亲和素标记的igg蛋白。
31.进一步优选的所述的酶联免疫试剂盒中,还包括包板溶液、封闭液、洗涤液、显色底物和终止液。
32.在本发明提出过程中,我们检测了大量目前在iga肾病研究中可以检测的生物标志物水平,从中筛选出三种不同检测方法检测的不同类型的iga免疫复合物,建立预测模型。预测模型具体通过以下方法建立:在89名iga肾病患者和61名健康对照的人群中,利用logistic回归模型,将探索过程中检测的五种生物标志物(iga1、gd-iga1、iga-igg免疫复合物、igg-iga1免疫复合物、以及和cd89结合的iga免疫复合物)水平作为自变量,为了利用logistic回归检测自变量对于iga肾病的预测预效应,首先利用box-tidwell方法统计方法证明连续自变量与因变量logit转换值之间存在线性关系;再利用共线性统计证明自变量之间容忍度大于0.1,方差膨胀因子小于10,自变量之间不存在多重共线性;将所有自变量分别加入模型,hosmer和lemeshow检验显示p》0.05,表示模型拟合度较高,最后发现只有cd89-a ics、a-g ics、g-a1 ics三个变量的对于iga肾病的预测风险or风险值仍然具有统计学意义(p《0.05)。因此根据给出的常数项得到下列公式,将计算结果定义为“多指标预测分数”。
33.实验证明,本发明所述的三种生物标志物联合检测之后,对于iga肾病诊断的预测具有更高的敏感度和更高的特异度,我们在两组完全独立的人群中进行模型预测的验证,证明了该模型可以在仅用外周血指标检测的情况下就可以帮助临床医生诊断iga肾病,起到指导治疗的作用。
附图说明
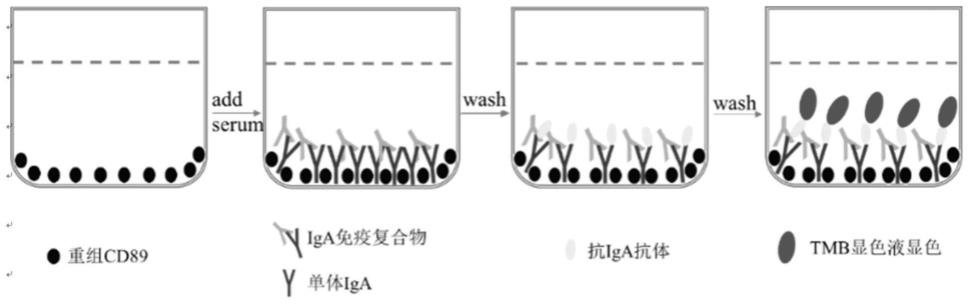
34.图1为实施例2所述的检测和cd89结合的iga免疫复合物水平的流程示意图。
35.图2是实施例2所述的检测血浆样本中iga-igg免疫复合物及igg-iga1免疫复合物水平流程示意图。
36.图3、4体现了实施例2的评估中多指标预测分数敏感性特异性展示以及利用预测分数确定截断值。
37.图5体现了采用不同生物标志物的评估方法的roc曲线下面积。
38.图6体现了采用不同生物标志物的评估方法的患者(igan)与正常人群(hc)的重叠率。
39.图7体现了对比例6各评估方法的roc曲线下面积。
40.图8体现了对比例7各评估方法的roc曲线下面积。
41.图9体现了对比例8各评估方法的roc曲线下面积。
具体实施方式
42.为了便于理解,以下通过列举实施例的方式进一步阐明本发明的方案,但本发明的方案并不限于所列举的实施例。
43.下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
44.实施例1.用于iga肾病临床辅助诊断的酶联免疫试剂盒
45.所述用于iga肾病临床辅助诊断的酶联免疫试剂盒具体包括:
46.1.包板溶液:ph=9.6重碳酸盐缓冲液
47.2.包板蛋白:
48.重组人cd89蛋白;
49.兔抗人igg多克隆抗体;
50.山羊抗人iga多克隆抗体fab段;
51.3.检测抗体:
52.小鼠抗人iga-辣根过氧化物酶标记抗体(abcam,ab7383);
53.biotin标记的小鼠抗人iga1重链单克隆抗体(southern);
54.extra-avidin-辣根过氧化物酶标记抗体(sigma);
55.小鼠抗人igg重链单克隆抗体(abcam);
56.山羊抗小鼠igg-辣根过氧化酶标记抗体;
57.4.标准品蛋白:
58.商品化人iga蛋白(abcam,ab91020);
59.商品化生物素(biotin)标记的人iga蛋白;
60.商品化链霉亲和素(streptavidin)标记的igg蛋白;
61.5.封闭液、样本、标准品以及检测抗体的稀释液:1%bsa/0.05%pbst溶液;
62.6.洗板液:0.05%pbst溶液;
63.7.显色液:过氧化物酶底物显色a液和b液;
64.8.终止液:1m浓硫酸;
65.9.酶联免疫吸附板(elisa板):高蛋白结合96孔板。
66.实施例2.肾组织病理性损伤的无创评估方法
67.以来源于北大医院肾内科的iga肾病患者血浆及健康人群的血浆为评估用检测样本。其中,患者为已经签署知情同意的肾活检诊断为iga肾病的患者,健康人群是已签署知情同意的健康献血者。
68.取实施例1所述的酶联免疫试剂盒,同步检测采集自人体的血浆样本中iga-igg免疫复合物的水平、igg-iga1免疫复合物的水平、以及和cd89结合的iga免疫复合物的水平,具体的检测方法如下:
69.一、和cd89结合的iga免疫复合物的水平的检测,大体流程如图1所示,具体包括以下步骤:
70.1.包板:取elisa板,用包板溶液将重组人cd89蛋白稀释至2.5μg/ml浓度后,每孔加入50μl,4℃包被过夜,得到cd89包被板,洗板液洗3次每次1分钟。
71.2.封闭:向步骤1制备的cd89包被板中加入封闭液1%bsa/pbst,100μl/孔,37℃封闭1h,洗板液洗3次每次1分钟。
72.3.加样:50μl待测血浆样本(血浆样本采用缓冲液1%bsa/pbst进行1:1000倍稀释),37℃孵育3h,洗板液洗3次每次1分钟。
73.4.加抗体:完成步骤3后,每孔加入50μl hrp标记的抗iga的抗体,用缓冲液1%bsa/pbst进行1:1000倍稀释,37℃孵育1h。
74.5.tmb显色:过氧化物酶底物tmb显色液1:1比例现配现用,避光,洗板时避光在摇床将a b液混匀,每孔50μl显色液,室温避光显色30min。
75.6.终止读数:以终止液终止读数。酶标仪450/570nm双波长读数,采用标准品蛋白中的商品化人iga蛋白进行倍比稀释作为标准品,logistic四参数拟合标准曲线计算对应水平浓度。logistic四参数拟合标准曲线方程如下:
76.y=(a-d)/[1+(x/c)^b]+d;其中,a=2.07884,b=-1.08659,c=1854.70355,d=0.00030。标准曲线方程r2=0.99994。
[0077]
将待测样本经过上述步骤检测得到的od度数代入标准曲线方程中的y值,计算x值,用以评价病人血浆样品中可与cd89结合的iga复合物水平,得到预测用指标cd89-a ics。
[0078]
二、检测血浆样本中iga-igg免疫复合物及igg-iga1免疫复合物水平:
[0079]
1.包板:取elisa板,用包板溶液稀释兔抗人多克隆igg抗体/山羊抗人iga多克隆抗体fab段至2.5μg/ml浓度后,每孔加入50μl,4℃包被过夜,得到igg抗体和iga抗体包被板,洗板液洗3次每次1分钟。
[0080]
2.封闭:向步骤1制备的igg抗体和iga抗体包被板中加入封闭液1%bsa/pbst,100μl/孔,37℃封闭1h,洗板液洗3次每次1分钟。
[0081]
3.加样:50μl待测血浆样本(血浆样本采用缓冲液1%bsa/pbst进行1:100000倍稀释),37℃孵育1h,洗板液洗3次每次1分钟。
[0082]
4.加检测抗体(一抗):完成步骤3后,对于igg抗体包被板,每孔加入50μl biotin标记的小鼠抗人iga1抗体,用缓冲液1%bsa/pbst进行1:4000倍稀释;对于iga抗体包被板,每孔加入50μl小鼠抗人igg重链单克隆抗体,用缓冲液1%bsa/pbst进行1:2000倍稀释。所有包被板37℃孵育1h。
[0083]
5.加二抗:完成步骤4后,对于igg抗体包被板,每孔加入50μl extra-avidin-辣根过氧化物酶标记抗体,用缓冲液1%bsa/pbst进行1:2000倍稀释;对于iga抗体包被板,每孔加入50μl山羊抗小鼠igg-辣根过氧化酶标记抗体,用缓冲液1%bsa/pbst进行1:4000倍稀释。所有包被板37℃孵育1h。
[0084]
6.tmb显色:过氧化物酶底物tmb显色液1:1比例现配现用,避光,洗板时避光在摇床将a b液混匀,每孔50μl显色液,室温避光显色30min。
[0085]
7.终止读数:使用终止液终止读数。酶标仪450/570nm双波长读数,采用标准品蛋白中的商品化biotin标记iga蛋白和streptavidin标记的igg蛋白结合进行倍比稀释作为标准品,logistic四参数拟合标准曲线计算对应水平浓度。logistic四参数拟合标准曲线
方程如下:
[0086]
igg抗体包被板:y=(a-d)/[1+(x/c)^b]+d;其中,a=1.48699,b=-0.97439,c=18.25720,d=-0.00767。标准曲线方程r2=0.99967。
[0087]
iga抗体包被板:y=(a-d)/[1+(x/c)^b]+d;其中,a=1.61149,b=-1.21433,c=93.22440,d=0.00374。标准曲线方程r2=0.99200。
[0088]
将待测样本经过上述步骤检测得到的od度数代入标准曲线方程中的y值,计算x值,得到预测用指标a-g ics和g-a1 ics。
[0089]
三、计算多指标预测分数
[0090]
基于步骤一和步骤二得到的a-g ics、g-a1 ics和cd89-a ics,利用以下公式(i)计算多指标预测分数a:
[0091]
a=0.127
×
(cd89-a ics)+(-0.529)
×
(a-g ics)+0.547
×
(g-a1 ics)
ꢀꢀꢀ(i)[0092]
四、肾组织病例性损伤的判别
[0093]
研究发现,如图3、4所示,在预测分数大于2.2456时,本发明的方法对于肾小球病理性损伤的判断特异度为95.1%。敏感度仍有67.4%。因此设置评估阈值为2.2456,将步骤三计算得到的多指标预测分数a与所述评估阈值比较,大于或等于所述评估阈值的,判定为肾小球病理性损伤;反之判定为非肾小球病理性损伤。
[0094]
对比例1.
[0095]
以与实施例2相同的血浆样本为评估样本,单独检测其中的iga-igg免疫复合物水平(检测方法同实施例2中步骤二所述),roc曲线下面积见图5。如图5中单点划线“ag_ics”所示,其特异性和敏感性为88.52%和32.58%;患者与正常人群的重叠率为75.3%(如图6中的“a-g ics”)。
[0096]
对比例2.
[0097]
以与实施例2相同的血浆样本为评估样本,单独检测其中的igg-iga1免疫复合物水平(检测方法同实施例2中步骤二所述),roc曲线下面积见图5。如图5中直线“ga_ics”所示,其特异性和敏感性为80.33%和85.39%;患者与正常人群的重叠率为27.0%(如图6中的“g-aics”)。
[0098]
对比例3.
[0099]
以与实施例2相同的血浆样本为评估样本,单独检测其中的和cd89结合的iga免疫复合物的水平(检测方法同实施例2中步骤一所述),roc曲线下面积见图5。如图5中直线“cd89_binding_iga_ics”所示,其特异性和敏感性为83.61%和69.66%;患者与正常人群的重叠率为39.3%(如图6中的“cd89-a ics”)。
[0100]
对比例4.
[0101]
以与实施例2相同的血浆样本为评估样本,单独检测其中的iga1的水平(检测方法见参考文献:moldoveanuz,wyatt r j,jy lee,etal.patients with iga nephropathy have increased serum galactose-deficient iga1levels[j].kidney international,2007,11(11):1148-1154),roc曲线下面积见图5。如图5中的虚线“iga1”所示,其特异性和敏感性为90.16%和60.67%;患者与正常人群的重叠率为40.4%(如图6中的“plasma iga1”)。
[0102]
对比例5.
[0103]
以与实施例2相同的血浆样本为评估样本,单独检测其中的gd-iga1的水平(km55检测检测试剂盒),roc曲线下面积见图5。如图5中的双点划线“gd_iga1”所示,其特异性和敏感性为75.41%和75.53%;患者与正常人群的重叠率为60.7%(如图6中的“gd-iga1”)。
[0104]
对比例6.
[0105]
以与实施例2相同的血浆样本为评估样本,检测其中的与cd89结合的iga免疫复合物的水平与igg-iga1复合物结合(检测方法同实施例2中步骤一所述),与传统指标iga1水平、gd-iga1水平以及单独igg-iga1复合物水平比较,roc曲线下面积如图7所示;roc曲线下面积0.883特异性和敏感性为93.44%和80.9%。
[0106]
对比例7.
[0107]
以与实施例2相同的血浆样本为评估样本,在检测其中的与cd89结合的iga免疫复合物的水平与igg-iga1复合物水平结合(检测方法同实施例2中步骤一所述)基础上,组合检测iga-igg复合物水平,roc曲线下面积如图8所示,roc曲线下面积相比对比例6增加至0.911。
[0108]
对比例8.
[0109]
以与实施例2相同的血浆样本为评估样本,在检测三种iga复合物的(检测方法同实施例2中步骤一所述)基础上,分别检测gd-iga1水平以及iga1水平,组合之后发现,roc曲线下面积如图9所示,并没有显著提高诊断效能。
[0110]
总之,本发明的三种标志物联合检测用于肾组织病理性损伤的评估及iga肾病的诊断,具有比现有其他标志物更优的敏感性和特异性,同时患者和健康人群间的重叠率低、检测手段简单、检测结果稳定可重复。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1