微纳光纤耦合器无标生物传感定量检测血清中目标蛋白的方法与流程
本发明涉及光纤传感器的生物传感技术领域,具体的说是涉及微纳光纤耦合器无标生物传感定量检测血清中目标蛋白的方法。
背景技术:
光纤微纳耦合器(omc)传感器由于其成本低、结构简单、电磁干扰小、灵敏度高在生物传感领域得到了广泛的研究和应用。然而,在检测血清中目标蛋白时,往往存在非特异性吸附,增加背景噪声信号,阻碍检测,降低传感器性能。当免疫传感器表面功能修饰过程中出现缺陷或抗体没有完全覆盖传感器表面时,血清中的复杂的蛋白质会由于疏水性,静电和分子间交换相互作用吸附到传感器表面的空白位点上,并与传感器表面修饰的基团结合。在这些情况下,无标免疫传感器就需要将由非特异性吸附引起的响应与分析物与特定受体的结合引起的响应区分开来。此外,生物免疫传感器的实际应用需要准确定量检测临床血清样品中的待测目标蛋白。但是,在进行无标定量检测时,需要解决人血清的个体差异的问题。由于个体差异,不同的人类血清样品被注入到omc中以反映不同的波长表达,基线是高度不确定的,很难使用某一血清透射光谱作为参考,这直接制约着生物传感器在临床样品的无标精准定量检测。
金纳米颗粒,磁性纳米颗粒,二氧化硅颗粒,量子点等被用于标记在二抗上,以增强特异性结合信号,提高信噪比,从而忽略非特异性吸附的影响。然而,这些纳米材料的制备、功能化和三明治夹心免疫分析需要额外的时间、成本和操作程序。同时,传感器的性能可靠性也受到纳米粒子标记的不确定性影响。使用抗非特异性蛋白吸附材料作为表面涂层是传感器无标签免疫检测在血清中应用的主要策略。聚乙二醇和低聚乙二醇(peg和oeg)材料是常见的选择,但它们在过渡金属离子和氧气存在下容易氧化,限制了生物传感器的长期应用。此外,已被证明具有良好防污性能的两性离子聚合物也是很好的候选材料。然而,合成此类材料的不足在于成本高、聚合步骤复杂,而且合成衍生物膜的方便性和高控制性仍然是一个挑战。
技术实现要素:
有鉴于此,本发明的目的在于提供微纳光纤耦合器无标生物传感定量检测血清中目标蛋白的方法,使得所述方法可以降低人血清的个体差异对无标定量检测的影响,保证后续目标蛋白omc定量检测结果更准确、灵敏度高和特异性高。
为了实现上述目的,本发明提供如下技术方案:
微纳光纤耦合器无标生物传感定量检测血清中目标蛋白的前置方法,包括:
步骤1、对omc进行表面功能化,将能够与目标蛋白的抗体偶联的活性基团固定在omc上,然后使用化学试剂淬灭表面功能化omc传感器表面剩余的活性基团;
步骤2、设置不同浓度的被测标准血清,获取来源于不同人体的被测健康人血清(优选为20人及以上),每个来源的被测健康人血清同样设置不同的浓度;采用浓度超过被测标准血清以及被测健康人血清浓度的标准血清封闭omc传感器表面,然后清洗omc传感器表面待用;
选择其中一个浓度的被测标准血清进行omc传感器检测,记录其波长信号的偏移量,计为a,所述偏移量为被测标准血清开始检测时波长信号和检测结束时的波长信号的差值(分两次测定);按照同样的方法选择其中一个浓度的所有来源的被测健康血清检测波长信号偏移量,计为b1-bx,x为健康血清来源数量;对比偏移量a和偏移量b1-bx的相对波长偏移差的平均值以及标准偏差;
通过本步骤上述检测,选择相对波长偏移差的平均值以及标准偏差最小的一组被测标准血清浓度a和被测健康血清浓度b,作为实际检测中采用的浓度;
步骤3、清洗omc传感器表面,然后以浓度为b的被测标准血清作为空白血清进行omc传感器检测,当空白血清曲线重合后(如不重合可重复加入空白血清直至重合),向浓度为b的被测标准血清中加入不同浓度的目标蛋白,配制成梯度浓度的目标蛋白标准检测液进行omc传感器检测,获取定标曲线;
步骤4、对omc传感器表面进行解离、清洗,待用。
在本发明具体实施方式中,本发明以sigma人血清作为标准血清;
作为优选,所述活性基团选择羧基或醛基;在本发明具体实施方式中,本发明选择羧基,通过nhs和edc活化后连接目标蛋白的抗体,所述羧基由paa提供;同时,本发明使用乙醇胺来淬灭多余的羧基或醛基,具体是采用1m乙醇胺-hcl(ph=8.5)淬灭。
作为优选,步骤1所述活性基团固定在omc上采用静电吸附或共价键连接的方式进行固定。在本发明具体实施方式中,本发明采用静电吸附方式进行固定,先通过氢氧化钾是omc表面带负电荷,然后通过pdda的正电解质溶液吸附,最后通过paa的负电解质溶液静电吸附并由其提供活性基团-羧基。
本发明步骤2为人血清个体差异校正,通过该步骤以某一浓度的标准血清的偏移量涵盖绝大多数的临床血清的偏移量,校正个体差异,使检测更加准确。在本发明具体实施方式中,本发明选择25%和30%两个浓度的标准血清,与23份25%浓度的健康人血清样本的波长偏移量进行对比,结果显示,在相同的波长附近,25%标准血清波长偏移与23份浓度为25%的健康人血清样品的波长偏移对比结果为:相对波长偏移差的平均值为0.64nm,标准偏差为0.42nm;30%标准血清波长偏移与23份浓度为25%的健康人血清样品的波长偏移对比结果为:相对波长偏移差平均值为0.08nm,标准偏差为0.27nm。实验结果表明对于25%浓度的临床血清样本检测,30%标准血清比25%标准血清更适合作为参考以减少血清个体差异对无标定量检测的影响。因此,本发明确定以sigma人血清作为标准血清,浓度为30%,将临床血清检测时的浓度确定为25%。其中,血清浓度通过pbs稀释调整。
在本发明具体实施方式中,封闭omc传感器表面的标准血清浓度为50%。
由于一个传感器往往无法覆盖整个测量范围,因此在本发明具体实施方式中使用不同线性动态范围的omc免疫传感器检测标准血清中不同浓度的目标蛋白,得到定标曲线。例如本发明实施例提供的标准血清中目标蛋白与omc表面固定的目标蛋白的抗体在200fg/ml-1pg/ml范围内的线性反应,200pg/ml-800pg/ml范围内的线性反应,以及2ng/ml-8ng/ml浓度范围内的线性反应;通过三个不同线性动态范围的omc免疫传感器检测标准血清中不同浓度的目标蛋白。
通过上述前置方法,本发明将检测过程中可能的非特异性吸附以及个体差异均进行了校正,可以保证后续检测更准确、灵敏度高和特异性高。
同时,本发明还提供了微纳光纤耦合器无标生物传感定量检测血清中目标蛋白的方法,在所述前置方法的基础上继续进行如下步骤:
将浓度为a的被测标准血清进行omc传感器检测,记录刚开始检测时的波长信号fs1以及检测完成时的波长信号fs2,偏移量计为fs2-fs1;
将临床待测血清的浓度调节为权利要求1中的浓度b,进行omc传感器检测,记录刚开始检测时的波长信号fp1以及检测完成时的波长信号fp2;
根据公式(fp2-fp1)-(fs2-fs1)获得临床待测血清的波长信号,代入到前述的定标曲线中,获得临床待测血清中目标蛋白的含量。
在本发明具体实施方式中,本发明以cea作为实验对象进行方法学上的验证,通过和临床检测结果比对,达到了优异的一致性;本发明所述前置方法以及后续的检测方法均可以用于非诊断目的的目标蛋白,即该目标蛋白的定量检测不能实现预期诊断,需要结合其他检测结果确定。
由以上技术方案可知,本发明提供一种利用微纳光纤耦合器(omc)生物传感器实现血清中目标蛋白的高灵敏度,高特异性无标定量检测的方法。本发明将血清预吸附到抗体修饰后的传感器上,作为防污界面,本发明提取了相对于重叠的空白血清基线的曲线偏差所引起的特异性结合信号以实现标准人血清环境下具有不同检测范围的omc免疫传感器的线性动态检测,以标准人血清环境下的线性动态检测结果作为定标直线。然后提出以标准人血清来降低人血清的个体差异影响对无标定量检测的影响。最后以标准人血清的偏移量作为参考,获取得不同的临床待测人血清和标准人血清偏移量的偏差之后,根据定标曲线对人血清中的目标蛋白进行定量检测。omc的定量检测结果与临床检测结果具有良好的一致。该策略填补了免疫传感器无标定量检测的空白,进一步的推进了微纳光纤耦合器生物传感器实用化。
附图说明
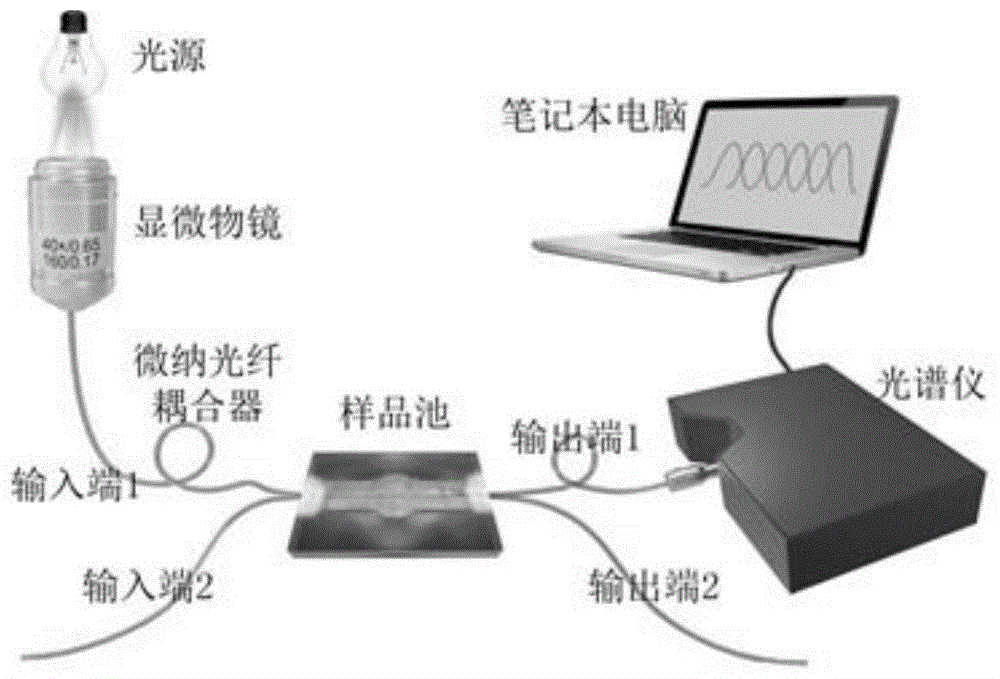
图1为本发明实施例提供的实验装置图;
图2为本发明实施例提供的抗体在omc表面固定化示意图;
图3为本发明实施例提供的免疫传感器阻断策略图;剩余的活化羧基被1m乙醇胺-hcl(ph=8.5)淬灭,以避免修饰后的传感器上更多的非特异性蛋白与其余羧基结合,血清预吸附在功能化的omc上作为防污界面;
图4为本发明实施例提供的以空白血清重叠曲线为基线,抗原检测曲线(200fg/ml)与基线对比图,检测样品的信号远大于基线信号,认为信号差异为抗原-抗体特异性结合信号;
图5为本发明实施例提供的25%sigma人血清中cea与omc表面固定的cea抗体在200fg/ml-1pg/ml范围内的线性反应;
图6为本发明实施例提供的25%sigma人血清中cea与omc表面固定的cea抗体在200pg/ml-800pg/ml范围内的线性反应;
图7为本发明实施例提供的25%sigma人血清中cea与omc表面固定的cea抗体在2ng/ml-8ng/ml浓度范围内的线性反应;
图8为无标记定量检测的特定信号提取策略的示意图,图中的△表示目标蛋白与抗体结合的信号值,fs1和fs2分别代表开始检测时(反应开始添加)和检测结束时(反应结束时)sigma人血清的波长信号。fp1和fp0分别代表未含目标蛋白的临床待测血清(健康状态时血清)样本在开始检测时(反应开始添加)和检测结束时(反应结束时)的波长信号,由于个体人血清差异,fp0具有不确定性;fp2是临床待测血清样本(当下状态时血清)检测结束时(反应结束后)的波长信号;fp1由于是开始添加时即被测定的波长信号,故无论样本取自什么状态都可以认定为未含目标蛋白的临床待测血清(或健康状态时血清)在开始检测时的波长信号,而fp2可由临床待测血清样本测得目前状态下的波长信号值;由于fp0的不确定性,无法通过fp2获取目标蛋白与抗体结合的信号值,因此本发明需要通过人血清个体差异校正环节(步骤2)确定出能够无限贴近于fp0-fp1=fs2-fs1情形的被测标准血清浓度a和对应的临床待测血清的浓度b;
图9上图为使用50%sigma人血清进行封闭后,对加入的第二次25%sigma人血清与23份25%不同健康人血清样本的波长偏移量对比。图9下图为使用50%sigma人血清进行封闭后,对加入的第二次30%sigma人血清与23份25%不同健康人血清样本的波长偏移量对比;
图10为omc免疫传感器对4份血清中cea的检测结果与临床对照示意图。
具体实施方式
本发明实施例公开了微纳光纤耦合器无标生物传感定量检测血清中目标蛋白的方法,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明内。本发明所述方法已通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述方法进行改动或适当变更与组合,来实现和应用本发明技术。
以下就本发明所提供的微纳光纤耦合器无标生物传感定量检测血清中目标蛋白的方法做进一步说明。
实施例1:本发明所述方法
(1)实验装置
使用卤素灯作为光源,并使用数值孔径为0.65的显微镜物镜将光聚焦到omc中。将光学微纤维耦合器固定在流体池中以输送样品溶液。使用分辨率为0.3nm的光谱仪作为检测器,并通过笔记本电脑获取实验数据。为了消除温度的影响,生物传感实验在洁净室环境中进行,整个实验保持温度为23±0.2℃;实验装置示意图见图1。
(2)omc表面功能化及检测
1、离子水清洗omc;
2、将omc浸入0.1mkoh溶液中10分钟,然后用离子水清洗;
3、加入2mg/mlpdda的正电解质溶液侵泡omc30分钟,然后用去离子水清洗以除去样品池中的多余试剂;
4、加入2mg/mlpaa的负电解质溶液侵泡omc30分钟,然后用去离子水清洗以除去样品池中的多余试剂;
5、加入50mmnhs和200mmedc在pbs缓冲液中的1:1混合物侵泡omc30分钟来激活paa的羧基。然后用pbs清洗;
6、通过抗体固定的动态响应时间及过程确定抗体浓度,固定时间,固定次数。一般第一次固定2小时,第二次固定10分钟以增加抗体在光纤表面的附着量,然后用pbs清洗,流程示意图见图2;
7、将omc暴露于1m乙醇胺-hcl(ph=8.5)30分钟,然后用pbs洗涤;示意图见图3;
(3)人血清个体差异校正对比实验
以sigma人血清的波长偏移作为参考以减少人血清个体差异的影响时,sigma人血清与相应浓度的健康人血清的偏移应尽可能小。因此考察了不同浓度的sigma人血清对校正23份25%浓度健康人血清个体差异的影响。使用50%sigma人血清进行封闭后,加入两次sigma人血清,然后记录第二次sigma人血清的偏移量,然后加入25%浓度健康人血清,并记录其偏移量。对加入的第二次浓度为25%和30%sigma人血清的波长偏移量与23份25%浓度的健康人血清样本的波长偏移量进行对比。
在同一微纳光纤耦合器上,将23份浓度为25%的健康人血清样品的波长偏移与第二次添加的25%sigma人血清的波长偏移进行了比较。结果如图9上图所示,在710nm的波长附近,相对波长偏移差的平均值为0.64nm,标准偏差为0.42nm。图9下图显示第二次添加的30%sigma人血清波长偏移与23份浓度为25%的健康人血清样品的波长偏移对比结果,在710nm波长附近的相对波长偏移差平均值为0.08nm,标准偏差为0.27nm。实验结果表明对于25%浓度的临床血清样本检测,30%sigma人血清比25%sigma人血清更适合作为参考以减少血清个体差异对无标定量检测的影响。
确定上述浓度后,采用50%sigma人血清封闭30分钟,然后用pbs洗涤传感器表面;
(4)定标曲线
加入25%sigma人血清作为空白血清,当空白血清曲线重合后加入25%sigma人血清中不同浓度的cea进行检测,制作定标曲线;
当检测样品的信号相对空白血清信号的波长偏移量大于0.6nm时,如图4所示,信号差异被认为是抗原-抗体特异性结合信号。在这种情况下,认为传感器装置对除了目标蛋白质cea之外的任何分子几乎没有响应。
由于一个传感器往往无法覆盖整个测量范围,这就需要使用不同线性动态范围的omc免疫传感器检测25%sigma人血清中不同浓度的目标蛋白cea,如图5、6、7,得到定标曲线。
(5)血清中目标蛋白cea的定量诊断
1、使用0.1m甘氨酸-hcl(ph=2.3)进行解离。
2、添加2次30%sigma人血清,记录第二次的30%sigma人血清的波长偏移量,即图8中的fs2-fs1。
3、加入待测临床人血清,记录其波长偏移量,即图8中的fp2-fp1;减去fs2-fs1,并将其信号差值代入至定标曲线中获得对应的浓度,实现不同25%人血清中目标蛋白的定量检测。
(6)本发明方法检测结果与临床检测结果对比
使用本发明omc免疫传感器方法对4份血清中cea的检测结果与临床检测结果对比,结果如图10所示,两者具有良好的一致。
以上所述只是用于理解本发明的方法及其核心思想,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,可以对本发明进行若干改进和修饰,这些改进和修饰也落入本发明权利的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!