一种体外测定碳水化合物食物的血糖生成指数的方法
本发明属于食品检测技术领域,特别涉及一种体外测定碳水化合物食物的血糖生成指数的方法。
背景技术:
随着社会经济的发展与居民生活水平的改善,大众的保健意识日益增强,消费者对饮食营养品质的需求逐渐提升,潜在的健康食品消费市场日益扩大。碳水化合物是最重要的食品营养成份之一,其通过人体消化系统的代谢吸收,以葡萄糖分子的形式进入人体,为各类新陈代谢活动提供主要的能量来源。为了研究人体中的血糖变化,加拿大多伦多大学jenkins等研究人员提出了血糖生成指数(glycemicindex,gi)这一重要的概念。基于饮食后血糖水平的变化,碳水化合物食物的gi值可分成0-100级。低血糖生成指数食物gi≤55;中等血糖生成指数食物gi56-69;高血糖生成指数食物gi≥70。高gi食物会被快速消化和吸收,导致血糖水平显著波动,对胰岛的刺激和负担更大;低gi食物较慢消化和吸收,使得血糖和胰岛素水平更平缓地升降,波动平坦,对胰岛的刺激和负担更小。现代科学研究证明,由碳水化合物所主导的血糖变化与人体健康密切相关。长期高血糖饮食会显著增加肥胖、糖尿病、心血管疾病等一系列慢性病的致病风险。与此相反,低血糖饮食被证明有显著的保健效果,不仅能帮助控制食欲和延迟饥饿,益于体重的控制,更能改善糖尿病(1型和2型)人的葡萄糖和脂质水平。因此,低血糖饮食开发低血糖生成指数的碳水化合物食物(lowgicarbohydratefood)已经成为国际趋势,蕴含巨大的市场价值。
血糖生成指数(gi)作为功能性碳水化合物食品的重要指标,当前公认的断食采血测定法”简要如下:选取至少6名过夜禁食后的健康受试者,让其摄入含有10~50克碳水化合物的受试食物,在食物消化开始前(0时)和接下来两小时消化时间内每隔15~30分钟采集血样。通常经扎手指取血,分析血糖水平。用所得数据制作2小时内的血糖响应曲线(即血糖水平对时间作图)。作为对照,再次过夜禁食后,让相同受试个体摄入等量碳水化合物中包含的葡萄糖(或具有已知gi值的白面包),进行相同的测试获得两小时内的血糖响应曲线。测定反应曲线下方面积(areaundercurve,auc),并规定葡萄糖作为标准参照品auc值为100;待测食物与葡萄糖参照品的auc比值乘以100,即得到血糖生成指数,即gi值。
血糖生成指数的体内测定方法通常需要人作为受试者,费用非常昂贵,耗时过长且效率不高,更是无法大规模进行碳水化合物食物gi值的检测。这一系列的缺点限制了其在现代育种或食品工业中的应用,因为此类体内测试无法满足这些产业中大量测试的需要。为了应对此问题,研究者陆续开发了一系列体外测试的方法,用以快速、高效、准确地预估食品的gi值。其中最典型的体外gi测试方法由k.n.englyst和其同事创立。englyst法让待测食物在37℃下与消化酶混合,使用比色法测定葡萄糖水平。该体外方法随后经历更新,被修改为使用包括高效液相色谱(hplc)在内的先进仪器进一步准确测定所释放的葡萄糖量。使用相关数学模型,通过20分钟以内释放的葡萄糖量就可以预测待测碳水化合物食品的gi值。但是,体外englyst方法已经遇到相当多的批评与质疑,尤其是来自体内血糖生成指数方法的支持者的批评。例如,garsetti等人使用englyst方法评估饼干食品(gi~35-60),随后与体内测定值作了比较,发现该体外方法几乎没有预测价值;又比如brand-miller等人采用体外englyst方法测试了三种中等血糖生成指数的食品样品,但测试结果却显示三种食品的gi<55属于低血糖食品。鉴于测试结果上的明显错误,研究作者竭力主张食品制造商承诺仅在经验丰富的实验室使用标准化的体内试验方法进行gi测试。
在englyst方法之后,研究人员继续对体外试验预测gi技术进行研究。如在卡夫卡食品所持有的专利(中国专利字号:cn101784898b)中,研究人员改良了englyst方法,运用低温均匀研磨食物并固化或半固化食物样品,以确保食物分子完整性。同时模拟食品与酶的消化,产生蛋白质、脂肪与糖醇的多种产物。在使用hplc测得样本糖类后,各类数据由计算机数据模型得到模拟的gi指数,借以提高预测的准确性。该方法虽然提高了gi指数预测的准确性,但是缺点同样明显,归纳起来有以下几方面:
1).不合理或非必要步骤导致操作繁琐。此方法需要使用液氮辅助设备来研磨处理固体或半固体食品材料,这与真实人体口腔咀嚼和肠道蠕动环境相差非常大;此法同时需要使用高效液相色谱法(hplc)或等同定量方法测定一系列糖或糖醇(果糖、半乳糖、乳糖、蔗糖和麦芽糖醇)的量,但在真实消化环境中,淀粉分子在多种消化酶共同作用下水解成的还原糖(麦芽糖、麦芽三糖、单分子葡萄糖)才是生成血糖的主要成份,该方法并没有专门对淀粉消化水解生成还原糖的速率进行表征测定,因此准确度不高。
2).孤点测试无法反应整体消化情况。此法―经过所述固定时间后,立即将消化的样品按其整体处理,以停止酶反应,这样只能获得一个单一时间点的食品消化产物进行测试,无法评价食物整体时间段内还原糖的释放速率,对于糖尿病以及肥胖症患者而言,还原糖的释放速率对其进食后的体内血糖水平具有更重要的影响。
3).数据分析过度依赖专业统计软件。此法―最终样品消化物分析可得到葡萄糖、果糖、半乳糖、乳糖、蔗糖和麦芽糖醇含量的定量值。这些数值与原始样品总蛋白质和脂肪等数据需要一起优选输入合适的统计软件程序(如jmp统计软件),才能得到原始样品的gi值。
在另一典型的专利(中国专利号:cn106979997b)中,研究人员发明公开了一种转糖酵素反应剂,并将其与待测食品混合进行生糖反应,并借助超声波震荡将食物击碎。食物中的淀粉、原生糖份与膳食纤维等进行类消化模拟反应后,得到类食糜状的转糖生成产物。依时序测定此生成产物中的葡萄糖浓度,可得到生糖反应曲线。经由数值方法与―转糖函数对应升糖指数”的转换计算后可快速评估出被测试样品的gi值。此法虽然大幅缩短体外检测时间,并精简所需的高级科学仪器与人力,但后期数据处理涉及大量数学积分和电脑软件程序应用,繁杂不易操作。
除此之外,其他相关的gi体外测试方法都存在各种问题,具体如下。在专利申请cn111239296a中,此方法因为完全没有使用任何有明确gi值的标准品在体外消化试验后,仅凭借其他文献中的经验公式去推测待测样品的gi,结果的准确性无法得到保证。此外,专利申请:cn106680383a中虽然简单地使用了麦芽糖作为标准品,但是在测定消化产物的时候却测定的是葡萄糖含量,前后不一致,同时也与人体内的真实消化产物严重不符。此外,该专利申请:cn106680383a中要求在不同时间点测定葡萄糖含量后,再根据公式gi=0.862hi+8.189(hi为2小时内水解率)计算得到食物的预测gi值。同样地1)该专利申请忽视了消化率与消化速率之间的差异性,2)该专利申请还忽视了真实体内消化过程中,淀粉水解产物的多样性等。
综上所述,在体外试验测试gi这一领域,诸多现有的分析方法都存在显著的缺陷。因此亟需一种高效、简便、准确的体外测定碳水化合物食物的血糖生成指数的方法。
技术实现要素:
本发明的目的在于克服现有技术的缺点与不足,提供一种体外测定碳水化合物食物的血糖生成指数的方法。本发明是基于食品的理化性质,结合生物化学、食品化学、有机化学和消化反应动力学模拟等多方面的知识构建而成的全新一代检测技术,可服务于育种工业、食品开发等领域,用以快速检测筛选低血糖生成指数的食物样本。
本发明的目的通过下述技术方案实现:
一种体外测定碳水化合物食物的血糖生成指数的方法,包括如下步骤:
(1)通过体外试验模拟人体的口腔、胃部、小肠的酶消化反应活动,测量获得待测碳水化合物食物释放还原糖的速率及其消化率;
(2)采用体外消化反应动力学方程及数据拟合模型获得相关体外消化试验参数;
(3)针对已知gi值的标准碳水化合物食物标准品进行体外消化实验,明确并建立标准样品血糖生成指数gi与体外消化试验参数之间的函数关系;
(4)根据待测碳水化合物食物的体外消化参数,通过对比(3)中建立的标准品gi值与其体外消化试验参数之间的函数关系,预测待测样品的血糖生成指数,即gi值。
所述的通过体外试验模拟人体口腔、胃部和小肠的酶消化反应活动的方法优选包括如下步骤:
1)体外试验模拟口腔咀嚼过程:碳水化合物食物样品按质量(g)体积(ml)比1:5~10的比例与模拟唾液(ssf)混合,模拟人体对碳水化合物食物的口腔咀嚼过程,得到模拟咀嚼物;
所述的碳水化合物样品包括但不限于米饭、面条、饼干和面包。
所述的模拟唾液(ssf)优选由含有以下组分的混合液组成:0.288mol/lkcl、0.07mol/lkh2po4、0.259mol/lnahco3、0.03mol/lmgcl2·6h2o、0.001mol/l(nh4)2co3和0.021mol/lhcl。
所述的模拟唾液(ssf)中不含有唾液淀粉酶。
所述的模拟人体对碳水化合物食物的口腔咀嚼过程的条件优选为:37℃水浴下于300rpm磁力转子搅拌25~35s;更优选为37℃水浴下于300rpm磁力转子搅拌30s。
2)将人工胃液(sgf)与步骤1)得到的模拟咀嚼物混合,模拟人体对碳水化合物食物的胃部消化过程,得到胃部消化物;
所述的人工胃液(sgf)由组分a和组分b以及胃蛋白酶组成;
所述的组分a由含有0.101mol/lkcl、0.013mol/lkh2po4、0.364mol/lnahco3、0.688mol/lnacl、0.002mol/lmgcl2、0.007mol/l(nh4)2co3和0.227mol/lhcl的混合液组成;
所述的组分b由0.03×10-3molcacl2·2h2o和5.4×10-3molhcl溶液组成。
所述的胃蛋白酶优选为猪胃蛋白酶。
所述的人工胃液(sgf)通过如下方法得到:向每100ml组分a中加入组分b,调节体系ph至2.0,然后按4~8mg/ml的比例加入胃蛋白酶,充分溶解后离心,得到的上清液即为人工胃液。
所述的模拟人体对碳水化合物食物的胃部消化过程的条件优选为37℃于300rpm搅拌反应1.5~2.5h;更优选为37℃于300rpm搅拌反应2h。
3)向步骤2)的胃部消化物中加入人工肠液(sif),模拟人体对碳水化合物食物的肠道消化过程,得到肠道消化模拟物;
所述的人工肠液(sif)由组分c和组分d以及胰酶组成;
所述的组分c由含有0.055mol/lkcl、0.006mol/lkh2po4、0.684mol/lnahco3、0.309mol/lnacl、0.003mol/lmgcl、0.126mol/lhcl的混合液组成。
所述的组分d为:0.21×10-3molcacl2·2h2o。
所述的胰酶优选为猪胰酶。
所述的人工肠液中胰酶的添加量优选为4~8mg/ml;更优选为4mg/ml。
所述的人工肠液(sif)的使用方法优选为:每100ml组分c中加入组分d,调节ph至7.0,然后按4~8mg/ml的比例加入胰酶,充分溶解后离心,得到的上清液即为人工肠液(sif)。
所述的模拟人体对碳水化合物食物的肠道消化过程的条件优选为37℃,并于300rpm搅拌反应1.5~2.5h;更优选为37℃于300rpm搅拌反应2h。
步骤(1)中所述的测量待测碳水化合物食物释放还原糖的速率的方法优选为:
将肠道消化模拟物与0.5%(w/v)4-羟基苯甲酰肼密闭混合后,沸水中加热后迅速冷却,然后利用分光光度计或microreadertm亲权鉴定计算软件在410nm下检测吸光度值。依据标准麦芽糖溶液浓度(浓度范围为0.125~1mmol/l)与吸光度之间的线性关系,即可获得待测碳水化合物食物在体外模拟消化反应下各个时间点的还原糖释放量。
所述的0.5%(w/v)4-羟基苯甲酰肼试剂优选通过如下方法制备得到:将4-羟基苯甲酰肼溶解于溶解液中即得,其中溶解液由1倍体积0.5mol/lhcl溶液与9倍体积的0.5mol/lnaoh的混合液混合而成。
所述的肠道消化模拟物与0.5%(w/v)4-羟基苯甲酰肼试剂优选按体积比1:8~12混合;更优选按体积比1:10混合。
所述的标准麦芽糖溶液的浓度优选为0.01~1mmol/l。
所述的加热的条件优选为:100℃加热4~6min;更优选为:100℃加热5min。
步骤(2)中采用体外消化反应动力学方程及数据拟合模型获得相关体外消化试验参数的方法优选为:
s1.依据体外酶消化在各个反应时间点释放的还原糖浓度,制作还原糖释放曲线,并将其转化成为淀粉消化百分比与反应时间构成的消化曲线图;
s2.结合对数斜率法对原始数据进行初步判断,鉴别食物的消化类型:若经对数斜率法判断后只得到单一的消化速率曲线,则该体系为均一体系;若经对数斜率法判断后得到了至少2条独立的消化速率曲线,则该体系为二项或多项消化体系;
s3.根据s2的结果,对均一消化体系的结果,则采用顺序体外消化模型(sequentialkinetics,sk),对多相消化体系则采用顺序/平行混合动力学体外消化模型(combinationofparallelandsequentialkineticsmodel,cps),并同时结合利用规划求解的方式对消化速率曲线进行非线性最小二乘法拟合,得到最优拟合度的还原糖释放曲线,获得一系列体外消化试验参数。
本发明相对于现有技术具有如下的优点及效果:
(1)本发明减少了传统体外测定碳水化合物食物的血糖生成指数的方法中的不合理或非必要步骤,操作更为简单,同时克服了传统技术中存在着的孤点测试无法反应整体消化情况的缺陷。
(2)本发明的体外测定碳水化合物食物血糖生成指数的方法数据分析不过度依赖专业统计软件,大大降低了数据分析的时间,并且数据的准确性可以完全得到保证。
(3)本发明所述方法得到的体外消化参数与gi值的关系,其线性相关性在0.9以上,预测精准度更高。
(4)本发明公开了一种简便高效的体外试验检测技术,以实现对碳水化合物食物的血糖生成指数(glycemicindex,gi)的精准预测。此方法的基础在于利用已知gi的碳水化合物食物作为标准参照物,建立体内gi指数与体外模拟胃肠消化试验(simulatedinvitrogastrointestinaldigestionassay)参数之间的数学函数关联,以实现对待测碳水化合物食物gi指数的精确预测。
(5)本发明是基于食品的理化性质,结合生物化学、食品化学,有机化学和反应动力学模拟等多方面的知识构建而成的全新一代检测技术,可服务于育种工业、食品开发等领域,用以快速检测筛选低血糖生成指数(lowgi)的食品样本。
附图说明
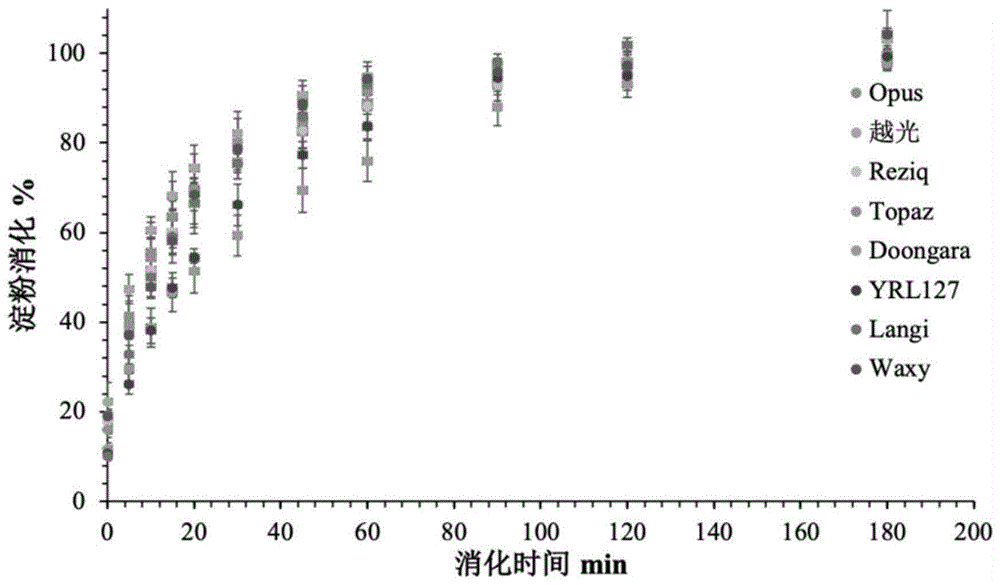
图1为实施例1中包括doogara大米品种在内的各大米淀粉消化百分比与反应时间构成的消化曲线图。
图2为实施例1中以doogara大米品种为例的体外消化数据的拟合结果图;其中,图a为经对数斜率法判断后得到的独立的消化速率曲线图;图b为利用顺序/平行混合动力学体外消化模型(combinationofparallelandsequentialkineticsmodel,cps),同时结合利用规划求解的方式对消化速率曲线进行非线性最小二乘法拟合,得到的最优拟合度的还原糖释放曲线图。
图3为实施例1中已知gi值的大米标准品的gi值与其体外消化参数之间的关系图。
具体实施方式
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
相关试剂的准备与配置:
kcl溶液:0.5mol/l
kh2po4溶液:0.5mol/l
nahco3溶液:1mol/l
nacl溶液:2mol/l
mgcl2·6h2o溶液:0.15mol/l
(nh4)2co3溶液:0.5mol/l
hcl溶液:6mol/l
cacl2·2h2o溶液:0.3mol/l
缓冲液的配置:
模拟唾液(ssf)由以下组分的混合液组成:30.2ml、0.5mol/l的kcl溶液+7.4ml、0.5mol/l的kh2po4溶液+13.6ml、1mol/l的nahco3溶液+1.0ml、0.15mol/l的mgcl2·6h2o溶液+0.12ml、0.5mol/l的(nh4)2co3溶液+0.18ml、6mol/l的hcl溶液。模拟唾液(ssf)中不含有唾液淀粉酶。
所述的人工胃液(sgf)由组分a和组分b以及商业猪胃蛋白酶(p110928-100g,酶活≥400unit/mg,购于sigma公司)。
所述的组分a由0.101mol/lkcl、0.013mol/lkh2po4、0.364mol/lnahco3、0.688mol/lnacl、0.002mol/lmgcl2、0.007mol/l(nh4)2co3和0.227mol/lhcl的混合液组成。
所述的组分b由0.10ml、0.3mol/lcacl2·2h2o和0.90ml、6mol/lhcl溶液组成;
所述的人工胃液(sgf)通过如下方法得到:向100ml组分a中加入组分b,调节体系ph至2.0,然后按4mg/ml的比例加入猪胃蛋白酶,充分溶解后离心,得到的上清液即为人工胃液。
所述的模拟人体对碳水化合物食物的胃部消化过程的条件为:37℃于300rpm搅拌反应2h。
所述的人工肠液(sif)由组分c和组分d以及猪胰酶组成;
所述的组分c由0.055mol/lkcl、0.006mol/lkh2po4、0.684mol/lnahco3、0.309mol/lnacl、0.003mol/lmgcl和0.126mol/lhcl组成的混合液组成。
所述的组分d为0.70ml、0.3mol/lcacl2·2h2o。
所述的人工肠液的使用方法为:向100ml组分c中加入组分d,调节ph至7.0,然后按4mg/ml的比例加入猪胰酶(p7545-100g,购于sigma公司),充分溶解后于4000g转速下离心10min,得到的上清液即为人工肠液(sif)。
所有涉及到的人工胃液、人工肠液、模拟唾液和酶液都需要提前置于37℃水浴中保温。
实施例1
选用已知gi值的7种商业大米(opus大米、reziq大米、doongara大米、langi大米、topaz大米、waxy大米、yrl127大米)作为标准碳水化合物食物,越光米为待测大米品种。
大米总淀粉含量测定:准确称取50g上述8种大米,分别使用粉碎机器(laboratorymill3100,perteninstruments,kungenskurva,sweden)磨碎并过筛(筛孔径500μm),得到大米米粉样品。严格遵守megazymetotalstarchassaykit(megazymek-tsta,wicklow,ireland)之要求,测定各品种大米的总淀粉含量,总淀粉含量测试结果如表1所示。
表1:不同大米品种的gi值及总淀粉含量
一种体外测定碳水化合物食品血糖生成指数的方法,具体包括如下步骤:
(1)通过体外试验模拟人体口腔、胃部和小肠的酶消化反应活动,测量获得待测碳水化合物食物释放还原糖的速率和食物的消化率;
1)对每种大米,各取20粒饱满、完整、无破损的大米颗粒,并准确记录其重量(确保每种大米的重量范围在350~500mg之间即可),且需要根据总淀粉比例(如表1所示)计算转化为总淀粉含量。将已称重的各品种大米分别转移至50ml试剂瓶中,向试剂瓶中加入5.0ml蒸馏水,旋紧瓶盖,于100℃水浴下模拟加热烹饪30min,得到碳水化合物食物样品;随后试剂瓶转入60℃水浴下保存,防止淀粉重结晶;
2)体外试验模拟口腔咀嚼过程:取5.0mlph=7.0的ssf模拟唾液与上述1g碳水化合物食物样品,在37℃水浴下于300rpm磁力转子搅拌30s,得到模拟咀嚼物;
3)模拟胃部消化:取10.0ml人工胃液(sgf)加入步骤2)经体外试验模拟口腔咀嚼过程得到的模拟咀嚼物中,于37℃水浴锅中反应2h,全过程保持磁力搅拌,转速为300rpm,得到胃部消化物。
4)模拟小肠消化:向步骤3)的胃部消化物中加入20.0ml人工肠液(sif)于37℃水浴锅中反应2h,全过程保持磁力搅拌,转速为300rpm,模拟人体对碳水化合物食物的肠道消化过程,得到肠道消化模拟物。
5)模拟小肠消化阶段开始后,分别在0,5min,10min,20min,30min,40min,60min,90min,120min取样,每次取样300μl,将所取样品迅速转移到已提前在80℃加热板上充分预热的2ml带盖离心管(购于eppendorf)中,并迅速盖上盖子,80℃加热10min灭酶,冷却至室温,作为待测样液。
6)消化产物测试:
s1.制备麦芽糖标准溶液:将标准品麦芽糖(m5885,购于sigma公司)溶解(溶解液为5ml水+5mlssf+10mlsgf+20mlsif,与待测物溶液背景完全一致)制备成0~1.0mmol/l标准麦芽糖溶液。
s2.预估待测样液需要稀释的倍数:这里以麦芽糖标准物作为参照,0~1.0mmol/l麦芽糖对应的吸光度最大是0.2~1.5。
s3.配制浓度为0.5%w/v的4-羟基苯甲酰肼(pahbah)试剂:500mgpahbah溶于100ml溶解液中。溶解液是1倍体积0.5mol/lhcl溶液与9倍体积的0.5mol/lnaoh的混合液,现配现用。
s4.分别取1mlpahbah试剂加入到各个2ml塑料管中,每管加入100μl待测样液,密闭混合后,沸水(100℃)中加热5min后用冷水迅速冷却30s,后快速用分光光度计或microreadertm亲权鉴定计算软件在410nm下测量其吸光度值。依据标准麦芽糖溶液浓度(浓度范围为0.125~1mmol/l)与吸光度之间的线性关系,即可获得待测碳水化合物食物在体外模拟消化反应下各个时间点的还原糖释放量。
(2)采用体外消化反应动力学方程及数据拟合模型获得相关体外消化试验参数:
s1.依据体外酶消化在各个反应时间点释放的还原糖浓度,制作还原糖释放曲线,并将其转化成为淀粉消化百分比与反应时间构成的消化曲线图(即:淀粉消化曲线)(如图1所示)。
s2.结合对数斜率法对原始数据进行初步判断,鉴别食物的消化类型:若经对数斜率法判断后只得到单一的消化速率曲线,则该体系为均一体系;若经对数斜率法判断后得到了至少2条独立的消化速率曲线,则该体系为二项或多项消化体系;
结果发现:经对数斜率法判断后得到了2条独立的消化速率曲线(如图2a所示),因此,本消化体系为二项消化体系。
s3.根据s2的结果,对均一消化体系的结果,则采用顺序体外消化模型(sequentialkinetics,sk),对多相消化体系则采用顺序/平行混合动力学体外消化模型(combinationofparallelandsequentialkineticsmodel,cps),并同时结合利用规划求解的方式对消化速率曲线进行非线性最小二乘法拟合,得到最优拟合度的还原糖释放曲线,获得一系列体外消化试验参数;
结果发现:经对数斜率法判断后发现本消化体系为二项消化体系。因此,采用顺序/平行混合动力学体外消化模型(combinationofparallelandsequentialkineticsmodel,cps),并同时结合利用规划求解的方式对消化速率曲线进行非线性最小二乘法拟合,即可得到最优拟合度的还原糖释放曲线(如图2b所示)。
具体地,
淀粉消化百分比(ct%)与消化时间(tmin)之间符合一阶反应动力学模型:
ct=cn∞×(1–e-knt)
其中n代表消化阶段,cn∞代表该消化阶段的可消化淀粉比例,kn(min-1)代表对应的消化速率参数。其对数斜率符合以下线性关系,并可据此画出对数斜率直线图logarithm-of-slope(los)plot。
ln(dct/dt)=-kt+ln[(c∞–c0)k]
分析losplot可知整个大米消化可大致分为先期快速消化(0-20min,消化速率k1)和后倾慢速消化(20-180min,消化速率k2)两个阶段(图2a)。同时依据线性方程斜率可知先期快速消化速率约为0.0564min-1,后期慢速消化速率约为0.0149min-1。考虑到总体消化曲线是由两个消化阶段加和而成(如图2a所示),因此在此分阶段模拟两个阶段的消化曲线。
将消化数据输入microsoftexcel表格中,分别罗列数据如下表所示。此表中c0默认为当t为0min时的原始消化百分比,在此例中为10.56%。在模拟过程中,需要根据losplot的分析结果预先输入大致的5个关键参数数据(k1,k2,c1∞,c2∞和tinterval)。通过excelsolver功能,自动计算出5个自变量参数的最佳数据组合,使作为目标量的“原始数据与模拟数据方差和”最小,从而得到最佳模拟结果(如表2b所示)。在获得最优模拟的参数后,可得到综合模拟方程。对其在0-20min以内的定积分进行计算可得auc-20值。
表2大米品种的体外消化数据拟合结果(以doogara大米为例)
*t-tinterval小于0时,则t-tinterval值默认为0
(3)针对已知gi值的标准碳水化合物食物标准品进行体外消化实验,明确并建立标准样品血糖生成指数gi与体外消化试验参数之间的函数关系;
对表1中的7种大米(opus大米、reziq大米、doongara大米、topaz大米、waxy大米和yrl127大米)的淀粉体外消化曲线进行相同拟合处理,并在0-20min以内,进行定积分计算得到各大米的auc-20值。针对上述7种已知gi值的大米品种,建立大米样品血糖生成指数gi值与体外消化试验参数之间的函数关系,结果如图3。
如图3所示,对于7种大米标样,auc-20作为关键体外消化参数与gi值呈现线性关系,且r2=0.9346。说明本发明所述方法得到的体外消化参数与gi值的关系,其线性相关性在0.9以上,预测精准度更高。
(4)根据待测碳水化合物食物的体外消化参数,通过对比(3)中建立的标准品gi值与其体外消化试验参数之间的函数关系,预测待测样品的血糖生成指数,即gi值。
经体外测试,待测越光大米的消化参数值auc-20为1110,根据图3所示的标准大米品种的体外消化参数与其gi值之间呈现出的线性关系,估计待测越光大米的gi值约为93。
本发明所述方法测定的gi值结果与太阳米公司提供的越光大米gi值90一致,误差在4%以内,说明本发明的方法是准确可信的。
米饭是我国最重要的主食之一。米饭中淀粉质量浓度可以达到90%,是含量最高的成分。研究已发现,米饭中淀粉的快速水解是引起餐后人体内血糖浓度升高的最重要因素之一。开发一种低gi大米因此对与维持国民健康具有重要的意义。相比于体内消化测试的耗时长、重复性较差以及经济投入大相比。通过本发明所述的操作方法,在模拟体内消化的基础上,既可以通过简单的体外消化测试以及体内—体外消化数据之间的内在关联,我们可以快速鉴定不同品种米饭的gi值,为水稻育种、种植以及大米生产企业提供指导依据。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!