一种瑞舒伐他汀钙制剂有关物质的检测方法与流程
1.本发明属于医药技术领域,涉及一种药物的分析检测方法,特别是对瑞舒伐他汀钙制剂的有关物质的检测方法。
背景技术:
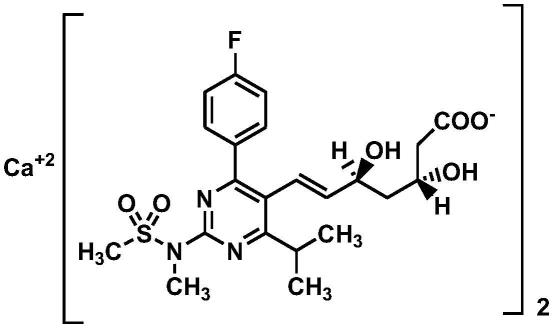
2.瑞舒伐他汀钙,英文名称为rosuvastation calcium,化学名称为双-[(e)-7-[4-(4-氟基苯基)-6-异丙基-2-[甲基(甲磺酰基)氨基]-嘧啶-5-基](3r,5s)-3,5-二羟基庚-6-烯酸]钙盐(2:1),分子式为c22h27fn3o6s)2
·
ca,分子量为1001.1,cas号为147098-20-2,化学结构式如下:
[0003][0004]
瑞舒伐他汀钙由盐野义(shionogi)与阿斯利康(az)联合研发,之后于2003年8月12日获美国食品药品管理局(fda)批准上市,于2005年4月27日获日本医药品医疗器械综合机构(pmda)批准上市,于2007年4月27日在中国上市,商品名为为瑞舒伐他汀是一种选择性hmg-coa还原酶抑制剂。hmg-coa还原酶抑制剂是转变3-羟基-3-甲基戊二酰辅酶a为甲戊酸盐-胆固醇的前体-的限速酶。瑞舒伐他汀的主要作用部位是肝-降低胆固醇的靶向器官。瑞舒伐他汀增加了肝ldl细胞表面受体数目,促进ldl的吸收和分解代谢,抑制了vldl的肝合成,由此降低vldl和ldl微粒的总数。适用于经饮食控制和其他非药物治疗(如:运动治疗、减轻体重)仍不能适当控制血脂异常的原发性高胆固醇血症(ⅱa型,包括杂合子家族性高胆固醇血症)或混合性血脂异常症(ⅱb型)。也适用于纯合子家族性高胆固醇血症的患者,作为饮食和其他降脂措施(如ldl去除疗法)的辅助治疗,或在这些方法不适用时使用。
[0005]
新药或仿制药研发,杂质是影响产品的关键质量属性,杂质的结构、理化性质和毒性情况复杂,因此有关物质检查常常是产品研发中的难点之一。药品在临床中产生的不良反应除了与主成分的药理活性有关外,与药品中存在的杂质也有很大关系。为保证临床用药的安全性,需要严格控制药品的杂质。由于瑞舒伐他汀钙在合成过程中有可能引入工艺杂质,在制剂的贮藏或运输过程中还有可能产生降解产物,因此实现瑞舒伐他汀钙及其主要杂质的分离和检测具有非常重要的意义。
[0006]
瑞舒伐他汀钙在高温、高湿、光照、酸等环境中,极易发生降解,生成非对映异构
体、氧化产物、内酯化物以及光降解产物1和光降解产物2等杂质。其杂质化学名称及结构式见表1。
[0007]
表1杂质信息
[0008]
[0009][0010]
目前,有一些针对瑞舒伐他汀钙有关物质的hlpc检测方法,云冲、朱峰、王玉娟《一种检测瑞舒伐他汀钙有关物质的方法》中提到采用主成分自身对照法计算各有关物质的含量。相比之下,本方法采用加校正因子的主成分自身对照法,使得结果更加准确。
[0011]
检测条件如下:
[0012]
色谱柱:岛津vp-ods 150
×
4.6mm;
[0013]
流动相a:0.01%三氟醋酸的乙腈溶液;
[0014]
流动相b:0.01%三氟醋酸的水溶液;
[0015]
流速:1.0ml/min;
[0016]
检测波长:242nm;
[0017]
进样量:20ul;
[0018]
柱温:30℃;
[0019]
梯度洗脱条件为:
[0020][0021]
在该检测方法下各杂质的检测限度分别是瑞舒伐他汀钙:2.5ng;n-甲基瑞舒伐他汀酰胺:16.0ng;非对映异构体:3.0ng;氧化降解产物:6.0ng;内酯化产物:6.5ng。各杂质检测限度仍较高且未有定量限的数据;未对光降解产物1、光降解产物2进行检测限的确定。上述方法在检出能力上存在不足,特别是未对校正因子进行确定,无法准确有效的检出低含量的杂质。因此,建立一种检出限更低的hlpc方法对瑞舒伐他汀钙制剂进行质量控制是非常重要的。
技术实现要素:
[0022]
为保证瑞舒伐他汀钙制剂的质量可控,确保其产品的有效性和安全性,本发明人建立一种专属性强、准确度高、重现性好、简便实用的瑞舒伐他汀钙制剂有关物质的检测方法。
[0023]
本发明通过以下技术方案实现:
[0024]
采用反相高效液相色谱法,以十八烷基硅烷键合硅胶为色谱柱填料,采用紫外检测器,采用梯度洗脱程序,流动相a为0.01%三氟乙酸水溶液-乙腈,流动相b为0.01%三氟乙酸水溶液-乙腈,采用加校正因子的主成分自身对照法检测各有关物质的含量及总杂含量。各杂质的含量(%)=(ru/rs)
×
(cs/cu)
×f×
100
[0025]
ru:样品溶液中各杂质的峰面积;
[0026]
rs:对照溶液中主成分的峰面积;
[0027]
cs:对照溶液中主成分的浓度(mg/ml);
[0028]
cu:样品溶液中主成分的浓度(mg/ml);
[0029]
f:相对校正因子。
[0030]
所述流动相a为0.01%三氟乙酸水溶液-乙腈的混合溶液,二者体积比为70:30;所述流动相b为0.01%三氟乙酸水溶液-乙腈的混合溶液,二者体积比为25:75。
[0031]
所述检测方法的梯度洗脱条件为:
[0032][0033]
更优选的,梯度洗脱条件如下:
[0034][0035]
所述检测方法以十八烷基硅烷键合硅胶为色谱柱填料,优选为inertsil ods-3,规格为3.0mm
×
150mm,3μm。
[0036]
所述检测方法的检测波长为230nm-250nm,优选为242nm。
[0037]
所述检测方法的流速为0.6-1.0ml/min,优选为0.75ml/min。
[0038]
所述检测方法的进样量为5-20ul,优选为10ul。
[0039]
所述检测方法的柱温为30-50℃,优选为40℃。
[0040]
所述检测方法的溶剂为乙腈-水(15~30:85~70),优选为25:75。
[0041]
所述检测方法采用加校正因子的主成分自身对照法检测各有关物质的含量及总杂含量,优选条件采用标准曲线法测定各杂质的相对校正因子。
[0042]
所述检测方法的样品配制方法为:称取瑞舒伐他汀钙制剂粉末适量,加溶剂超声使溶解并定量稀释制成每1ml中含瑞舒伐他汀0.7mg的溶液。
[0043]
本发明的检测方法既确定了各杂质的校正因子,又能准确、高效的检测出各杂质的量,该方法较现有技术公开的方法灵敏度更高,检测限更低使得杂质的含量检测更加准确,从而能更有效控制瑞舒伐他汀钙制剂的质量。
附图说明
[0044]
图1瑞舒伐他汀钙有关物质对照品混合溶液色谱图。
[0045]
图2瑞舒伐他汀钙制剂未破坏色谱图。
[0046]
图3瑞舒伐他汀钙制剂酸破坏色谱图。
[0047]
图4瑞舒伐他汀钙制剂碱破坏色谱图。
[0048]
图5瑞舒伐他汀钙制剂氧化破坏色谱图。
[0049]
图6瑞舒伐他汀钙制剂高温破坏色谱图。
[0050]
图7瑞舒伐他汀钙制剂光照破坏色谱图。
[0051]
图8系统适用性色谱图。
[0052]
图9瑞舒伐他汀钙制剂供试品色谱图。
具体实施方式
[0053]
本发明实施例公开了一种检测瑞舒伐他汀钙制剂有关物质的检测方法。本领域技术人员可以借鉴本文内容,适当改进相关参数实现。特别需要指出的是,所有类似的替换和改动对领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法已经通过较佳实施例进行了描述,相关人员明显能在不脱离本
技术实现要素:
、经审核范围内对本文所述的产品及方法进行改动或适当变更与组合来实现和应用本发明技术,均视为包括在本发明内。
[0054]
具体实施例方式中,所用各试剂、药品、试验环境等在未经特殊说明下,均来源相同或一致。
[0055]
色谱方法的方法学验证
[0056]
1.有关物质专属性试验
[0057]
取杂质对照品a、b、c、d、e、f及瑞舒伐他汀钙适量,精密称定,加稀释液超声使溶解,并稀释制成每1ml中分别含杂质a、e、f约140μg/ml、b约350μg/ml和c、d约150μg/ml、瑞舒伐他汀约100mg/ml的溶液作为各杂质对照品储备液。分别依次精密量取杂质a、b、e、f对照品储备液各100μl,杂质c、d对照品储备液各700μl及瑞舒伐他汀钙对照品储备液140μl置10ml量瓶中,用稀释液稀释至刻度,摇匀,即得。
[0058]
取上述溶液10ul注入液相色谱仪,记录色谱图。瑞舒伐他汀与各杂质分离度结果见下表2,图谱见图1:
[0059]
表2对照品混合溶液
[0060]
名称保留时间相对保留时间分离度杂质a21.6550.90-主成分24.1061.003.3杂质b26.9191.123.4杂质c38.1581.5816.1杂质d43.4231.804.9杂质e39.1991.632.1杂质f41.4041.724.9
[0061]
结果显示:瑞舒伐他汀钙各有关物质和主成分之间,各有关物质之间能达到良好
的分离。
[0062]
2.破坏试验
[0063]
取瑞舒伐他汀钙制剂适量,在强碱、强酸、高温、光照、氧化等条件下分别对其进行破坏试验,进样并记录色谱图,统计被破坏出杂质情况,破坏试验杂质变化情况结果见下表3~8,图谱见3~8:
[0064]
表3瑞舒伐他汀钙制剂未破坏杂质分析结果
[0065][0066][0067]
表4瑞舒伐他汀钙制剂酸破坏试验结果
[0068]
相对保留时间1.121.591.791.82λ
max
(nm)241.3256.7;292.4242.5242.5杂质(%)0.220.190.2610.41归属杂质b杂质c/杂质d
[0069]
表5瑞舒伐他汀钙制剂碱破坏试验结果
[0070]
相对保留时间1.122.24λ
max
(nm)242.5254.3;293.6杂质(%)0.130.14归属杂质b/
[0071]
表6瑞舒伐他汀钙制剂氧化破坏试验结果
[0072]
相对保留时间0.770.801.591.81λ
max
(nm)235.4;285.2235.4;285.2255.5;294.8242.5杂质(%)0.910.470.380.40归属//杂质c杂质d
[0073]
表7瑞舒伐他汀钙制剂高温破坏试验结果
[0074]
相对保留时间1.121.581.802.41λ
max
(nm)241.3255.5;294.8242.5246.1;300.7杂质(%)0.080.840.510.23归属杂质b杂质c杂质d/
[0075]
表8瑞舒伐他汀钙制剂光破坏试验结果
[0076]
相对保留时间1.591.631.72λ
max
(nm)256.7313.8312.6杂质(%)0.331.741.71归属杂质c杂质e杂质f
[0077]
结论:瑞舒伐他汀钙制剂杂质b主要在酸性条件下降解产生,杂质c在紫外光、氧化
及高温条件下均可降解产生,杂质d在酸、氧化及高温条件下均可降解产生,但酸性条件下较易降解;杂质e、f在紫外光下可降解产生。且主峰与其相邻的杂质峰能较好分离,主峰纯度角度《纯度阈值,主峰纯度符合要求,证明该方法专属性强。
[0078]
3.线性试验
[0079]
精密量取瑞舒伐他汀钙及各有关物质,用乙腈-水(25:75)溶解并稀释,配成不同浓度的溶液分别进样,以浓度为横坐标,峰面积为纵坐标,得到瑞舒伐他汀钙及各有关物质的线性回归方程,
[0080]
杂质a线性结果见表9:
[0081]
表9杂质a线性与范围试验结果
[0082][0083]
杂质b线性结果见表10:
[0084]
表10杂质b线性与范围试验结果
[0085][0086]
杂质c线性结果见表11:
[0087]
表11杂质c线性与范围试验结果
[0088][0089]
杂质d线性结果见表12:
[0090]
表12杂质d线性与范围试验结果
[0091][0092][0093]
杂质e线性结果见表13:
[0094]
表13质e线性与范围试验结果
[0095][0096]
杂质f线性结果见表14:
[0097]
表14杂质f线性与范围试验结果
[0098][0099]
瑞舒伐他汀钙线性结果见表15:
[0100]
表15瑞舒伐他汀钙线性与范围试验结果
[0101][0102]
结论:杂质a在0.14μg/ml~2.151μg/ml(相当于供试品溶液0.020%~0.31%)范围内;杂质b在0.36μg/ml~5.351μg/ml(相当于供试品溶液0.051%~0.76%)范围内;杂质c在0.91μg/ml~12.99μg/ml(相当于供试品溶液0.13%~1.86%)范围内;杂质d在1.20μg/ml~17.11g/ml(相当于供试品溶液0.17%~2.44%)范围内;杂质e在0.14μg/ml~2.14μg/
ml(相当于供试品溶液0.020%~0.31%)范围内;杂质f在0.15μg/ml~2.21μg/ml(相当于供试品溶液0.021%~0.31%)范围内;瑞舒伐他汀钙在0.79g/ml~11.79μg/ml(相当于供试品溶液0.11%~1.68%)范围内线性关系良好。
[0103]
4.校正因子
[0104]
根据线性与范围试验项下瑞舒伐他汀钙及各杂质标准曲线的斜率计算各杂质的校正因子,试验结果见表16。
[0105]
表16瑞舒伐他汀钙片各杂质校正因子计算结果
[0106]
成分瑞舒伐他汀钙杂质a杂质b杂质c杂质d杂质e杂质f斜率27746277002691420069325741738719478校正因子—1.001.031.380.861.601.42
[0107]
最终确定各杂质校正因子的结果见表17。
[0108]
表17瑞舒伐他汀钙片各杂质校正因子
[0109]
杂质杂质a杂质b杂质c杂质d杂质e杂质f校正因子1.01.01.41.01.61.4
[0110]
5.准确度试验
[0111]
杂质对照品溶液:分别依次精密量取杂质a、b、e、f对照品储备液各100μl,杂质c、d对照品储备液700μl置同一10ml量瓶中,用稀释液稀释至刻度,摇匀,作为杂质对照品溶液。
[0112]
空白校正溶液:取本品粉末适量(约相当于瑞舒伐他汀7mg),精密称定,置10ml量瓶中,加稀释液适量超声使瑞舒伐他汀钙溶解,用稀释液稀释至刻度,摇匀,作为空白校正溶液。
[0113]
供试品溶液:取本品适量(约相当于瑞舒伐他汀7mg),精密称定,置10ml量瓶中,加稀释液适量超声溶解,然后分别依次精密量取杂质a、b、e、f对照品储备液各20μl,杂质c、d对照品储备液各140μl置上述10ml量瓶中,用稀释液稀释至刻度,摇匀,作为低浓度溶液(20%),同法制备中浓度溶液(100%)、高浓度溶液(150%),每个浓度同法配制3份。分别精密量取上述各溶液10μl,依法测定,按外标法以峰面积计算回收率,并计算相对标准偏差,结果见表18。
[0114]
表18杂质a、b、c、d、e、f回收率试验结果
[0115]
[0116][0117]
由结果可见,本法测定各杂质的回收率较高,准确度较好。
[0118]
为了进一步理解本发明,下面结合实施例对本发明提供的一种运用高效液相色谱法检测瑞舒伐他汀钙制剂有关物质的方法进行详细说明。
[0119]
实施例1检测限与定量限
[0120]
仪器:waters acq-2998
[0121]
色谱柱:inertsil ods-3 3.0
×
150mm,3um
[0122]
流动相a:0.01%三氟乙酸水溶液-乙腈(70:30)
[0123]
流动相b:0.01%三氟乙酸水溶液-乙腈(25:75)
[0124]
检测波长:242nm;
[0125]
流速:0.75ml/min;
[0126]
进样量:10ul;
[0127]
柱温:40℃;
[0128]
稀释液:乙腈-水(25:75)
[0129]
梯度洗脱条件:
[0130][0131]
[0132]
检测限、定量限溶液:采用信噪比法测定瑞舒伐他汀钙及其各有关物质的检测限和定量限。取表1中各杂质适量用稀释剂定量稀释制成适宜浓度后进样,其信噪比约为10的样品检测量即为定量限,信噪比约为3的样品检测量即为检测限,定量限及检测限实验结果见下表19、20;定量限、检测限图谱见图1、图2.
[0133]
表19检测限试验结果
[0134]
组分名称杂质a杂质b杂质c杂质d杂质e杂质f瑞舒伐他汀s/n3.058.522.6710.444.244.886.02检测限0.72ng1.78ng0.45ng0.60ng0.72ng0.74ng0.73ng相当于供试品(%)0.0100.0260.00640.00860.0100.0110.010
[0135]
表20定量限试验结果
[0136]
组分名称杂质a杂质b杂质c杂质d杂质e杂质f瑞舒伐他汀s/n3.058.522.6710.444.244.886.02定量限1.43ng3.57ng1.78ng1.15ng1.42ng1.47ng1.50ng相当于供试品(%)0.0200.0510.0260.0170.0200.0210.021
[0137]
结论:各杂质检测限、定量限均符合测定要求,本方法灵敏度较高。能够更加准确、有效的检测出各杂质。
[0138]
实施例2系统适用性试验
[0139]
仪器:waters acq-2998;
[0140]
色谱柱:inertsil ods-3 3.0
×
150mm,3um;
[0141]
流动相a:0.01%三氟乙酸水溶液-乙腈(70:30);
[0142]
流动相b:0.01%三氟乙酸水溶液-乙腈(25:75);
[0143]
检测波长:242nm;
[0144]
流速:0.75ml/min;
[0145]
进样量:10ul;
[0146]
柱温:40℃;
[0147]
稀释液:乙腈-水(25:75);
[0148]
梯度洗脱条件:
[0149]
[0150]
系统适用性溶液配制:
[0151]
取瑞舒伐他汀钙对照品约7mg,置10ml量瓶中,加稀释液1ml,再加1%三氟乙酸乙腈溶液1ml,密塞,于60℃水浴中加热60分钟,放冷,加水2ml,用0.1mol/l的氢氧化钠溶液中和至ph6~8,并精密量取杂质c、d对照品储备液{分别取杂质c、d对照品适量,加稀释液[乙腈-水(1:1)]溶解并稀释制成每1ml中含杂质c、d约1mg的对照品储备液}1ml,置上述10ml量瓶中,用稀释液稀释至刻度,摇匀,作为系统适用性溶液。
[0152]
量取上述系统适用性试验溶液10ul注入液相色谱仪,按本实施例色谱条件进行测定,记录色谱图,结果见图8。结果显示,系统适用性试验溶液中各杂质峰与主峰之间、杂质与杂质之间的分离度均大于1.5,且峰型较好,符合要求。
[0153]
实施例3瑞舒伐他汀钙制剂有关物质的检测
[0154]
避光操作。取参比制剂(厂家:阿斯利康,规格:10mg)细粉适量,用稀释液[乙腈-水(25:75)]溶解并稀释制成每1ml中约含瑞舒伐他汀0.7mg的溶液,摇匀,滤过,取续滤液作为供试品溶液;精密量取适量,用稀释液定量稀释制成每1ml中约含瑞舒伐他汀1.4μg的溶液,作为自身对照溶液;配制各杂质的对照品溶液,其他条件同实施例1。供试品溶液和自身对照溶液及杂质对照品混合溶液的液相色谱图见说明书附图9,瑞舒伐他汀钙制剂有关物质检测结果见表21。
[0155]
表21瑞舒伐他汀钙片有关物质测定结果
[0156][0157][0158]
由试验结果可知,加校正因子主成分自身对照法和外标法测定已知杂质结果无明显差异,由于外标法采用杂质对照品,不经济、实用,为方便后期检测,我们采用加校正因子的主成分自身对照法检查本品的有关物质。
[0159]
实施例4耐用性试验
[0160]
通过改变有关物质检查方法的色谱条件,对本方法的耐用性进行考察,具体内容如下:
[0161]
4.1标准条件,如实施例1所述,检测结果见表22。
[0162]
4.2更换色谱柱(waterst3),其他色谱条件如实施例1所述,检测结果见表22。
[0163]
4.3改变柱温:35℃,其他色谱条件如实施例1所述,检测结果见表22。
[0164]
4.4改变柱温:45℃,其他色谱条件如实施例1所述,检测结果见表22。
[0165]
4.5改变流速:0.7ml/min,其他色谱条件如实施例1所述,检测结果见表22。
[0166]
4.6改变流速:0.8ml/min,其他色谱条件如实施例1所述,检测结果见表22。
[0167]
供试品溶液:瑞舒伐他汀钙制剂与杂质对照品混合溶液。
[0168]
表22耐用性试验结果
[0169][0170][0171]
由上表可见,改变流速、柱温、波长以及更换色谱柱等各条件下检测的结果无明显差异。所以色谱条件中流速、柱温、波长等参数在本发明的范围内波动,不会对检测结果产生显著影响,证明本检测方法耐用性好。
[0172]
对比实施例1系统适用性试验
[0173]
仪器:waters acq-2998
[0174]
色谱柱:inertsil ods-3 3.0
×
150mm,3um
[0175]
流动相a:0.03%三氟乙酸水溶液-乙腈(60:40)
[0176]
检测波长:242nm;
[0177]
流速:1.0ml/min;
[0178]
进样量:10ul;
[0179]
柱温:40℃;
[0180]
稀释液:乙腈-水(25:75)
[0181]
系统适用性溶液配制:同实施例2中系统适应性溶液。
[0182]
结果显示系统溶液中各有关物质未能有效分离,且峰型较差。
[0183]
对比实施例2系统适用性试验
[0184]
仪器:waters acq-2998
[0185]
色谱柱:inertsil ods-3 3.0
×
150mm,3um
[0186]
流动相:0.05%三氟乙酸水溶液-甲醇(75:25)
[0187]
检测波长:242nm;
[0188]
流速:1.0ml/min;
[0189]
进样量:10ul;
[0190]
柱温:40℃;
[0191]
稀释液:乙腈-水(25:75)
[0192]
系统适用性溶液配制:同实施例2中系统适应性溶液。
[0193]
结果显示系统溶液中各有关物质未能有效检出。
[0194]
综上所述,本发明中所使用的液相检测方法,该方法较现有技术公开的方法灵敏度更高,检测限更低且确定了各杂质的校正因子,使得杂质的含量检测更加准确,从而能更有效控制产品质量。本方法耐用性良好,操作简便,适于工业化应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1