用于电化学方法检测肌酐的电极、试纸及其制备方法
1.本发明涉及一种对临床样本进行分析测试用的材料,具体涉及一种用于电化学检测肌酐的电极、试纸,及其制备方法。
背景技术:
2.目前,全世界患有肾脏疾病的人,特别是慢性肾脏疾病(ckd)的人,日益增多。2017 年,全球疾病、创伤及危险因素负担(gbd)研究估计全球ckd流行率为9.1%。1990年至 2017年间,全球各年龄段的ckd死亡率增加了41.5%。伴随着高发病率和高死亡率,ckd 给全球经济带来了巨大的负担。因此,定期监测肾功能,避免肾功能损伤发展到不可逆的程度是非常必要的。
3.肌酐是临床工作中最常用的肾功能监测指标。肌酐(2
‑
氨基
‑1‑
甲基
‑
5h
‑
咪唑
‑4‑
酮)是肌肉和蛋白质代谢产生的磷酸肌酸的化学废代谢物。在人体中,内源性肌酐是由肌肉组织产生的,外源性肌酐主要来自饮食中肉类的代谢。在正常情况下,我们日常生活中的肌酐产生量是相对稳定的,几乎所有的肌酐都是通过肾脏过滤并释放到尿液中的。因此,血清肌酐(scr)水平会保持在稳定的范围内,约为44
‑
106μmol/l。当肾脏功能发生障碍、肌酐排泄能力受损时,肌酐浓度将超过生理范围的上限。在早期阶段,肾病患者不会感到不适,但是scr水平的异常会引起医生的注意。因此,scr水平通常被认为是检测肾功能不全的一个重要的生物标志物。
4.现有技术中,已有一系列定量测定肌酐的方法。传统的方法主要有jaffe反应法和酶法。 jaffe反应快速、经济,但容易受到血清中酮、葡萄糖等干扰性色原的影响,使其有时不准确。因此酶法被认为是更优的方法。使用生物酶的确可以大大提高检测的准确性和效率。尽管酶法比jaffe反应对患者的经济负担更重,但更高的特异性让使用酶法检测肌酐逐渐成为医院临床检测的主流手段。然而,对于不方便到医院但又需要定期检查肾功能的患者来说,现有的这两种肌酐检测方法都是不容易实现的。
5.说到健康状况的日常监测,基于poct的血糖仪无疑给人留下了最深刻的印象。遗憾的是,没有像血糖仪这样的智能设备在世界范围内被广泛接受。生物传感器是一种将生物材料的浓度转化为电信号的电化学检测技术。与传统的测量方法相比,生物传感器具有测量时间短、操作简单、灵敏度高、选择性好等优点。因此,使用生物传感器通过电化学法检测肌酐被认为是一种有前途的肌酐检测替代方法。
6.现有技术中对于电化学法检测肌酐的方法及其所用材料已有一些公开。例如美国雅培护理点公司的i
‑
sata光学和电学检测设备包含了执行电化学检测肌酐的组件,但该设备和组件机构复杂,造价昂贵,不适合普通患者使用,不能满足居家随检的快速、便捷的需求。另外,还有一些现有产品存在抗干扰能力差,检测结果准确度和灵敏度都不高的缺点。
7.由于机体血液成分复杂,肌酐的电化学检测结果很容易受到血液中其他非目标物质的干扰。为了降低这种干扰带来的检测误差,现有技术中有很多测试材料设置了血液过滤装置,目的在于在发生电化学反应前滤去血液中容易产生干扰的非目标物质。但是实践
中发现,现有技术中设置的血液过滤装置不仅使传感器造价高、工艺复杂,而且仍无法有效地避免血液中肌酸对肌酐检测带来的干扰。
8.因此,有必要提供一种结构简单、造价低,同时能够精准定量检测血液肌酐的电化学电极及试纸,使肾病关键指标也能够实现居家自我监测。
技术实现要素:
9.鉴于上述背景,本发明的首要目的在于:提供一种电化学法检测肌酐的电极,具有灵敏度高、抗干扰性强、性能稳定、结构简单、体积小、造价低等综合优势。
10.本发明的另一个目的在于:提供一种包含本发明所述电极的可用电化学法检测肌酐的试纸,可以用于临床或居家的快速、便捷检测。
11.本发明的再一个目的在于:提供制备所述电极和试纸的方法,具有用料少、精度高、成本低等综合优势,适合产业化制造和推广。
12.本发明的上述目的通过以下技术方案实现:
13.第一个方面,本发明提供一种用于电化学法检测肌酐的电极,包括电极材料基础层;所述的电极材料基础层外表面覆有电子介体增强层;所述的电子介体增强层外表面固定有可与肌酐反应生成过氧化氢的酶组合物。
14.本发明所述的电极方案中,所述的电极材料基础层的材料可以是现有的各种可用于制作氧化还原电极的材料组合物,包括各种含惰性金属材料的组合物(例如铂电极材料、金电极材料或汞电极材料)或者含碳电极材料的组合物,等等。所述的材料组合物中可以含有或不含电子介体成分。
15.本发明优选的方案中,所述的电极材料基础层是以碳电极材料为主的组合物,所述的碳电极材料可以选自石墨、碳糊或玻碳中的任意一种;最优选碳糊或石墨。本发明进一步优选的方案中,所述的以碳电极材料为主的组合物还含有电子介体,所述的电子介体可以选自普鲁士蓝、亚甲基蓝、二茂铁或其衍生物、或铁氰化钾等;最优选普鲁士蓝。
16.本发明所述的电极中,所述的可与肌酐反应生成过氧化氢的酶组合物优选肌酐酶(ca)、肌酸酶(ci)和肌氨酸氧化酶(so)的组合物;进一步优选的方案中,所述的肌酐酶、肌酸酶和肌氨酸氧化酶的比例为:3.75
‑
6.25:1.25
‑
2:0.75
‑
1.25;更优选的比例为4
‑
5.5:1.75
‑
2: 1.0
‑
1.25;最优选的比例为4
‑
5:2:1.25。
17.更进一步优选的方案中,所述的电极表面,所述的肌酐酶载量为0.5
‑
0.85u/mm2、肌酸酶载量为0.15
‑
0.28u/mm2、且肌氨酸氧化酶载量为0.1
‑
0.15u/mm2。
18.第二个方面,本发明提供一种可利用电化学法检测肌酐的试纸,所述的试纸包括绝缘底板,所述的绝缘底板表面设有电极组和电路;所述的电极组至少由工作电极、对电极和参比电极组成,所述的工作电极为本发明第一个方面所述的用于电化学法检测肌酐的电极;所述的电路包括所述工作电极与对电极之间、以及所述工作电极与参比电极之间形成的回路。
19.本发明所述的试纸作为电化学生物传感器的工作原理是:检测时按照常规方法加样后,样本中的肌酐会与固定在工作电极上的酶组合物发生系列反应,肌酐经肌酐酶分解为肌酸,肌酸在肌酸酶和肌氨酸氧化酶作用下生成过氧化氢,过氧化氢被电子介体增强层的电子介体催化还原,电子被传递到所述工作电极的电极材料基础层上,产生还原电流,根
据电流响应值与样本中肌酸的浓度关系,可以得知样本的肌酸含量。用本发明所述试纸检测肌酐时,检测样本可以是全血、血浆、血清、尿液等等各种形式。
20.本发明所述的试纸中,对于所述的绝缘底板的具体材料、规格及形状没有特别的限制。所述的绝缘底板材料优选绝缘纸、塑料、橡胶等具有疏水表面的材料;所述的塑料进一步优选pet、pvc、pe或pp中的任意一种。所述的绝缘底板的规格可以根据需要制造成不同厚度和大小。所述的绝缘底板的形状可以是实际测量时应用场景可接受的任意形状。
21.本发明所述的试纸中,所述的电极组中的各电极,具体形状和规格没有特别的限制,在可以实现有效的电化学法检测的前提下,各电极可以制作成各种可以接受的形状,例如电极横截面可以呈长方形、圆形或其他任意形状。
22.本发明所述的试纸中,所述的对电极的材料优选与所述工作电极的电极材料基础层相同;所述的参比电极可以由现有的多种适合作为参比电极的材料制得,优选的参比电极是银
‑
氯化银电极。
23.在本发明的一种实施方式中,所述的电极组可以仅由一个工作电极、一个对电极和一个参比电极构成,所述的一个工作电极是本发明所述的用于电化学法检测肌酐的电极。该试纸可以作为单独检测一份样本中肌酐含量的电化学传感器,用于简易、便携的肌酐检测设备中,适合于肾病患者的居家自我监测。
24.第三个方面,本发明提供一种用于电化学检测肌酐的生物传感器,包括绝缘底板,所述的绝缘底板表面固定连接有电极组、导线和加样腔;所述的加样腔由四周的绝缘材料墙和中间的镂空区构成;所述的电极组主体处于所述镂空区范围内,所述的电极组至少由工作电极、对电极和参比电极组成,所述的工作电极为本发明第一个方面所述的用于电化学法检测肌酐的电极;所述的导线包括分别与所述工作电极、对电极和参比电极连接的金属导线,用于将所述的各电极与外设的电位检测设备电连接。
25.使用本发明所述的生物传感器检测血液肌酐水平时,将生物传感器的导线与外设的电位检测设备连通,将采集的血样以合适剂量滴加至所述加样腔的镂空区,其四周的绝缘材料墙可以将样品液滴限制在镂空区内与电极充分接触。样本中的肌酐与工作电极上的酶组合物反应生成过氧化氢,过氧化氢被所述工作电极上的电子介体增强层的电子介体催化还原,由此将酶组合物活性中心的电子转移至电极材料基础层,在工作电极上产生还原电流,电位检测设备通过参比电极测量电位,电流响应值大小在一定范围内与血液肌酐水平相关,从而根据电流检测结果推算得到相应肌酐水平。
26.本发明所述的生物传感器中,对于所述的绝缘底板的具体材料、规格及形状没有特别的限制。所述的绝缘底板材料优选绝缘纸、塑料、橡胶等具有疏水表面的材料;所述的塑料进一步优选pet、pvc、pe或pp中的任意一种。所述的绝缘底板的规格可以根据需要制造成不同厚度和大小。所述的绝缘底板的形状可以是实际测量时应用场景可接受的任意形状。
27.本发明所述的生物传感器中,所述的电极组中的各电极,具体形状和规格没有特别的限制,在可以实现有效的电化学法检测的前提下,各电极可以制作成各种可以接受的形状,例如电极横截面可以呈长方形、圆形或其他任意形状。所述的对电极的材料优选与所述工作电极的电极材料基础层相同;所述的参比电极可以由现有的多种适合作为参比电极的材料制得,优选的参比电极是银
‑
氯化银电极。
28.本发明所述的生物传感器中,所述的导线可以是各种金属导电材料,优选铜导线。
29.本发明所述的生物传感器中,所述的加样腔的绝缘材料墙可以选择由多种现有的绝缘材料,优选热熔胶。
30.第四个方面,本发明还提供制备本发明所述的电极和试纸的方法。
31.制备本发明第一个方面所述的一种电极的方法,包括:
32.1)以含有电子介体的碳浆料形成电极材料基础层并干燥;
33.2)在1)所得的电极材料基础层上表面设置一层电子介体增强层并干燥;
34.3)在2)所得的电子介体增强层表面固定酶组合物;所述的酶组合物是肌酐酶、肌酸酶和肌氨酸氧化酶的组合物;进一步优选的所述酶组合物中,所述的肌酐酶、肌酸酶和肌氨酸氧化酶的比例为:3.75
‑
6.25:1.25
‑
2:0.75
‑
1.25;优选的比例为4
‑
5.5:1.75
‑
2:1.0
‑
1.25;最优选的比例为4
‑
5:2:1.25;得到酶修饰的电极,即所述的用于电化学法检测肌酐的电极。
35.本发明优选的制备所述电极的方法中,1)所述的以含有电子介体的碳浆料形成电极材料基础层,是将所述的碳浆料基于预先设计的网版通过丝网印刷打印在可接受的表面形成所述电极材料基础层。
36.本发明进一步优选的制备所述电极的方法中,1)所述的含有电子介体的碳浆料是掺杂普鲁士蓝的碳糊。
37.本发明优选的制备所述电极的方法中,2)所述的电子介体增强层的设置是通过电沉积的方法将电子介体修饰在所述电极材料基础层表面,形成所述的电子介体增强层。
38.更优选的方案中,所述的电子介体是普鲁士蓝,且所述的电沉积法具体包括:
39.将1)所述的电极材料基础层浸泡在fecl3和k3[fe(cn)6]的混合物中,扫描速度控制在 10
‑
30mv/s、扫描电压控制在
‑
0.15v
‑
0.3v,持续扫描4
‑
20个循环,优选8
‑
16个循环,最优选 8
‑
10个循环;然后在kcl和hcl的混合溶液中,以40
‑
60mv/s的扫描速度、在
‑
0.2
‑
0.5v的电压范围内进一步扫描持续4
‑
20个循环,优选8
‑
16个循环,最优选8
‑
10个循环。
[0040]
本发明优选的制备所述电极的方法中,3)所述的酶组合物的固定通过戊二醛交联方式完成;进一步优选通过以下方式完成:
[0041]
3.1)将肌酐酶、肌酸酶和肌氨酸氧化酶溶于中性缓冲液,得到混合酶液;控制所述混合酶液中肌酐酶、肌酸酶和肌氨酸氧化酶的浓度分别为:5
‑
8.5/μl、1.5
‑
2.8/μl和1
‑
1.8/μl;进一步优选的浓度分别为:5.3
‑
7.3/μl、2.3
‑
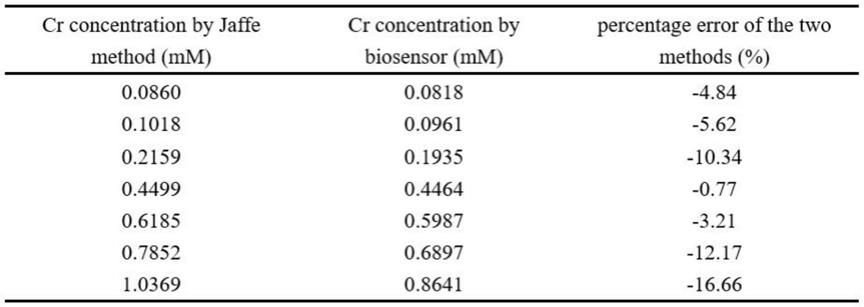
2.7/μl和1.3
‑
1.7/μl;最优选的三种酶浓度分别为: 5.3
‑
6.7/μl、2.5
‑
2.7/μl和1.6/μl;
[0042]
3.2)制备浓度为0.5
‑
1%的戊二醛溶液;
[0043]
3.3)将3.1)制得的所述混合酶液与3.2)所得的戊二醛溶液等体积比混合,得到酶修饰液;
[0044]
3.4)将3.3)得到的酶修饰液滴加至2)所得的电子介体增强层表面,然后在0
‑
4℃晾干,即完成所述的固定,得到酶修饰的电极。
[0045]
制备本发明第二个方面所述的可利用电化学法检测肌酐的试纸的方法,包括:
[0046]
以含有电子介体的碳浆料作为工作电极和对电极材料、以银
‑
氯化银浆料为参比电极材料,在绝缘且疏水的底板表面制备工作电极、对电极、参比电极和匹配的电路;在制得的所述工作电极表面施加电子介体增强层;然后将肌酐酶、肌酸酶和肌氨酸氧化酶组成
的酶组合物固定在所述的电子介体增强层表面;得到可利用电化学法检测肌酐的试纸。
[0047]
本发明所述的制备所述试纸的方法中,所述的含有电子介体的碳浆料优选是掺杂普鲁士蓝的碳糊;所述的在绝缘且疏水的底板表面制备工作电极、对电极、参比电极和匹配的电路优选通过丝网印刷方式打印完成;所述的在制得的所述工作电极表面施加电子介体增强层优选通过在制得的所述工作电极表面通过电沉积法修饰普鲁士蓝;所述酶组合物中肌酐酶、肌酸酶和肌氨酸氧化酶的比例优选为3.75
‑
6.25:1.25
‑
2:0.75
‑
1.25;更优选的比例为4
‑
5.5: 1.75
‑
2:1.0
‑
1.25;最优选的比例为4
‑
5:2:1.25;所述的的酶组合物固定在所述的电子介体增强层表面优选通过在所述电子介体增强层表面滴加所述酶组合物与戊二醛的混合液并在0
‑
4℃晾干的方式完成。
[0048]
第五个方面,本发明还提供一种电化学法检测肌酐的方法,包括:
[0049]
使用本发明所述的电化学检测肌酐的生物传感器,将所述生物传感器的导线与外设的电位检测设备连通;在所述生物传感器的加样腔内滴加ph值在7
‑
9.5的缓冲液,然后在缓冲液中滴加待测血浆或全血样本,电位检测设备在
‑
0.4~
‑
0.1v的工作电压下进行检测,得到响应电流的强度,最终根据肌酐浓度与电流信号的关系曲线推算得到样本中的肌酐浓度。
[0050]
本发明优选的电化学法检测肌酐的方法中,所述的缓冲液ph值为7.4。
[0051]
本发明优选的电化学法检测肌酐的方法中,所述的工作电压为
‑
0.2~
‑
0.1v,最优选
‑
0.1v。
[0052]
与现有技术相比,本发明的电极通过优化内部组成结构,在检测肌酐的三酶组合物与电极电极材料基础层之间增设了电子介体增强层,从而显著增强了电子传递效率,使检测时的工作电位降低至
‑
0.1v,从而有效排除了肌酐检测中由肌酸等非目标物带来的干扰,显著提高了本发明电极及试纸的抗干扰能力。同时,本发明的电极还具有较高的灵敏度和重复测量稳定性。此外,本发明的试纸可以用于多种便携、快捷的小型电化学检测设备中,所以,利用本发明的试纸能够实现快速、便利的血液肌酐或尿肌酐的临床检测或居家监测。
附图说明
[0053]
图1是本发明实施例1所述的电化学检测肌酐的生物传感器制备流程示意图。
[0054]
图2是本发明实施例1所述的方法制备得到的生物传感器结构示意图。
[0055]
图3a显示了在1mm肌酐溶液中实施例3的生物传感器在不同扫描速率下的循环伏安法曲线。
[0056]
图3b显示了在1mm h2o2溶液中实施例3的生物传感器在不同扫描速率下的循环伏安法曲线。
[0057]
图4a显示了实验例2的ca的酶载量研究结果。
[0058]
图4b显示了实验例2的ci的酶载量研究结果。
[0059]
图4c显示了实验例2的so的酶载量研究结果。
[0060]
图5显示了实施例3的传感器在不同ph值条件下的检测性能。
[0061]
图6显示了实施例3的传感器在工作电极相对参比电极的不同电位下的检测性能。
[0062]
图7显示了不同电极材料制备的传感器的灵敏度研究结果。
[0063]
图8a显示了实施例3生物传感器检测h2o2的标准曲线。
[0064]
图8b显示了实施例3生物传感器检测肌酐溶液的标准曲线。
[0065]
图9显示了实施例3生物传感器检测肌酐溶液的测量重复性。
[0066]
图10a显示了采用实施例3生物传感器检测血浆肌酐浓度的标准曲线。
[0067]
图10b显示了采用实施例3生物传感器检测血浆肌酐浓度与采用传统的jaffe法检测血浆肌酐浓度的检测结果之间的相关性。
具体实施方式
[0068]
以下将以列举实施例的方式详细说明本发明的技术方案,但本发明的范围不限于所列举的实施例。
[0069]
实施例1
[0070]
一种可用于电化学法检测肌酐的酶电极结构,包括电极材料基础层;所述的电极材料基础层外表面覆有电子介体增强层;所述的电子介体增强层外表面固定有可与肌酐反应生成过氧化氢的酶组合物。所述的电极材料基础层由掺杂普鲁士蓝的碳糊构成;所述的电子介体增强层是通过电化学沉积修饰在电极材料基础层上的普鲁士蓝层;所述的酶组合物由肌酐酶、肌酸酶和肌氨酸氧化酶按照5:2:1.25的比例组成。
[0071]
制备所述酶电极的方法如下:
[0072]
1)在pet底板上用掺杂普鲁士蓝的碳糊浆料涂刷形成0.2mm厚度的条形并干燥,得到电极材料基础层;
[0073]
2)先将1)所述的电极材料基础层在0.1m h2so溶液中以1000mv/s的扫描速度,在 0.2
‑
1.2v的电位范围内循环扫描20次,以清洗所述电极材料基础层;紧接着将清洗后的电极材料基础层浸泡在2.5mm fecl3和2.5mm k3[fe(cn)6]的混合物(以0.1m kcl和0.1m hcl为支持电解质)中,扫描速度控制在20mv/s、扫描电压控制在
‑
0.15v
‑
0.3v,持续扫描8 个循环;然后再将电极材料基础层在0.1m kcl和0.1m hcl的混合溶液中,以50mv/s的扫描速度、在
‑
0.2
‑
0.5v的电压范围内进一步扫描8个循环,以稳定电极上的普鲁士蓝;最后经干燥得到电极材料基础层表面修饰有普鲁士蓝的电极,修饰在电极材料基础层表面的普鲁士蓝作为电子介体增强层;
[0074]
3)在2)所得的电子介体增强层表面固定酶组合物:
[0075]
3.1)将
‑
20℃下保存的粉状肌酐酶、肌酸酶和肌氨酸氧化酶取出后制备成混合酶溶液;控制所述混合酶液中肌酐酶、肌酸酶和肌氨酸氧化酶的比例为:5:2:1.25;
[0076]
3.2)制备浓度为0.8%的戊二醛溶液;将所述混合酶溶液与戊二醛溶液等体积比混合,得到酶修饰液;
[0077]
3.3)将3.2)得到的酶修饰液滴加至2)所得的电子介体增强层表面,然后4℃冰箱冷藏过夜,即完成酶组合物的固定,得到所述的酶电极。
[0078]
实施例2
[0079]
一种可通过电化学法检测肌酐的试纸,包括长方形的pet底板,所述的pet底板表面设有电极组和电路;所述的电极组由平行排列的一个长条形工作电极、一个长条形对电极和一个长条形参比电极构成,所述的工作电极的结构与实施例1所述的电极相同;所述的对电极的材料由掺杂普鲁士蓝的碳糊构成;所述的参比电极是银
‑
氯化银电极。
[0080]
实施例3
[0081]
制备一种可通过电化学法检测样本肌酐水平的生物传感器,流程如图1所示,包括:
[0082]
(1)选择25mm
×
30mm规格的长方形pet材料作为绝缘底板,并在绝缘底板上预设好工作电极、对电极和参比电极各自的位置;
[0083]
(2)在(1)所述的绝缘底板上按照预设位置制作电极,即,用掺杂普鲁士蓝的碳糊涂刷制得工作电极和对电极,同时用ag/agcl油墨涂刷得到参比电极。每个电极的长度、宽度和厚度分别为20mm、2mm和0.2mm,如图1(2)所示,中间为工作电极,左侧为对电极,右侧为参比电极;涂有电极的绝缘底板置于干燥炉内75℃下干燥30分钟,室温冷却;
[0084]
(3)在(2)得到的冷却后的绝缘底板上,使用银浆在三个电极同一侧的端头上分别连接铜导线;然后用胶封住所述连接部位以保证连接的稳固性。再围绕三个电极另一侧未连接铜导线的端头用热熔胶围筑起绝原材料墙,形成周围凸起中间有2mm
×
8mm镂空区的加样腔。
[0085]
(4)在(3)得到的加样腔内的工作电极表面通过电沉积法修饰一层普鲁士蓝层作为电子介体增强层;
[0086]
(5)在(4)处理后的工作电极表面按以下方式进行复合酶的固定:
[0087]
将
‑
20℃下保存的粉状肌酐酶、肌酸酶和肌氨酸氧化酶取出后制备成复合酶溶液;控制所述混合酶液中肌酐酶、肌酸酶和肌氨酸氧化酶的比例为:4:1.6:1;
[0088]
制备浓度为0.8%的戊二醛溶液;将所述复合酶溶液与戊二醛溶液等体积比混合,得到酶修饰液;
[0089]
将酶修饰液滴加至工作电极表面经过(4)修饰得到的电子介体增强层表面,然后4℃冰箱冷藏过夜,即完成复合酶的固定,得到所述的生物传感器。
[0090]
本实施例得到的生物传感器结构如图2所示,包括长方形pet绝缘底板1,所述的绝缘底板1表面固定连接有电极组、导线和加样腔;所述的加样腔2由四周的热熔胶墙和中间的镂空区构成;所述的电极组主体处于所述镂空区范围内,所述的电极组由工作电极31、对电极32和参比电极33组成,所述的工作电极31为实施例1所述的电极;所述的导线包括分别与所述工作电极31、对电极32和参比电极33连接的铜导线4,用于将所述的每个电极与外设的电位检测设备电连接。
[0091]
用于检测前,将本实施例所制备的生物传感器从冰箱取出后,在缓冲液中于室温下孵化 1小时。使用本发明所述的生物传感器检测血液肌酐水平时,如图2所示,将生物传感器的导线4与外设的电位检测设备连通,将缓冲液和采集的血样先后以合适剂量滴加至所述加样腔2的镂空区,其四周的绝缘材料墙可以将液滴限制在镂空区内与电极充分接触。样本中的肌酐0与工作电极31上的复合酶反应生成过氧化氢,过氧化氢被所述工作电极31上的电子介体增强层的电子介体催化还原,由此将复合酶活性中心的电子转移至电极材料基础层,在工作电极31上产生还原电流,电位检测设备通过参比电极33测量电位,电流响应值大小在一定范围内与血液肌酐水平相关,从而根据电流检测结果推算得到相应肌酐水平。
[0092]
实施例4
[0093]
制备一种可通过电化学法检测样本肌酐水平的生物传感器,包括:
[0094]
基于预先设计的网版通过丝网印刷将工作电极、对电极和参比电极打印在pet材质表面的合适位置,其中,工作电极和对电极使用掺杂普鲁士蓝的碳糊为打印墨水,参比电极使用 ag/agcl油墨为打印墨水;
[0095]
通过电沉积的方法将普鲁士蓝进一步修饰在所述工作电极的表面,形成所述的电子介体增强层;
[0096]
在所述工作电极上的电子介体增强层表面按照实施例1步骤3)的方法固定复合酶,得到酶修饰的工作电极;
[0097]
使用银浆在三个电极同一侧的端头上分别连接铜导线;然后用胶封住所述连接部位以保证连接的稳固性;
[0098]
再围绕三个电极另一侧未连接铜导线的端头用热熔胶围筑起绝原材料墙,形成周围凸起中间有镂空区的加样腔,即得到所述的生物传感器。
[0099]
实施例5
[0100]
使用实施例3所述的生物传感器通过电化学法检测血肌酐的方法:
[0101]
将所述生物传感器的铜导线与外设的电位检测设备连通;在所述生物传感器的加样腔内滴加ph值在7.4的缓冲液,然后在缓冲液中滴加待测血浆或全血样本,电位检测设备在
‑
0.1v 的工作电压下进行检测,得到响应电流的强度,最终根据肌酐浓度与电流信号的关系曲线推算得到样本中的肌酐浓度。
[0102]
对比例1
[0103]
制备一种可用于电化学法检测肌酐的生物传感器,其方法大体上与实施例3相同,区别在于:所述的工作电极上未修饰普鲁士蓝层。
[0104]
对比例2
[0105]
制备一种可用于电化学法检测肌酐的生物传感器,其方法大体上与实施例3相同,区别在于:工作电极和对电极使用未掺杂普鲁士蓝的碳糊为打印墨水。
[0106]
对比例3
[0107]
制备一种对照的生物传感器,其方法大体上与实施例3相同,区别在于:工作电极和对电极使用未掺杂普鲁士蓝的碳糊为打印墨水,且工作电极上不增设普鲁士蓝修饰的电子介体增强层。
[0108]
实验例1
[0109]
为了探讨实施例3的肌酐传感器在不同电位下对h2o2或肌酐的检测性能,在含有1mmh2o2或1mm肌酐的缓冲液中,研究了不同扫描速率下的循环伏安法曲线。图3a显示了在扫描速率分别为30、50、70和100mv/s时1mm肌酐溶液的循环伏安法曲线。虽然扫描速率不同,但曲线的形状和变化趋势相似。随着扫描速率的加快,氧化还原峰电流逐渐增大。随着扫描速率的增加,氧化峰电位呈上升趋势,还原峰电位呈下降趋势。结果表明,该曲线呈现出一对明显的氧化还原峰,其电位分别为
‑
0.034v(a)和
‑
0.325v(d)。在
‑
0.034v电位下,肌酐在工作电极上似乎发生了强烈的氧化反应。曲线上还有两个氧化峰,相应的电位分别为
‑
0.169v(b)和0.254v(c)。因此,最佳电位还有待于进一步研究探索和验证。图3b显示了1mmh2o2溶液在不同扫描速率下的循环伏安法曲线。h2o2的曲线与肌酐溶液的曲线相似,这主要取决于印刷电极材料的性质。此外,通过比较相同电位下的电流反应,h2o2比肌酐产生更大的反应,这是由于h2o2在电极上直接发生氧化还原反应,而肌酐转化为h2o2需要酶促反应,
然后h2o2在电极上被氧化/还原。
[0110]
实验例2
[0111]
验证三种酶ca、ci、so的浓度对肌酐生物传感器的灵敏度的影响。从理论上讲,传感器的电流信号很大程度上取决于酶的数量,但过多的酶会降低电流信号。因此,考虑到传感器的测量性能和成本,有必要研究这三种酶的最佳酶浓度,以便以较低的成本获得较好的检测结果。分别以100u/μl、8u/μl、5u/μl制备ca、ci、so酶溶液,并以1:1:1的体积比混合三种酶溶液。然后将2μl混合酶溶液与2μl 0.8%的戊二醛溶液混合,在工作电极上进行酶组合物的固定。因此,工作电极上每种酶的实际浓度是其单一酶溶液的六分之一。图4显示了这三种酶的酶载量研究。以各酶溶液的浓度为横坐标,纵坐标为标准曲线的斜率,它是单位肌酐浓度引起的电流响应,代表传感器的灵敏度。斜率越高,传感器的灵敏度越好。
[0112]
本实验中,单独制备的ci酶溶液和so酶溶液浓度分别为8u/μl和5u/μl。为了观察传感器斜率随ca浓度增加的变化,设计了一系列ca酶溶液的浓度,包括0.1、1、5、10、20、 50、100u/μl。从图4a中可以看出,ca浓度在0.1
‑
20u/μl之间时,传感器斜率由
‑
0.4255μa/mm 显著增加到
‑
2.3413μa/mm。ca浓度分别为50和100u/μl时与ca浓度为20u/μl时相比斜率变化不大。因此,20u/μl被认为是较为理想的ca浓度。
[0113]
ci酶载量实验采用的ci酶溶液浓度分别为0.5、1、2、4、8u/μl,另外两种酶ca、so 浓度分别为20u/μl和5u/μl。如图4b所示,与ca不同,斜率在未饱和的情况下与ci浓度成正比。
[0114]
图4c显示了so酶载量的研究,其中so浓度分别为0.05、0.2、0.5、1、2、4和5u/μl。如图4c所示,随着so浓度的增加,斜率的变化趋势与ca相似。当so浓度为5u/μl时,传感器的斜率最大。
[0115]
结果表明,20u/μl、8u/μl和5u/μl分别为ca、ci和so三种酶的最适酶浓度。
[0116]
如图4a和4b所示,随着酶浓度的增加,斜率趋于饱和。这是意料之中的,因为当没有考虑底物的数量时,反应速率与酶的浓度呈正相关。当底物用量一定时,反应速率在一定的酶浓度下可以达到极限。此时提高酶浓度并不能加快反应速率,而且过量的酶可能会阻碍肌酐分解产生的h2o2的释放和扩散,从而影响电子的转移。另外值得一提的是,ca:ci:so的最佳比例为5:2:1.25,提示了:要想提高传感器的检测性能,ca催化的肌酐向肌酸的转化需要足够充分,而肌酸转化为h2o2似乎只需要少量的so酶。
[0117]
实验例3
[0118]
肌酐测定过程中,在所述传感器的加样腔内加入不同ph的200μl nah2po4·
2h2o缓冲液浸沫电极和固定在工作电极上的酶。发现酶活性在上述不同的缓冲液ph值条件下会发生变化,从而影响传感器的检测性能。因此,我们制备了一系列ph值为6.0
‑
9.5的缓冲液,以探索传感器工作的适宜酸碱环境。结果表明,该传感器在ph值为7.5
‑
9.5范围内保持了良好的检测性能。最差的检测效果出现在ph值为6时,最佳的检测效果出现在ph值为8.5时,如图5所示。
[0119]
鉴于实际血液样本的ph值范围为7.35
‑
7.45,故选择ph值为7.4的缓冲液作进一步研究。通过这项研究,我们相信本发明的肌酐生物传感器能够在没有任何酸碱预处理的情况下对人体血液样本进行准确的检测。
[0120]
实验例4
[0121]
如实验例1所述,不同扫描速率下1mm肌酐和1mm h2o2溶液的循环伏安法曲线研究中,实施例3的传感器的氧化还原电位曲线存在多个峰,需要进行传感器的最佳检测电位研究。如图6所示,传感器在
‑
0.4、
‑
0.2、
‑
0.1、
‑
0.05和0v电位下表现出较高的灵敏度,在
‑
0.1v时获得最佳的检测效果,而在0.05、0.1和0.2v电位时,传感器信号明显减小,特别是在0.1v 和0.2v时。总之,该传感器在
‑
0.1v电位下的性能是最佳的,这对于临床上的人体血液样本测量也是极其重要和关键的。因为现有的许多传感器的检测原理都是基于h2o2的浓度,这种传感器在实际应用中存在的主要问题是h2o2的氧化电位偏高,在实际被检测的血液样本中,某些还原性物质,如抗坏血酸、尿酸和胆红素,在高电位下也会被氧化,这些物质一旦被氧化,产生的干扰电流会阻碍对目标物质(肌酐)的精准检测。在这种情况下,本发明的生物传感器可以在
‑
0.1v的低电位下发挥优越的检测性能,可显著提高传感器在实际血液样本检测中的抗干扰能力,从而使检测结果更加准确可靠。
[0122]
实验例5
[0123]
本实验研究了不同电极材料的四种生物传感器的检测灵敏度,四种生物传感器分别为实施例3、对比例1、对比例2和对比例3的方法制备的生物传感器。研究结果如图7所示,对比例3的生物传感器检测不产生电流信号。对比例2和对比例1的生物传感器检测性能相近,灵敏度约为1.4μa/mm。实施例3的传感器,与对比例1、2相比,用普鲁士蓝电沉积层修饰 pb碳糊电极后,传感器的灵敏度明显提高到2.2μa/mm左右。结果表明,本发明的电子介体增强层可以使传感器在
‑
0.1v电位下表现出良好的检测性能。
[0124]
实验例6
[0125]
参照实施例5所述的检测方法,以实施例3的生物传感器为检测传感器,在实施例3的生物传感器的加样腔内滴加ph值在7.4的缓冲液,当缓冲溶液的电流基线稳定时,在缓冲溶液中加入一系列浓度从低到高的h2o2溶液。h2o2在扩散到工作电极表面之后被氧化,并经电子转移产生电流信号。结果显示,在加入h2o2时,由于工作电极表面局部h2o2浓度的瞬时增加,电流立即上升;随着h2o2的扩散,电流峰值逐渐降低;当h2o2的扩散和氧化过程达到平衡时,电流信号又达到一个新的平台;这一电流变化过程只用了100秒左右,说明本发明的生物传感器的传感测量速度快、效率高。其标准曲线如图8a所示,当h2o2浓度在 0.05
‑
1.4mm范围内时,电流响应与h2o2浓度呈线性关系。所述标准曲线斜率为
‑
5.5739 μa/mm,相关系数为0.999,显示出近乎完美的比值。实验结果表明,该传感器能够准确、灵敏地实现h2o2的检测,h2o2的成功检测表明该传感器具有检测肌酐的可能性。
[0126]
参照实施例5所述的检测方法,设置多个平行试验组,每组先在实施例3制备的生物传感器的加样腔内加入200μlph值在7.4的缓冲液,浸没电极组,当缓冲液的电流基线稳定后,各组分别在缓冲液内加入不同浓度的肌酐溶液。可以观察到,各组在加入肌酐后1s内电流信号增加,100s左右达到稳定状态,表明传感器响应迅速。
[0127]
为了探讨肌酐传感器的检测范围,本实验还对几种高浓度的肌酐溶液进行了测定。从图8b中我们可以看到,电流信号与肌酐浓度在0.05
‑
1.4mm范围内成正比。然而,随着肌酐浓度的持续增加,电流信号趋于平缓。因此,本发明所述的生物传感器对肌酐线性检测范围为 0.05
‑
1.4mm,足以在临床实践中测量实际人体血液样本。
[0128]
图8b显示了实施例3制备的用于电化学检测肌酐的生物传感器的电流响应和肌酐浓度之间的标准曲线。如图8b所示,与h2o2一致,电流响应与肌酐浓度成正比。在标准曲线
上,我们可以直观地看到0.05
‑
1.4mm的线性检测范围,斜率为
‑
1.8918μa/mm,相关系数为0.9957。这些结果表明,该生物传感器成功地实现了肌酐的快速、灵敏检测。
[0129]
实验例7
[0130]
为了研究实施例3方法制备的生物传感器的测量稳定性,采用实施例5所述的方法对同一肌酐溶液连续测量74次。首先将200μl缓冲溶液滴在电极表面,浸没电极组,当缓冲液的电流基线趋于平稳后,在缓冲液中加入41mm肌酐溶液5μl,由此使肌酐的最终浓度为1mm。然后记录1mm肌酐溶液引起的电流反应。以第1次测量的电流响应为100%,后续73次测量的电流响应基于第1次的响应量化,以百分比计。
[0131]
74次检测结果如图9所示,横坐标是测量次数,纵坐标是归一化的响应比例。可以观察到,以第1次检测的电流响应为标准,随后73次检测的电流响应趋于稳定,电流响应在上下 20%的范围内(80
‑
120%)变化。值得注意的是,经过74次测量后,传感器仍然保持了优良的性能,而且与初始信号相比,电流响应并没有减小,而是增加了,这可能是由于酶活性的增加。结果表明,该传感器在连续测量肌酐时具有良好的测量稳定性。
[0132]
实验例8
[0133]
采用本发明实施例5的方法检测7组血浆样本中的肌酐水平,每组血浆样本同时采用传统的jaffe法检测作为对照,两种检测结果及其误差率见下表1:
[0134]
表1
[0135][0136]
采用实施例3生物传感器检测血浆肌酐浓度的标准曲线如图10a所示,可见本发明生物传感器检测的响应电流强度与肌酐浓度成高度相关。同时,如图10b所示,本发明生物传感器检测结果与传统的jaffe法的检测结果之间同样存在高度相关性。证明本发明的生物传感器对血浆肌酐水平的检测具有良好的准确性。
[0137]
实验例9
[0138]
传感器的储存稳定性决定了商用肌酐生物传感器的有效期。本实验研究了肌酐传感器的贮存稳定性。第1天,准备了足够数量的实施例3制备的生物传感器,并将其储存在摄氏4 度的冰箱中。分别于第2、5、8、11、14、17、20天测定肌酐,每次使用4个生物传感器。随后,在第30天和第60天进行测量。观察了传感器检测性能随时间的变化。结果显示,与第1次检测相比,实施例3制备的用于电化学检测肌酐的生物传感器的检测性能并没有随着时间的推移而下降。其中,储存后的第2天、第30天和第60天进行肌酐测定的标准曲线斜率分别为
‑
1.9475μa/mm、
‑
2.5791μa/mm和
‑
2.3389μa/mm,具有良好的一致性。这些结果表明,本发明的肌酐生物传感器在4℃保存2个月后仍然保持良好的检测性能,提供了长期有效性的可
能性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1