一种检测水生生物体内微塑料丰度的方法
1.本发明属于污染物检测技术领域。更具体地,涉及一种检测水生生物体内微塑料丰度的方法。
背景技术:
2.在水体中游荡的微塑料很容易被贻贝、鱼等水生生物误食,并在水生生物消化液的作用下发生降解,形成尺寸更小的颗粒,甚至是纳米塑料,对水生生物机体产生一系列不良影响,导致水生生物生病甚至死亡;研究证实,微塑料可在食物链中进行传递,且广泛存在于水产品、饮用水及其他人类可摄入的食品中,最终进入人体,产生难以预计的危害。
3.然而现有对微塑料在生物体内引起不良影响的暴露剂量方面的研究有限,但检测水生生物体内微塑料的丰度,对微塑料在水生生物体内的吸收途径和不良影响方面的研究具有重要意义,因此,寻找高效准确的检测水生生物体内微塑料丰度的方法成为了当前研究热点之一,claessens等公开了一种检测贻贝体内微塑料的方法(claessens michiel et al.,marine pollution bulletin,2013:227
‑
233.),但该方法需要耗费较长时间才能去除部分生物有机质,且不能完全去除生物有机质,为了解决这个问题,目前最常用的方式是加入饱和氯化钠溶液进行密度浮选分离,但其过程较为繁琐,限制了检测水生生物体内微塑料方法的效率提升。
4.因此,有必要寻找一种可高效检测水生生物体内微塑料丰度的方法,为微塑料在水生生物体内的吸收途径和不良影响方面的研究奠定基础。
技术实现要素:
5.本发明针对现有检测水生生物体内微塑料丰度方法的不足,旨在提供一种可高效、准确地检测水生生物体内微塑料的丰度的方法。
6.本发明上述目的通过以下技术方案实现:
7.本发明提供了一种检测水生生物体内微塑料丰度的方法,包括如下步骤:
8.s1.将水生生物与消解剂在40~70℃下混合,搅拌20~40min后得到消解液,抽滤得滤渣;
9.s2.将步骤s1所得滤渣进行拉曼表征得到样品拉曼谱图,将样品拉曼谱图与拉曼谱库进行对比分析,得出微塑料颗粒数,即得到所述微塑料丰度;
10.其中,所述消解剂由hno3水溶液和h2o2水溶液组成,hno3水溶液的浓度为63%~73%(w/w),h2o2水溶液的浓度为24%~34%(w/w);所述水生生物干重、hno3水溶液体积、h2o2水溶液体积之比为0.25~0.5g:3~5ml:0.8~1.2ml。
11.优选地,步骤s1所述水生生物包括贝壳类、鱼类。
12.进一步优选地,所述贝壳类包括贻贝;所述鱼类包括野生鱼类、养殖鱼类。
13.更优选地,所述野生鱼类包括罗非鱼和/或草鱼;所述养殖鱼类包括鲳鱼、金线鱼、黄花鱼、沙尖鱼或舌鳎鱼的一种或几种。
14.优选地,所述微塑料的粒径为150~1000μm。
15.进一步优选地,所述微塑料包括低密度聚乙烯、聚四氟乙烯、低塑性聚乙烯、聚氯乙烯、聚乙烯、聚苯乙烯或聚对苯二甲酸乙二酯的一种或几种。
16.优选地,所述hno3水溶液的浓度为65%(w/w),h2o2水溶液的浓度为30%(w/w)。
17.优选地,所述hno3水溶液和h2o2水溶液的体积比为4:1,见实施例1~7。
18.优选地,步骤s1所述混合的温度为50℃;所述搅拌的时间为30min,见实施例1~7。
19.优选地,步骤s1所述抽滤为利用真空泵将所述消解液通过硝酸纤维滤膜进行抽滤。
20.优选地,步骤s1所述抽滤后还将滤渣进行干燥。
21.本发明的检测方法对水生生物体内微塑料具有极高的加标回收率和保真性,能在短时间内有效去除生物有机质,可高效、准确地检测水生生物体内微塑料的丰度,因此,上述方法在检测水生生物体内微塑料丰度方面的应用也在本发明请求保护的范围内。
22.本发明具有以下有益效果:
23.本发明通过拉曼表征的检测方法对水生生物体内微塑料具有极高的加标回收率和保真性,能在短时间内有效去除生物有机质,可高效、准确地检测水生生物体内微塑料的丰度。
附图说明
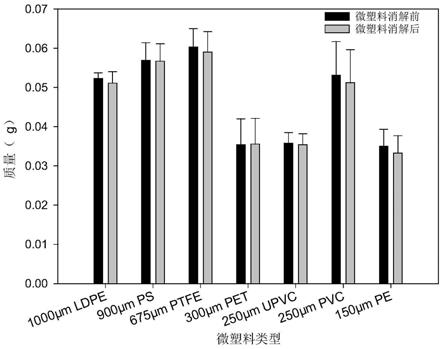
24.图1是消解前后微塑料的质量对比。
25.图2是消解前后微塑料的粒径对比。
26.图3是消解前后微塑料的表面积对比。
27.图4是聚苯乙烯消解前后的显微镜观察结果对比。
28.图5是消解前后微塑料的红外谱图对比。
具体实施方式
29.以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
30.除非特别说明,以下实施例所用试剂和材料均为市购。
31.为了最大程度地减少实验过程中的污染,所有的实验均在通风橱中进行操作,实验员在整个过程中都穿戴实验服、口罩、护目镜和手套,所有器皿在使用前均用超纯水润洗3次。实验过程中使用的所有贻贝软组织和鱼消化道前期均在
‑
20℃下保存。
32.实施例1一种检测水生生物体内微塑料丰度的方法
33.s1.将30颗粒径为1000μm的低密度聚乙烯(ldpe)与干重为0.25g的贻贝软组织混合均匀,得到附着ldpe的贻贝软组织;
34.s2.将附着有ldpe的贻贝软组织与消解剂在50℃下混合,搅拌30min后得到消解液,利用真空泵将消解液通过硝酸纤维滤膜进行抽滤,将滤渣干燥;
35.s3.将步骤s1所得干燥后的滤渣进行拉曼表征得到样品拉曼谱图,将样品拉曼谱图与拉曼谱库进行对比分析,得出微塑料颗粒数,即得到所述微塑料丰度;
36.其中,所述消解剂由4ml浓度为65%(w/w)的hno3水溶液和1ml浓度为30%(w/w)的h2o2水溶液组成。
37.实施例2一种检测水生生物体内微塑料丰度的方法
38.同实施例1的方法,区别在于,用粒径为900μm的聚苯乙烯(ps)替代粒径为1000μm的低密度聚乙烯;用罗非鱼消化道替代贻贝软组织。
39.实施例3一种检测水生生物体内微塑料丰度的方法
40.同实施例1的方法,区别在于,用粒径为675μm的聚四氟乙烯(ptfe)替代粒径为1000μm的低密度聚乙烯;用草鱼消化道替代贻贝软组织。
41.实施例4一种检测水生生物体内微塑料丰度的方法
42.同实施例1的方法,区别在于,用粒径为300μm的聚对苯二甲酸乙二酯(pet)替代粒径为1000μm的低密度聚乙烯;用鲳鱼消化道替代贻贝软组织。
43.实施例5一种检测水生生物体内微塑料丰度的方法
44.同实施例1的方法,区别在于,用粒径为250μm的低塑性聚乙烯(upvc)替代粒径为1000μm的低密度聚乙烯;用金线鱼消化道替代贻贝软组织。
45.实施例6一种检测水生生物体内微塑料丰度的方法
46.同实施例1的方法,区别在于,用粒径为150μm的聚乙烯(pe)替代粒径为1000μm的低密度聚乙烯;用黄花鱼消化道替代贻贝软组织。
47.实施例7一种检测水生生物体内微塑料丰度的方法
48.同实施例1的方法,区别在于,用粒径为250μm的聚氯乙烯(pvc)替代粒径为1000μm的低密度聚乙烯;用沙尖鱼消化道和舌鳎鱼消化道替代贻贝软组织。
49.实施例8一种检测水生生物体内微塑料丰度的方法
50.同实施例1的方法,区别在于,步骤s1所述混合的温度为40℃;所述搅拌的时间为40min。
51.实施例9一种检测水生生物体内微塑料丰度的方法
52.同实施例1的方法,区别在于,步骤s1所述混合的温度为70℃;所述搅拌的时间为20min。
53.实施例10一种检测水生生物体内微塑料丰度的方法
54.同实施例1的方法,区别在于,hno3水溶液的浓度为63%(w/w),h2o2水溶液的浓度为34%(w/w)。
55.实施例11一种检测水生生物体内微塑料丰度的方法
56.同实施例1的方法,区别在于,hno3水溶液的浓度为73%(w/w),h2o2水溶液的浓度为24%(w/w)。
57.实施例12一种检测水生生物体内微塑料丰度的方法
58.同实施例1的方法,区别在于,贻贝软组织的干重为0.5g;hno3水溶液体积为3ml;h2o2水溶液的体积为0.8ml。
59.实施例13一种检测水生生物体内微塑料丰度的方法
60.同实施例1的方法,区别在于,hno3水溶液体积为5ml;h2o2水溶液的体积为1.2ml。
61.对比例1
62.同实施例1的方法,区别在于,低密度聚乙烯的粒径为50μm。
63.对比例2
64.同实施例1的方法,区别在于,低密度聚乙烯的粒径为1500μm。
65.对比例3
66.同实施例1的方法,区别在于,步骤s1所述混合的温度为25℃;所述搅拌的时间为60min。
67.对比例4
68.同实施例1的方法,区别在于,步骤s1所述混合的温度为80℃;所述搅拌的时间为13min。
69.对比例5
70.同实施例1的方法,区别在于,hno3水溶液的浓度为50%(w/w),h2o2水溶液的浓度为15%(w/w)。
71.对比例6
72.同实施例1的方法,区别在于,hno3水溶液的浓度为85%(w/w),h2o2水溶液的浓度为45%(w/w)。
73.对比例7
74.同实施例1的方法,区别在于,hno3水溶液体积为1ml;h2o2水溶液的体积为0.3ml。
75.对比例8
76.同实施例1的方法,区别在于,hno3水溶液体积为7ml;h2o2水溶液的体积为2ml。
77.对比例9
78.同实施例1的方法,区别在于,hno3水溶液体积为7ml;h2o2水溶液的体积为0.3ml。
79.对比例10
80.同实施例1的方法,区别在于,hno3水溶液体积为1ml;h2o2水溶液的体积为2ml。
81.对比例11
82.同实施例1的方法,区别在于,将步骤s2所述消解液进行密度浮选分离后,再进行抽滤;其中,所述密度浮选分离的步骤是:1)将消解液从烧杯转移至干净的分液漏斗中,用超纯水润洗烧杯3次,并将润洗液全部转移至分液漏斗中;
83.2)向分液漏斗中加入氯化钠,并振荡摇晃分液漏斗15分钟,确保氯化钠溶液达到饱和状态;3)将分液漏斗静置10分钟,排出漏斗下方浑浊溶液,保留上澄清液进行下一步的抽滤操作。
84.实验例1
85.肉眼观察实施例1~13和对比例1~11步骤s2的消解液,发现对比例1~11的消解液较为浑浊,均存在絮状或块状物质,说明对比例1~11的方法不能有效消解生物有机质;而实施例1~13未发现絮状或块状物质,表明应用本发明的方法消解水生生物后,可在短时间内有效消解生物有机质,在后续的抽滤过程中不会附着在滤渣上,不会影响拉曼表征与计数的结果,可高效、准确地检测水生生物体内微塑料的丰度。
86.计算实施例1~13和对比例1~11的加标回收率(加标回收率=微塑料丰度/初始与水生生物混匀的微塑料颗粒数*100%),结果如表1所示。
87.表1
88.实施例加标回收率/%对比例加标回收率/%
实施例199
±
1%对比例179
±
2%实施例2100%对比例280
±
4%实施例397
±
3%对比例378
±
2%实施例495
±
5%对比例476
±
5%实施例593
±
3%对比例577
±
3%实施例693
±
4%对比例678
±
1%实施例796
±
4%对比例775
±
2%实施例897
±
1%对比例878
±
3%实施例996
±
2%对比例977
±
1%实施例1098
±
1%对比例1072
±
3%实施例1195
±
5%对比例1193
±
5%实施例1292
±
7%
ꢀꢀ
实施例1399
±
1%
ꢀꢀ
89.从表1可以看出,实施例1~13的加标回收率显著高于对比例1~10的加标回收率,表明本发明的检测方法对水生生物体内微塑料具有极高的加标回收率,可准确地检测水生生物体内微塑料的丰度。
90.此外,实施例1没有进行密度浮选分离操作,对比例11进行了密度浮选分离操作,而两者在加标回收率方面的表现却相当,结合前述肉眼观察的结果,进一步证明了本发明的检测方法能有效去除生物有机质,而不需要进行密度浮选分离,在后续的抽滤过程中不会附着在滤渣上,不会影响拉曼表征与计数的结果,可高效、准确地检测水生生物体内微塑料的丰度。
91.实验例2
92.取实施例1~7步骤s1中加入的微塑料颗粒,以及步骤s3中筛选得到的微塑料颗粒,分别进行称重(图1)、测量粒径(图2)和表面积(图3),再用显微镜观察后拍照(图4),并用红外光谱仪检测得到红外谱图(图5)。
93.从图1~3可以看出,7种微塑料在消解前后的质量、粒径和表面积没有显著差异。
94.结合图4~5可以看出,聚苯乙烯(ps)经过本发明的方法消解后颜色轻微变黄,这可能是因为聚苯乙烯被hno3轻微腐蚀而导致其颜色轻微变黄,但不影响其红外表征;聚对苯二甲酸乙二酯(pet)经过本发明的方法消解后,红外光谱在波长为1382cm
‑1处发生轻微变化,这可能是因为本发明的方法轻微降解了聚对苯二甲酸乙二酯,但不影响其准确识别;而其余5种微塑料的颜色、外观和红外谱图没有发生变化。
95.综上可得,应用本发明的方法不会损坏水生生物体内微塑料的结构,具有高保真性,说明本发明可准确检测水生生物体内微塑料的丰度。
96.上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1