离体血液样品的分析方法和免疫力评估装置与流程
1.本发明涉及离体血液样品分析技术领域,尤其涉及离体血液样品的分析方法和免疫力评估装置。
背景技术:
2.免疫系统在成长过程中,随之发育成熟,整体免疫细胞数量、比例、功能水平在健康人体内呈现一种稳态。但随著年龄增长,部分细胞进入衰老阶段,免疫系统就会失去平衡。免疫系统的失衡,往往在初期都不会有显著的变化,直到身体状况恶化以及罹患疾病(感染、肿瘤)时才会被注意,但进一步的干预往往需要耗费更多时间与金钱。另一方面,对已经通过现有治疗手段达成缓解的癌症患者,需要一种能在影像学、肿瘤标示物之外,提早预警复发可能性的手段。因此目前急需一种能对个体免疫功能进行评估方案。
3.目前,在医学检验上,通过设备检测免疫细胞分类,依据细胞分类的比例与数量变化,对受试者状态进行评估。但检测项目通常较少,最常检测的亚群包括t细胞(cd3+)、b细胞(cd3
‑
cd19+)、nk细胞(cd3
‑
56+)、th细胞(cd3+cd4+)和细胞毒性t细胞(cd3+cd8+)等,临床价值仅能提供细菌或病毒感染可能性。对于亚健康人群、肿瘤患者、肿瘤治愈患者而言,这些检查并没有参考价值。
4.鉴于现有免疫检测和评估的不足,本发明提出一种基于高通量单细胞功能分析,实现对免疫系统整体水平的全面、精确且量化的评估分析方法和装置。
技术实现要素:
5.(一)要解决的技术问题
6.鉴于现有技术的上述缺点、不足,本发明提供一种离体血液样品的分析方法,将分析结果作为免疫力评估的参考值。此外,本发明还提供一种受试者免疫力评估装置。
7.(二)技术方案
8.为了达到上述目的,本发明采用的主要技术方案包括:
9.第一方面,本发明一种离体血液样品的分析方法,其包括:
10.s1、从受试者提供的离体血液中分离淋巴细胞并计数,体外培育淋巴细胞进行刺激和细胞染色,对淋巴细胞中单个淋巴细胞表面的特异性表面蛋白进行检测,根据不同特异性表面蛋白显示阳性或阴性的结果,检测并计算出各类细胞的数量和所占比例;
11.s2、对各类细胞的数量和比例进行标准化评分,以得到对应的标准分值;
12.s3、根据分值对应的细胞种类所表征的功能进行归类,分成6类,即t细胞储备、固有免疫系统、nk细胞杀伤功能、t细胞平衡、t细胞活化和t细胞功能;将各类中包含的指标项目的评分汇总,得到该类的总分值;
13.s4、对受试者的所述六类总分值求和,得到对应某受试者血液样品的分析结果。
14.根据本发明较佳实施例,其中,s1中,若检测仪器只能检测到某特异性表面蛋白阳性细胞占该类细胞总数的百分比值,则进一步换算成该特异性表面蛋白阳性细胞的绝对数
量。
15.根据本发明较佳实施例,其中,s1中,所述数量为每升血液中细胞的个数,单位为109个/l血液。
16.根据本发明较佳实施例,其中,s1中所述各类细胞的数量包括:总nk细胞数、总th细胞数、cd4:cd8比例、总treg细胞(cd3+cd4+cd25+cd127
‑
/low)数、总初始t细胞(cd3+cd45ra+cd62l+)数、总中央记忆t细胞(cd3+cd45ra
‑
cd62l+)数、总tcrγδt细胞数、总nk
‑
ifnγ细胞数、总nk
‑
cd107a细胞数、总nk
‑
tnfα细胞数、总t
‑
ifnγ细胞数、总t
‑
cd107a细胞数、总t
‑
tnfα细胞数、总th
‑
ifnγ细胞数、总th
‑
tnfα细胞数、总细胞毒性t
‑
ifnγ细胞数、总细胞毒性t
‑
cd107a细胞数和总细胞毒性t
‑
tnfα细胞数;
17.s1中所述各类细胞的比例包括:初始t细胞%、中央记忆t细胞%、th细胞(cd3+cd4+)%、treg细胞(cd3+cd4+cd25+cd127
‑
/low)%、活化t淋巴细胞(cd3+hla
‑
dr+)%、抑制性ts细胞(cd3+cd8+cd28
‑
)%、活化ts细胞(cd3+cd8+hla
‑
dr+)%、细胞毒性t细胞(cd3+cd8+)%、细胞毒性tc细胞(cd3+cd8+cd28+)%、nk
‑
ifnγ%、nk
‑
tnfα%、总t
‑
ifnγ%、总t
‑
tnfα%、细胞毒t
‑
ifnγ%、细胞毒t
‑
tnfα%。
18.根据本发明较佳实施例,其中,s2中,评分规则如下:
19.以下除比例外,其余各数值的单位为109/l血液;
20.总nk细胞数≥0.3174,评10分;介于0.2809~0.3174评8分;介于0.2445~0.2809评6分;介于0.1753~0.2445评4分;介于0.1318~0.1753评2分;介于0.08494~0.1318评1分;低于0.08494评0分;
21.th细胞(cd3+cd4+)%≥60.85评10分;介于57.26~60.85评7分;介于41.49~57.26评6分;介于38.06~41.49评3分;低于38.06评0分;
22.总th细胞数≥0.9161评10分;介于0.853~0.9161评8分;介于0.79~0.853评6分;介于0.4435~0.79评4分;介于0.2548~0.4435评2分;低于0.2548评0分;
23.细胞毒性t细胞(cd3+cd8+)%<29.66评10分;介于29.66~32.69评7分;介于32.69~44.8评5分;介于44.8~48.49评2分;介于48.49~51.25评1分;大于51.25评0分;
24.cd4:cd8比例<1.083评10分;介于1.083~1.3评6分;介于1.3~1.943评4分;介于1.943~2.259评2分;大于2.259评0分;
25.treg细胞(cd3+cd4+cd25+cd127
‑
/low)%<6.552评8分;介于6.552~7.267评7分;介于7.267~8.516评4分;介于8.516~9.264评2分;大于9.264评0分;
26.初始t细胞(cd3+cd45ra+cd62l+)%≥29.17评10分;介于24.98~29.17评8分;介于20.9~24.98评5分;介于16.86~20.9评2分;低于16.86评1分;
27.中央记忆t细胞(cd3+cd45ra
‑
cd62l+)%≥31.99评10分;介于28.97~31.99评8分;介于24.11~28.97评5分;介于22.85~24.11评2分;低于22.85评1分;
28.活化t淋巴细胞(cd3+hla
‑
dr+)%<21.15评10分;介于21.15~24.66评8分;介于24.665~46.41评5分;介于46.41~56.76评2分;大于56.76评1分;
29.抑制性ts细胞(cd3+cd8+cd28
‑
)%<11.56评10分;介于11.56~14.49评8分;介于14.49~24.67评5分;介于24.67~31.46评2分;大于31.46评1分;
30.细胞毒性tc细胞(cd3+cd8+cd28+)%≥62.56评10分;介于56.22~62.56评8分;介于45.56~56.22评5分;介于39.93~45.56评2分;小于39.93评1分;
31.nk
‑
ifnγ%≥17.12评10分;介于13.8~17.12评9分;介于10.48~13.8评8分,介于5.034~10.48评4分;介于3.113~5.034评2分;低于3.113评1分;
32.nk
‑
tnfα%≥30.16评10分;介于27.39~30.16评9分;介于24.62~27.39评8分,介于15.68~24.62评4分;介于10.96~15.68评2分;低于10.96评1分;
33.总t
‑
ifnγ%≥18.39评10分;介于16.02~18.39评9分;介于13.65~16.02评8分,介9.739~13.65评4分;介于7.052~9.739评2分;低于7.052评1分;
34.总t
‑
tnfα%≥46.26评10分;介于43.64~46.26评9分;介于41.01~43.64评8分,介于28.97~41.01评4分;介于21.36~28.97评2分;低于21.36评1分;
35.细胞毒性t
‑
ifnγ%≥30.93评10分;介于27.13~30.93评9分;介于23.33~27.13评8分,介14.58~27.13评4分;介于11.5~14.58评2分;低于11.5评1分;
36.细胞毒性t
‑
tnfα%≥44.15评10分;介于40.79~44.15评9分;介于37.43~40.79评8分,介于20.77~37.43评4分;介于16.35~20.77评2分;低于16.35评1分;
37.总treg细胞数≥206.3评10分;介于131.8~206.3评7分;介于79.25~131.8评6分;介于57.42~79.25评3分;介于55.05~57.42评1分;小于55.05评0分;
38.总tcrγδt细胞数≥106.7评10分;介于91.7~106.7评9分;介于76.67~91.7评8分;介于75.24~76.67评5分;介于53.24~75.24评3分;小于53.24评0分;
39.总初始t细胞数≥419.5评10分;介于377.8~419.5评9分;336~377.8评8分;介于222.5~336评5分;小于222.5评1分;
40.总中央记忆t细胞(cd3+cd45ra
‑
cd62l+)数≥465.9评10分;介于423.5~465.9评9分;381.2~423.5评8分;介于348.4~381.2评6分;介于240.8~348.4评2分;小于240.8评1分;
41.总nk
‑
ifnγ细胞数≥46.24评10分;介于46.24~34.73评9分;介于34.73~23.21评8分;介于10.4~23.21评4分;介于5.31~10.4评2分;小于5.31评1分;
42.总nk
‑
cd107a细胞数≥106.9评10分;介于92.67~106.9评9分;介于78.44~92.67评8分;介于46.72~78.44评4分;介于21.89~46.72评2分;小于21.89评1分;
43.总nk
‑
tnfα细胞数≥92.7评10分;介于92.7~77.2评9分;介于77.2~61.69评8分;介于61.69~23.88评4分;介于23.88~15.37评2分;小于15.37评1分;
44.总t
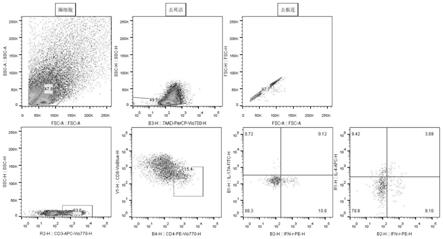
‑
ifnγ细胞数≥233.9评10分;介于200.1~233.9评9分;介于166.3~200.1评8分;介于127~166.3评5分;介于81.16~127评3分;小于81.16评1分;
45.总t
‑
cd107a细胞数≥443.5评10分;介于390.3~443.5评9分;介于337.1~390.3评8分;介于248.3~337.1评6分;介于159.4~248.3评3分;小于159.4评1分;
46.总t
‑
tnfα细胞数≥634.6评10分;介于569~634.6评9分;介于503.4~569评8分;介于265~503.4评5分;小于265评3分;
47.总th
‑
ifnγ细胞数≥88.6评10分;介于76.81~88.6评9分;介于65.01~76.81评8分;介于38.84~65.01评6分;介于20.36~38.84评3分;小于20.36评1分;
48.总th
‑
tnfα细胞数≥397.2评10分;介于361.5~397.2评9分;介于325.8~361.5评8分;介于129~325.8评6分;介于89.01~129评3分;小于89.01评1分;
49.总细胞毒性t
‑
ifnγ细胞数≥131.2评10分;介于113.4~131.2评9分;介于95.48~113.4评8分;介于50.72~95.48评5分;小于50.72评1分;
50.总细胞毒性t
‑
cd107a细胞数≥210.3评10分;介于186.8~210.3评9分;介于163.4~186.8评8分;介于103.3~163.4评5分;小于103.3评1分;
51.总细胞毒性t
‑
tnfα细胞数≥210.7评10分;介于184.8~210.7评9分;介于158.9~184.8评8分;介于87.28~158.9评5分;小于87.28评1分。
52.根据本发明较佳实施例,其中,s3中,按照如下方式分类:
53.t细胞储备包含的指标项为:初始t细胞(cd3+cd45ra+cd62l+)%、中央记忆t细胞(cd3+cd45ra
‑
cd62l+)%、总初始t细胞(cd3+cd45ra+cd62l+)数、总中央记忆t细胞(cd3+cd45ra
‑
cd62l+)数;
54.固有免疫系统包含的指标项为:总nk细胞数、总tcrγδt细胞数、nk
‑
ifnγ%、总nk
‑
ifnγ细胞数;
55.nk细胞杀伤功能包含的指标项为:总nk细胞数、nk
‑
ifnγ%、总nk
‑
ifnγ细胞数、nk
‑
tnfα%、总nk
‑
tnfα细胞数、总nk
‑
cd107a细胞数;
56.t细胞平衡包含的指标项为:th细胞(cd3+cd4+)%、总th细胞数、细胞毒性t细胞(cd3+cd8+)%、cd4:cd8比例、treg细胞(cd3+cd4+cd25+cd127
‑
/low)%、总treg细胞数;
57.t细胞活化包含的指标项为:活化t淋巴细胞(cd3+hla
‑
dr+)%、抑制性ts细胞(cd3+cd8+cd28
‑
)%、活化ts细胞(cd3+cd8+hla
‑
dr+)%、细胞毒性tc细胞(cd3+cd8+cd28+)%;
58.t细胞功能包含的指标项为:nk
‑
ifnγ%、总nk
‑
ifnγ细胞数、总nk
‑
cd107a细胞数、nk
‑
tnfα%、总nk
‑
tnfα细胞数、总t
‑
ifnγ%、总t
‑
ifnγ细胞数、总t
‑
cd107a细胞数、总t
‑
tnfα%、总t
‑
tnfα细胞数、总th
‑
ifnγ细胞数、总th
‑
tnfα细胞数、细胞毒性t
‑
ifnγ%、总细胞毒性t
‑
ifnγ细胞数、总细胞毒性t
‑
cd107a细胞数、细胞毒性t
‑
tnfα%、总细胞毒性t
‑
tnfα细胞数。
59.第二方面,在上述分析方法基础上,本发明提供一种基于离体血液样品的免疫力评估装置,其包括检测单元和数据分析单元;
60.所述检测单元用于对离体血液样品中分离的淋巴细胞中单个淋巴细胞表面的特异性表面蛋白进行检测,根据不同特异性表面蛋白显示阳性或阴性的结果,检测并计算出各类细胞的数量和所占比例;所述淋巴细胞为经过细胞刺激的淋巴细胞;
61.所述数据分析单元用于对检测单元的检测结果进行分析处理,所述分析处理包括将检测结果进行标准化评分,根据分值对应的细胞种类所表征的功能归为t细胞储备、固有免疫系统、nk细胞杀伤功能、t细胞平衡、t细胞活化和t细胞功能6大类;将各类中包含的指标项目的评分汇总,得到该类的分值;对受试者的所述六类的分值求和,用求和值与预设值进行比对,根据比对结果评估受试者的免疫力状况。
62.根据本发明较佳实施例,所述数据分析单元包含计算机存储介质,所述计算机存储介质存储有计算机程序指令,所述程序指令被执行以实现对检测单元的检测结果的分析处理。
63.根据本发明较佳实施例,所述检测单元的检测项目包括:总nk细胞数、总th细胞数、cd4:cd8比例、总treg细胞(cd3+cd4+cd25+cd127
‑
/low)数、总初始t细胞(cd3+cd45ra+cd62l+)数、总中央记忆t细胞(cd3+cd45ra
‑
cd62l+)数、总tcrγδt细胞数、总nk
‑
ifnγ细胞数、总nk
‑
cd107a细胞数、总nk
‑
tnfα细胞数、总t
‑
ifnγ细胞数、总t
‑
cd107a细胞数、总t
‑
tnfα细胞数、总th
‑
ifnγ细胞数、总th
‑
tnfα细胞数、总细胞毒性t
‑
ifnγ细胞数、总细胞毒性t
‑
cd107a细胞数和总细胞毒性t
‑
tnfα细胞数;初始t细胞%、中央记忆t细胞%、th细胞(cd3+cd4+)%、treg细胞(cd3+cd4+cd25+cd127
‑
/low)%、活化t淋巴细胞(cd3+hla
‑
dr+)%、抑制性ts细胞(cd3+cd8+cd28
‑
)%、活化ts细胞(cd3+cd8+hla
‑
dr+)%、细胞毒性t细胞(cd3+cd8+)%、细胞毒性tc细胞(cd3+cd8+cd28+)%、nk
‑
ifnγ%、nk
‑
tnfα%、总t
‑
ifnγ%、总t
‑
tnfα%、细胞毒t
‑
ifnγ%、细胞毒t
‑
tnfα%。
64.其中,总nk细胞数、总th细胞数、cd4:cd8比例、总nk
‑
ifnγn细胞数、总nk
‑
cd107a细胞数、总nk
‑
tnfα细胞数、总t
‑
ifnr细胞数、总t
‑
cd107a细胞数、总t
‑
tnfα细胞数、总th
‑
ifnγ细胞数、总th
‑
tnfα细胞数、总细胞毒性t
‑
ifnγ细胞数、总细胞毒性t
‑
cd107a细胞数和总细胞毒性t
‑
tnfα细胞数为该细胞在血液中的绝对数量,单位为109个/l;总treg细胞(cd3+cd4+cd25+cd127
‑
/low)数、总tcrγδt细胞数、总初始t细胞(cd3+cd45ra+cd62l+)数、总中央记忆t细胞(cd3+cd45ra
‑
cd62l+)数为该细胞在血液中的绝对数量,单位为106个/l;初始t细胞%、中央记忆t细胞%、th细胞(cd3+cd4+)%、treg细胞(cd3+cd4+cd25+cd127
‑
/low)%、活化t淋巴细胞(cd3+hla
‑
dr+)%、抑制性ts细胞(cd3+cd8+cd28
‑
)%、活化ts细胞(cd3+cd8+hla
‑
dr+)%、细胞毒性t细胞(cd3+cd8+)%、细胞毒性tc细胞(cd3+cd8+cd28+)%、nk
‑
ifnγ%、nk
‑
tnfα%、总t
‑
ifnγ%、总t
‑
tnfα%、细胞毒t
‑
ifnγ%、细胞毒t
‑
tnfα%为该特异性表面蛋白阳性细胞在该类细胞中的百分比值。
65.根据实际检测结果,计算如下细胞在每l血液中的绝对数量:总treg细胞数、总tcrγδt细胞数、总初始t细胞数、总中央记忆t细胞(cd3+cd45ra
‑
cd62l+)数、总nk
‑
ifnγ细胞、总nk
‑
cd107a细胞、总nk
‑
tnfα细胞、总t
‑
ifnγ细胞、总t
‑
cd107a细胞、总t
‑
tnfα细胞、总th
‑
ifnγ细胞、总th
‑
tnfα细胞、总细胞毒性t
‑
ifnγ细胞、总细胞毒性t
‑
cd107a细胞、总细胞毒性t
‑
tnfα细胞。
66.计算方式如下:
67.总treg细胞数=treg细胞(cd3+cd4+cd25+cd127
‑
/low)%检测值*总t淋巴细胞(cd3+)数*1000;
68.总tcrγδt细胞数=tcrγδt细胞(cd3+tcrγδ+)%检测值*总t淋巴细胞(cd3+)数*1000;
69.总初始t细胞数=初始t细胞(cd3+cd45ra+cd62l+)%检测值*总t淋巴细胞(cd3+)数*1000;
70.总中央记忆t细胞(cd3+cd45ra
‑
cd62l+)数=中央记忆t细胞(cd3+cd45ra
‑
cd62l+)%检测值*总t淋巴细胞(cd3+)数*1000;
71.总nk
‑
ifnγ细胞数=nk细胞(cd3
‑
cd56+)
‑
ifnγ%检测值*总nk细胞数;
72.总nk
‑
cd107a细胞数=nk细胞(cd3
‑
cd56+)
‑
cd107a检测值*总nk细胞数;
73.总nk
‑
tnfα细胞数=nk细胞(cd3
‑
cd56+)
‑
tnfα检测值*总nk细胞数;
74.总t
‑
ifnγ细胞数=总t
‑
ifnγ%检测值*总t淋巴细胞(cd3+)数;
75.总t
‑
cd107a细胞数=总t
‑
cd107a%检测值*总t淋巴细胞(cd3+)数;
76.总t
‑
tnfα细胞数=总t
‑
tnfα%检测值*总t淋巴细胞(cd3+)数;
77.总th
‑
ifnγ细胞=th
‑
ifnγ%检测值*总th细胞数;
78.总th
‑
tnfα细胞=th
‑
tnfα%检测值*总th细胞数;
79.总细胞毒性t
‑
ifnγ细胞=细胞毒性t
‑
ifnγ%检测值*总细胞毒性t细胞(cd3+
cd8+)数;
80.总细胞毒性t
‑
cd107a细胞=细胞毒性t
‑
cd107a%检测值*总细胞毒性t细胞(cd3+cd8+)数;
81.总细胞毒性t
‑
tnfα细胞=细胞毒性t
‑
tnfα%检测值*总细胞毒性t细胞(cd3+cd8+)数。
82.本发明还涉及一种计算机设备,其包括存储器、处理器及存储在存储器上并可在处理器上运行的计算机程序,其中,所述处理器执行所述计算机程序以实现:根据从离体血液中分离的淋巴细胞被刺激前后不同特异性表面蛋白呈显示阳性或阴性的结果所检测和计算出来的各类细胞的数量和所占比例获得免疫力评估结果;
83.其中,所述检测和计算出来的各类细胞的数量包括:
84.总nk细胞数、总th细胞数、cd4:cd8比例、总treg细胞(cd3+cd4+cd25+cd127
‑
/low)数、总初始t细胞(cd3+cd45ra+cd62l+)数、总中央记忆t细胞(cd3+cd45ra
‑
cd62l+)数、总tcrγδt细胞数、总nk
‑
ifnγ细胞数、总nk
‑
cd107a细胞数、总nk
‑
tnfα细胞数、总t
‑
ifnγ细胞数、总t
‑
cd107a细胞数、总t
‑
tnfα细胞数、总th
‑
ifnγ细胞数、总th
‑
tnfα细胞数、总细胞毒性t
‑
ifnγ细胞数、总细胞毒性t
‑
cd107a细胞数和总细胞毒性t
‑
tnfα细胞数;
85.所述比例包括:初始t细胞%、中央记忆t细胞%、th细胞(cd3+cd4+)%、treg细胞(cd3+cd4+cd25+cd127
‑
/low)%、活化t淋巴细胞(cd3+hla
‑
dr+)%、抑制性ts细胞(cd3+cd8+cd28
‑
)%、活化ts细胞(cd3+cd8+hla
‑
dr+)%、细胞毒性t细胞(cd3+cd8+)%、细胞毒性tc细胞(cd3+cd8+cd28+)%、nk
‑
ifnγ%、nk
‑
tnfα%、总t
‑
ifnγ%、总t
‑
tnfα%、细胞毒t
‑
ifnγ%、细胞毒t
‑
tnfα%。
86.优选地,所述数据分析单元还包括:矩阵输入模块,用于接收所述标准化的评分值,将所述标准化评分值以矩阵形式输入到所述计算模块;
87.输出模块,用于将得到的分析结果输出。
88.(三)有益效果
89.本发明基于对受试者血液样品的高通量单细胞功能分析,在检测的项目中还引入各类细胞的刺激响应的检测,将常规的检测项和刺激响应结果均采用标准化评分机制得到无单位的标准化分值,之后根据细胞种类所表征的功能归为t细胞储备、固有免疫系统、nk细胞杀伤功能、t细胞平衡、t细胞活化和t细胞功能6大类;将各类中包含的全部指标项目的评分汇总,得到该类的分值;最后对受试者的所述六类的分值求和,用求和值与预设值进行比对,根据比对结果评估受试者的免疫力状况。本发明可实现对受试者免疫系统的整体水平更加全面、更加精确且量化的评估。
附图说明
90.图1为使用十字门画出ifn
‑
γ和il17a、il4的阳性细胞的示例。
91.图2为在cd4门和cd8门内以画出pd1+细胞、tim3+细胞、lag3+细胞的比例的示例。
具体实施方式
92.为了更好的解释本发明,以便于理解,下面结合附图,通过具体实施方式,对本发明作详细描述。
93.本发明分为如下几个部分:
94.(一)淋巴细胞分离与淋巴细胞刺激与检测
95.本步骤要使用的试剂和来源及储存条件如下表:
[0096][0097]
1、采用常规方法通过密度离心法分离淋巴细胞,取受试者静脉血10ml,置于紫盖edta抗凝管中,用人淋巴细胞分离液(东方华辉,货号25610)分离淋巴细胞。分离具体步骤如下:
[0098]
(1)取3支50ml离心管,分别标注
①
分离液、
②
血液样本、
③
pbmc。
[0099]
(2)向
①
号50ml离心管中加入15ml人单个核细胞分离液。
[0100]
(3)向
②
号50ml离心管中加入5ml(样本体积不低于5ml)全血,然后向该离心管中加入氯化钠溶液至35ml,将血液样本稀释,并充分混匀。
[0101]
(4)将
②
号50ml离心管中稀释后的血液样本缓慢移至到
①
号50ml离心管内,使分离液和血液样本保持界线分明。
[0102]
(5)然后在2000rpm,升速2,降速0的条件下离心20min。
[0103]
(6)弃掉部分上清液,用移液枪将
①
号50ml离心管内的单个核细胞移至到标有pbmc的
③
号50ml离心管中,然后加入等体积的氯化钠溶液,混匀。
[0104]
(7)然后在2000rpm,升速9,降速9的条件下离心5min。
[0105]
(8)弃掉上清,向该离心管中加入培养基1
‑
2ml,重悬细胞。
[0106]
2、淋巴细胞刺激与检测
[0107]
(1)取细胞悬浮液10ul加入到1.5mlep管中,向其中加入10ul细胞染色液,然后加细胞缓冲液稀释至10倍(细胞数多的样本,可加大稀释倍数),充分混匀后,取10ul加入到牛鲍计数板中的计数池中,使之充满,无气泡。
[0108]
(2)计数完成后,按照每孔1.5*106的细胞量(每孔需要加入细胞悬浮液的体积为:
1.5*106/6.25*106=0.24ml=240ul,需要补充培养基的量为:1000ul
‑
240ul=760ul)计算每孔加入细胞悬浮液的体积,在24孔板中,每孔加入1.5*106个细胞,然后补充加入培养基至1ml,需要铺3个孔。
[0109]
(3)向其中加入2ulcellactivationcocktail(thermofisher,00
‑
4970
‑
93)并充分混匀。
[0110]
(4)然后置于37度co2培养箱中培养3小时。
[0111]
(5)取出后将3个孔标记ifn
‑
γ、ifn
‑
γ
‑
iso、tnf
‑
α,向ifn
‑
γ孔中加入cd107a
‑
apc(biolegend,328620)2ul,向ifn
‑
γ
‑
iso孔中加入igg1
‑
apc(biolegend,)0.2ul,然后使用移液枪将其充分混匀。
[0112]
(6)置于37度co2培养箱中再培养1小时。
[0113]
(7)取出后,再另外取3支1.5mlep管,并标记ifn
‑
γ、ifn
‑
γ
‑
iso、tnf
‑
α,将其样本对应移至到1.5mlep管中,离心,4min,2000rpm。
[0114]
(8)弃掉上清,向其中加入88ul2%fbs,使细胞悬浮,然后分别做如下处理:
[0115]
①
向ifn
‑
γep管中,分别加入2ul的cd3
‑
apc/cy7(biolegend,300426)、cd4
‑
pe/cy7(biolegend,300512)、cd8apacificblue(biolegend,301033)、cd19
‑
fitc(biolegend,200045)、7aad(biolegend,420404)抗体,使用涡旋器轻轻地涡旋混匀。
[0116]
②
向ifn
‑
γ
‑
isoep管中,分别加入2ul的cd3
‑
apc/cy7、cd4
‑
pe/cy7、cd8apacificblue、cd19
‑
fitc、7aad抗体,使用涡旋器轻轻地涡旋混匀。
[0117]
③
向tnf
‑
αep管中,分别加入2ul的cd3
‑
apc(biolegend,)、cd4
‑
pe/cy7(biolegend,300512)、cd8apacificblue(biolegend,301033)、cd56
‑
fitc(biolegend,318304)、cd19
‑
apc/cy7(biolegend,363010)、cd14
‑
percp(biolegend,367110)抗体,使用涡旋器轻轻地涡旋混匀。
[0118]
(9)将各ep管置于4℃冰箱,孵育10min。
[0119]
(10)取出,加入1ml2%fbs清洗,离心,4min,2000rpm。
[0120]
(11)标记ifn
‑
γ
‑
iso的ep管,弃上清,加入100ul2%fbs,重悬上机。
[0121]
(12)胞内抗原染色:
[0122]
①
将标记ifn
‑
γ、tnf
‑
αep管,弃掉上清,向洗净的细胞中加入250ul fix/permeabilization固定破膜剂,4度避光孵育20min。
[0123]
②
取出后,加入1mlpermwashbuffer(保持细胞透化),离心,250g,5min。
[0124]
③
弃掉上清,向其中加入98ul的2%fbs,使细胞悬浮。向ifn
‑
γ管中加入2ulifn
‑
γ
‑
pe混合于50ulpermwashbuffer中;向tnf
‑
α管中加入2ul tnf
‑
α
‑
pe混合于50ulpermwashbuffer中,将其混匀置于4度,避光孵育30min。
[0125]
④
取出后,加入1mlpermwashbuffer(保持细胞透化),离心,250g,5min。弃掉上清液,加入200ulpermwashbuffer,等待上机。
[0126]
分析方案:在fsc、ssc图中圈中细胞门,后去黏连、死细胞后进行分析,在cd3/ssc门内设门cd3+细胞群,双击该门后选择cd4/cd8双参数门,画出cd4+cd8
‑
细胞,双击此门,再选择ifn
‑
γ和il17a、ifn
‑
γ和il4双参数门,选择十字门画出ifn
‑
γ和il17a、il4的阳性细胞(如图1所示,为一名受试者血液样品的按照上述方式分析都结果)。
[0127]
(二)淋巴细胞亚群检测
[0128]
本步骤需要使用的试剂和来源及保存方式如下表:
[0129][0130]
具体操作如下:
[0131]
1、样本染色(细胞表面抗原染色)及裂红:
[0132]
(1)全血细胞混匀后用细胞计数仪进行计数。
[0133]
(2)分别取100ul(样本体积不低于100ul)全血加入到1.5mlep管中。
[0134]
(3)向其中分别加入2ulcd3
‑
apc(biolegend,300412)、cd56
‑
pe(biolegend,200055)、cd4
‑
pe/cy7(biolegend,300512)、cd8
‑
fitc(biolegend,)、cd45pacificblue(biolegend,304029)、cd16
‑
pe(biolegend,302008)、cd19
‑
apc/cy7(biolegend,363010)、7aad(biolegend,420404)抗体,混匀,避光4℃孵育10min。
[0135]
(4)取出向其中加入1ml2%fbs,2000rpm离心4min。
[0136]
(5)弃掉上清液,向其中加入配置好的裂解液1ml(按照1:10比例添加裂解液),混匀后室温避光10~15min(由于裂解时间过长会对细胞表面抗原造成影响,所以应尽量避免裂解时间过长)。
[0137]
(6)红细胞裂解后若液体为透明红色即为裂解完成,为浑浊不透明红色表未示裂解成功,必要时需要进行二次裂解。
[0138]
(7)裂解后离心,4min,2000rpm。
[0139]
(8)弃掉上清,加入1ml2%fbs,2000rpm离心4min。
[0140]
(9)弃掉上清,加入200ul2%fbs,重悬细胞,上机。
[0141]
2、分析方案
[0142]
(1)初步设门:圈定细胞门p1门后,在p1门内设置cd3/ssc显示cd3占所有有核细胞
的比例。
[0143]
(2)在cd3门内,以“十字门”的方式画出cd4+cd8+细胞、cd4
‑
cd8+细胞、cd4+cd8
‑
细胞。
[0144]
(3)在p1门内,以“十字门”的方式画出cd3+cd56+细胞、cd3
‑
cd19+细胞、cd3
‑
cd56+细胞。
[0145]
(4)报告中应体现cd3+细胞、cd3
‑
cd56+细胞、cd3+cd56+细胞、cd3
‑
cd19+细胞、cd19+细胞所占有核细胞的比值以及粒细胞、单核细胞、淋巴细胞的比例。
[0146]
(5)报告中还应体现cd4+cd8+细胞、cd4
‑
cd8+细胞、cd4+cd8
‑
细胞占cd3+t淋巴细胞的比例。
[0147]
(三)淋巴细胞免疫抑制受体检测
[0148]
本步骤需要使用的试剂和来源及保存方式如下表:
[0149][0150]
具体操作如下:
[0151]
(1)全血细胞混匀后用细胞计数仪进行计数。
[0152]
(2)取100ul(样本体积不低于100ul)全血加入到1.5mlep管中。
[0153]
(3)向其中分别加入2ullag3
‑
apc(美天旎,130
‑
119
‑
567)、cd8pacificblue(biolegend,301033)、tim3
‑
pe(biolegend,345006)、ctla
‑
4bv421(biolegend,369605)、pd1
‑
fitc(biolegend,329904)、cd4
‑
pe/cy7(biolegend,300512)、cd3
‑
apc/cy7(biolegend,300426)、7aad抗体(biolegend,420404),混匀,避光4℃孵育10min;
[0154]
(4)取出向其中分别加入1ml2%fbs,2000rpm离心4min。
[0155]
(5)弃掉上清液,向其中加入配置好的裂解液1ml(按照1:10比例添加裂解液),混匀后室温避光10~15min(由于裂解时间过长会对细胞表面抗原造成影响,所以应尽量避免裂解时间过长)。
[0156]
(6)红细胞裂解后若液体为透明红色即为裂解完成,为浑浊不透明红色表未示裂解成功,必要时需要进行二次裂解。
[0157]
(7)裂解后离心,4min,2000rpm。
[0158]
(8)弃掉上清,加入1ml2%fbs,2000rpm离心4min。
[0159]
(9)弃掉上清,加入200ul2%fbs,重悬细胞,上机。
[0160]
2、分析方案
[0161]
(1)初步设门:圈定细胞门p1门后,在p1门内设置cd3/ssc显示cd3占所有有核细胞的比例。
[0162]
(2)在cd3门内,以“十字门”的方式画出cd4+pd1+/cd4
‑
pd1+/cd4+tim3+/cd4
‑
tim3+/
[0163]
cd4+tim3+/cd4+lag3+/cd4
‑
lag3+细胞。
[0164]
(3)再在cd4门和cd8门内以画出pd1+细胞、tim3+细胞、lag3+细胞的比例。如图2所示,为一名受试者血液样品的按照上述方式分析都结果。
[0165]
报告中应体现pd1、lag3、tim3占cd3+t细胞以及cd4+t细胞、cd8+t细胞的比例及参考范围,对超出参考值的淋巴细胞亚群作出分析。
[0166]
(四)淋巴细胞记忆表型检测
[0167]
本步骤需要使用的试剂和来源及保存方式如下表:
[0168]
[0169][0170]
具体操作如下:
[0171]
1、样本染色(细胞表面抗原染色)及裂红:
[0172]
(1)全血细胞混匀后用细胞计数仪进行计数。
[0173]
(2)分为四管,treg、gdt、pb2、45ra,分别取100ul(样本体积不低于100ul)全血加入到1.5mlep管中。
[0174]
(3)向treg管加入2ulcd3
‑
apc/cy7、cd4
‑
pe/cy7、cd8
‑
pb、cd25
‑
apc、cd127
‑
pe、hla
‑
dr
‑
fitc、7aad抗体,混匀,避光4℃孵育10min。
[0175]
(4)向gdt管加入2ulgd
‑
pb、ab
‑
pe、cd3
‑
apc、7aad抗体,混匀,避光4℃孵育10min。
[0176]
(5)向pb
‑
2管加入2ulcd3
‑
apc、cd45
‑
pb、cd20
‑
fitc、cd56+16
‑
pe、cd19
‑
pecy7、cd27
‑
apc
‑
vio770、7aad抗体,混匀,避光4℃孵育10min。
[0177]
(6)向45ra管加入2ulcd8
‑
pb、cd62l
‑
viogreen、45ra
‑
fitc、cd28
‑
pecy7、cd95
‑
apc、cd3
‑
apc
‑
vio770、7aad抗体,混匀,避光4℃孵育10min。
[0178]
(7)取出向其中加入1ml2%fbs,2000rpm离心4min。
[0179]
(8)弃掉上清液,向其中加入配置好的裂解液1ml(按照1:10比例添加裂解液),混匀后室温避光10~15min(由于裂解时间过长会对细胞表面抗原造成影响,所以应尽量避免裂解时间过长)。
[0180]
(9)红细胞裂解后若液体为透明红色即为裂解完成,为浑浊不透明红色表未示裂解成功,必要时需要进行二次裂解。
[0181]
(10)裂解后离心,4min,2000rpm。
[0182]
(11)弃掉上清,加入1ml2%fbs,2000rpm离心4min。
[0183]
(12)弃掉上清,加入200ul2%fbs,重悬细胞,上机。
[0184]
2、分析方案
[0185]
(1)初步设门:圈定细胞门p1门后,在p1门内设置cd3/ssc显示cd3占所有有核细胞的比例。
[0186]
(2)在cd3门内,以“十字门”的方式画出cd4+cd8+细胞、cd4
‑
cd8
‑
细胞、cd4+cd25+cd127
‑
细胞、cd45ra+cd62l+细胞、cd45ra
‑
cd62l
‑
细胞、cd8+cd28
‑
细胞、cd8+hla
‑
dr+细胞、
cd8+cd28+细胞。
[0187]
(3)在p1门内,以“十字门”的方式画出cd3+tcrγδ+细胞、cd3+hla
‑
dr+细胞。
[0188]
采集30位健康人与肿瘤患者,进行上述的样本处理方案以及分析方案,获得如下的各项指标的检测值:
[0189]
总nk细胞数、总th细胞数、cd4:cd8比例、总treg细胞(cd3+cd4+cd25+cd127
‑
/low)数、总初始t细胞(cd3+cd45ra+cd62l+)数、总中央记忆t细胞(cd3+cd45ra
‑
cd62l+)数、总tcrγδt细胞数、总nk
‑
ifnγ细胞数、总nk
‑
cd107a细胞数、总nk
‑
tnfα细胞数、总t
‑
ifnγ细胞数、总t
‑
cd107a细胞数、总t
‑
tnfα细胞数、总th
‑
ifnr细胞数、总th
‑
tnfα细胞数、总细胞毒性t
‑
ifnγ细胞数、总细胞毒性t
‑
cd107a细胞数和总细胞毒性t
‑
tnfα细胞数;初始t细胞%、中央记忆t细胞%、th细胞(cd3+cd4+)%、treg细胞(cd3+cd4+cd25+cd127
‑
/low)%、活化t淋巴细胞(cd3+hla
‑
dr+)%、抑制性ts细胞(cd3+cd8+cd28
‑
)%、活化ts细胞(cd3+cd8+hla
‑
dr+)%、细胞毒性t细胞(cd3+cd8+)%、细胞毒性tc细胞(cd3+cd8+cd28+)%、nk
‑
ifnγ%、nk
‑
tnfα%、总t
‑
ifnγ%、总t
‑
tnfα%、细胞毒t
‑
ifnγ%、细胞毒t
‑
tnfα%。
[0190]
上述检测值中,总nk细胞数、总th细胞数、cd4:cd8比例、总nk
‑
ifnγn细胞数、总nk
‑
cd107a细胞数、总nk
‑
tnfα细胞数、总t
‑
ifnr细胞数、总t
‑
cd107a细胞数、总t
‑
tnfα细胞数、总th
‑
ifnγ细胞数、总th
‑
tnfα细胞数、总细胞毒性t
‑
ifnγ细胞数、总细胞毒性t
‑
cd107a细胞数和总细胞毒性t
‑
tnfα细胞数为该细胞在血液中的绝对数量,单位为109个/l;总treg细胞(cd3+cd4+cd25+cd127
‑
/low)数、总tcrγδt细胞数、总初始t细胞(cd3+cd45ra+cd62l+)数、总中央记忆t细胞(cd3+cd45ra
‑
cd62l+)数为该细胞在血液中的绝对数量,单位为106个/l;初始t细胞%、中央记忆t细胞%、th细胞(cd3+cd4+)%、treg细胞(cd3+cd4+cd25+cd127
‑
/low)%、活化t淋巴细胞(cd3+hla
‑
dr+)%、抑制性ts细胞(cd3+cd8+cd28
‑
)%、活化ts细胞(cd3+cd8+hla
‑
dr+)%、细胞毒性t细胞(cd3+cd8+)%、细胞毒性tc细胞(cd3+cd8+cd28+)%、nk
‑
ifnγ%、nk
‑
tnfα%、总t
‑
ifnγ%、总t
‑
tnfα%、细胞毒t
‑
ifnγ%、细胞毒t
‑
tnfα%为该特异性表面蛋白阳性细胞在该类细胞中的百分比值。
[0191]
(五)原始检测数据的换算及标准评分
[0192]
根据上述实际检测值,计算如下细胞在每l血液中的绝对数量:总treg细胞数、总tcrγδt细胞数、总初始t细胞数、总中央记忆t细胞(cd3+cd45ra
‑
cd62l+)数、总nk
‑
ifnγ细胞、总nk
‑
cd107a细胞、总nk
‑
tnfα细胞、总t
‑
ifnγ细胞、总t
‑
cd107a细胞、总t
‑
tnfα细胞、总th
‑
ifnγ细胞、总th
‑
tnfα细胞、总细胞毒性t
‑
ifnγ细胞、总细胞毒性t
‑
cd107a细胞、总细胞毒性t
‑
tnfα细胞。
[0193]
上述各指标计算方式如下:
[0194]
总treg细胞数=treg细胞(cd3+cd4+cd25+cd127
‑
/low)%检测值*总t淋巴细胞(cd3+)数*1000;
[0195]
总tcrγδt细胞数=tcrγδt细胞(cd3+tcrγδ+)%检测值*总t淋巴细胞(cd3+)数*1000;
[0196]
总初始t细胞数=初始t细胞(cd3+cd45ra+cd62l+)%检测值*总t淋巴细胞(cd3+)数*1000;
[0197]
总中央记忆t细胞(cd3+cd45ra
‑
cd62l+)数=中央记忆t细胞(cd3+cd45ra
‑
cd62l+)%检测值*总t淋巴细胞(cd3+)数*1000;
[0198]
总nk
‑
ifnγ细胞数=nk细胞(cd3
‑
cd56+)
‑
ifnγ%检测值*总nk细胞数;
[0199]
总nk
‑
cd107a细胞数=nk细胞(cd3
‑
cd56+)
‑
cd107a检测值*总nk细胞数;
[0200]
总nk
‑
tnfα细胞数=nk细胞(cd3
‑
cd56+)
‑
tnfα检测值*总nk细胞数;
[0201]
总t
‑
ifnγ细胞数=总t
‑
ifnγ%检测值*总t淋巴细胞(cd3+)数;
[0202]
总t
‑
cd107a细胞数=总t
‑
cd107a%检测值*总t淋巴细胞(cd3+)数;
[0203]
总t
‑
tnfα细胞数=总t
‑
tnfα%检测值*总t淋巴细胞(cd3+)数;
[0204]
总th
‑
ifnγ细胞=th
‑
ifnγ%检测值*总th细胞数;
[0205]
总th
‑
tnfα细胞=th
‑
tnfα%检测值*总th细胞数;
[0206]
总细胞毒性t
‑
ifnγ细胞=细胞毒性t
‑
ifnγ%检测值*总细胞毒性t细胞(cd3+cd8+)数;
[0207]
总细胞毒性t
‑
cd107a细胞=细胞毒性t
‑
cd107a%检测值*总细胞毒性t细胞(cd3+cd8+)数;
[0208]
总细胞毒性t
‑
tnfα细胞=细胞毒性t
‑
tnfα%检测值*总细胞毒性t细胞(cd3+cd8+)数。根据实际检测值“总nk细胞数、th细胞(cd3+cd4+)%、总th细胞数、细胞毒性t细胞(cd3+cd8+)%、cd4:cd8比例、treg细胞(cd3+cd4+cd25+cd127
‑
/low)%、初始t细胞(cd3+cd45ra+cd62l+)、中央记忆t细胞(cd3+cd45ra
‑
cd62l+)、活化t淋巴细胞(cd3+hla
‑
dr+)、抑制性ts细胞(cd3+cd8+cd28
‑
)、活化ts细胞(cd3+cd8+hla
‑
dr+)、细胞毒性tc细胞(cd3+cd8+cd28+)、nk
‑
ifnγ%、nk
‑
tnfα%、总t
‑
ifnγ%、总t
‑
tnfα%、细胞毒性t
‑
ifnγ%、细胞毒性t
‑
tnfα%”和经过上述计算方法计算所得的“总treg细胞数、总tcrγδt细胞数、总初始t细胞数、总中央记忆t细胞(cd3+cd45ra
‑
cd62l+)数、总nk
‑
ifnγ细胞、总nk
‑
cd107a细胞、总nk
‑
tnfα细胞、总t
‑
ifnγ细胞、总t
‑
cd107a细胞、总t
‑
tnfα细胞、总th
‑
ifnγ细胞、总th
‑
tnfα细胞、总细胞毒性t
‑
ifnγ细胞、总细胞毒性t
‑
cd107a细胞、总细胞毒性t
‑
tnfα细胞”,最终得如下表所示各指标:
[0209][0210][0211]
将采集的60位健康人与肿瘤患者(各30名)的上述34个指标结果,按照如下规则进行评分:
[0212]
[0213][0214]
注:黑体数字对应的指标是指标值越小其分值越高;其他则是越大分值越高,指标大小介于两个判断值之间的取两个判断值之间的分值。
[0215]
(六)分类汇总和评估判断
[0216]
按照上述规则,得到60名受试者的上述各指标的标准化分值,然后按照下表分成6大类:
[0217][0218]
按照上述表格,分别将各类别所包含的指标项目的标准分值代入,得到对应t细胞储备、固有免疫系统、nk细胞杀伤功能、t细胞平衡、t细胞活化、t细胞功能的各类别总分。
[0219]
如下表所示,为60个受试者血液样品(p+数字编号)按照前文详述的分析方法各类别的分值总和,以及对应每个受试者6大类分值的总和。
[0220]
[0221][0222]
其中,总分在200以上的为健康人、200
‑
125为免疫受损(肿瘤、感染高风险人群)、125以下为免疫缺陷。
[0223]
需要说明的是,前文所述各检测项目可由现有仪器设备完成,也可以由集成了现有仪器功能的仪器设备完成,而关于各检测项目的数据处理、计算转化、标准化评分、分类、汇总、与预设值比较大小等均可由计算机设备来完成,而该计算机设备安装软件程序,该软件程序能够被驱动执行对各检测项目的数据处理、计算转化、标准化评分、分类、汇总、与预设值比较的功能。
[0224]
以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1