一种保健品中芬太尼类药物的高分辨质谱检测方法
1.本发明涉及保健品检测技术领域,具体涉及一种保健品中芬太尼类药物的高分辨质谱检测方法。
背景技术:
2.芬太尼类物质属于阿片类化合物中的一大类。我国作为药品批准上市的有芬太尼、瑞芬太尼和舒芬太尼3个品种,阿芬太尼尚处于药物研发阶段。国际上常用的剂型有注射剂、透皮贴剂、舌下片剂、鼻腔喷剂等。其中芬太尼在医学临床中常被用于晚期癌症的麻醉性镇痛。但是,芬太尼类物质具备阿品类化合物的显著性特点——易成瘾,依赖性强,戒断难,而且大剂量使用还可导致昏迷、呼吸抑制,甚至死亡。因此,芬太尼类物质是继传统毒品、合成毒品之后的第三代毒品——“实验室毒品”中的重要成分,并于2019年5月1日起被列入《非药用类麻醉药品和精神药品管制品种增补目录》,该目录中收录了25种芬太尼类物质。
3.目前,对于芬太尼类化合物的检测多采用三重四级杆的质谱检测技术,且主要针对血液、尿液、环境水等样本,且样本的前处理方法多采用液
‑
液萃取的方式。而保健品中的成分复杂,尤其是含有植物提取物的保健品,仅靠液
‑
液萃取无法实现对待测物中芬太尼类药物的提取净化。因此,现有技术中针对血液、尿液、环境水等样本的前处理方法并不适用于保健品中芬太尼类药物的检测。另外,目前采用的三重四级杆质谱检测技术是基于其定量/定性离子对检测,质量数精确到小数点后1位,在假阳性及假阴性判定方面存在一定缺陷。因此,在进出口岸上货物查验批次成持续增长态势的前提和背景下,研究开展针对25种芬太尼类化合物的高效液相色谱
‑
高分辨质谱的筛查及确证方法研究具有十分重要的意义。
技术实现要素:
4.为解决上述问题,本发明的目的在于提供一种保健品中芬太尼类药物的高分辨质谱检测方法,该方法采用内标法与mcx阳离子固相萃取柱相结合,有助于消除保健品的基质效应影响,且采用qe高分辨质谱,其质量分析器以纺锤结构为主要特点,同时结合prm(平行反应监测)技术实现精确定量。
5.为实现上述目的,本发明的技术方案如下。
6.一种保健品中芬太尼类药物的高分辨质谱检测方法,包括以下步骤:
7.s1、待测样品前处理
8.向待测样品中加入内标,并用乙腈水溶液进行提取、离心;上清液过mcx固相萃取柱,先用水和甲醇淋洗,弃去淋洗液;再用氨水甲醇溶液洗脱,并收集洗脱液;然后去除洗脱液中的溶剂,残留物用初始流动相溶解并过滤,得到样品溶液;
9.s2、标准工作溶液制备
10.量取混合标准工作溶液及内标标准工作溶液,用初始流动相稀释配制成质量浓度
为0.01~10ng/ml的系列标准工作溶液,其中内标物浓度均为10.0ng/ml;
11.s3、高效液相色谱
‑
高分辨质谱检测
12.利用高效液相色谱
‑
高分辨质谱仪分别对s2的标准工作溶液和s1的样品溶液进行检测分析,得到相关色谱图;
13.s4、标准曲线绘制
14.将s2配制的标准工作溶液采用内标法进行定量分析,将标准溶液中的待测组分与内标物的峰面积比值与待测组分的浓度进行线性回归分析,得到标准曲线线性回归方程;
15.s5、待测组分浓度计算
16.将s1的样品溶液进行测定,测得样品中待测组分与内标物的峰面积比值,代入标准曲线线性回归方程,计算得到待测组分的浓度。
17.进一步,s1中,内标为芬太尼
‑
d5,内标在样品溶液中的浓度为10.0ng/ml。
18.进一步,s1中,乙腈水溶液的体积百分比为75%;氨水甲醇溶液的体积百分比为5%。
19.进一步,s1中,mcx固相萃取柱在使用前,用5ml甲醇和5ml水活化处理。
20.进一步,s2中,混合标准工作溶液中的芬太尼药物标准品包括乙酰阿法甲基芬太尼盐酸盐、阿芬太尼盐酸盐、α
‑
甲基芬太尼盐酸盐、β
‑
羟基芬太尼盐酸盐、β
‑
羟基
‑3‑
甲基芬太尼、(
±
)
‑
顺式
‑3‑
甲基芬太尼盐酸盐、3
‑
甲基硫代芬太尼、对氟芬太尼、瑞芬太尼盐酸盐、柠檬酸舒芬太尼、芬太尼、乙酰芬太尼、丁酰芬太尼、(
±
)
‑
β
‑
羟基硫代芬太尼盐酸盐、4
‑
氟丁酰芬太尼、异丁酰芬太尼盐酸盐、奥芬太尼、卡芬太尼、呋喃芬太尼盐酸盐、盐酸丙烯酰芬太尼、戊酰芬太尼盐酸盐、4
‑
氟异丁酰芬太尼、n
‑
苯乙基
‑4‑
哌啶酮、4
‑
苯胺基
‑
n
‑
苯乙基哌啶、羟化去甲芬太尼。
21.进一步,s3中,高效液相色谱条件为:
22.采用的色谱柱为thermoaccucorephenyl
‑
hexyl,长度为100mm,内径为2.1mm,填料粒径为2.6μm;柱温45℃,进样量10μl。
23.进一步,s3中,采用梯度洗脱程序,流动相a为甲酸与甲酸铵溶液的混合液,其中,甲酸的体积百分比为0.1%,甲酸铵溶液的浓度为2mmol/l;流动相b为甲酸与甲醇/乙腈溶液的混合液,其中,甲酸的体积百分比为0.1%,甲醇/乙腈的体积比为50:50;
24.以体积百分比计,所述梯度洗脱程序具体为:时刻0~1.0min,采用5%的流动相a和95%的流动相b,流速为0.3ml/min;时刻1.0~10.0min,采用5%的流动相a和95%的流动相b,流速为0.3ml/min;时刻10.0~11.6min,采用95%的流动相a和5%的流动相b,流速为0.3ml/min;时刻11.6~15.5min,采用5%的流动相a和95%的流动相b,流速为0.3ml/min。
25.进一步,s3中,高分辨质谱条件为:
26.采用加热的电喷雾正离子源q
‑
exactive;喷雾电压3.5kv,透镜电压55v,毛细管温度350℃,辅助气温度320℃;鞘气压力40arb,辅助气压力15arb,一级及二级扫描分辨率17500,采用离子化模式同时平行反应监测;agc1e5,maximum it 50ms。
27.本发明的有益效果:
28.1、本发明的方法采用内标法与mcx阳离子固相萃取柱相结合,有助于消除保健品的基质效应影响;且采用qe高分辨质谱,其质量分析器以纺锤结构为主要特点,同时结合prm(平行反应监测)技术实现精确定量。本发明对于非液体样品定量限为0.2μg/kg,液体样
品为0.05μg/kg,其灵敏度是现有技术的50倍以上。
29.2、本发明的方法利用高分辨质谱的平行反应监测(prm)技术可实现对保健品中25种芬太尼类化合物的定量及定性检测,提升我国芬太尼类物质的监测预警、检验鉴定和危害评估水平。
30.3、本发明的方法针对的是保健品中芬太尼类药物的检测,而保健品成分较为复杂,且其有效成分多为植物提取物,基质较为复杂,而采用外标法定量无法消除基质效应影响,故本发明的方法采用内标法定量。
31.4、芬太尼类化合物的结构含有苯环及吡啶环结构,且属于碱性化合物,mcx阳离子固相萃取对这类化合物的净化有明显优势,且本发明基质针对的是保健品,保健品基质比较复杂,mcx对复杂基质尤其是含有植物提取物的基质净化具有优势。
附图说明
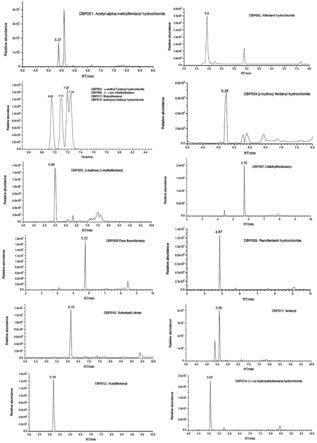
32.图1~图2是本发明实施例中25种芬太尼类化合物和内标的色谱图。
33.图3~图6是本发明实施例中液体样品的色谱图。
34.图7~图8是本发明实施例中液体样品的检出限加标prm色谱图。
35.图9~图12是本发明实施例中固体样品的色谱图。
36.图13~图14是本发明实施例中固体样品的检出限加标prm色谱图。
具体实施方式
37.为了使本发明的目的、技术方案及优的更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
38.基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
39.本发明实施例所涉及到的试剂和材料及实验仪器如下:
40.a、试剂和材料
41.芬太尼
‑
d5内标储备液(100μg/ml,甲醇,achemtek公司);
42.保健品试样(液体/固体;均于市场购买);
43.甲醇、乙腈、甲酸、甲酸铵均为色谱纯(merck公司);其他试剂均为分析纯;
44.25种芬太尼类化合物储备液(各化合物的质量浓度均为100μg/ml,achemtek公司);
45.其余试剂和耗材,如无特殊说明,均可在市场上购买得到。
46.b、实验仪器
47.液相色谱
‑
高分辨质谱仪(thermo q
‑
exactive,美国赛默飞世尔公司);涡旋振荡仪(ika vortex genius3,德国ika公司);高速冷冻离心机(allegratm x
‑
22r centrifuge,德国beckman公司);高纯水发生器(milli
‑
q advantage
‑
10/elix,美国millpore公司);氮吹浓缩仪(turbovap lv,美国caliper公司);
48.mcx固相萃取柱(3ml,60mg,美国waters公司);0.22μm有机滤膜(岛津,日本);色谱柱thermoaccucorephenyl
‑
hexyl(100
×
2.1mm,2.6μm,美国赛默飞世尔公司)。
49.实施例1
50.保健品中芬太尼类药物的高分辨质谱检测,内标法/mcx固相萃取柱。
51.1、内标标准工作溶液制备
52.内标标准工作溶液(1.0μg/ml):量取芬太尼
‑
d5内标储备液1ml,于10ml容量瓶中,用甲醇稀释至刻度,配置成浓度为10.0μg/ml的内标中间液,再量取该中间液1.0ml鱼10ml容量瓶中,摇匀,得1.0μg/ml内标工作溶液。0℃~4℃避光保存,有效期6个月。
53.2、试样前处理
54.液体样品:精确称取液体样品5.00g置于50ml离心管中,加入芬太尼
‑
d5内标标准工作溶液(浓度1.0μg/ml)40μl,加入20ml乙腈水溶液(体积百分比为75%),涡旋混合,振荡提取30min,在4500r/min下离心5min;取上清液5ml过mcx固相萃取柱(使用前用5ml甲醇,5ml水活化),上清液以1.5ml/min的速度上样于活化过的mcx固相萃取柱。用5ml水,5ml甲醇淋洗,弃去淋洗液;用10ml体积百分比为5%的氨水甲醇溶液洗脱,并收集洗脱液;洗脱液于40℃氮气吹至近干,用1ml初始流动相(5%的流动相a+95%的流动相b)溶解残渣,涡旋混匀,0.22μm有机滤膜过滤,得到样品溶液,供液相色谱
‑
高分辨质谱测定。
55.固体样品:精确称取固体样品1.00g,按照液体样品的方法处理后进样。
56.3、标准工作溶液制备
57.混合标准工作溶液(1.0μg/ml):分别量取25种芬太尼类化合物储备液各1ml,于10ml容量瓶中,在混合过程中用氮气吹扫,并用甲醇稀释至刻度,配制成浓度均为10.0μg/ml混合标准中间液,再量取该中间液1.0ml于10ml容量瓶中,摇匀,得混合标准工作溶液(各化合物的浓度均为1.0μg/ml)。0℃~4℃避光保存,有效期6个月。
58.量取混合标准工作溶液及内标标准工作溶液,用初始流动相(5%的流动相a+95%的流动相b)稀释配制成质量浓度为0.01、0.02、0.05、0.1、0.5、1.0、2.0、5.0、10ng/ml的系列标准工作溶液,其中内标物浓度均为10.0ng/ml。
59.4、高效液相色谱条件
60.色谱柱:thermoaccucorephenyl
‑
hexyl(100
×
2.1mm,2.6μm,美国赛默飞世尔公司);柱温45℃,进样量10μl。流动相a:0.1%(v/v)甲酸,2mmol/l甲酸铵溶液;b:0.1%甲酸,甲醇/乙腈(v/v=50:50);梯度洗脱程序如表1所示。
61.表1梯度洗脱程序
62.时间/min流速/ml/mina/%b/%0~1.00.35951.0~10.00.359510.0~11.60.395511.6~15.50.359515.5~20.00.3595
63.5、质谱条件
64.离子化模式:加热电喷雾正离子源,喷雾电压3.5kv,透镜电压55v,毛细管温度350℃,辅助气温度320℃;鞘气压力40arb,辅助气压力15arb,一级及二级扫描分辨率17500,采用离子化模式同时平行反应监测,agc1e5,maximum it 50ms。质谱扫描参数如表2所示。25种芬太尼类化合物和内标的保留时间如图1~图2所示。
65.表2芬太尼类化合物精确质量数、保留时间及nce电压
[0066][0067]
6、标准曲线的制备及待测组分浓度计算
[0068]
量取适量混合标准工作溶液及内标标准工作溶液,用初始流动相稀释配制成0.01、0.02、0.05、0.1、0.5、1.0、2.0、5.0、10ng/ml系列标准溶液(内标物浓度均为10.0ng/
ml)。以标准溶液中被测组分峰面积和芬太尼
‑
d5内标物峰面积的比值为纵坐标,标准溶液浓度为横坐标,绘制标准曲线。具体结果如表2所示。
[0069]
对制备的样品溶液进行测定,测得样品中待测组分与内标物的峰面积比值,代入标准曲线线性回归方程,计算得到待测组分的浓度。
[0070]
表2混合标准工作溶液中25种芬太尼类化合物的标准工作曲线
[0071][0072]
[0073]
由表2结果可知,采用标准曲线进行校正,25种芬太尼化合物在0.01~10ng/ml范围内呈良好线性关系,相关系数均大于0.99。
[0074]
7、方法的定量限、检出限和加标回收率
[0075]
7.1液体样品的定量限、检出限和加标回收率
[0076]
液体样品加入低浓度25种芬太尼化合物混标,重复5次测定,确定液体保健品中25种芬太尼类化合物的检出限、定量限和加标回收率,结果见图3~8和表3~4,其中图3~图6是液体样品的色谱图,图7~图8是液体样品的检出限加标色谱图。
[0077]
加标回收率的计算公式如下:
[0078][0079]
式中:
[0080]
x—试样中待分析物的残留量,单位为微克每千克(g/kg);
[0081]
a—试样溶液中被测物质的峰面积;
[0082]
a
is
—试样溶液中内标的峰面积;
[0083]
a
′
is
—标准工作溶液中内标的峰面积;
[0084]
a
s
—标准工作溶液中被测物质的峰面积;
[0085]
c
s
—标准工作溶液中被测物质的浓度,单位为纳克每毫升(ng/ml);
[0086]
c
′
is
‑
标准工作溶液中内标的浓度,单位为纳克每毫升(ng/ml);
[0087]
c
is
—试样溶液中内标的浓度,单位为纳克每毫升(ng/ml);
[0088]
v—试样溶液定容体积,单位为毫升(ml);
[0089]
m—试料质量,单位为克(g)。
[0090]
表3液体样品的检出限和加标回收率
[0091][0092]
由表3结果可知,液体保健品中,β
‑
羟基芬太尼盐酸盐(no.4)、β
‑
羟基
‑3‑
甲基芬太尼(no.5)、3
‑
甲基硫代芬太尼(no.7)、对氟芬太尼(no.8)、柠檬酸舒芬太尼(no.10)、芬太尼(no.11)、(
±
)
‑
β
‑
羟基硫代芬太尼盐酸盐(no.14)、4
‑
氟丁酰芬太尼(no.15)、异丁酰芬太尼盐酸盐(no.16)、奥芬太尼(no.17)、卡芬太尼(no.18)、呋喃芬太尼盐酸盐(no.19)、盐酸丙烯酰芬太尼(no.20)、戊酰芬太尼盐酸盐(no.21)、4
‑
氟异丁酰芬太尼(no.22)、4
‑
苯胺基
‑
n
‑
苯乙基哌啶(no.24)检出限为0.05μg/kg;乙酰阿法甲基芬太尼盐酸盐(no.1)、阿芬太尼盐酸盐(no.2)、α
‑
甲基芬太尼盐酸盐(no.3)、(
±
)
‑
顺式
‑3‑
甲基芬太尼盐酸盐(no.6)、乙酰芬太尼(no.12)、丁酰芬太尼(no.13)、n
‑
苯乙基
‑4‑
哌啶酮(no.23)、羟化去甲芬太尼(no.25)检出限为0.1μg/kg;瑞芬太尼盐酸盐(no.9)检出限为0.5μg/kg。
[0093]
对空白样品进行3水平6平行的加标回收率测定,平均回收率在70.0%~128.0%之间,相对标准偏差为0.3%~3.5%之间。
[0094]
表4液体样品的定量限和加标回收率
[0095][0096]
由表4结果可知,液体保健品中
‑
羟基芬太尼盐酸盐(no.4)、
‑
羟基
‑3‑
甲基芬太尼(no.5)、3
‑
甲基硫代芬太尼(no.7)、对氟芬太尼(no.8)、芬太尼(no.11)、(
±
)
‑‑
羟基硫代芬太尼盐酸盐(no.14)4
‑
氟丁酰芬太尼(no.15)、奥芬太尼(no.17)、卡芬太尼(no.18)、呋喃芬太尼盐酸盐(no.19)、戊酰芬太尼盐酸盐(no.21)、4
‑
氟异丁酰芬太尼(no.22)、4
‑
苯胺基
‑
n
‑
苯乙基哌啶(no.24)定量限为0.1μg/kg,乙酰阿法甲基芬太尼盐酸盐(no.1)、阿芬太尼盐酸盐(no.2)、
‑
甲基芬太尼盐酸盐(no.3)、(
±
)
‑
顺式
‑3‑
甲基芬太尼盐酸盐(no.6)、乙酰芬太尼(no.12)、丁酰芬太尼(no.13)、异丁酰芬太尼(no.16)、n
‑
苯乙基
‑4‑
哌啶酮(no.23)、羟化去甲芬太尼(no.25)定量限为0.2μg/kg,瑞芬太尼定量限为1.0μg/kg。
[0097]
对空白样品进行3水平6平行的加标回收率测定,平均回收率在70.7%~112.6%之间,相对标准偏差为0.6%~4.8%之间。
[0098]
7.2固体样品的定量限、检出限和加标回收率
[0099]
固体样品加入低浓度25种芬太尼化合物混标,重复5次测定,确定固体保健品中25种芬太尼类化合物的检出限、定量限和加标回收率,结果见图9~14和表5
‑
6,其中图9~12是固体样品的色谱图,图13~14是固体样品的检出限加标色谱图。
[0100]
表5固体样品的检出限和加标回收率
[0101][0102]
由表5结果可知,固体保健品中,阿芬太尼盐酸盐(no.2)、α
‑
甲基芬太尼盐酸盐(no.3)、(
±
)
‑
顺式
‑3‑
甲基芬太尼盐酸盐(no.6)、瑞芬太尼盐酸盐(no.9)、柠檬酸舒芬太尼(no.10)、芬太尼(no.11)、乙酰芬太尼(no.12)、丁酰芬太尼(no.13)、4
‑
氟丁酰芬太尼(no.15)、异丁酰芬太尼盐酸盐(no.16)、卡芬太尼(no.18)、盐酸丙烯酰芬太尼(no.20)、4
‑
氟异丁酰芬太尼(no.22)、4
‑
苯胺基
‑
n
‑
苯乙基哌啶(no.24)、羟化去甲芬太尼(no.25)检出限为0.05μg/kg;乙酰阿法甲基芬太尼盐酸盐(no.1)、3
‑
甲基硫代芬太尼(no.7)、对氟芬太尼(no.8)、戊酰芬太尼盐酸盐(no.21)、n
‑
苯乙基
‑4‑
哌啶酮(no.23)检出限为0.1μg/kg;奥芬太尼(no.17)、呋喃芬太尼盐酸盐(no.19)检出限为0.2μg/kg、β
‑
羟基芬太尼盐酸盐(no.4)、β
‑
羟基
‑3‑
甲基芬太尼(no.5)、(
±
)
‑
β
‑
羟基硫代芬太尼盐酸盐(no.14)检出限为0.5μg/kg。
[0103]
对空白样品进行3水平6平行的加标回收率测定,平均回收率在70.2%~114.0%之间,相对标准偏差为0.4%~4.3%之间。
[0104]
表6固体样品的定量限和加标回收率
[0105][0106][0107]
由表6结果可知,固体保健品中,阿芬太尼盐酸盐(no.2)、乙酰阿法甲基芬太尼盐酸盐(no.1)、α
‑
甲基芬太尼盐酸盐(no.3)、瑞芬太尼盐酸盐(no.9)、柠檬酸舒芬太尼(no.10)、芬太尼(no.11)、乙酰芬太尼(no.12)、丁酰芬太尼(no.13)定量限为0.10μg/kg,(
±
)
‑
顺式
‑3‑
甲基芬太尼盐酸盐(no.6)、4
‑
氟丁酰芬太尼(no.15)、异丁酰芬太尼盐酸盐(no.16)、卡芬太尼(no.18)、盐酸丙烯酰芬太尼(no.20)、4
‑
氟异丁酰芬太尼(no.22)、4
‑
苯胺基
‑
n
‑
苯乙基哌啶(no.24)、羟化去甲芬太尼(no.25)定量限为0.20μg/kg,3
‑
甲基硫代芬太尼(no.7)、对氟芬太尼(no.8)、奥芬太尼(no.17)、呋喃芬太尼盐酸盐(no.19)、戊酰芬太尼盐酸盐(no.21)、n
‑
苯乙基
‑4‑
哌啶酮(no.23)定量限为0.50μg/kg,β
‑
羟基芬太尼盐酸盐(no.4)、β
‑
羟基
‑3‑
甲基芬太尼(no.5)、(
±
)
‑
β
‑
羟基硫代芬太尼盐酸盐(no.14)检出限为1.0μg/kg。
[0108]
对空白样品进行3水平6平行的加标回收率测定,平均回收率在75.0%~111.0%之间,相对标准偏差为0.2%~2.2%之间。
[0109]
对比实施例1
[0110]
保健品中芬太尼类药物的高分辨质谱检测方法,内标法/prime hlb固相萃取柱。该方法与实施例1的方法基本相同,其不同之处在于,
[0111]
将mcx固相萃取柱替换为prime hlb固相萃取柱。
[0112]
采用prime hlb固相萃取柱净化时,乙酰芬太尼、(
±
)
‑
β
‑
羟基硫代芬太尼盐酸盐、卡芬太尼、戊酰芬太尼盐酸盐、羟化去甲芬太尼回收率差,其中乙酰芬太尼及羟化去甲芬太尼回收率低于50%,(
±
)
‑
β
‑
羟基硫代芬太尼盐酸盐、卡芬太尼、戊酰芬太尼盐酸盐回收率高于150%。故prime hlb固相萃取柱不适用于对25种芬太尼类化合物的净化。
[0113]
对比实施例2
[0114]
保健品中芬太尼类药物的高分辨质谱检测方法,外标法/prime hlb固相萃取柱。该方法与实施例1的方法基本相同,其不同之处在于,
[0115]
将mcx固相萃取柱替换为prime hlb固相萃取柱,且采用外标法。
[0116]
同上,采用prime hlb固相萃取柱净化时,乙酰芬太尼、(
±
)
‑
β
‑
羟基硫代芬太尼盐酸盐、卡芬太尼、戊酰芬太尼盐酸盐、羟化去甲芬太尼回收率差,其中乙酰芬太尼及羟化去甲芬太尼的回收率低于50%,(
±
)
[0117]
‑
β
‑
羟基硫代芬太尼盐酸盐、卡芬太尼、戊酰芬太尼盐酸盐的回收率高于150%。故prime hlb固相萃取柱不适用于对25种芬太尼类化合物的净化。且由于样品基质较为复杂,对每一种样品基质采用基质标准曲线定量工作量较大,故实验中我们采用了内标法进行定量分析,内标法可完全校正基质带来的影响。
[0118]
通过实施例1和对比实施例1的测试,分别采用mcx固相萃取柱和hlb固相萃取柱等分别进行基质效应考察,由此说明,mcx对复杂基质尤其是含有植物提取物的基质净化具有优势。
[0119]
通过实施例1和对比实施例2的测试,分别采用内标法和外标法分别进行基质效应考察,由此说明采用外标法无法消除基质效应影响,而本技术采用内标法可以消除基质效应影响。
[0120]
以上仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1