用于猪囊尾蚴病的上转发光颗粒检测卡,其制备方法及应用
1.本发明涉及生物检测技术领域,具体讲,涉及用于猪囊尾蚴病的上转发光颗粒检测卡,其制备方法及应用。
背景技术:
2.猪囊尾蚴病是猪带绦虫的幼虫寄生在猪或人的体内而引起的一种人兽共患寄生虫病。该病不但给养猪业造成巨大损失,而且危害人类的健康,严重的甚至导致死亡。目前世界卫生组织(who)已将其列为“17个被忽略的热带疾病之一”,并将其确定为重点研究和控制的疾病。联合国粮食与农业组织(fao)和世界卫生组织公布的“十大危害人类食源性寄生虫”,囊尾蚴位列首位,同时也是我国“国家卫生部规划防治的重点寄生虫病之一”。猪带绦虫囊尾蚴病的诊断依赖于成像技术或免疫学诊断。成像技术中对于囊虫病最具诊断价值的是计算机扫描(ct)和磁共振成像(mri),但这两项技术的准确性与敏感性高度依赖囊肿定位与感染阶段,因此具有敏感性低、成本高和可用性低等缺点,欲适时普遍作为猪囊尾蚴病的检测,从某种角度来说缺少可行性。另外,两种检测方法无法实现对虫卵入侵到成囊阶段及人患绦虫病的检测。免疫学检测方法具有适用性好的特点被广泛应用,目前猪带绦虫/囊尾蚴病免疫学检测研究所依赖的抗原多为囊液抗原、虫体抗原、排泄/分泌抗原等,这些抗原不仅来源有限、制备繁琐,而且与多种寄生虫存在严重交叉反应。基于单一重组抗原的血清学方法,如酶联免疫吸附法(elisa)和酶联免疫电转移印迹法(eitb)检测方法克服上述缺点,但在检测上仍然会与类似疾病(如包虫病、细颈棘球蚴病)存有交叉反应,更为重要的缺陷是需要昂贵的仪器设备、专业的操作人员、复杂的数据处理及灵敏性不理想等问题,致使两种方法多停留在研究的初级阶段,而不能满足适时检测的要求。胶体金免疫层析检测方法的出现,一定程度上解决了上述检测法中存在的问题,但其方法难以实现对样品的多重分析和定量分析,结果判断的误差多种免疫学检测法无法避免的问题。另外,现今诊断所选表达重组抗原,其抗原决定簇极易翻译后因修饰而改变或内部错综折叠,导致所具有的活性明显降低或失去活性,影响检测的效果,欲想将工厂化生产高质量和数量的重组抗原难度较大,并且所产生的费用非常的昂贵。因此,加强筛选特异性重组抗原或单克隆抗体,建立检测抗体或抗原的新型免疫学诊断方法显得尤为重要。而依赖于重组抗原/抗体研制高敏感性、高特异性和适用性强的检测产品将成为当下研究的热点,同时也是解决上述检测方法缺点的新手段。因此,而依赖于重组抗原/抗体研制高敏感性、高特异性和适用性强的检测产品将成为当下研究的热点,同时也是解决上述检测方法缺点的新手段。
3.鉴于此,特提出本发明。
技术实现要素:
4.本发明的首要发明目的在于提供一种检测猪囊尾蚴病的上转发光颗粒的检测卡。
5.本发明的第二发明目的在于提供该检测猪囊尾蚴病的上转发光颗粒的检测卡的制备方法。
6.本发明的第三发明目的在于提供该检测猪囊尾蚴病的上转发光颗粒的检测卡的应用。
7.为了完成本发明的发明目的,采用的技术方案为:
8.本发明涉及一种用于猪囊尾蚴病的上转发光颗粒检测卡,所述上转发光颗粒检测卡包括样品垫、结合垫、分析膜和吸水垫;所述分析膜上设置有检测线和质控线;所述结合垫上包被有上转换发光颗粒标记的山羊抗猪igg,所述检测线上包被有猪囊尾蚴活性蛋白gp50;编码所述猪囊尾蚴活性蛋白gp50的核苷酸序列如seq id no:1所示。
9.本发明还涉及上述上转发光颗粒检测卡的制备方法,包括以下步骤:
10.s1、制备猪囊尾蚴活性蛋白gp50;
11.s2、制备上转换发光颗粒标记的山羊抗猪igg;
12.s3、在检测线上固定所述猪囊尾蚴活性蛋白gp50,在质控线上固定兔抗山羊igg,在结合垫上包被上转换发光颗粒标记的山羊抗猪igg;
13.优选的,所述猪囊尾蚴活性蛋白gp50的溶液的浓度为1~5mg/ml,优选为2mg/ml;
14.更优选的,所述兔抗山羊igg的溶液的浓度为30~80μg/ml,优选为50μg/ml;
15.进一步优选的,上转换发光颗粒标记的山羊抗猪igg的溶液的浓度为0.3~1mg/ml,优选为0.5mg/ml。
16.本发明还涉及一种用于检测猪囊尾蚴病的试剂盒,所述试剂盒中含有上述上转发光颗粒检测卡和上样缓冲液;
17.优选的,所述上样缓冲液的组成为含有质量体积比为2%的牛血清白蛋白、体积比为0.1%的吐温20和体积比为0.9%的聚乙二醇单辛基苯基醚的、浓度为0.03m的pbs溶液;所述上样缓冲液的ph为7.2。
18.本发明还涉及上述猪囊尾蚴病抗体检测卡在囊尾蚴病检测中的应用。
19.本发明至少具有以下有益的效果:
20.本发明利用囊尾蚴时期的原核表达重组蛋白gp50作为猪囊虫病的抗体检测抗原,所建立的猪囊虫上转发光免疫层析检测方法与elisa相比具有高的灵敏性和特异性,显著缩短了检测范围以及检测时间。
21.本发明制备的检测卡具有抗原制备简单,无需专业人员操作、简便快捷和结果易判读等elisa不具备的优点,且在检测时不与其他寄生虫阳性血清发生交叉反应,特异性高、稳定性好,实用性较强、容易保存、可用于大批量检测,极具市场前景。
附图说明
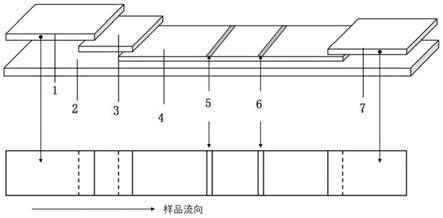
22.图1本发明检测卡结构示意图;其中:
[0023]1‑
样品垫、2
‑
底板、3
‑
结合垫、4
‑
分析膜、5
‑
检测线、6
‑
质控线、7
‑
吸水垫。
[0024]
图2本发明检测卡检测结果判定示意图;其中,8
‑
加样孔、5
‑
检测线、6
‑
质控线;检测卡a)为阳性结果示意图;b)为阴性结果示意图;c)为无效示意图。
[0025]
图3为gp50蛋白sds
‑
page图;其中,m:protein marker;1:上样;2:流出;3
‑
4:20mm imidazole洗脱组分;5:50mm imidazole洗脱组分;6:500mm imidazole洗脱组分。
[0026]
图4为gp50蛋白western blot图;其中,m:protein marker;1:纯化后蛋白。
[0027]
图5是本发明与不同虫体血清样本的测试结果图。
具体实施方式
[0028]
下面将更详细地描述本发明的优选实施方式。虽然以下描述了本发明的优选实施方式,然而应该理解,可以以各种形式实现本发明而不应被这里阐述的实施方式所限制。相反,提供这些实施方式是为了使本发明更加透彻和完整,并且能够将本发明的范围完整地传达给本领域的技术人员。
[0029]
本发明实施例涉及一种用于猪囊尾蚴病的上转发光颗粒检测卡,包括样品垫、结合垫、分析膜和吸水垫;分析膜上设置有检测线和质控线。具体的,结合垫上包被有上转换发光颗粒(ucp)标记的山羊抗猪igg,检测线上包被有猪囊尾蚴活性蛋白gp50,质控线包被有兔抗山igg;其中,本发明所采用的猪囊尾蚴活性蛋白gp50,其表达的gp50抗原基因去除5’端原基因(ay212944.1)51个碱基所表达的信号肽,同时去除3’端影响蛋白跨膜域和基本结构的基因序列250个碱基,使表达重组gp50(17
‑
276aa)蛋白具有更好的反应原性,核苷酸序列如seq id no:1所示。本发明用于定性或半定量检测猪或其他动物血清中抗体,为囊尾蚴病的诊断提供参考。本发明利用囊尾蚴时期的原核表达重组蛋白gp50作为猪囊虫病的抗体检测抗原,所建立的猪囊虫上转发光免疫层析检测方法与elisa相比具有高的灵敏性和特异性,显著缩短了检测范围以及检测时间。
[0030]
seq id no:1所示的核苷酸序列为:
[0031]
ggatccgaaaacgcaccaaagatgtggggtagccgtgtaatcggtaagccatctggtccttctgataccatgtcctacgagtacaacgacaactaccgtacggtcctgatcaacgactccgtgctgggtactatgtctatcaagcgcaaccagtgcatgctgtgggagactaagccttggggtgaaccgtgtaacatctttccgggttacgtcaacatcactctgaacaacgtgaccgcacagaaaatcatggagatggacgaaatcaccgctcgtccgcgtgtagcatctactacgttcttcgtgccgcactgtaacttcaccaaaccggctccgggtgaagttgatgtatggacttctttcccgctgtctcgtttcgtgaaagacaccccgtggtttcgtgttgacttcgctgtgggtggcgcaaattatgactctactgcaactttcgacattaacgccacctccctgtgcttctggcgtggcactaaactgctgcataaaggcgctgaattctgcaccgatatggttaaagacgaaagcgccgatctgcgtgttttccgtggcgttttcccgcgcaaaacgaatatttcccgcgaatcttttgcctttgctggcctgaaaaccgcgctgacggtttccattgattacagccagtccggcatttccccggaagttgcggattgcaaacaatatgcgaaagttaaagatctgagcaccctggtagcgaccatgccggcgtatgcgaccaaaaccagcacccgcaataacagcaaaaccaccagctaactcgag。
[0032]
待检血清样本为阳性时,样本中的抗囊尾蚴igg首先与结合垫上ucp与山羊抗猪igg结合物相结合,流经分析膜时,与检测线上gp50抗原相结合,未被结合的继续向前涌动被质控线捕获;当待检血清样本为阴性时,ucp标记的山羊抗猪igg只被质控线捕获。
[0033]
在本发明实施例的某一具体实施方式中,猪囊尾蚴活性蛋白gp50的包被量为10~20mg,优选为12mg。优选包被量的条件下,与血清结合效率最高。
[0034]
在本发明实施例的某一具体实施方式中,结合垫上山羊抗猪igg的包被量为5~15mg,优选10mg;结合垫上上转换发光颗粒的包被量为50~150mg,优选100mg。优选包被量的条件下,与c线上兔抗山羊igg结合效率最高。
[0035]
在本发明实施例的某一具体实施方式中,质控线包被有兔抗山igg,兔抗山igg的包被量为3~7mg,优选5mg。优选包被量的条件下,与山羊抗猪igg结合效率最高。
[0036]
具体的,检测卡中采用的原料的指标为:
[0037]
样品垫:玻璃纤维素膜,厚度优选为0.70mm;
[0038]
结合垫:玻璃纤维素膜,厚度优选为0.25mm;
[0039]
分析膜:硝酸纤维素膜,平均孔径优选为5μm;
[0040]
吸水垫:纤维素膜,厚度优选为1.10mm;
[0041]
粘性底衬:附有压力敏感胶的聚氯乙烯板,厚度0.25mm;
[0042]
检测卡组装塑料外壳。
[0043]
本发明实施例还涉及上转发光颗粒检测卡的制备方法,包括以下步骤:
[0044]
s1、制备猪囊尾蚴活性蛋白gp50;
[0045]
s2、制备上转换发光颗粒标记的山羊抗猪igg;
[0046]
s3、在检测线上固定所述猪囊尾蚴活性蛋白gp50,在质控线上固定兔抗山羊igg,在结合垫上包被上转换发光颗粒标记的山羊抗猪igg。
[0047]
其中:猪囊尾蚴活性蛋白gp50的溶液的浓度为1~5mg/ml,优选为2mg/ml;兔抗山igg的溶液的浓度为30~80μg/ml,优选为50μg/ml;上转换发光颗粒标记的山羊抗猪igg的溶液的浓度为0.3~1mg/ml,优选为0.5mg/ml。
[0048]
其中:制备猪囊尾蚴活性蛋白gp50包括:
[0049]
s11、提取囊尾蚴虫体总rna;取囊尾蚴时期虫体总rna混合后进行反转录,得到cdna模板;
[0050]
s12、采用如seq id no.2、seq id no.3所示的引物进行扩增,回收后与载体连接、转化、培养、抽提,获得重组质粒,并进行酶切鉴定;
[0051]
s13、扩大培养,纯化,得到所述猪囊尾蚴活性蛋白gp50。
[0052]
在本发明实施例的某一具体实施方式中,制备猪囊尾蚴活性蛋白gp50的方法为:
[0053]
(1)囊尾蚴时期虫体总rna的提取
[0054]
用trizol试剂提取囊尾蚴的rna,每50~100mg的样品加入1ml trizol试剂。提取的虫体总rna,1%琼脂糖凝胶电泳鉴定提取总rna的完整性,核酸蛋白测定仪检测其纯度。稀释各组样品总rna浓度至60ng/μl,
‑
80℃保存备用。
[0055]
(2)重组活性蛋白的表达与纯化
[0056]
取囊尾蚴时期虫体总rna混合后进行反转录,得到cdna模板,优化基因序列如seq id no.1所示,其表达的gp50抗原基因去除5’端原基因(ay212944.1)51个碱基所表达的信号肽,同时去除3’端影响蛋白跨膜域和基本结构的基因序列250个碱基,使表达重组gp50(17
‑
276aa)蛋白具有更好的反应原性,获得如seq id no:1所示的编码所述猪囊尾蚴活性蛋白gp50的核苷酸序列。
[0057]
将克隆重组子pgem
‑
t
‑
gp50经bamhi/xhoi双酶切产物与pet
‑
32a bamhi/xhoi双酶切后载体链接,转化重组子pet
‑
32a gp50到大肠杆菌,lb培养基培养,37℃培养至od600到达0.4
‑
0.6,加入1mol/l iptg,130rpm/min、37℃、5h振荡诱导表达。经菌体离心、超声破碎、低温高速离心、抽滤蛋白后,利用亲和层析技术纯化his标签的表达蛋白。经sds
‑
page、western blot分析鉴定后,
‑
80℃保存备用。
[0058]
在本发明实施例的某一具体实施方式中,制备上转换发光颗粒标记的山羊抗猪igg,包括:
[0059]
s21、活化上转换发光颗粒,该方法为现有技术;
[0060]
s22、将活化后上转换发光颗粒溶液与山羊抗猪igg溶液,混合搅拌1~2h;加入
bsa,反应15~30min;4~6℃13000rpm离心20~40分钟弃上清,即为上转换发光颗粒标记的山羊抗猪igg。
[0061]
优选的,活化后上转换发光颗粒溶液的浓度为0.2~1mg/ml,优选0.5mg/ml,山羊抗猪igg溶液的浓度为0.2~1mg/ml,优选0.5μg/ml,活化后上转换发光颗粒溶液与山羊抗猪igg溶液的体积比为1:20~100,优选1:50。
[0062]
在本发明实施例的某一具体实施方式中,上转换发光颗粒的活化具体为:
[0063]
(1)向上转发光纳米颗粒(ucp)加入异丙醇,充分将混合后加入84μl正硅酸乙酯(teos)搅拌,4℃12000r离心5min后,使用异丙醇清洗2次,重悬溶液充分搅拌。
[0064]
(2)加入3
‑
氨丙基三乙氧基硅烷(aptes)42℃搅拌30min,12000r 4℃离心5min后,使用dd h2o清洗,再用dd h2o重悬ucp颗粒。
[0065]
(3)向修饰后ucp颗粒加入2
‑
吗啉乙磺酸(mes)缓冲液,超声后,加入n
‑
羟基琥珀酰亚胺和1,3
‑
二甲氨基丙基
‑3‑
乙基碳二亚胺(edc)混匀,再次超声。
[0066]
(4)取200μl激活ucp颗粒,加入含有25μg抗体的20m m mes缓冲液至1ml,室温孵育2h。
[0067]
(5)4℃14000r离心15min,弃上清。加入1ml常规标记缓冲液重悬。
[0068]
在本发明实施例的某一具体实施方式中,上转发光颗粒检测卡的包被方法具体为:检测线上固定猪囊尾蚴表达纯化活性蛋白gp50,浓度为2mg/ml,质控线上固定兔抗山羊igg,浓度为50μg/ml,将上转换发光颗粒标记的山羊抗猪igg调至浓度为0.5mg/ml,将其喷涂于1.0cm
×
12.5cm的结合垫,并干燥备用。
[0069]
其中,常规标记缓冲液的组成为:0.05m的na2co3–
nahco3缓冲液,ph 9.5,4℃,预冷。
[0070]
本发明实施例还涉及一种用于检测猪囊尾蚴病的试剂盒,该试剂盒中含有上转发光颗粒检测卡和上样缓冲液;
[0071]
上样缓冲液的组成为含有质量体积比为2%的牛血清白蛋白、体积比为0.1%的吐温20和体积比为0.9%的聚乙二醇单辛基苯基醚的0.03m的pbs;
[0072]
上样缓冲液的ph为7.2。
[0073]
本发明实施例的试剂盒可特异性地针对猪等动物血清中的抗体,利用上转发光免疫分析仪检测15min后,可以检出是否感染囊尾蚴病。
[0074]
本发明实施例还涉及该猪囊尾蚴病抗体检测卡或试剂盒在囊尾蚴病检测中的应用。
[0075]
具体的,在应用时,将待测血清用样品稀释液稀释后,加入到检测卡加样孔中,室温静置5~20min,将检测卡插入upt生物传感器观察结果,根据t/c比值进行分析;
[0076]
优选的,判定条件为:
[0077]
阳性:在检测区(t)及控制区(c)各出现较高的峰,且cutoff>0.375时,判定检测结果为阳性;
[0078]
阴性:仅在控制区(c)出现一个较高的峰,且cutoff<0.375时,判定检测结果为阴性;
[0079]
无效:控制区(c)无较高峰出现,表明该次检测无效,重新进行加样检测。
[0080]
本发明所用原料,如无特殊说明,均为市售。
[0081]
实施例1颗粒硅化与氨基化修饰
[0082]
(1)向50mg的ucp颗粒加入16.7ml的异丙醇,超声2min后,磁力搅拌电热套中42℃搅拌30min。继续加入84μl正硅酸乙酯(teos)搅拌1h,4℃12000r离心5min后,使用异丙醇清洗两次,重悬溶液并超声30s,继续搅拌30min。
[0083]
(2)加入167μl的3
‑
氨丙基三乙氧基硅烷(aptes)磁力搅拌电热套中42℃搅拌30min,12000r 4℃离心5min后,使用去离子水清洗两次,再用500μl去离子水重悬ucp颗粒。
[0084]
(3)向0.5mg修饰后ucp颗粒加入500μl 20mm 2
‑
吗啉乙磺酸(mes)缓冲液,超声后,加入30μl n
‑
羟基琥珀酰亚胺(nhs)和30μl 1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺(edc)混匀,再次超声。
[0085]
(4)取200μl激活ucp颗粒,加入含有25μg抗体的20mm mes缓冲液至1ml,室温孵育2h。
[0086]
(5)4℃,14000r离心15min,弃上清。加入1ml偶联储存液重悬。
[0087]
实施例2猪囊尾蚴重组gp50(rtgp50)制备
[0088]
(1)重组蛋白的诱导表达
[0089]
a.虫体总rna的提取
[0090]
每50~100mg的样品加入1ml trizol试剂。玻璃匀浆器匀浆20min,研磨捣碎组织。室温静置5min。加入0.2ml氯仿/ml,剧烈振荡15s,室温静置3min。12000g、4℃离心15min,离心后混合液分为上、中、下三层。吸取上层无色水相于无菌离心管中,加入0.5ml异丙醇/ml,颠倒混匀,室温静置10min。12000g、4℃离心10min,弃上清。加入1ml 75%乙醇(depc水配制)洗涤rna沉淀。7500g、4℃离心5min,弃上清。将液体吸净,风干rna,用30μl无rnase的depc水溶解rna,55℃水浴10min。1%琼脂糖凝胶电泳鉴定提取总rna的完整性,核酸蛋白测定仪检测其纯度。稀释各组样品总rna浓度至60ng/μl,
‑
70℃保存备用。
[0091]
取囊尾蚴时期虫体总rna各0.3μg,反转录后,
‑
20℃保存。
[0092]
b.引物设计
[0093]
根据genbank数据库中gp50抗原基因,登录号:ay212944,序列设计目的基因pcr特异引物,送由上海生工合成。
[0094]
gp50抗原基因扩增所用模板为囊尾蚴cdna,扩增引物如下:
[0095]
seq id no:2
[0096]
gp50
‑
f:5
’‑
taatacgactcactataggg
‑3’
;
[0097]
seq id no:3
[0098]
gp50
‑
r:5
’‑
gctagttattgctcagcgg
‑3’
;
[0099]
下划线部分为引入的bam hi和xhoi酶切位点后进行胶回收。将回收纯化好的目的dna片段和载体进行连接。将连接产物全部采用42℃热激法进行转化,感受态菌株为top10,挑取转化后平板上的单菌落于试管中37℃220rpm/min培养过夜,抽提质粒,采用双bamhi/xhoi酶切鉴定,并将重组质粒送测序鉴定,获得含有如seq id no:1所示核苷酸序列的重组质粒。
[0100]
c.重组蛋白诱导表达与纯化:
[0101]
对验证正确转入质粒gp50的表达菌进行扩大培养,取10ml菌液接种于含50μg/ml kana的1l新鲜lb液体培养基中,置于震荡摇床中37℃180rpm培养至菌液od600约达到0.6
时,加入iptg,继续培养6h后,将菌液置于离心机中8000rpm,离心10min。弃上清,沉淀用5ml的1
×
pbs多次冲洗,然后用40ml细菌裂解液重悬后,反复冻融3
‑
4次后冰上超声破碎。超声条件为功率400w,超声时间3s,间歇时间3s,全程时间约为30min。超声破碎的菌体4℃8000rpm离心10min,弃掉上清,留沉淀,加5ml binding buffer重悬,4℃溶解过夜。4℃8000rpm离心30min,将溶液于直径0.45μm滤器过滤后备用。
[0102]
使用美国ge healthcare公司的akta purifier 100系统纯化his标签的表达蛋白。将流速调为1ml/min后,用20%乙醇洗泵,曲线平稳时,再将his
‑
trap hp柱与系统连接,用20%乙醇至曲线平稳后,再用bingding buffer平衡his
‑
trap hp柱至紫外吸收曲线平稳。紫外吸收峰调零后,流速调为0.5ml/min,用注射器进行蛋白上样,当bingding buffer洗脱峰平衡后改用elution buffer进行洗脱,出现洗脱峰后延迟500μl用无菌试管收集洗脱液,将洗脱的重组抗原,经pbs 4℃透析过夜及3kda超滤管浓缩后即得到重组抗原,最后通过sds
‑
page、western blot检验纯化结果。
[0103]
sds
‑
page检测结果如图3所示,western blot检测结果如图4所示。
[0104]
实施例3
[0105]
荧光专用黑色底板;
[0106]
样品垫xq
‑
y8:玻璃纤维素膜,厚度0.70mm;
[0107]
结合垫ahistrom8964:玻璃纤维素膜,厚度0.25mm;
[0108]
分析膜:硝酸纤维素膜shf1350225,平均孔径5μm;
[0109]
吸水垫h5072:纤维素膜,厚度1.10mm;
[0110]
粘性底衬:附有压力敏感胶的聚氯乙烯板,厚度0.25mm;
[0111]
检测卡组装塑料外壳;
[0112]
猪囊尾蚴病上转发光检测卡检测线和质控带喷膜浓度:
[0113]
检测线t上固定猪囊尾蚴表达纯化活性蛋白gp50,浓度为2mg/ml,质控带c固定兔抗山igg,浓度为50μg/ml,将硅化及其羧基修饰活化的上转换发光颗粒0.5mg/ml(实施例1制备)与山羊抗猪igg 0.5μg/ml,混合搅拌2h;加入bsa,反应15min;4
‑
6℃13000rpm离心0.5h弃上清,即为上转换发光颗粒山羊抗猪igg混合物,再用结合物稀释液悬起调至浓度为0.5mg/ml,将其喷涂于1.0cm
×
12.5cm的结合垫,并干燥备用;其中:
[0114]
gp50用量12mg;
[0115]
山羊抗猪igg用量10mg;
[0116]
兔抗山羊igg用量5mg;
[0117]
ucp
‑
nps用量100mg。
[0118]
结合物稀释液:0.01m磷酸盐缓冲溶液pbs,ph 7.2,含有1%质量浓度(w/v)bsa,10%(w/v)蔗糖,1%(v/v)tween
‑
20。
[0119]
沿检测时从左到右按照样品垫、结合垫、分析膜、吸水垫的顺序粘贴在粘性底板上,制成检测卡,具体方法为:按图1的示意图所示,将底板2、样品垫1、结合垫3、吸水垫7、分析膜4粘在一起,分析膜4上设置体有检测线5和质控线6,并用检测卡切割机将其切成4mm宽的检测卡,将检测卡放入试纸卡中,将试纸卡放入含有干燥剂的密封袋内,密封后于4℃保存备用。
[0120]
使用方法:将10μl血清与90μl上样缓冲液混合均匀后加入加样孔,静置15min后使
用上转发光生物传感器进行结果读取。传感器测定检测线和质控带峰面积,并以检测线/质控带值作为最终检测结果。图2为检测结果判定示意图,待测样本添加至加样孔8中,观察检测线5、质控线6的颜色变化。其中,检测卡a为阳性结果示意图;检测卡b为阴性结果示意图;检测卡c为无效示意图。
[0121]
上样缓冲液:0.03m pbs,ph 7.2,包括:2%(w/v)牛血清白蛋白,0.1%(v/v)吐温20,0.9%(v/v)聚乙二醇单辛基苯基醚。
[0122]
实验例1:本发明的cutoff(临界)值确定
[0123]
采用本发明的方法和酶联免疫吸附方法(elisa法)分别检测78份健康猪血清,每份血清检测三次并求平均值。用每份血清的检测平均值进行再计算,本发明求得的平均值为0.339,标准差为0.017,因此设定cutoff为0.375;elisa法求得的平均值为0.253,标准差为0.117,因此设定cutoff为0.486。
[0124]
酶联免疫吸附方法的步骤如下:
[0125]
(1)包被液稀释囊尾蚴蛋白抗原gp50至1μg/ml,每孔100μl进行包被,4℃过夜。
[0126]
(2)弃去酶标板中的溶液,加入洗涤液,摇床上重复5次。
[0127]
(3)加入100ul 1%bsa,室温封闭2h。
[0128]
(4)重复步骤(2)。
[0129]
(5)加入100ul按比例稀释处理后的猪血清,室温孵育1h。
[0130]
(6)重复步骤(2)。
[0131]
(7)加入100ul hrp标记的兔抗猪igg,1:2000倍稀释,孵育30min。
[0132]
(8)重复步骤(2)后,加入100ul的tmb底物显色液。
[0133]
(9)15min后,在450nm波长条件下进行吸光度检测,如果发现所得结果为阴性的2.1倍判定为阳性。
[0134]
实验例2:考察本发明制备的猪囊尾蚴病抗体检测卡灵敏性、特异性以及稳定性。
[0135]
(一)灵敏性试验:
[0136]
用囊尾蚴检测卡检测不同浓度下的猪血清中抗囊尾蚴抗体,将检测结果和酶联免疫吸附抗体检测方法进行对比。确保检测中应用的检测卡来自同一批次。
[0137]
酶联免疫吸附方法的步骤同实验例1。
[0138]
本发明检测卡与elisa分别检测78份阴性血清,elisa检测72为阴性,上转发光免疫层析技术检测77份为阴性。说明两种方法在检测动物猪囊尾蚴病方面一致率和吻合度较强;检测卡和elisa在敏感性上的差异无统计学意义,同时囊尾蚴重组抗原可以降低假阳性率。说明本发明的敏感性与elisa检测方法相当,而特异性高于elisa。同时又具备操作简单、快速和结果易判读等elisa不具备的优点,具有广泛推广空间,极具市场前景。
[0139]
(二)特异性检测:
[0140]
检测其他寄生虫阳性血清,主要有猪旋毛虫、弓形虫、亚洲带绦虫和华支睾吸虫阳性血清和阴性血清,并进行特异性分析,实验结果如图5所示。如图5可知,除猪囊尾蚴阳性血清外,其他血清均为阴性,即囊尾蚴病检测卡不与其他寄生虫发生交叉反应,满足其特异性要求。
[0141]
(三)重复性检测:
[0142]
选择不同批次的检测卡进行重复性分析。分别用4个不同批次的检测卡检测,经
elisa检测后的30份猪囊尾蚴感染阳性血清及20份正常猪阴性血清;4个不同批次的检测卡对30份阳性血清检测结果均为阳性,对20份阴性血清检测结果均为阴性,显示出本发明良好的灵敏性和特异性,且稳定性和重复性良好。
[0143]
(四)稳定性检测:
[0144]
将检测卡置于室温和4℃保存,前16周内每隔两周,16周后每隔一周检测猪阳性和阴性血清各10份。4℃条件下保存的检测卡在24周,敏感性和特异性均为100%,表明检测卡在4℃至少可保存6个月;室温条件下保存的检测卡在第16周,敏感性和特异性均为100%,且检测线和控制线的颜色均不存在明显的差异。从第18周起,t线和c线的颜色均变浅,故室温环境下可保存16周。证明本检测卡具有稳定性好、实用性强、容易保存等特点,具有市场开发价值。
[0145]
本技术虽然以较佳实施例公开如上,但并不是用来限定权利要求,任何本领域技术人员在不脱离本技术构思的前提下,都可以做出若干可能的变动和修改,因此本技术的保护范围应当以本技术权利要求所界定的范围为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1