PBMC的免疫系统重建能力的检测方法及应用与流程
pbmc的免疫系统重建能力的检测方法及应用
技术领域
1.本发明涉及医药技术领域,特别是涉及一种pbmc的免疫系统重建能力的检测方法及应用。
背景技术:
2.实验动物模型在医学生命科学发展中发挥着重要作用。啮齿类动物模型广泛应用于药物及疫苗的研究,但由于种属差异或应用的致病原与感染人类的致病原的不同,许多药物或疫苗不能有效地针对人类疾病而无法应用于临床。寄生虫、细菌以及病毒感染是危害人类健康的主要致病因素,许多病原体的感染及致病特点具有种属特异性,如艾滋病病毒仅感染人类细胞而不会感染小鼠细胞。由于缺乏理想的动物疾病模型,而限制了对相应疾病机理与防治的深入研究。人源化小鼠模型的建立为人类疾病的研究提供了新的选择。免疫系统人源化小鼠就是指通过移植人的造血干细胞或免疫组织、细胞,在小鼠体内重建人类免疫系统。
3.目前方兴未艾的肿瘤免疫药物开发中,亟需构建含有人源免疫系统的实验动物模型,这其中以人的pbmc在小鼠体内重建人的免疫系统作为模型代表,能很好的用来做免疫检查点肿瘤免疫药物的药效评估。但是人群中不同个体来源的donor(供者)重建能力差异非常之大,以至于必须要做每个donor的筛选,才能获得合格的pbmc(外周血单个核细胞),进行下一步的药效实验。其简要步骤是使用重症免疫缺陷小鼠,尾静脉注射大剂量的pbmc(5
×
10e6/只),2~4周后,评估一个pbmc在小鼠体内的重建能力的强弱,其表现为人源免疫系统细胞信号指标人cd45阳性。
4.但是,这种检测重建能力的过程耗时很长且成本很高,不便于donor的选取和实验时间规划,阻碍了药物研发所用的人源化实验动物模型的快速建立,不利于新的抗肿瘤免疫相关药物的开发。
技术实现要素:
5.基于此,有必要提供一种准确快捷的pbmc的免疫系统重建能力的检测方法。
6.一种pbmc的免疫系统重建能力的检测方法,包括以下步骤:
7.获取pbmc样本;
8.获取所述pbmc样本中cd3阳性细胞的比例a,以及所述cd3阳性细胞中cd45ra阳性细胞的比例b,通过a
×
b计算得到所述pbmc样本中cd45ra阳性细胞的比例作为重建指数;
9.所述重建指数数值越大,则所述pbmc样本的免疫系统重建能力越高,且所述重建指数的cut
‑
off值为0.2。
10.在其中一个实施例中,获取所述cd3阳性细胞中cd45ra阳性细胞的比例的方法包括以下步骤:获取所述cd3阳性细胞中cd45ro阳性细胞的比例c,通过1
‑
c计算得到所述cd3阳性细胞中cd45ra阳性细胞的比例。
11.在其中一个实施例中,所述pbmc样本为人源pbmc样本,获取所述pbmc样本中cd3阳
性细胞的比例的方法包括以下步骤:获取所述pbmc样本中cd45阳性细胞的数量d以及cd3阳性细胞的数量e,根据e/d计算得到所述pbmc样本中cd3阳性细胞的比例。
12.在其中一个实施例中,使用流式细胞术检测所述pbmc样本中cd45ra阳性细胞的比例。
13.在其中一个实施例中,所述流式细胞术包括以下步骤:取pbmc样本至流式管中,采用荧光抗体进行染色,然后放置于流式细胞仪中进行检测和分析。
14.在其中一个实施例中,所述采用荧光抗体进行染色的方法包括以下步骤:将pbmc样本与荧光抗体混合,室温避光孵育10~30min,加入缓冲液后100g~400g离心1~5分钟取沉淀,然后加入缓冲液重悬。
15.在其中一个实施例中,所述重建能力为在免疫系统人源化小鼠模型中所体现的重建能力;优选的,所述模型所用小鼠为t/b/nk细胞联合缺失型小鼠。
16.本发明还提供了一种用于治疗免疫缺陷性疾病药物的筛选方法,包括以下步骤:
17.根据如上所述的检测方法检测pbmc的免疫系统重建能力;
18.选取重建指数>0.2的pbmc接种于实验动物体内,构建实验动物模型;
19.使用所述实验动物模型测试候选药物。
20.本发明还提供了一种计算机可读存储介质,所述计算机存储介质用于存储计算机指令、程序、代码集或指令集,当其在计算机上运行时,使得计算机执行如上所述的检测方法。
21.本发明还提供了一种电子设备,包括:
22.一个或多个处理器;以及
23.计算机可读存储介质,所述计算机存储介质用于存储计算机指令、程序、代码集或指令集,当其在计算机上运行时,使得所述一个或多个处理器实现如上所述的检测方法。
24.传统的pbmc免疫系统重建能力的检测方法,只能把pbmc注射入小鼠体内进行,这无可避免出现以下问题:(1)体内筛选经济成本高昂。现有的筛选方式,须依赖能饲养重度免疫缺陷鼠的高等级的动物设施才能进行,每个pbmc筛选一般需要3~5只重度免疫缺陷小鼠,经济成本很高。(2)筛选的时间长。pbmc在动物体内的重建过程需要2~3周,因此判断某一个donor的重建能力需要的时间很长。因此,在小鼠体内确定pbmc的重建能力需要大量的时间和经济成本。
25.本发明总结了多次筛选的经验,定义了每个donor的重建指数(reconstitution index,ri),当重建指数大于0.2,即可认为donor在20天内重建良好,从而可以脱离小鼠,通过体外的方式准确快速地判定donor在小鼠体内重建状况好坏。如此,极大方便了donor的选取和实验时间规划,同时也降低了成本,能够既快又好地推进药物研发所用的人源化实验动物模型的建立,助力于新的抗肿瘤免疫相关药物的开发。本发明的检测方法通过重建指数量化了pbmc重建能力,不依赖动物房,仅需肿瘤免疫实验室常规设备,如流式细胞仪等,完全可在体外操作。本发明的检测方法所需时间极短,例如使用流式细胞术可在二小时内获得结果。而且,如果pbmc供应商能提供相应指标数据,则可完全省略掉流式细胞术,只需计算即可判定。
附图说明
26.图1为t细胞增殖能力和效应功能的关系示意图;
27.图2~图10分别为实施例1~9使用cd3荧光抗体、cd45ro荧光抗体染色的流式细胞术检测结果;
28.图11~图12分别为实施例10~11使用cd3荧光抗体、cd45ra荧光抗体染色的流式细胞术检测结果;
29.图13~图19分别为实施例12~18使用cd3荧光抗体、cd45ro荧光抗体和cd45ra荧光抗体染色的流式细胞术检测结果;
30.图20为实施例1~9的pbmc在小鼠体内的重建曲线;
31.图21为实施例10~18的pbmc在小鼠体内的重建曲线;
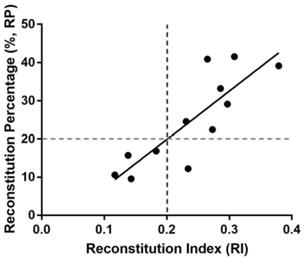
32.图22为实施例20中重建指数和重建比例的线性相关回归及cut
‑
off值的确定;
33.图23~图34为实施例21中12例pbmc的流式细胞术检测结果;
34.图35为实施例21中12例pbmc的重建指数和重建比例之间的关联性。
具体实施方式
35.为了便于理解本发明,下面将对本发明进行更全面的描述,并给出了本发明的较佳实施例。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。
36.除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
37.本发明一实施例的pbmc的免疫系统重建能力的检测方法,包括以下步骤:
38.获取pbmc样本;
39.获取pbmc样本中cd3阳性细胞的比例a,以及cd3阳性细胞中cd45ra阳性细胞的比例b,通过a
×
b计算得到pbmc样本中cd45ra阳性细胞的比例作为重建指数;
40.重建指数数值越大,则pbmc样本的免疫系统重建能力越高,且重建指数的cut
‑
off值为0.2。
41.在肿瘤免疫的新药物研发中,尤其是以pd1抗体生物大分子药为代表的免疫检查点药物的开发,需要人源化的免疫系统测试生物大分子药物药效。人外周血来源的单个核免疫细胞(pbmc,其所捐献的供体称之为donor)经尾静脉注射到重症免疫缺陷小鼠(t/b/nk细胞联合缺失),可简单快速的构建人源化动物模型,能供大多数免疫检查点药物的体内药效测试。但是来源于健康人的pbmc,其在动物体内重建的能力却差别很大,即有的供体(donor)能很好的重建,而有的供体却很难重建,目前pbmc重建基本上需要进行动物体内的批量筛选,来判定每个donor能不能重建。pbmc在小鼠体内重建的过程,实际上是t细胞的扩增过程。pbmc进入小鼠体内后,很快被小鼠体内免疫系统非特异性的清除殆尽,只残留一部分人的t细胞。这部分残留的t细胞会逐渐累计细胞因子,尤其是il2,维持t细胞存活和支持t细胞的扩增,累积到一定量后,t细胞会被克隆化扩增,最后达到相当比例的人源化t细胞的存在,即免疫系统人源化动物实验模型建立成功。
42.cd45ra+t(cd45ra阳性t)是t细胞扩增、增殖能力强的细胞群体,亦即naive t细胞,其增殖潜能巨大,对应的cd45ro+t(cd45ro阳性t)效应细胞执行效应功能强大,但增殖能力弱(如图1所示)。进一步,对t细胞的naive t进行研究,发现小鼠体内的重建和naive t(cd45ro阴性,即cd45ro
‑
,等同于cd45ra阳性,即cd45ra+)亚群比例有着明确的正相关,和cd45ro+记忆t细胞群体有着显著的负相关。本发明总结了多次筛选的经验,定义了每个donor的重建指数ri,当重建指数大于0.2,即可认为donor在20天内重建良好,从而可以脱离小鼠,通过体外的方式准确快速地判定donor在小鼠体内重建状况好坏。如此,极大方便了donor的选取和实验时间规划,同时也降低了成本,能够既快又好地推进药物研发所用的人源化实验动物模型的建立,助力于新的抗肿瘤免疫相关药物的开发。
43.可以理解,医学上的cut
‑
off值,为分界值、临界值或截断值的意思,是阳性判断值或者“阈值”,也就是说如果检测数值大于cut
‑
off值就是阳性,而小于cut
‑
off值就是阴性,即重建指数大于0.2,即可认为donor在20天内重建良好。使用重建指数去判定未知donor的重建能力,当其大于0.2时,能非常明确地表明donor能够良好重建,而当其小于0.2时,能良好重建的可能性就会大大下降。因此,使用ri作为评价未知donor的重建能力的指标,是非常简单快速方便的。
44.在一个具体示例中,获取cd3阳性细胞中cd45ra阳性细胞的比例的方法包括以下步骤:获取cd3阳性细胞中cd45ro阳性细胞的比例c,通过1
‑
c计算得到cd3阳性细胞中cd45ra阳性细胞的比例。t细胞可按cd45ro和cd45ra划分为两群相对的群体,因此减去cd3阳性细胞中cd45ro阳性细胞的比例即可得到cd3阳性细胞中cd45ra阳性细胞的比例。
45.在一个具体示例中,pbmc样本为人源pbmc样本,获取pbmc样本中cd3阳性细胞的比例的方法包括以下步骤:获取pbmc样本中cd45阳性细胞的数量d以及cd3阳性细胞的数量e,根据e/d计算得到pbmc样本中cd3阳性细胞的比例。人的pbmc基本上都是cd45阳性,因此cd45阳性细胞的数量等同于全细胞数量。
46.在一个具体示例中,使用流式细胞术检测pbmc样本中cd45ra阳性细胞的比例。可以理解,检测细胞类型及比例的方法不限于此,可根据需要选择。
47.在一个具体示例中,流式细胞术包括以下步骤:取pbmc样本至流式管中,采用荧光抗体进行染色,然后放置于流式细胞仪中进行检测和分析。
48.在一个具体示例中,采用荧光抗体进行染色的方法包括以下步骤:将pbmc样本与荧光抗体混合,室温避光孵育10~30min,加入缓冲液后100g~400g离心1~5分钟取沉淀,然后加入缓冲液重悬。
49.在一个具体示例中,上述重建能力为在免疫系统人源化小鼠模型中所体现的重建能力。优选地,上述模型所用小鼠为t/b/nk细胞联合缺失型小鼠。
50.本发明一实施例的用于治疗免疫缺陷性疾病药物的筛选方法,包括以下步骤:
51.根据如上所述的检测方法检测pbmc的免疫系统重建能力;
52.选取重建指数>0.2的pbmc接种于实验动物体内,构建实验动物模型;
53.使用上述实验动物模型测试候选药物。
54.在一个具体示例中,上述免疫缺陷性疾病为肿瘤。
55.本发明一实施例的计算机可读存储介质,其用于存储计算机指令、程序、代码集或指令集,当其在计算机上运行时,使得计算机执行如上所述的检测方法。
56.本发明一实施例的电子设备,包括:一个或多个处理器;以及计算机可读存储介质,其用于存储计算机指令、程序、代码集或指令集,当其在计算机上运行时,使得上述一个或多个处理器实现如上所述的检测方法。
57.本发明一实施例的白细胞分化抗原检测试剂在检测pbmc的免疫系统重建能力中的应用,上述白细胞分化抗原检测试剂包括cd45ra抗体。在一个具体示例中,白细胞分化抗原检测试剂还包括cd3抗体、cd45ro抗体和cd45抗体中的一种或多种。
58.以下为具体实施例。
59.一、实验整体流程:
60.1.1使用流式细胞术检测cd3、cd45ra、cd45ro细胞比例;
61.1.2计算cd3 of total cells比例和cd45ra+(或cd45ro
‑
)of cd3比例乘积,得到重建指数ri。
62.1.3 ri≥0.3的donor判定为重建能力良好。
63.二、具体仪器、试剂和操作如下:
64.表1仪器信息
[0065][0066][0067]
表2试剂耗材信息
[0068]
试剂名称品牌货号1640细胞培养基thermoc11875500bt胎牛血清bi04
‑
001
‑
1atrypsin
‑
edta(0.25%)gibco25200056pbsgibcoc20012500btanti
‑
cd45raebioscience11
‑
0458
‑
42anti
‑
cd45roebioscience12
‑
0457
‑
42anti
‑
cd3ebioscience56
‑
0038
‑
42
pbmc妙顺/
[0069]
2.1复苏细胞:
[0070]
(1)复苏细胞之前先将超净台用酒精擦拭,紫外照射15分钟,离心机打开,水浴锅开至37℃;
[0071]
(2)配置完全培养基:1640培养基中加入终体积为10%fbs和1%的青霉素链霉素双抗;
[0072]
(3)准备10ml的完全培养基备用;
[0073]
(4)解冻细胞:从液氮中取出所需细胞,复核细胞编号是否正确,将冻存管至于水浴锅中快速晃动,融化后转入10ml的完全培养基中;
[0074]
(5)洗涤细胞:300g转速离心10分钟后弃去上清;
[0075]
(6)用pbs重悬细胞,并计数调整浓度为1
×
10e6/ml,供注射小鼠重建使用及流式细胞术检测重建指数(ri)使用。
[0076]
2.2流式细胞术检测重建指数(ri)流程:
[0077]
(1)样品获取:取上述备用细胞100μl至流式管中,共三份,编号1#,2#,3#;
[0078]
(2)细胞染色:
[0079]
配置样品检测管:取5μl cd45ra、5μl cd45ro、5μl cd3抗体加入1#管中,室温避光20min,加入1ml pbs后300g离心3分钟,100μl pbs重悬备用跑流式;
[0080]
配置cd45ra fmo对照管:取5μl cd45ra iso
‑
type、5μl cd45ro、5μl cd3抗体加入2#管中,室温避光20min,加入1ml pbs后300g离心3分钟,100μl pbs重悬备用跑流式;
[0081]
配置cd45ra fmo对照管:取5μl cd45ra、5μl cd45ro iso
‑
type、5μl cd3抗体加入3#管中,室温避光20min,加入1ml pbs后300g离心3分钟,100μl pbs重悬备用跑流式;
[0082]
(3)上机流式细胞仪跑样,收集cd3门细胞个数≥10000events;
[0083]
(4)结果使用专业流式软件flowjo或者流式机器自带的分析软件,进行cd3、cd45ra、cd45ro细胞群占比分析。
[0084]
(5)根据比例进行重建指数计算,重建指数(ri)计算如下:
[0085]
先确定cd3比例(a),即cd3 of total cells;以及cd45ra比例(b),即cd45ra of cd3;以及cd45ro比例(c),即cd45ro of cd3。实际计算过程中,cd45ro of cd3比例约等于1
‑
(cd45ra of cd3),反之cd45ra of cd3比例约等于1
‑
(cd45ro of cd3)。重建指数ri=a
×
b,或者ri=a
×
(1
‑
c),ri>0.2即认为donor在规定时间(2周)内重建良好,其显著性水平设α=0.05,置信区间为95%。
[0086]
实施例1
[0087]
11号donor:取11号donor的pbmc,经过荧光抗体染色并上流式细胞仪分析后,结果如图2所示。
[0088]
计算其重建指数ri值如下:cd3占总细胞数比例为56.777%,而cd45ra占cd3比例为64.432%,ri=56.777%
×
64.432%=0.365;或者计算cd45ro比例,cd45ro占cd3比例为35.519%,ri=56.777%
×
(1
‑
35.519%)=0.366;使用cd45ro和cd45ra计算的ri,两者在百分位小数点上相同,相对误差小于1%。
[0089]
实施例2
[0090]
12号donor:取12号donor的pbmc,经过荧光抗体染色并上流式细胞仪分析后,结果
如图3所示。
[0091]
计算其重建指数ri值如下:cd3占总细胞数比例为40.244%,而cd45ra占cd3比例为70.216%,ri=40.244%
×
70.216%=0.283;或者计算cd45ro比例,cd45ro占cd3比例为29.710%,ri=40.244%
×
(1
‑
29.710%)=0.283;使用cd45ro和cd45ra计算的ri,两者在百分位小数点上相同,相对误差小于1%。
[0092]
实施例3
[0093]
13号donor:取13号donor的pbmc,经过荧光抗体染色并上流式细胞仪分析后,结果如图4所示。
[0094]
计算其重建指数ri值如下:cd3占总细胞数比例为57.539%,而cd45ra占cd3比例为62.016%,ri=57.539%
×
62.016%=0.357;或者计算cd45ro比例,cd45ro占cd3比例为37.915%,ri=57.539%
×
(1
‑
37.915%)=0.357;使用cd45ro和cd45ra计算的ri,两者在百分位小数点上相同,相对误差小于1%。
[0095]
实施例4
[0096]
14号donor:取14号donor的pbmc,经过荧光抗体染色并上流式细胞仪分析后,结果如图5所示。
[0097]
计算其重建指数ri值如下:cd3占总细胞数比例为53.365%,而cd45ra占cd3比例为69.857%,ri=53.365%
×
69.857%=0.373;或者计算cd45ro比例,cd45ro占cd3比例为30.064%,ri=53.365%
×
(1
‑
30.064%)=0.373;使用cd45ro和cd45ra计算的ri,两者在百分位小数点上相同,相对误差小于1%。
[0098]
实施例5
[0099]
15号donor:取15号donor的pbmc,经过荧光抗体染色并上流式细胞仪分析后,结果如图6所示。
[0100]
计算其重建指数ri值如下:cd3占总细胞数比例为45.562%,而cd45ra占cd3比例为59.682%,ri=45.562%
×
59.682%=0.272;或者计算cd45ro比例,cd45ro占cd3比例为40.250%,ri=45.562%
×
(1
‑
40.250%)=0.272;使用cd45ro和cd45ra计算的ri,两者在百分位小数点上相同,相对误差小于1%。
[0101]
实施例6
[0102]
16号donor:取16号donor的pbmc,经过荧光抗体染色并上流式细胞仪分析后,结果如图7所示。
[0103]
计算其重建指数ri值如下:cd3占总细胞数比例为50.882%,而cd45ra占cd3比例为55.860%,ri=50.882%
×
55.860%=0.284;或者计算cd45ro比例,cd45ro占cd3比例为44.065%,ri=50.882%
×
(1
‑
44.065%)=0.285,使用cd45ro和cd45ra计算的ri,两者在百分位小数点上相同,相对误差小于1%。
[0104]
实施例7
[0105]
17号donor:取17号donor的pbmc,经过荧光抗体染色并上流式细胞仪分析后,结果如图8所示。
[0106]
计算其重建指数ri值如下:cd3占总细胞数比例为68.044%,而cd45ra占cd3比例为46.268%,ri=68.044%
×
46.268%=0.315,或者计算cd45ro比例,cd45ro占cd3比例为53.656%,ri=68.044%
×
(1
‑
53.656%)=0.315;使用cd45ro和cd45ra计算的ri,两者在
百分位小数点上相同,相对误差小于1%。
[0107]
实施例8
[0108]
18号donor:取18号donor的pbmc,经过荧光抗体染色并上流式细胞仪分析后,结果如图9所示。
[0109]
计算其重建指数ri值如下:cd3占总细胞数比例为44.210%,而cd45ra占cd3比例为54.493%,ri=44.210%
×
54.493%=0.241;或者计算cd45ro比例,cd45ro占cd3比例为45.453%,ri=44.210%
×
(1
‑
45.453%)=0.241;使用cd45ro和cd45ra计算的ri,两者在百分位小数点上相同,相对误差小于1%。
[0110]
实施例9
[0111]
19号donor:取19号donor的pbmc,经过荧光抗体染色并上流式细胞仪分析后,结果如图10所示。
[0112]
计算其重建指数ri值如下:cd3占总细胞数比例为47.431%,而cd45ra占cd3比例为29.061%,ri=47.431%
×
29.061%=0.138,或者计算cd45ro比例,cd45ro占cd3比例为70.879%,ri=47.431%
×
(1
‑
70.879%)=0.138;使用cd45ro和cd45ra计算的ri,两者在百分位小数点上相同,相对误差小于1%。
[0113]
实施例10
[0114]
2号donor:取2号donor的pbmc,经过荧光抗体染色并上流式细胞仪分析后,结果如图11所示。
[0115]
计算其重建指数ri值如下:cd3占总细胞数比例为70.611%,而cd45ra占cd3比例为65.76%,ri=70.611%
×
65.753%=0.464;或者计算cd45ro比例,cd45ro占cd3比例为34.237%,ri=70.611%
×
(1
‑
34.237%)=0.464;使用cd45ro和cd45ra计算的ri,两者在百分位小数点上相同,相对误差小于1%。
[0116]
实施例11
[0117]
3号donor:取3号donor的pbmc,经过荧光抗体染色并上流式细胞仪分析后,结果如图12所示。
[0118]
计算其重建指数ri值如下:cd3占总细胞数比例为58.874%,而cd45ra占cd3比例为64.207%,ri=58.874%
×
64.207%=0.378;或者计算cd45ro比例,cd45ro占cd3比例为35.778%,ri=58.874%
×
(1
‑
35.778%)=0.378,使用cd45ro和cd45ra计算的ri,两者在百分位小数点上相同,相对误差小于1%。
[0119]
实施例12
[0120]
34号donor:取34号donor的pbmc,经过荧光抗体染色并上流式细胞仪分析后,结果如图13所示。
[0121]
计算其重建指数ri值如下:cd3占总细胞数比例为13.702%,而cd45ra占cd3比例为53.492%,ri=13.702%
×
53.492%=0.073;或者计算cd45ro比例,cd45ro占cd3比例为46.274%,ri=13.702%
×
(1
‑
46.274%)=0.074;使用cd45ro和cd45ra计算的ri,两者在百分位小数点上相同,相对误差小于1%。
[0122]
实施例13
[0123]
101号donor:取101号donor的pbmc,经过荧光抗体染色并上流式细胞仪分析后,结果如图14所示。
[0124]
计算其重建指数ri值如下:cd3占总细胞数比例为42.708%,而cd45ra占cd3比例为59.561%,ri=42.708%
×
59.561%=0.254;或者计算cd45ro比例,cd45ro占cd3比例为40.329%,ri=42.708%
×
(1
‑
40.329%)=0.255;使用cd45ro和cd45ra计算的ri,两者在百分位小数点上相同,相对误差小于1%。
[0125]
实施例14
[0126]
102号donor:取102号donor的pbmc,经过荧光抗体染色并上流式细胞仪分析后,结果如图15所示。
[0127]
计算其重建指数ri值如下:cd3占总细胞数比例为64.252%,而cd45ra占cd3比例为48.694%,ri=64.252%
×
48.694%=0.313;或者计算cd45ro比例,cd45ro占cd3比例为51.137%,ri=64.252%
×
(1
‑
51.137%)=0.314,使用cd45ro和cd45ra计算的ri,两者在百分位小数点上相同,相对误差小于1%。
[0128]
实施例15
[0129]
103号donor:取103号donor的pbmc,经过荧光抗体染色并上流式细胞仪分析后,结果如图16所示。
[0130]
计算其重建指数ri值如下:cd3占总细胞数比例为53.361%,而cd45ra占cd3比例为71.512%,ri=53.361%
×
71.512%=0.382;或者计算cd45ro比例,cd45ro占cd3比例为28.471%,ri=53.361%
×
(1
‑
28.471%)=0.382;使用cd45ro和cd45ra计算的ri,两者在百分位小数点上相同,相对误差小于1%。
[0131]
实施例16
[0132]
104号donor:取104号donor的pbmc,经过荧光抗体染色并上流式细胞仪分析后,结果如图17所示。
[0133]
计算其重建指数ri值如下:cd3占总细胞数比例为44.720%,而cd45ra占cd3比例为53.238%,ri=44.720%
×
53.238%=0.238;或者计算cd45ro比例,cd45ro占cd3比例为46.670%,ri=44.720%
×
(1
‑
46.670%)=0.238;使用cd45ro和cd45ra计算的ri,两者在百分位小数点上相同,相对误差小于1%。
[0134]
实施例17
[0135]
105号donor:取105号donor的pbmc,经过荧光抗体染色并上流式细胞仪分析后,结果如图18所示。
[0136]
计算其重建指数ri值如下:cd3占总细胞数比例为68.377%,而cd45ra占cd3比例为60.064%,ri=68.377%
×
60.064%=0.410;或者计算cd45ro比例,cd45ro占cd3比例为39.819%,ri=68.377%
×
(1
‑
39.819%)=0.411;使用cd45ro和cd45ra计算的ri,两者在百分位小数点上相同,相对误差小于1%。
[0137]
实施例18
[0138]
4093号donor:取4093号donor的pbmc,经过荧光抗体染色并上流式细胞仪分析后,结果如图19所示。
[0139]
计算其重建指数ri值如下:cd3占总细胞数比例为26.029%,而cd45ra占cd3比例为58.490%,ri=26.029%
×
58.490%=0.152;或者计算cd45ro比例,cd45ro占cd3比例为40.968%,ri=26.029%
×
(1
‑
40.968%)=0.152;使用cd45ro和cd45ra计算的ri,两者在百分位小数点上相同,相对误差小于1%。
[0140]
实施例19donor(pbmc)的动物体内免疫系统重建
[0141]
取6~8周美国jaxson lab的nsg
tm
鼠或同等级的t/b/nk细胞重度缺陷小鼠,经过一周适应性饲养,称重后分别使用实施例1~18的pbmc进行接种,接种信息如下表3所示。
[0142]
表3经过复苏后的pbmc接种信息
[0143]
动物品系pbmc动物只数接种方式接种细胞量/只接种细胞悬液体积/只nsgdonor5尾静脉i.v.5
×
1060.1ml
[0144]
接种pbmc细胞7天前后测量小鼠血液中人cd45+(即hcd45+)细胞比例,在首次检测后每周一次检测外周血免疫系统重建数值,检测方案见下表4所示。
[0145]
表4外周血pbmc重建流式细胞术检测
[0146]
检测指标分析方法hcd45,mcd45外周血人pbmc重建比例(%)=hcd45
+
/(hcd45+mcd45)
×
100%
[0147]
记录各个实施例的donor(pbmc)的重建数值,结果如图20及图21所示。
[0148]
实施例20 cut
‑
off值的确定
[0149]
计算每个donor的ri,并结合体内19~21天左右的重建比例(见表5),进行线性回归统计,以业界通用的重建比例数值大于20%作为判定免疫重建成功的界限,两者相交的点作为cut
‑
off值的设置点,如图22所示。通过计算可得交界点对应的ri值约为0.2左右,此时ri大于0.2且重建比例低于20%有2例,ri大于0.2且重建比例高于20%有13例,按ri>0.2计算阳性比例为13/15=86.6%,ri≤0.2的样品全为阴性,如果不使用此重建指数筛选,其成功率为13/18=72.2%。因此ri设置在0.2,是一个适合的体外筛选标准,能完全排除重建不良的donor,并能提高donor的重建筛选成功率。
[0150]
表5小鼠体内donor重建19~21天左右的人cd45重建比例
[0151][0152][0153]
实施例21
[0154]
人的pbmc donor基本上都是cd45阳性,因此染cd45的标志所圈出的细胞等同于做cut
‑
off设定时的total cell,根据donor供应商提供的coa(产品分析报告),我们摘取了一
批需要小鼠体内建模donor的cd3 of cd45的比例以及cd45ra of cd3的比例,计算其ri,根据cut
‑
off设为0.2判定其体内重建能力,如图23~34为具体实例。
[0155]
该12例donor每只小鼠5
×
10e6尾静脉注射,20天后检测人cd45占人cd45+鼠cd45总和的重建比例(见表6),结合根据donor厂商的coa报告计算的重建指数ri,分析其重建指数ri和重建比例之间的关联性。结果如图35所示,几乎完美的重现了cut
‑
off确定时的关联性,ri=0.2很好地过滤掉了重建不良的donor,ri>0.2的8个donor中7个能很好的重建,成功比例为7/8=87.5%,如果不使用此重建指标筛选,其成功率为7/12=58.3%。相比之下,可以显著地提高重建成功率。
[0156]
表6在新一批小鼠体内donor重建19~21天左右的人cd45重建比例
[0157]
donor编号重建指数,ri重建比例,rp9044#39.95%
×
(23.781%+22.118%)=0.18316.8348006a#54.727%
×
(23.436%+28.871%)=0.28633.2194071#58.104%
×
(40.323%+12.718%)=0.30841.5420903c#44.746%
×
(37.28%+14.24%)=0.23124.5910503c#62.162%
×
(33.61%+27.42%)=0.37939.1520027#38.729%
×
(39.437%+20.928%)=0.23412.2213070#51.678%
×
(35.687%+15.505%)=0.26540.8877023#26.964%
×
(37.616%+5.746%)=0.11710.5832066#52.295%
×
(40.674%+16.086%)=0.29729.1164089#35.302%
×
(27.836%+12.770%)=0.1439.5462101#38.960%
×
(26.960%+8.397%)=0.13815.7159113#57.689%
×
(24.977%+22.388%)=0.27322.485
[0158]
综上可知,通过重建指数(reconstitution index,ri)可以较准确地量化pbmc的免疫系统重建能力,而且使用ri=0.2这个cut
‑
off设定,能很好的筛选掉重建不良的donor,从而可以快速挑选重建良好的donor,大大加快了肿瘤免疫药物药效筛选过程中免疫系统人源化小鼠模型的构建过程,并显著提高了免疫系统人源化小鼠模型的构建成功率。本发明的检测方法有助于donor的选取和实验时间规划,同时也降低了成本,能够既快又好地推进药物研发所用的人源化实验动物模型的建立,助力于新的抗肿瘤免疫相关药物的开发,有良好的应用价值。
[0159]
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0160]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1