分解放热性化学品热稳定微观特征的量化表征方法与流程
1.本发明涉及分解放热性化学品热稳定性分析技术领域,具体涉及分解放热性化学品热稳定微观特征的量化表征方法。
背景技术:
2.分解放热性化学品的热稳定性是热安全的重要评价指标,认识并掌握分解放热性化学品的热稳定特征,对于化工过程失控、危险化学品的火灾、爆炸等事故的预防及管控具有重要意义。目前对于分解放热性化学品热稳定性分析主要是采用各种测量技术,如热重分析法、差示扫描量热仪分析、微量热仪分析以及绝热量热仪分析技术等。这些热分析测量技术只能获得质量、热流、温度、压力等宏观参数变化信息,不能获得化学品热分解过程中的微观信息。目前,也有研究通过热分解测量技术与在线红外(ftir)和色谱-质谱联用(gc/ms)等结合对热失控过程中化学品官能团及产物的变化信息进行检测。然而,热失控过程详细的微观反应信息尚难以获得。并且绝大多数热分析在线检测技术不能得到全面的热分解反应信息,例如封闭条件下差式扫描量热技术难以获得在线产物检测信息,敞口环境下热重及量热技术可与在线产物检测进行联用,却难以实现封闭空间内热分解反应的完整分析。为克服上述实验条件下,无法获得化学品较为全面的热分解信息以及无法获得热分解过程中的微观数据的局限性,本发明提出一种分解放热性化学品微观热稳定特征量化表征方法,该方法主要基于反应分子动力学、量子化学计算并结合热分析检测技术来获取化学品热分解微观过程反应及特征,该方法省时省力、安全高效,并能够获取化学品热分解微观反应路径及放热性微观反应活化能及反应热,得到较为全面且准确的化学品热分解过程中的微观反应信息,包括化学品的热分解温度、反应活化能、反应热、反应路径和产物生成机理,为分解放热性化学品热稳定性的评估技术提供微观层次新方法。
技术实现要素:
3.本发明的目的是为了克服现有技术存在上述问题,提供一种分解放热性化学品热稳定微观特征的量化表征方法,该方法省时省力、安全高效,能够从微观角度获得较为全面且准确的化学品分解过程中的微观反应信息,包括化学品的热分解温度、热分解曲线、反应活化能、反应热、反应路径和产物生成机理,为分解放热性化学品热稳定性的评估技术提供微观层次新方法。
4.为了实现上述目的,本发明提供一种分解放热性化学品热稳定微观特征的量化表征方法,该方法包括:
5.(1)获取所述分解放热性化学品的三维结构分子并进行结构优化,得到优化分子,采取优化分子,在三维周期盒子中构建封闭空间分子体系,并对所述封闭空间分子体系进行分子动力学计算,得到初始分子体系;
6.其中,所述初始分子体系含有的分子片段个数为n0;
7.(2)将所述初始分子体系采用reaxff力场进行升温模拟,至n》n0且n不再发生变
化;获取升温模拟过程中,所述化学品的模拟热分解温度、模拟热分解曲线、模拟热分解反应路径和模拟产物生成机理;
8.其中,升温模拟过程中所述三维周期盒子中含有的分子片段个数为n;
9.(3)采用热分析(dsc)和色谱/质谱联用(gc/ms)实验程序升温测量所述化学品的实验热分解温度和实验热分解曲线,并获取中间物分子信息;
10.(4)基于(3)中获取的结果对(2)中得到的模拟热分解温度及模拟热分解曲线进行修正,得到所述化学品的热分解温度和热分解曲线,并基于上述中间物分子信息和模拟产物生成机理确定热分解反应路径和产物生成机理,并获取分解基元反应步骤;
11.(5)基于(4)中获得的热分解反应路径和分解基元反应步骤,采用密度泛函理论计算所述化学品的分解基元反应的活化能和反应热。
12.本发明的技术方案取得的有益效果为:
13.1、本发明提出一种基于反应分子动力学、量子化学计算以及热分析检测技术相结合获取分解放热性化学品热失控中微观特征量化表征方法,相比实验手段难以检测、时间、材料成本较高的问题,该方法省时省力、安全高效,能够获取化学品热分解反应微观详细信息。
14.2、目前的实验条件下,无法获得化学品分解放热反应详细且全面的微观信息,而本发明的方法能够从微观角度获得较为全面且准确的分解放热性化学品热分解过程中的微观反应信息,包括化学品的热分解温度、热分解曲线、反应活化能、反应热、反应路径和产物生成机理,为分解放热性化学品热稳定性的评估技术提供微观层次新方法。
附图说明
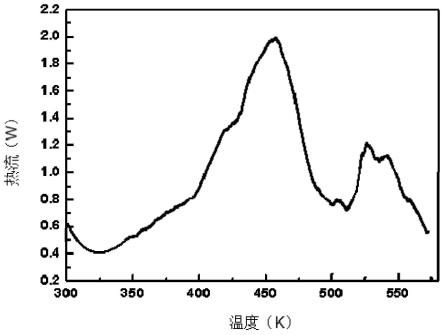
15.图1是实施例1获得的热分解曲线;
16.图2是实施例1获得热分解过程中产物演变表示的反应路径和产物生成机理;
17.图3是实施例1获得的产物生成机理。
具体实施方式
18.在本文中所披露的范围的端点和任何值都不限于该精确的范围或值,这些范围或值应当理解为包含接近这些范围或值的值。对于数值范围来说,各个范围的端点值之间、各个范围的端点值和单独的点值之间,以及单独的点值之间可以彼此组合而得到一个或多个新的数值范围,这些数值范围应被视为在本文中具体公开。
19.本发明提供一种分解放热性化学品热稳定微观特征的量化表征方法,该方法包括:
20.(1)获取所述分解放热性化学品的三维结构分子并进行结构优化,得到优化分子,采取优化分子,在三维周期盒子中构建封闭空间分子体系,并对所述封闭空间分子体系进行分子动力学计算,得到初始分子体系;
21.其中,所述初始分子体系含有的分子片段个数为n0;
22.(2)将所述初始分子体系采用reaxff力场进行升温模拟,至n》n0且n不再发生变化;获取升温模拟过程中,所述化学品的模拟热分解温度、模拟热分解曲线、模拟热分解反应路径和模拟产物生成机理;
23.其中,升温模拟过程中所述三维周期盒子中含有的分子片段个数为n;
24.(3)采用热分析(dsc)和色谱/质谱联用(gc/ms)实验程序升温测量所述化学品的实验热分解温度和实验热分解曲线,并获取中间物分子信息;
25.(4)基于(3)中获取的结果对(2)中得到的模拟热分解温度及模拟热分解曲线进行修正,得到所述化学品的热分解温度和热分解曲线,并基于上述中间物分子信息和模拟产物生成机理确定热分解反应路径和产物生成机理,并获取分解基元反应步骤;
26.(5)基于(4)中获得的热分解反应路径和分解基元反应步骤,采用密度泛函理论计算所述化学品的分解基元反应的活化能和反应热。
27.在本发明中,所述热分解温度为所述分解放热性化学品开始发生热分解的温度。
28.根据本发明一种优选的方式,步骤(1)中,先构建所述分解放热性化学品的二维结构分子,再通过二维结构分子构建三维结构分子;
29.其中,通过二维结构分子构建三维结构分子所使用的分子动力学软件没有特别的限制,可以为本领域常用的分子动力学软件;优选的,通过二维结构分子构建三维结构分子所使用的分子动力学软件选自amber、gromacs、lammps、namd和materials studio,更优选为materials studio。
30.根据本发明,步骤(1)中,优选的,所述结构优化的方法选自dreiding、compass、compassii、cvff力场,更优选为dreiding力场。
31.根据本发明,优选的,步骤(1)中,将优化分子导入到分子动力学软件中,来构建封闭空间分子体系;其中,所采用的分子动力学软件没有特别的限制,可以为本领域常用的分子动力学软件,优选选自amber、gromacs、lammps、namd和materials studio,更优选为lammps。
32.优选的,步骤(1)中,为了能够从微观角度获得更为全面且准确的分解放热性化学品热分解过程中的微观反应信息,所述n0为100-1000。
33.根据本发明,为了能够从微观角度获得更为全面且准确的分解放热性化学品热分解过程中的微观反应信息,优选的,步骤(1)中,所述分子动力学计算的方法包括:将封闭空间分子体系在低温下进行能量最小化计算,得到能量最小化的封闭空间分子体系,再将能量最小化的封闭空间分子体系进行nvt系综分子动力学计算;
34.其中,所述低温为5-100k;
35.进一步优选的,所述能量最小化计算的方法还包括:时间为10-150ps。
36.根据本发明,优选的,步骤(1)中,当所述nvt系综分子动力学计算的方法包括:采用berendsen、gaussian、nose-hoover控温方法时,能够获得更为全面且准确的分解放热性化学品热分解过程中的微观反应信息;更优选的,所述控温方法为berendsen控温方法。
37.根据本发明一种特别优选的实施方式,步骤(1)中,将能量最小化的封闭空间分子体系在与上述相同的低温下进行nvt系综分子动力学计算;再升温至室温,进行nvt系综无反应的分子动力学计算;再调整封闭空间分子体系密度到所述分解放热性化学品真实密度,再进行一次nvt系综反应分子动力学计算,能够获得更为全面且准确的分解放热性化学品热分解过程中的微观反应信息。
38.根据本发明,优选的,步骤(2)中,当所述reaxff力场选自hconsb、cho、chon参数时,能够获得更为全面且准确的分解放热性化学品热分解过程中的微观反应信息;进一步
优选为hconsb参数。
39.根据本发明,优选的,步骤(2)中,当所述升温模拟的升温速率为1-100k/fs时,能够获得更为全面且准确的分解放热性化学品热分解过程中的微观反应信息。
40.根据本发明,优选的,步骤(3)还包括:在程序升温过程中,抽取挥发性气体进行色谱/质谱联用(gc/ms)分析。能够理解的是,在分解放热性化学品的热分析升温中,间隔一定时间或温度条件下抽取一定挥发性气体进行色谱/质谱联用(gc/ms)分析析出的挥发性产物分子结构及组成数据,可以获得中间物分子信息,其中,所述间隔的时间或温度的具体数值可以为本领域的常规选择。
41.能够理解的是,步骤(4)中,根据步骤(3)中获取的实验热分解温度和实验热分解曲线对(2)中的得到的模拟热分解温度及模拟热分解曲线进行修正,所述修正的方法可以为系数法,所述系数法可以为以步骤(3)中获取的的结果为基准,对(2)中得到的模拟的结果进行系数修正。
42.并且,能够理解的是,步骤(4)中,所述基于上述中间物分子信息和模拟产物生成机理确定热分解反应路径和产物生成机理的含义包括:在步骤(2)中,可能获得多个不同的模拟热分解反应路径和模拟产物生成机理,采取步骤(3)获得的中间物分子信息和(2)中获得的结果进行比对和筛选,能够获得与所述中间物分子信息对应的模拟热分解反应路径和模拟产物生成机理,从而从多个(2)中得到的模拟热分解反应路径和模拟产物生成机理确定热分解反应路径和产物生成机理,并获得分解基元反应步骤。
43.根据本发明,步骤(5)中,基于(4)中获得的热分解反应路径和分解基元反应步骤,可以得到基元反应步骤的过渡态,可以通过密度泛函理论计算得到分解基元反应的活化能和反应热。
44.根据本发明,步骤(5)中,所述密度泛函理论没有特别的限制,可以为本领域常用的密度泛函理论。优选的,所述密度泛函理论选自b3lyp、blyp、b3pw91泛函时,能够获得更为全面且准确的分解放热性化学品分解过程中的微观反应信息;进一步优选的,所述密度泛函理论为b3lyp。
45.本发明的发明人在研究中发现,步骤(5)中,所述基组没有特别的限制,可以为本领域常用的基组。优选的,所述基组选自3-21g、6-31g(d)、6-311g(d)基组时,能够获得更为全面且准确的分解放热性化学品分解过程中的微观反应信息;进一步优选的,所述基组为6-311g(d)。
46.根据本发明,为了能够获得更为全面且准确的分解放热性化学品分解过程中的微观反应信息,步骤(5)还包括:采用高精度的密度泛函和高精度的基组计算单点能;
47.其中,所述高精度的密度泛函选自b2plypd,b2plyp-d3,优选为b2plyp-d3;
48.其中,所述高精度的基组选自deftzvp、def2tzvp,def2tzvpp,优选为def2tzvpp。
49.根据本发明一种特别优选的方式,步骤(5)中,采用密度泛函和基组对所述分解放热性化学品分解反应的反应物、产物、过渡态(ts)进行结构优化。对所述化学品热分解反应进行势能面(pes)扫描,采用opt=ts进行过渡态搜索,并进行内禀反应坐标(irc)计算,以确保过渡态能够有效连接其反应物和产物,从而获得正确的反应物、产物和过渡态。对反应物、产物和过渡态进行谐波振动频率计算,获得反应物、产物和过渡态的零点能校正量,焓和吉布斯自由能的校正量。采用高精度的密度泛函和高精度基组计算反应物、产物、ts单点
能。然后将所述零点能校正量,焓和吉布斯自由能的校正量加到分别加到对应的单点能上,获得焓和吉布斯。过渡态和反应物的吉布斯自由能差值为反应活化能,产物与反应物焓值的差值为反应热。
50.根据本发明一种特别优选的实施方式,按照如下的方法分析分解放热性化学品微观热稳定特性:
51.(1)构建分解放热性化学品的二维结构分子,采用materials studio,通过二维结构分子构建三维结构分子;采用dreiding力场对所述三维结构分子进行结构优化,得到优化分子;在三维周期盒子中构建封闭空间分子体系,其中,n0为400-500。将封闭空间分子体系在50-60k下进行能量最小化计算,时间为100-120ps,再在相同低温下进行nvt系综动力学平衡计算,时间为20-40ps;升温至300k,进行nvt系综分子动力学计算,时间为50ps;调整封闭空间分子体系密度到所述分解放热性化学品真实密度,再进行一次nvt系综分子动力学计算,得到初始分子体系。其中,所述控温方法为berendsen控温方法。
52.(2)将所述初始分子体系采用hconsb参数进行升温模拟,升温速率为10-30k/fs,至n》n0且n不再发生变化。通过统计分析模拟体系温度、分子片段变化、分子结构组成数据,获取化学品的模拟热分解温度、模拟热分解曲线、模拟热分解反应路径和模拟气体产物生成机理。
53.(3)采用热分析(dsc)和色谱/质谱联用(gc/ms)实验程序升温获取化学品的实验热分解温度、实验热分解曲线,并在一定时间或温度下抽取一定挥发性气体进行色谱/质谱联用(gc/ms)分析析出的挥发性气体产物分子结构及组成数据,获取中间物分子信息。
54.(4)基于热分析(dsc)实验获取的分解放热曲线对reaxff升温模拟的热分解温度范围及热流曲线进行修正,并通过色谱/质谱联用(gc/ms)检测的挥发性中间产物分子结构及组成结果对reaxff升温模拟获取的模拟热分解反应路径进行筛选,确定热分解反应路径和产物生成机理,获取最合理的分解基元反应步骤。
55.(5)采用b3lyp密度泛函,6-311g(d)基组,对有机化合物热分解基元反应的反应物、产物、中间体和过渡态(ts)进行结构优化。对硝基苯热分解反应进行势能面(pes)扫描,采用opt=ts进行过渡态搜索,并进行内禀反应坐标(irc)计算,获得正确的反应物、产物和过渡态。对反应物、产物、ts进行谐波振动频率计算,获得反应物、产物、ts的零点能校正量,采用高精度的密度泛函和高精度基组b2plyp-d3/def2tzvpp计算反应物、产物、ts单点能,然后将所述反应物、产物、ts的零点能校正量,焓和吉布斯自由能的校正量加到分别加到其对应的单点能上,获得焓和吉布斯值。
56.以下将通过实施例对本发明进行详细描述。
57.实施例1
58.用于说明本发明提供的分解放热性化学品热稳定微观特征的量化表征方法
59.(1)构建亚硝酸甲酯二维结构分子,采用materials studio,通过二维结构分子构建三维结构分子;采用dreiding力场对所述三维结构分子进行结构优化,得到优化分子;在三维周期盒子中构建封闭空间分子体系,其中,n0为100。将封闭空间分子体系在5k下进行能量最小化计算,时间为10ps,再在5k下进行nvt系综动力学平衡计算,时间为20ps;升温至300k,进行nvt系综分子动力学计算,时间为20ps;再在0.2gpa压力下压缩至高于实际密度0.3kg/dm3(1.29kg/dm3),后在0pa下将体系密度松弛到实际密度(即0.99kg/dm3),再进行一
次nvt系综分子动力学计算,得到初始分子体系。其中,所述控温方法为berendsen控温方法。
60.(2)将所述初始分子体系采用hconsb参数进行升温模拟,升温速率为1k/fs,至n》n0且n不再发生变化。通过统计分析模拟体系温度、分子片段变化、分子结构组成数据,获取亚硝酸甲酯的模拟热分解温度,模拟热分解曲线,模拟热分解反应路径和模拟气体产物生成机理。
61.(3)采用热分析(dsc)和色谱/质谱联用(gc/ms)实验程序升温获取亚硝酸甲酯实验热分解温度、实验热分解曲线,并在一定时间或温度下抽取一定挥发性气体进行色谱/质谱联用(gc/ms)分析析出的挥发性气体产物分子结构及组成数据,获取中间物分子信息。
62.(4)基于热分析(dsc)实验获取的分解放热曲线对reaxff升温模拟的热分解温度范围及热流曲线进行修正,并通过色谱/质谱联用(gc/ms)检测的挥发性中间产物分子结构及组成结果对reaxff升温模拟获取的模拟热分解反应路径进行筛选,确定热分解反应路径和产物生成机理,并获取亚硝酸甲酯最合理的分解基元反应步骤;
63.(5)采用b3lyp密度泛函,6-311g(d)基组,对亚硝酸甲酯热分解基元反应的反应物、产物、中间体和过渡态(ts)进行结构优化。对亚硝酸甲酯热分解反应进行势能面(pes)扫描,采用opt=ts进行过渡态搜索,并进行内禀反应坐标(irc)计算,获得正确的反应物、产物和过渡态。对反应物、产物、ts进行谐波振动频率计算,获得反应物、产物、ts的零点能校正量,分别为0.04784hartree、0.04051hartree、0.04386hartree,焓的校正量0.05285hartree、0.04810hartree、0.04816hartree,吉布斯自由能的校正量0.02172hartree、-0.00241hartree、0.01824hartree。采用高精度的密度泛函和高精度基组b2plyp-d3/def2tzvpp计算反应物、产物、ts单点能,分别为-244.9437hartree、-244.9170hartree、-244.8808hartree。然后将所述反应物、产物、ts的零点能校正量,焓和吉布斯自由能的校正量加到分别加到其对应的单点能上,获得焓和吉布斯值。过渡态和反应物的吉布斯自由能差值为反应活化能156.1116kj/mol,产物与反应物焓值的差值为反应热57.6848kj/mol。
64.实施例2
65.用于说明本发明提供的分解放热性化学品热稳定微观特征的量化表征方法
66.(1)构建硝基苯二维结构分子,采用materials studio,通过二维结构分子构建三维结构分子;采用dreiding力场对所述三维结构分子进行结构优化,得到优化分子;在三维周期盒子中构建封闭空间分子体系,其中,n0为500。将封闭空间分子体系在50k下进行能量最小化计算,时间为100ps,再在50k下进行nvt系综动力学平衡计算,时间为20ps;升温至300k,进行nvt系综分子动力学计算,时间为50ps;再在0.2gpa压力下压缩至高于实际密度0.3kg/dm3(1.50kg/dm3),后在0pa下将体系密度松弛到实际密度(即1.20kg/dm3),再进行一次nvt系综分子动力学计算,得到初始分子体系。其中,所述控温方法为berendsen控温方法。
67.(2)将所述初始分子体系采用hconsb参数进行升温模拟,升温速率为10k/fs,至n》n0且n不再发生变化。通过统计分析模拟体系温度、分子片段变化、分子结构组成数据,获取硝基苯的模拟热分解温度,模拟热分解曲线,模拟热分解反应路径和模拟气体产物生成机理。
68.(3)采用热分析(dsc)和色谱/质谱联用(gc/ms)实验程序升温获取硝基苯实验热分解温度、实验热分解曲线,并在一定时间或温度下抽取一定挥发性气体进行色谱/质谱联用(gc/ms)分析析出的挥发性气体产物分子结构及组成数据,获取中间物分子信息。
69.(4)基于热分析(dsc)实验获取的分解放热曲线对reaxff升温模拟的热分解温度范围及热流曲线进行修正,并通过色谱/质谱联用(gc/ms)检测的挥发性中间产物分子结构及组成结果对reaxff升温模拟获取的模拟热分解反应路径进行筛选,确定热分解反应路径和产物生成机理,并获取硝基苯最合理的分解基元反应步骤;
70.(5)采用b3lyp密度泛函,6-311g(d)基组,对硝基苯热分解基元反应的反应物、产物、中间体和过渡态(ts)进行结构优化。对硝基苯热分解反应进行势能面(pes)扫描,采用opt=ts进行过渡态搜索,并进行内禀反应坐标(irc)计算,获得正确的反应物、产物和过渡态。对反应物、产物、ts进行谐波振动频率计算,获得反应物、产物、ts的零点能校正量,分别为0.1036hartree、0.09645hartree、0.09879hartree,焓的校正量0.1113hartree、0.1056hartree、0.1069hartree,吉布斯自由能的校正量0.07177hartree、0.04437hartree、0.06683hartree。采用高精度的密度泛函和高精度基组b2plyp-d3/def2tzvpp计算反应物、产物、ts单点能,分别为-436.5966hartree、-436.4787hartree、-436.4945hartree。然后将所述反应物、产物、ts的零点能校正量,焓和吉布斯自由能的校正量加到分别加到其对应的单点能上,获得焓和吉布斯值。过渡态和反应物的吉布斯自由能差值为反应活化能255.1815kj/mol,产物与反应物焓值的差值为反应热294.9913kj/mol。
71.实施例3
72.用于说明本发明提供的分解放热性化学品热稳定微观特征的量化表征方法
73.(1)构建二硝基苯酚二维结构分子,采用materials studio,通过二维结构分子构建三维结构分子;采用dreiding力场对所述三维结构分子进行结构优化,得到优化分子;在三维周期盒子中构建封闭空间分子体系,其中,n0为1000。将封闭空间分子体系在100k下进行能量最小化计算,时间为150ps,再在100k下进行nvt系综动力学平衡计算,时间为50ps;升温至300k,进行nvt系综分子动力学计算,时间为50ps;再在0.2gpa压力下压缩至高于实际密度0.3kg/dm3(1.80kg/dm3),后在0pa下将体系密度松弛到实际密度(即1.50kg/dm3),再进行一次nvt系综分子动力学计算,得到初始分子体系。其中,所述控温方法为berendsen控温方法。
74.(2)将所述初始分子体系采用hconsb参数进行升温模拟,升温速率为100k/fs,至n》n0且n不再发生变化。通过统计分析模拟体系温度、分子片段变化、分子结构组成数据,获取二硝基苯酚的模拟热分解温度,模拟热分解曲线,模拟热分解反应路径和模拟气体产物生成机理。
75.(3)采用热分析(dsc)和色谱/质谱联用(gc/ms)实验程序升温获取二硝基苯酚实验热分解温度、实验热分解放热曲线,并在一定时间或温度下抽取一定挥发性气体进行色谱/质谱联用(gc/ms)分析析出的挥发性气体产物分子结构及组成数据,获取中间物分子信息。
76.(4)基于热分析(dsc)实验获取的分解放热曲线对reaxff升温模拟的热分解温度范围及热流曲线进行修正,并通过色谱/质谱联用(gc/ms)检测的挥发性中间产物分子结构及组成结果对reaxff升温模拟获取的所有可能的热分解反应路径进行筛选,确定热分解反
应路径和产物生成机理,并获取二硝基苯酚最合理的分解基元反应步骤;
77.(5)采用b3lyp密度泛函,6-311g(d)基组,对二硝基苯酚热分解基元反应的反应物、产物、中间体和过渡态(ts)进行结构优化。对二硝基苯酚热分解反应进行势能面(pes)扫描,采用opt=ts进行过渡态搜索,并进行内禀反应坐标(irc)计算,获得正确的反应物、产物和过渡态。对反应物、产物、ts进行谐波振动频率计算,获得反应物、产物、ts的零点能校正量,分别为0.1106hartree、0.1036hartree、0.1059hartree,焓的校正量0.1216hartree、0.1163hartree、0.1172hartree,吉布斯自由能的校正量0.07398hartree、0.04585hartree、0.06904hartree。采用高精度的密度泛函和高精度基组b2plyp-d3/def2tzvpp计算反应物、产物、ts单点能,分别为-716.2849hartree、-716.1636hartree、-716.1791hartree。然后将所述反应物、产物、ts的零点能校正量,焓和吉布斯自由能的校正量加到分别加到其对应的单点能上,获得焓和吉布斯值。过渡态和反应物的吉布斯自由能差值为反应活化能265.0733kj/mol,产物与反应物焓值的差值为反应热302.2754kj/mol。
78.实施例4
79.用于说明本发明提供的分解放热性化学品热稳定微观特征的量化表征方法
80.按照实施例2的方法对硝基苯的微观热稳定特性进行分析,不同的是,步骤(5)中,密度泛函理论为b3pw91,基组为6-31g(d),高精度的密度泛函为b2plypd,高精度的基组为deftzvp。
81.实施例5
82.用于说明本发明提供的分解放热性化学品热稳定微观特征的量化表征方法
83.按照实施例2的方法对硝基苯的微观热稳定特性进行分析,不同的是,步骤(2)中,所述升温速率为110k/fs;步骤(5)中,计算单点能时不采用高精度密度泛函及基组,即采用blyp密度泛函,3-21g基组计算单点能。
84.对比例1
85.用于说明参比的提供的分解放热性化学品热稳定微观特征的量化表征方法
86.按照cn102539624b的方法对硝基苯的微观热稳定特性进行分析。
87.测试例
88.汇总实施例1-5和对比例1得到的结果,并与从文献上获得亚硝酸甲酯、硝基苯和二硝基苯酚的结果对比,见表1.
89.表1
[0090][0091]
通过表1的结果可以看出,实施例1-5能够获得分解放热性化学品热分解温度、分解活化能和反应热数据,并且与文献值较为接近,其中,实施例1-3获得的热分解温度、分解活化能和反应热与文献值更为接近。而对比例1无法获得分解活化能和反应热。
[0092]
测试例2
[0093]
实施例1获得的化学品的热分解曲线,如图1所示;其反应路径和产物生成机理,如图2-3所示。
[0094]
通过图1-3可以看出,通过实施例1的方法可以获得较为全面且准确的分解放热性化学品热分解过程中的微观反应信息。通过实施例2-5也获得了相应物质的热分解曲线,反应路径和产物生成机理。
[0095]
以上详细描述了本发明的优选实施方式,但是,本发明并不限于此。在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,包括改变各类化学剂分子结构及组成,进行各个技术特征以任何其它的合适方式进行组合,这些简单变型和组合同样应当视为本发明所公开的内容,均属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1