一种泪液试纸上ApoJ提取和定量检测方法及其试剂盒和应用与流程
一种泪液试纸上apoj提取和定量检测方法及其试剂盒和应用
技术领域
1.本发明涉及检测技术领域,特别涉及一种泪液试纸上apoj提取和定量检测方法及其试剂盒和应用。
背景技术:
2.干眼症是一种由于各种不同的功能和眼表保护机制紊乱所致的眼表疾病,它是眼科中发病率最高的眼表疾病之一,干眼症的发病是多方面因素导致的,眼表组织和泪膜的缺失等都会引起干眼症。目前研究显示神经机能、性激素和炎症因子等在调节泪液分泌的过程中起重要作用。干眼症为任何原因所致泪液质和量及动力学的异常,从而导致泪膜不稳定和/或眼表面的异常,并伴有眼部不适症状的一类疾病。引起干眼症的病因很多,环境因素、个人习惯等引起的轻度干眼症患者(如长时间使用电脑、长期处于空调环境等)仅出现较轻的症状,而无明显的眼表损害,这些影响因素的及时改善可使眼部不适感消失;但对于局部或全身有明确病因引起的干眼症(如眼表化学及热烧伤、sj69ren综合征、过敏、睑缘炎等),其发病机制十分复杂。眼表(角膜、结膜、副泪腺和睑板腺)、主泪腺和它们之间的神经连接由于其密切的解剖和功能联系构成一个整体功能单位,共同发挥对泪液分泌和泪膜形成的调控作用,维护眼表健康,任一环节的损害均可导致泪膜完整性和功能的破坏,从而出现干眼症不适症状,泪膜的持续异常可损伤眼表正常的修复或防御机制,导致眼表和泪腺处于一种慢性炎症状态。尽管引起干眼症的起始病因不同,一旦进入进展阶段,炎症成为干眼症发病机制中最关键的因素,而细胞凋亡、神经调节及性激素等也共同参与了干眼症的发病过程,因此不同类型的干眼症表现出相似的病理生理改变。
3.泪液分泌实验(schirmeri)是临床上用于筛查干眼症的主要手段之一,具有明显精密刻度,易于观察,是一种客观的检查,简便易操作,准确率较高。具体操作方法是用一条5mm
×
35mm的试纸,将一端折弯5mm,置于下睑内侧1/3结膜囊内,其余部分悬垂于皮肤表面,轻闭双眼,5分钟后测量试纸被泪水渗湿的长度。泪液分泌实验的结果为:正常人的结果为10-15mm/5min,<10mm为低分泌,<5mm为干眼。
4.载脂蛋白j(apoj,又称clusterin)是一种多功能的糖蛋白,广泛存在于人体多种组织及体液中。载脂蛋白j是一种相对分子质量为75-80kda的异质二聚体蛋白质,能够与人血浆高密度脂蛋白(hdl)和极高密度脂蛋白(vhdl)相结合。载脂蛋白j的功能复杂,参与包括补体功能的调节、抑制凋亡和炎症、参与脂质的运输等多种体内生理过程。1996年apoj被证明是人类角膜中表达最高的转录物,蛋白产物定位于角膜和结膜粘膜上皮的顶端层。apoj也存在于人类眼泪中。apoj在液-组织界面上表现突出,在严重的干眼症中其表达显着降低。在模拟人干眼疾病的临床前应激小鼠模型中,当眼睛受到干燥压力时,眼表上皮细胞中apoj mrna和蛋白的表达水平都降低了约30%。通过对小鼠眼睛局部施用apoj可以提供完全保护,表现为apoj能够密封眼睛表面以防止荧光素染料的渗透。apoj在体内和体外选择性地结合在干燥应力作用下的眼表,并结合到关键屏障成分lgals3(galectin-3),进一步抑制眼表面结构蛋白(例如lgals3和ocln)的蛋白水解。通过这种方式定位,apoj不仅在
物理上密封了眼表屏障,而且还保护了屏障细胞,防止了屏障结构的进一步损伤。apoj具有保护眼睛表面蛋白免于酶解的能力,可能是通过与mmp9之间相互作用,从而抑制了mmp9的蛋白酶活性。在人类和小鼠的各种炎症条件下,可以看到眼表上皮细胞的clu耗竭,从而导致鳞状化生和角化上皮。这表明apoj可能在维持粘膜上皮分化方面有特殊作用。
5.泪液分泌实验仅仅可以通过在一定时间内泪液浸润的长度来初步判断泪液分泌情况但是无法知悉被测者眼底屏障是否正常。
技术实现要素:
6.有鉴于此,本发明旨在提出一种泪液试纸上apoj提取和定量检测方法及其试剂盒和应用,以利用泪液分泌实验使用的泪液检测试纸进一步分析干眼症病人apoj的表达情况,并为干眼症的诊断及后续的治疗提供依据。
7.为达到上述目的,本发明的技术方案是这样实现的:
8.一方面,本发明提出一种泪液试纸上apoj提取和定量检测方法,包括如下步骤:
9.s1.标准品的制备:将天然或重组apoj蛋白配制成蛋白溶液,
10.对照品的制备:将泪液试纸放入蛋白溶液中,然后取出并阴干;
11.待测品的制备:将泪液分泌实验的泪液试纸阴干;
12.s2.配制蛋白提取液:将十二烷基肌氨酸钠配制成蛋白提取液;
13.s3.蛋白提取:在步骤s1的泪液试纸中分别加入蛋白提取液,混匀后,4℃放置过夜,离心后获取上清液,即可得到提取的蛋白溶液;
14.s4.apoj定量检测方法:利用elisa方法检测标准品的apoj的含量,并获得回归线性方程;取对照品和待测品提取的蛋白溶液,经过elisa方法检测获得吸光度值,与所述回归线性方程比较,获得对照品和待测品的apoj浓度。
15.进一步的,所述步骤s4中通过elisa方法获取回归线性方程的具体操作步骤为:
16.s41.将标准品的蛋白溶液用稀释液稀释到不同浓度;
17.s42.在包被板中每孔加入100μl样品,轻微晃动混合均匀,覆上板贴37℃反应2小时;
18.s43.弃去液体,甩干;每孔加生物素抗体标记的抗体工作液100μl,覆上新板贴37℃反应1小时;
19.s44.弃去孔内液体,甩干,洗板3次,每次浸泡2min,200μl/每孔,甩干;
20.s45.每孔加辣根过氧化物酶标记亲和素工作液100μl,覆上新板贴37℃反应1小时;
21.s46.弃去孔内液体,甩干,洗板5次,每次浸泡2min,200μl/每孔,甩干;
22.s47.依序每孔加入tmb底物显色溶液90μl,37℃避光显色;
23.s48.依序每孔加入tmb终止液50μl,终止反应;
24.s49.在终止反应后5min内用酶标仪在450nm波长测量各孔od值,做回归线性方程。
25.进一步的,所述步骤s1对照品的制备中,将天然或重组apoj蛋白配制成50μg/ml的蛋白溶液。
26.进一步的,所述步骤s2中,将十二烷基肌氨酸钠配制成1%的蛋白提取液。
27.进一步的,所述步骤s3中,在12000-15000rpm条件下离心3min获取上清液。
28.进一步的,所述步骤s4中,是以标准品的蛋白溶液的浓度为横坐标,od值为纵坐标,绘制标准曲线,并计算回归线性方程。
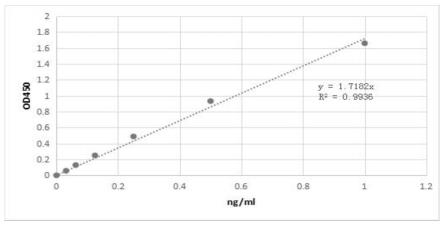
29.进一步的,所述步骤s4中,回归线性方程为y=1.7182x,其中相关系数r2=0.9936。
30.进一步的,所述步骤s41中,稀释液为1%bsa的pbst溶液。
31.进一步的,所述步骤s43中,抗体工作液为含apoj抗体的1%bsa的pbst溶液。
32.进一步的,所述步骤s44、s46中洗板所用的洗涤液为pbst溶液。
33.相对于现有技术,本发明所述的一种泪液试纸上apoj提取和定量检测方法具有以下优势:利用十二烷基肌氨酸钠从泪液中剥离收集apoj蛋白,然后通过elisa检测方法定量检测泪液试纸上apoj的含量,从而判断干眼症患者的眼底屏障情况,为后续的诊断和治疗提供了一种快速便捷的手段,且elisa检测方法检测灵敏度高。
34.另一方面,本发明提供一种泪液试纸上apoj提取和定量检测的试剂盒,所述试剂盒是以所述的一种泪液试纸上apoj提取和定量检测方法进行检测的。
35.另一方面,本发明提出一种泪液试纸上apoj提取和定量检测的试剂盒在干眼症中的应用。
36.所述试剂盒及其应用与上述泪液试纸上apoj提取和定量检测方法相对于现有技术所具有的优势相同,在此不再赘述。
附图说明
37.构成本发明的一部分的附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
38.图1为本发明的标准曲线;
具体实施方式
39.下面结合具体实施方式,进一步阐述本发明。首先应说明的是,下述实验例中的数据是由发明人通过大量实验获得,限于篇幅,在说明书中只展示其中的一部分,且本领域普通技术人员可以在此数据下理解并实施本发明。这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些改动或修改同样落于本技术所保护的范围。
40.本发明提供的方法中所用试剂均可由市场购得。其中作为标准品的apoj可以为天然的也可以是重组的。
41.实施例1一种泪液试纸上apoj提取和定量检测方法
42.具体包括如下步骤:
43.s1.样品制备
44.s11.标准品的制备:
45.将天然或重组apoj蛋白配制成蛋白溶液,
46.s12.泪液试纸饱和体积的确认:
47.先将未使用过的泪液试纸剪成3mm/段,分别吸取1-5μl体积的pbs溶液,观察能使泪液试纸充分吸干pbs溶液的体积,结果为:使用2μl体积的pbs溶液就能完全浸润试纸且基
本无液体残留;
48.s13.对照品的制备:
49.将天然或重组的apoj蛋白用pbs溶液配制成50μg/ml的蛋白溶液,用所述蛋白溶液浸润未使用过的泪液试纸,然后将试纸放入ep管中阴干,模拟泪液试纸被泪液浸润;
50.s14.待测品的制备:
51.将患者泪液分泌实验的泪液试纸放入ep管中阴干。
52.s2.配制蛋白提取液:
53.取1g十二烷基肌氨酸钠(skl)用100ml pbs溶液溶解,配制成含1%skl的pbs溶液。
54.s3.蛋白提取:
55.取出阴干后的步骤s1的泪液试纸,所述泪液试纸为对照品的泪液试纸和待测品的泪液试纸,观察泪液浸湿染色情况,按需要在被浸润区间的中间部分取其中3mm,放入ep管中,加入200μl的蛋白提取液,用移液枪吹打数次或振荡器混匀,4℃放置过夜。最后13000rpm离心3min取上清,即可得到提取的蛋白溶液。
56.s4.apoj定量检测方法:
57.利用elisa方法检测标准品apoj的含量,并获得回归线性方程;取对照品和待测品提取的蛋白溶液,经过elisa方法检测,获得吸光度值,与所述回归线性方程比较,获得对照品和待测品的apoj浓度。
58.其中,通过elisa方法获取回归线性方程的具体操作步骤为:
59.s41.将标准品的蛋白溶液用稀释液稀释到不同浓度;所述稀释液为1%bsa的pbst溶液;
60.s42.在包被板中每孔加入100μl样品,轻微晃动混合均匀,覆上板贴37℃反应2小时;
61.s43.弃去液体,甩干;每孔加生物素抗体标记抗体工作液100μl,覆上新板贴37℃反应1小时;所述抗体工作液为含apoj抗体的1%bsa的pbst溶液;
62.s44.弃去孔内液体,甩干,洗板3次,每次浸泡2min,200μl/每孔,甩干;
63.s45.每孔加辣根过氧化物酶标记亲和素工作液100μl,覆上新板贴37℃反应1小时;
64.s46.弃去孔内液体,甩干,洗板5次,每次浸泡2min,200μl/每孔,甩干;洗板所用的洗涤液为pbst溶液。
65.s47.依序每孔加入tmb底物显色溶液90μl,37℃避光显色;
66.s48.依序每孔加入tmb终止液50μl,终止反应;
67.s49.在终止反应后5min内用酶标仪在450nm波长测量各孔od值;以标准品的蛋白溶液的浓度为横坐标,od值为纵坐标,绘制标准曲线。
68.apoj蛋白溶液的浓度与450nm波长下的od值呈线性关系,标准曲线具体如图1所示。所述回归线性方程为y=1.7182x,其中相关系数r2=0.9936。
69.具体实验数据如表1所示:
70.表1
71.浓度ng/ml00.031250.06250.1250.250.51od450nm0.1150.1740.240.3670.5851.0221.777
72.检测对照品或待测品的od值,并由所述回归线性方程查出相应的浓度,再乘以稀释倍数,便可得到对照品或待测品中apoj的实际浓度。
73.进一步的,将通过本发明elisa检测方法获得的回归线性方法所计算的对照品apoj的浓度,和对照品实际的apoj浓度进行对比,二者结果一致,说明了本发明的检测方法准确可靠。
74.apoj在严重的干眼症中表达明显下降,且利用apoj作为药物既可以抵抗引起干眼症的干燥压力,又可以防止mmp9的下游激活干眼症病理途径。如果能快速检测干眼症患者泪液中apoj的表达量,可以判断干眼症患者是否属于泪液中apoj含量低引起的眼底屏障受损,为后期的诊断及治疗提供依据。若干眼症患者泪液中apoj的表达量较底,可以将apoj作为药物对患者施用。故采用本发明的检测方法,先利用十二烷基肌氨酸钠将泪液试纸上的apoj蛋白剥离和洗脱下来,所述十二烷基肌氨酸钠溶液还能帮助apoj蛋白维持一定的单体结构,抑制蛋白的聚集,便于测量apoj的表达量;然后通过elisa方法准确检测泪液试纸上的apoj的表达量。通过干眼症患者泪液分泌实验的泪液试纸上apoj的表达量和正常人泪液分泌实验的泪液试纸上apoj的表达量进行比较,当干眼症患者apoj的表达量低于正常人时,说明干眼症患者眼底屏障受损,需要及时进行相应的治疗。
75.实施例2elisa试剂盒的组装
76.所述elisa试剂盒的具体组成如下:(1)空白酶标板一块;(2)apoj标准品一份;(3)十二烷基肌氨酸钠;(4)生物素抗体标记抗体工作液(所述抗体工作液为含apoj抗体的1%bsa的pbst溶液)、辣根过氧化物酶标记亲和素工作液;(5)pbs缓冲液、洗涤液(pbst溶液)、底物显色液(tmb系统)及终止液(tmb系统)。
77.实施例3临床样本的检测
78.从某医院随机挑选4名干眼症患者进行泪液分泌实验,将得到的泪液试纸阴干后,剪取其中3mm,放入ep管中;将十二烷基肌氨酸钠配制成1%的蛋白提取液,将阴干后的泪液试纸中加入200μl的蛋白提取液,用移液枪吹打数次或者振荡器混匀,4℃放置过夜。最后13000rpm离心3min取上清,即可得到提取的蛋白溶液,采用elisa检测方法进行测定,记录450nm波长的od值,利用标准曲线计算泪液样品中apoj的含量,具体结果如表2所示。
79.表2
80.编号右眼mg/l左眼mg/l116.3610.08219.8015.78326.7511.03429.4335.86
81.通过表2可知,同样是干眼病患者,泪液中apoj的含量也不同。例如4号患者左右眼apoj的含量分别为35.86mg/l和29.43mg/l,而1号患者左右眼apoj的含量分别为10.08mg/l和16.36mg/l。1号患者泪液中apoj的含量下降较多,眼底屏障受损。
82.以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1