SARS-CoV-2中和抗体的检测试剂盒及其应用的制作方法
本发明涉及抗体检测领域,具体而言,涉及一种sars-cov-2中和抗体的检测试剂盒及其应用。
背景技术:
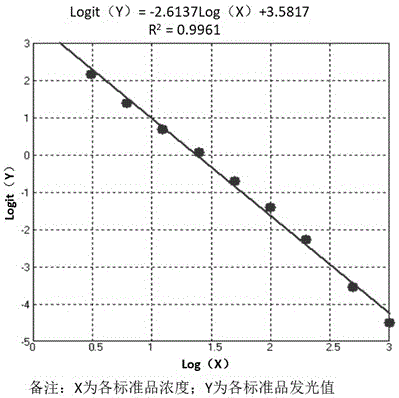
:新型冠状病毒(sars-cov-2)是2019年新发现的一种病毒,属于β属的新型冠状病毒,有包膜,颗粒呈圆形或椭圆形,常为多形性,直径60-140nm。经呼吸道飞沫传播是主要的传播途径,亦可通过接触传播。人群普遍易感,可导致肺部感染或病毒性肺炎疾病(covid-19)。潜伏期一般为3-7天,最长不超过14天。以发热、乏力、干咳为主要表现,少数患者伴有鼻塞、流涕、腹泻等症状。重型病例多在一周后出现呼吸困难,严重者快速进展为急性呼吸窘迫综合征、脓毒症休克、难以纠正的代谢性酸中毒和出凝血功能障碍。sars-cov-2基因组依次编码棘突蛋白(s)、包膜蛋白(e)、膜蛋白(m)和核衣壳蛋白(n)。s蛋白包含两个功能性亚基,分别是n端的s1和c端的s2,其中s1负责与宿主细胞受体结合,s2负责病毒膜和细胞膜融合。s蛋白介导病毒进入宿主细胞,对决定组织嗜性和宿主范围至关重要,负责新型冠状病毒与宿主细胞膜受体结合及膜融合,是新型冠状病毒中和抗体的重要作用位点以及疫苗设计的关键靶点。新型冠状病毒疫苗是预防sars-cov-2病毒感染的有效方法。为了应对新型冠状病毒疫情威胁,目前已经有很多国家开始了疫苗接种工作,但接种新型冠状病毒疫苗后,产生的保护效果并不确定,评估新型冠状病毒疫苗有效性的重要指标之一就是接种者体内中和抗体的含量,因此建立安全、有效的中和抗体检测方法,评价疫苗注射后的免疫效果,对于疫情的全面防控具有重要的意义。目前新型冠状病毒中和抗体检测方法中,“金标准”是真病毒中和试验,即用真病毒去感染细胞,然后观察接种者或者康复者的血清是否可以阻断病毒与细胞受体的结合,但真病毒中和试验对条件要求十分苛刻,生物安全风险较高,只能在生物安全三级防护(bsl-3)及以上实验室进行,而且非常耗时,通常要2天到4天才能完成。另一种方法是基于假病毒的中和试验,即将水痘病毒或疱疹病毒等病毒的某个蛋白替换成新型冠状病毒的s蛋白进行中和试验,其可以在生物安全二级实验室(bsl-2)操作,但仍需使用活病毒和细胞。因此,针对大规模疫苗接种后的人群,需要更加简便、高效、灵敏、准确的检测方法,达到快速评估其体内中和抗体水平的目的。但目前相关的酶联免疫吸附和免疫层析等检测方法,在特异性、敏感性、时效性、自动化等方面的性能还有待提高。有鉴于此,特提出本发明。技术实现要素:本发明的第一目的在于提供一种sars-cov-2中和抗体的检测试剂盒。本发明的第二目的在于提供检测试剂盒的应用。为了实现本发明的上述目的,特采用以下技术方案:一种sars-cov-2中和抗体的检测试剂盒,包括组分a和组分b;组分a包括包被于固相载体的rbd蛋白和包被于固相载体的ntd蛋白;组分b包括示踪物标记的ace2蛋白和示踪物标记的axl蛋白;所述检测试剂盒还包括ace2抗体和/或axl抗体。进一步地,组分a的rbd蛋白和ntd蛋白的工作浓度均独立地为0.2-200μg/ml,rbd蛋白和ntd蛋白的质量比为(1-10):1;组分b的ace2蛋白和axl蛋白的工作浓度均独立地为10-1000ng/ml,ace2蛋白和axl蛋白的质量比为(1-10):1。进一步地,ace2抗体和axl抗体的工作浓度均独立地为0.1-10μg/ml。进一步地,组分a的rbd蛋白的工作浓度为20μg/ml,ntd蛋白的工作浓度为4μg/ml;组分b的ace2蛋白的工作浓度为100ng/ml,axl蛋白的工作浓度为20ng/ml。进一步地,ace2抗体和axl抗体的工作浓度均独立地为1μg/ml。进一步地,所述检测试剂盒的检测方法包括化学发光法、酶联免疫吸附分析、免疫层析、免疫渗滤分析、免疫荧光法、单分子免疫分析或多重免疫分析。进一步地,固相载体包括磁性微粒、微孔滴定板、硝酸纤维素膜或聚苯乙烯胶乳,磁性微粒包括羧基磁珠、氨基磁珠、nhs磁珠、羟基磁珠、甲苯磺酰基磁珠或环氧基磁珠;包被或标记的方式包括直接或间接,间接方式包括采用sa-biotin体系、fitc-抗fitc体系或his-抗his体系;示踪物包括吖啶酯及其衍生物、辣根过氧化物酶、碱性磷酸酶、异鲁米诺或三联吡啶钌。进一步地,组分a的工作液包括0.01-0.2mol/lph7.4tris-hcl缓冲液,1-50mg/mlbsa和0.1-5ml/l吐温20。进一步地,组分b的工作液包括0.01mol/l-0.2mol/l磷酸盐缓冲液,0.1-50g/l牛血清白蛋白,5-50g/l氯化钠,10-50g/l蔗糖和0.5-5ml/lproclin300,ph为6.0-7.6。进一步地,还包括中和抗体标准品、预激发液和激发液;预激发液为含有0.5-2ml/lh2o2的0.05-0.2mol/lhno3溶液;激发液为含有10-30ml/ltritonx-100的0.15-0.4mol/lnaoh。上述检测试剂盒在sars-cov-2疫苗评价或制备检测sars-cov-2中和抗体产品中的应用。进一步地,评价或检测包括方法步骤:在ace2抗体和/或axl抗体存在的条件下,组分a和待测样本发生反应,然后利用固相载体分离纯化,再与组分b反应,经检测示踪物信号得到sars-cov-2中和抗体含量。与现有技术相比,本发明的有益效果为:本发明提供一种sars-cov-2中和抗体的检测试剂盒,该检测试剂盒利用竞争法对sars-cov-2中和抗体进行检测,通过同时应用sars-cov-2rbd蛋白和ntd蛋白两种抗原模拟病毒感染时的作用位点,中和抗体可以竞争性阻断ace2受体蛋白和axl受体蛋白与作用位点的结合,从而实现中和抗体的检测。该检测试剂盒不仅避免了活病毒的应用,提高安全性,同时灵敏度高,特异性好,提高了中和抗体检测准确性,对疫苗评价具有重要意义。此外,由于待检测样本自身含有ace2和axl蛋白,会对上述检测体系产生干扰,导致产生非特异性反应或假阳结果,所以,本发明创造性加入了ace2抗体和/或axl抗体,从而消除了样本中所含ace2蛋白或axl蛋白对检测体系的干扰,进一步提高了试剂的特异性和灵敏度。附图说明为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。图1为对比例1中标准曲线图。具体实施方式下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。除非另有说明,本文中所用的专业与科学术语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法或材料也可应用于本发明中。本发明提供的检测试剂盒包括组分a和组分b,其中,组分a包括包被于固相载体的rbd蛋白和包被于固相载体的ntd蛋白;组分b包括示踪物标记的ace2蛋白和示踪物标记的axl蛋白。同时,所述检测试剂盒还包括ace2抗体和/或axl抗体。该检测试剂盒的检测原理为:在ace2抗体和/或axl抗体存在的条件下,在反应管中加入组分a,再加入待测样本,样本中的中和抗体与rbd蛋白或ntd蛋白发生反应,通过洗涤得到sars-cov-2中和抗体-固相载体rbd、sars-cov-2中和抗体-固相载体ntd、固相载体rbd和固相载体ntd,然后再加入组分b,利用组分b中的ace2蛋白和axl蛋白对未与sars-cov-2中和抗体结合的固相载体rbd和固相载体ntd进行封闭,通过检测ace2蛋白和axl蛋白上的示踪物信号,从而实现中和抗体的检测。需要说明的是,ace2抗体和/或axl抗体可以添加在组分a中,也可以单独存在作为组分c,在检测时加入组分a中。由于检测体系中已含有ace2抗体和/或axl抗体,加入待测样本后,样本中起干扰作用的ace2蛋白或axl蛋白会与组分a中的ace2抗体或axl抗体结合,从而使得包被于固相载体的rbd蛋白和包被于固相载体的ntd蛋白优先与样本中的待测中和抗体发生反应,通过分离洗涤,除去样本中的其他非特异性成分和组分a中过量的ace2抗体和axl抗体,将ace2抗体和axl抗体浓度稀释至不会干扰ace2蛋白、axl蛋白分别与通过洗涤得到sars-cov-2中和抗体-固相载体rbd、sars-cov-2中和抗体-固相载体ntd作用的浓度,再加入组分b,示踪物标记的ace2蛋白和示踪物标记的axl蛋白会与固相载体表面未反应的rbd蛋白或ntd蛋白反应,分离洗涤除去未反应物质,最后加入底物或激发液,使得示踪物产生光信号,光信号由光子计数器读取,信号强度与样本中的中和抗体含量呈负相关。在一些实施方式中,组分a中,rbd蛋白和ntd蛋白的工作浓度均独立地为0.2-200μg/ml,同时,rbd蛋白和ntd蛋白的质量比为(1-10):1;组分b中,ace2蛋白和axl蛋白的工作浓度为10-1000ng/ml,ace2蛋白和axl蛋白的质量比为(1-10):1。需要说明的是,rbd蛋白、ntd蛋白、ace2蛋白、axl蛋白、ace2抗体和axl抗体均可为商品化产品。组分a中rbd蛋白和ntd蛋白的质量比与组分b中ace2蛋白和axl蛋白的质量比相近,避免检测误差和成本过高。rbd蛋白和ntd蛋白的工作浓度均独立地可以但不限于为0.2μg/ml、1μg/ml、5μg/ml、20μg/ml、50μg/ml、100μg/ml、150μg/ml或200μg/ml;rbd蛋白和ntd蛋白的质量比可以但不限于为1:1、3:1、5:1、7:1或10:1;ace2蛋白和axl蛋白的工作浓度均独立地可以但不限于为10ng/ml、50ng/ml、100ng/ml、300ng/ml、500ng/ml、700ng/ml或1000ng/ml;ace2蛋白和axl蛋白的质量比为可以但不限于为1:1、3:1、5:1、7:1或10:1。本发明中所述的“工作浓度”是指组分a或组分b含有某物质的浓度,可以直接取样进行反应检测。在优选的实施方式中,组分a的rbd蛋白的工作浓度为20μg/ml,ntd蛋白的工作浓度为4μg/ml;组分b的ace2蛋白的工作浓度为100ng/ml,axl蛋白的工作浓度为20ng/ml。在优选的实施方式中,ace2抗体和axl抗体的工作浓度均独立地为0.1-10μg/ml,其浓度依据现有临床数据中人体生理和病理状态下的最大含量而定。具体地,ace2抗体和axl抗体的工作浓度均独立地可以但不限于为0.1μg/ml、0.5μg/ml、1μg/ml、5μg/ml或10μg/ml,优选为1μg/ml。在一些实施方式中,检测试剂盒的检测方法包括酶联免疫吸附分析、免疫层析、免疫渗滤分析、免疫荧光法、单分子免疫分析或多重免疫分析。可以根据不同的检测方法选择对应的固相载体和示踪物。在一些实施方式中,固相载体可以为磁性微粒、微孔滴定板、硝酸纤维素膜或聚苯乙烯胶乳,磁性微粒可以为羧基磁珠、氨基磁珠、nhs磁珠、羟基磁珠、甲苯磺酰基磁珠或环氧基磁珠。可以理解的是,本发明中的固相载体可以用于分离纯化rbd蛋白和ntd蛋白以及二者连接的物质,同时不影响反应体系中的特异性结合反应,优选为磁性微粒。固相载体为磁性微粒,则组分a的工作液包括0.01-0.2mol/lph7.4tris-hcl缓冲液,1-50mg/mlbsa和0.1-5ml/l吐温20。在一些实施方式中,示踪物可以为吖啶酯及其衍生物、辣根过氧化物酶、碱性磷酸酶、异鲁米诺或三联吡啶钌,优选为吖啶酯。示踪物为吖啶酯,则组分b的工作液包括0.01mol/l-0.2mol/l磷酸盐缓冲液,0.1-50g/l牛血清白蛋白,5-50g/l氯化钠,10-50g/l蔗糖和0.5-5ml/lproclin300,ph为6.0-7.6。在一些实施方式中,固相载体的包被和示踪物的标记,其方式均独立地可以为直接或间接,间接方式例如可以采用sa-biotin体系、fitc-抗fitc体系或his-抗his体系。为了实现中和抗体的定量检测,可以提供中和抗体标准品,通过对已知不同含量的标准品浓度和发光信号值拟合后所建立的标准曲线,可以计算出样本中新型冠状病毒中和抗体的浓度,从而判断其是否能处于正常参考范围。以固相载体为磁性微粒,示踪物为吖啶酯为例,上述检测试剂盒的制备如下:a)磁微粒偶联物的制备:利用直径为0.1-5μm表面修饰有化学基团的磁微粒,直接或间接在不同的磁微粒表面分别偶联rbd蛋白和ntd蛋白,蛋白与磁珠质量比为1:500-1:10,用磁微粒稀释液将其稀释成rbd蛋白和ntd蛋白浓度均为0.2-200μg/ml的磁微粒偶联物工作液,且rbd蛋白与ntd蛋白的质量比为10:1-1:1。磁微粒稀释液,含有0.01-0.2mol/lph7.4的tris-hcl缓冲液,1-50mg/ml的bsa,0.1-5ml/l的吐温20,且另外加入浓度为0.1-10μg/ml的ace2抗体和0.1-10μg/mlaxl抗体。b)标记结合物的制备:在ace2蛋白和axl蛋白上分别标记示踪物质,用标记物稀释液将其稀释成ace2蛋白和axl蛋白分别为10-1000ng/ml的标记结合物工作液,且ace2与axl的质量比为10:1-1:1。标记物稀释液,含有0.01mol/l-0.2mol/l磷酸盐缓冲液,0.1-50g/l牛血清白蛋白,5-50g/l氯化钠,10-50g/l蔗糖和0.5-5ml/lproclin300,ph为6.0-7.6。c)预激发液和激发液的制备:先配制0.lmol/l的hno3溶液,再加入1ml/l的h2o2,即配制为预激发液;先配制0.25mol/l的naoh溶液,再加入20ml/l的tritonx-100,即配制为激发液。d)标准曲线的建立:用样品稀释液,将中和抗体标准品稀释为不同浓度进行测试,根据浓度和信号值,选择适当的数学模型进行拟合,建立标准曲线。样品稀释液含有0.01-0.2mol/l磷酸盐缓冲液,100-500ml/l小牛血清,0.2-10ml/ltween20和0.5-5ml/lproclin300,ph为6.0-7.6。e)阳性判断值(cutoff值)的建立:收集注射sars-cov-2灭活病毒疫苗后经过病毒中和实验(mnt)验证有病毒阻断能力的样本作为阳性样本和未注射过新冠疫苗且未感染过sars-cov-2病毒的健康人样本作为阴性样本。采用新冠中和抗体试剂盒全部测试后,通过roc曲线法,y轴为灵敏度,x轴为特异性,约登指数是灵敏度与特异性之和减1。通过spss软件分析找出灵敏度和特异性最高即约登指数最高点的临界值,为理论最佳临界值,将其定为cutoff值。试剂盒的检测程序如下:1)加待测样本和磁微粒偶联物:将5-100μl待测样本和10-200μl磁微粒偶联物工作液分别加入到反应管中,37℃温育5-60min,使待测样本中的新型冠状病毒中和抗体与相应蛋白优先反应,形成免疫复合物。2)洗涤:利用磁分离洗涤原理,对反应体系进行2-6次清洗,除去未结合物质和非特异性成分,使其不影响后续反应过程。3)加标记结合物:在清洗后的反应体系中,加入10-200μl标记结合物工作液,37℃温育5-60min,使标记结合物与尚未反应的rbd或ntd蛋白进行反应,形成带有示踪物质的免疫复合物。4)洗涤:利用磁分离洗涤原理,对反应体系进行2-6次清洗,除去未结合物质和非特异性成分,使其不影响后续反应过程。5)检测:加入20-400μl预激发液、激发液或发光底物,检测产生的相对光信号强度(rlu),通过拟合计算判定新型冠状病毒中和抗体的测试结果。上述检测试剂盒可以用于sars-cov-2疫苗评价或制备检测sars-cov-2中和抗体产品。下面通过具体的实施例进一步说明本发明,但是,应当理解为,这些实施例仅仅是用于更详细地说明之用,而不应理解为用于以任何形式限制本发明。对比例11)磁微粒偶联物的制备取10mg羧基磁微粒,磁分离洗涤3次,加入0.9mlph5.5的mes缓冲液,旋涡混匀,加入0.1ml浓度为50mg/ml的edc溶液,混匀,25℃混匀反应0.5小时,磁分离洗涤3次,加入0.9mlph5.5的mes缓冲液,旋涡混匀,加入0.1ml浓度为2mg/ml的rbd蛋白,旋涡混匀,25℃混匀反应2小时,加入100μl的100mg/mlbsa,37℃混匀反应4小时,磁分离洗涤3次,加10ml磁微粒稀释液,使rbd蛋白浓度为20.0μg/ml,制成磁微粒偶联物。所述磁微粒稀释液,含有0.05mol/lph7.4的tris-hcl缓冲液,10mg/ml的bsa,0.5ml/l的tween-20。2)标记结合物的制备将0.5mg的ace2蛋白用0.1mol/l的碳酸盐缓冲液进行透析。将吖啶磺酰胺(nsp-sa-nhs)溶于二甲亚砜(dmso)中,按照吖啶磺酰胺与ace2蛋白摩尔比为20:1的比例将二者混合,25℃避光反应2h,再按照赖氨酸与吖啶磺酰胺摩尔比100:1的比例加入赖氨酸,25℃避光反应30min,将反应后的液体用20mmol/lpbs于4℃透析24小时,最后用标记物稀释液稀释,使ace2标记结合物的浓度为100ng/ml,即制成标记结合物。所述标记物稀释液,含有0.1mol/l磷酸盐缓冲液,5g/l牛血清白蛋白,8.5g/l氯化钠,20g/l蔗糖,以及0.1ml/l的proclin300,ph为7.2。3)预激发液和激发液的制备先配制0.lmol/l的hno3溶液,再加入1ml/l的h2o2,即配制为预激发液。先配制0.25mol/l的naoh溶液,再加入20ml/l的tritonx-100,即配制为激发液。4)标准曲线的建立用样品稀释液,将中和抗体标准品稀释为不同浓度进行测试,将标准品各浓度值和所测得的发光值按照log-logit数学模型进行拟合,其中横坐标为log(x),纵坐标为logit(y),按公式logit(y)=ln[(y/y0)/(1-y/y0)]计算,其中y表示标准品各浓度的发光值,y0表示标准品浓度为0时的发光值,建立标准曲线,如图1所示。所述样品稀释液,含有0.05mol/l磷酸盐缓冲液,100ml/l小牛血清,0.5ml/ltween20和0.1ml/lproclin300,ph为7.2。5)阳性判断值(cutoff值)的建立收集120例注射sars-cov-2灭活病毒疫苗后经过病毒中和实验(mnt)验证有病毒阻断能力的样本作为阳性样本和120例未注射过新冠疫苗且未感染过sars-cov-2病毒的健康人样本作为阴性样本。采用新冠中和抗体试剂盒全部测试后,通过roc曲线法,y轴为灵敏度,x轴为特异性,约登指数是灵敏度与特异性之和减1。通过spss软件分析找出灵敏度和特异性最高即约登指数最高点的临界值,为理论最佳临界值,将其定为cutoff值。6)将试剂盒和样本采用全自动化学发光仪进行分析检测,检测程序如下:a)加样本和磁微粒偶联物:将50μl待测样本和50μl磁微粒偶联物工作液分别加入到反应管中,37℃温育10min,使待测样本中的新型冠状病毒中和抗体与相应蛋白优先反应,形成免疫复合物。b)洗涤:利用磁分离洗涤原理,对反应体系进行3次清洗,除去未结合物质和非特异性成分,使其不影响后续反应过程。c)加标记结合物:在清洗后的反应体系中,加入100μl标记结合物工作液,37℃温育10min,使标记结合物与尚未反应的rbd或ntd蛋白进行反应,形成带有示踪物质的免疫复合物。d)洗涤:利用磁分离洗涤原理,对反应体系进行3次清洗,除去未结合物质和非特异性成分,使其不影响后续反应过程。e)检测:先加入100μl预激发液,再加入100μl激发液,检测产生的相对光信号强度(rlu),通过拟合计算判定新型冠状病毒中和抗体的测试结果。对比例2参照对比例1,不同在于,在磁珠稀释液中另外加入浓度为1μg/ml的ace2抗体,其浓度依据现有临床数据中人体生理和病理状态下的最大含量而定。对比例3参照对比例1,但在磁微粒偶联蛋白时,根据对比例1偶联方法,另行偶联ntd蛋白,制成磁微粒-ntd偶联物,与对比例1中的rbd磁微粒偶联物以适当比例混合,作为磁微粒偶联物工作液。在吖啶酯标记时,另行标记axl蛋白,制成axl吖啶酯标记结合物,与对比例1中的ace2吖啶酯标记结合物以适当比例混合,作为标记结合物工作液。具体如下:取20mg羧基磁微粒,磁分离洗涤3次,加入1.8mlph5.5的mes缓冲液,旋涡混匀,加入0.2ml浓度为50mg/ml的edc溶液,混匀,25℃混匀反应0.5小时,磁分离洗涤3次,加入1.8mlph5.5的mes缓冲液,旋涡混匀,平均分为2管,第1管加入0.1ml浓度为2mg/ml的rbd蛋白,第2管加入0.1ml浓度为2mg/ml的ntd蛋白,分别旋涡混合,再25℃混匀反应2小时,各加入100μl10%bsa,37℃混匀反应4小时,磁分离洗涤3次,再分别加入1ml磁微粒稀释液,制成磁微粒-rbd浓缩偶联物和磁微粒-ntd浓缩偶联物,将两者以5:1混合,使rbd蛋白和ntd蛋白的浓度分别为20μg/ml和4μg/ml,制成磁微粒偶联物工作液。所述磁微粒稀释液,含有0.05mol/lph7.4的tris-hcl缓冲液,10mg/ml的bsa,0.5ml/l的tween-20。按照ace2吖啶磺酰胺标记结合物制备方法,另行制备axl吖啶磺酰胺标记结合物,将两者以5:1混合,使ace2蛋白和axl蛋白浓度分别为100ng/ml和20ng/ml,制成标记结合物工作液。其他同对比例1。实施例1参照对比例3,但在磁珠稀释液中另外加入浓度为1μg/ml的axl抗体,其浓度依据现有临床数据中人体生理和病理状态下的含量而定,其他同对比例3。实施例2参照实施例1,但在磁珠稀释液中另外加入浓度为1μg/ml的ace2抗体,其浓度依据现有临床数据中人体生理和病理状态下的含量而定,其他同对比例3。实施例3参照实施例1,但在磁珠稀释液中另外加入浓度均为1μg/ml的ace2抗体和axl抗体,其浓度依据现有临床数据中人体生理和病理状态下的含量而定,其他同对比例3。实施例4将磁微粒-rbd浓缩偶联物和磁微粒-ntd浓缩偶联物以1:1混合,使rbd蛋白和ntd蛋白的浓度分别均为0.2μg/ml,制成磁微粒偶联物工作液,另外加入浓度均为0.1μg/ml的ace2抗体和axl抗体。将ace2吖啶磺酰胺标记结合物和axl吖啶磺酰胺标记结合物以1:1混合,使ace2蛋白和axl蛋白浓度分别均为10ng/m,制成标记结合物工作液。其他同实施例3。实施例5将磁微粒-rbd浓缩偶联物和磁微粒-ntd浓缩偶联物以1:1混合,使rbd蛋白和ntd蛋白的浓度分别均为200μg/ml,制成磁微粒偶联物工作液,另外加入浓度均为10μg/ml的ace2抗体和axl抗体。将ace2吖啶磺酰胺标记结合物和axl吖啶磺酰胺标记结合物以1:1混合,使ace2蛋白和axl蛋白浓度均为1000ng/ml,制成标记结合物工作液。其他同实施例3。对比例4将磁微粒-rbd浓缩偶联物和磁微粒-ntd浓缩偶联物以1:1混合,使rbd蛋白和ntd蛋白的浓度均为0.16μg/ml,制成磁微粒偶联物工作液,另外加入浓度均为0.08μg/ml的ace2抗体和axl抗体。将ace2吖啶磺酰胺标记结合物和axl吖啶磺酰胺标记结合物以1:1混合,使ace2蛋白和axl蛋白浓度均为8ng/m,制成标记结合物工作液。其他同实施例3。对比例5将磁微粒-rbd浓缩偶联物和磁微粒-ntd浓缩偶联物以1:1混合,使rbd蛋白和ntd蛋白的浓度均为240μg/ml,制成磁微粒偶联物工作液,另外加入浓度均为12μg/ml的ace2抗体和axl抗体。将ace2吖啶磺酰胺标记结合物和axl吖啶磺酰胺标记结合物以1:1混合,使ace2蛋白和axl蛋白浓度均为1200ng/ml,制成标记结合物工作液。其他同实施例3。实施例6将磁微粒-rbd浓缩偶联物和磁微粒-ntd浓缩偶联物以1:1混合,使rbd蛋白和ntd蛋白的浓度均为20μg/ml,制成磁微粒偶联物工作液,另外加入浓度均为1μg/ml的ace2抗体和axl抗体。将ace2吖啶磺酰胺标记结合物和axl吖啶磺酰胺标记结合物以1:1混合,使ace2蛋白和axl蛋白浓度均为100ng/ml,制成标记结合物工作液。其他同实施例3。实施例7将磁微粒-rbd浓缩偶联物和磁微粒-ntd浓缩偶联物以10:1混合,使rbd蛋白和ntd蛋白的浓度分别为20μg/ml和2μg/ml,制成磁微粒偶联物工作液,另外加入浓度均为1μg/ml的ace2抗体和axl抗体。将ace2吖啶磺酰胺标记结合物和axl吖啶磺酰胺标记结合物以10:1混合,使ace2蛋白和axl蛋白浓度分别为100ng/ml和10ng/ml,制成标记结合物工作液。其他同实施例3。对比例6将磁微粒-rbd浓缩偶联物和磁微粒-ntd浓缩偶联物以1:2混合,使rbd蛋白和ntd蛋白的浓度分别为10μg/ml和20μg/ml,制成磁微粒偶联物工作液,另外加入浓度均为1μg/ml的ace2抗体和axl抗体。将ace2吖啶磺酰胺标记结合物和axl吖啶磺酰胺标记结合物以1:2混合,使ace2蛋白和axl蛋白浓度分别为50ng/ml和100ng/ml,制成标记结合物工作液。其他同实施例3。对比例7将磁微粒-rbd浓缩偶联物和磁微粒-ntd浓缩偶联物以11:1混合,使rbd蛋白和ntd蛋白的浓度分别为20μg/ml和1.81μg/ml,制成磁微粒偶联物工作液,另外加入浓度均为1μg/ml的ace2抗体和axl抗体。将ace2吖啶磺酰胺标记结合物和axl吖啶磺酰胺标记结合物以11:1混合,使ace2蛋白和axl蛋白浓度分别为100ng/ml和9.09ng/ml,制成标记结合物工作液。其他同实施例3。实施例1-7和对比例1-7的不同条件具体如下表所示:rbd蛋白浓度(μg/ml)ntd蛋白浓度(μg/ml)rbd:ntd蛋白质量比ace2蛋白浓度(ng/ml)axl蛋白浓度(ng/ml)ace2:axl蛋白质量比ace2抗体浓度(μg/ml)axl抗体浓度(μg/ml)界限值0.2-2000.2-200(1:10)-110-100010-1000(1:10)-10.1-100.1-10对比例120020:01000100:000对比例220020:01000100:010对比例32045:1100205:100实施例12045:1100205:101实施例22045:1100205:110实施例32045:1100205:111实施例40.20.21:110101:10.10.1实施例52002001:1100010001:11010对比例40.160.161:1881:10.080.08对比例52402401:1120012001:11212实施例620201:11001001:111实施例720210:11001010:111对比例610201:2501001:211对比例7201.8111:11009.0911:111使用上述对比例和实施例的试剂盒,分别检测198例注射sars-cov-2灭活病毒疫苗后经过病毒中和实验(mnt)验证有病毒阻断能力的样本作为阳性样本,以及397例未注射过新冠疫苗且未感染过sars-cov-2病毒的健康人样本作为阴性样本,比较各种方法的阳性检出率(灵敏度)和阴性检出率(特异性)。以全自动化学发光法免疫分析仪(丽珠试剂,leacl-600)为分析检测仪器,将试剂盒装载到仪器上进行测试,结果如表1所示。表1样本检测结果比较实施例阳性样本试剂盒阳性检出数量阳性样本试剂盒阴性检出数量阳性样本阳性检出率阴性样本试剂盒阴性检出数量阴性样本试剂盒阳性检出数量阴性样本阴性检出率对比例11861293.94%3811695.97%对比例21861293.94%388997.73%对比例3194497.98%3762194.71%实施例1194497.98%3811695.97%实施例2194497.98%388997.73%实施例3194497.98%394399.24%实施例4191796.46%390798.24%实施例5193597.47%390798.24%对比例41851393.43%3821596.22%对比例51881094.95%3871097.48%实施例6191796.46%394399.24%实施例7192696.97%392598.74%对比例61881094.95%391498.99%对比例71871194.44%392598.74%从上述结果中可以看出,本发明对比例2试剂盒与对比例1的检测结果相比,检测阳性样本的检出率均为93.94%,但检测397例中和抗体阴性样本,对比例2能检出阴性388例,特异性为97.73%,而对比例1只能检出阴性381例,特异性为95.97%,对比例2相较于对比例1的检测假阳数量从16例降至9例,降幅43.8%,说明对比例2的试剂盒特异性更好。在部分心血管疾病患者中,血液中ace2含量可能过高,检测时会竞争性结合rbd蛋白,引起假阳结果,而对比例2试剂盒中加入的ace2抗体,能够减弱血液中ace2对磁微粒表面rbd蛋白的结合反应,从而降低非特异性反应。本发明对比例3试剂盒与对比例1的检测结果相比,检测阳性样本198例,对比例1检出186例,检出率为93.94%,对比例3检出194例,检出率为97.89%,对比例3相较于对比例1的漏检数量从12例降至4例,降幅66.7%,说明对比例3的试剂盒灵敏度更好。研究表明,新型冠状病毒中和抗体的靶点不仅包含rbd蛋白,还包含ntd蛋白。sars-cov-2中和抗体一方面通过阻断rbd蛋白与其受体ace2蛋白结合,另一方面通过阻断ntd蛋白与其受体axl蛋白结合,从而达到保护机体免受病毒侵入的效应。对比例3由于在检测体系中加入了ntd蛋白磁微粒标记物和axl蛋白标记结合物,使得sars-cov-2中和反应更为完全,因此提升了检测灵敏度。但同时,对比例3与对比例1的相比,特异性有所下降,假阳数量从16例升至21例,特异性从95.97%降至94.71%,可能主要是受到血液中axl蛋白的影响而导致了部分样本的假阳现象。本发明实施例1试剂盒与对比例3的检测结果相比,检测阳性样本的检出率均为97.98%,但检测397例中和抗体阴性样本,实施例1能检出阴性381例,特异性为95.97%,而对比例3只能检出阴性376例,特异性为94.7%,实施例1相较于对比例3的检测假阳数量从21例降至16例,降幅23.8%,说明实施例1相对于对比例3的特异性更好。在部分肾炎患者、肿瘤患者中,血液中axl蛋白含量可能过高,检测时会竞争性结合磁微粒表面偶联的ntd蛋白,引起假阳结果,而实施例1试剂盒中加入的axl抗体,能够减弱血液中axl蛋白对磁微粒表面ntd蛋白的结合反应,从而降低非特异性反应。本发明实施例2试剂盒与对比例3的检测结果相比,检测阳性样本的检出率均为97.98%,但检测397例中和抗体阴性样本,实施例2能检出阴性388例,特异性为97.73%,而对比例3只能检出阴性376例,特异性为94.71%,实施例2相较于对比例3的检测假阳数量从21例降至9例,降幅57.1%,说明实施例2的试剂盒特异性更好。在部分心血管疾病患者中,血液中ace2含量可能过高,检测时会竞争性结合磁微粒表面偶联的rbd蛋白,引起假阳结果,而实施例2试剂盒中加入的ace2抗体,能够减弱血液中ace2对磁微粒表面rbd蛋白的结合反应,从而降低非特异性反应。本发明实施例3中的试剂盒,对198例中和抗体阳性样本的检出数量为194,检出率为97.98%,对397例中和抗体阴性样本的检出数量为394,检出率为99.24%。与实施例2相比,检测结果假阳数量从9例降至3例,降幅66.7%,说明实施例3相对于实施例2的特异性更好。与实施例1相比,检测结果假阳数量从16例降至3例,降幅81.3%,说明实施例3相对于实施例1的特异性更好。与对比例3相比,检测结果假阳数量从21例降至3例,降幅85.7%,说明实施例3相对于对比例3的特异性更好。与对比例2相比,检测结果漏检数量从12例降至4例,降幅66.7%,说明实施例3相对于对比例2的灵敏度更好。与对比例1相比,检测结果漏检数量从12例降至4例,降幅66.7%,同时检测结果假阳数量从16例降至3例,降幅81.3%,说明实施例3相对于对比例1的特异性和灵敏度均更好。实施例3中,包含了新型冠状病毒中和抗体的2个作用靶点—rbd蛋白和ntd蛋白,及其相应受体蛋白ace2和axl,因此灵敏度得到了提升。但血液中如果含有ace2蛋白和axl蛋白,会对竞争反应体系产生干扰,导致出现假阳结果。因此,实施例3在磁微粒偶联物工作液中同时加入了ace2抗体和axl抗体,可与样本中的ace2蛋白和axl蛋白进行反应,从而降低其对检测体系的干扰,减少了假阳结果的出现。因此,实施例3在中和抗体检测的灵敏度和特异性方面均有一定的改善效果。实施例3中为避免ace2抗体和axl抗体影响rbd蛋白与其受体ace2蛋白的竞争结合和ntd蛋白与其受体axl蛋白的竞争结合,从而选择先将ace2抗体和axl抗体与样本中的ace2蛋白和axl蛋白反应,之后以清洗的方式将多余的ace2抗体和axl抗体去除,避免其与后续加入的ace2蛋白标记结合物和axl蛋白标记结合物发生竞争性反应。对比实施例3和实施例4、实施例5、对比例4、对比例5五种试剂盒的检测结果:实施例4试剂盒中的rbd蛋白浓度为0.2μg/ml、ntd蛋白浓度为0.2μg/ml,为最低工作浓度,阳性检出率为96.46%,阴性检出率为98.24%;实施例5试剂盒中的rbd蛋白浓度为200μg/ml、ntd蛋白浓度为200μg/ml,为最高工作浓度,阳性检出率为97.47%,阴性检出率为98.24%;此时阳性检出率和阴性检出率均略低于实施例3,但阳性检出率仍在95%以上。对比例4中的rbd蛋白浓度为0.16μg/ml,ntd蛋白浓度为0.16μg/ml,ace2蛋白浓度为8ng/ml,axl蛋白浓度为8ng/ml,ace2抗体蛋白浓度为0.08ng/ml,axl抗体蛋白浓度为0.08ng/ml,均低于最低工作浓度,检测物质量不足,且血清中的ace2抗体、axl抗体仍对检测产生干扰,阳性检出率为93.43%,阴性检出率为96.22%;对比例5试剂盒中的rbd蛋白浓度为240μg/ml,ntd蛋白浓度为240μg/ml,ace2蛋白浓度为1200ng/ml,axl蛋白浓度为1200ng/ml,ace2抗体蛋白浓度为12ng/ml,axl抗体蛋白浓度为12ng/ml,均超过工作浓度区间,存在空间位阻与非特异性结合干扰,且清洗后的ace2抗体、axl抗体仍过高,可与ace2蛋白、axl蛋白结合,对检测产生干扰,阳性检出率为94.95%,阴性检出率为97.48%;相较实施例3,对比例4、对比例5的阳性检出率与阴性检出率明显下降,且阳性检出率低于95%。说明试剂盒中蛋白在工作浓度区间时,有较好的阴阳性检出率,其中阳性检出率能在96%以上,阴性检出率能在98%以上。rbd蛋白浓度为0.2-200μg/ml、ntd蛋白浓度为0.2-200μg/ml、ace2蛋白浓度为10-1000ng/ml、axl蛋白浓度为10-1000ng/ml、ace2抗体蛋白浓度为0.1-10ng/ml、axl抗体蛋白浓度为0.1-10ng/ml为可接受范围,实施例3中,rbd蛋白浓度为20μg/ml、ntd蛋白浓度为4μg/ml、ace2蛋白浓度为100ng/ml、axl蛋白浓度为20ng/ml、ace2抗体蛋白浓度为1ng/ml、axl抗体蛋白浓度为1ng/ml为已知最优条件。对比实施例3和实施例6、实施例7、对比例6、对比例7五种试剂盒的检测结果:实施例6中的rbd蛋白/ntd蛋白质量比为1:1、ace2蛋白/axl蛋白的质量比为1:1,较实施例3的rbd蛋白、ntd蛋白检测量较低,处于质量比范围的最低端点;实施例7试剂盒中的rbd蛋白/ntd蛋白质量比为10:1、ace2蛋白/axl蛋白的质量比为10:1,较实施例3的rbd蛋白、ntd蛋白检测量空间位阻增多,处于质量比范围的最高端点,此时阳性检出率略低于实施例3,但仍在95%以上。对比例6中的rbd蛋白/ntd蛋白质量比为1:2、ace2蛋白/axl蛋白的质量比为1:2,质量比小于质量比范围端点,较实施例6的rbd蛋白量不足,对与rbd蛋白结合的新冠中和性抗体的灵敏度不足阳性检出率为94.95%,阴性检出率为98.99%;对比例7试剂盒中的rbd蛋白/ntd蛋白质量比为11:1、ace2蛋白/axl蛋白的质量比为11:1,质量比小于质量比范围端点,较实施例7的ntd蛋白量不足,对与ntd蛋白结合的新冠中和性抗体的灵敏度不足,阳性检出率为94.45%,阴性检出率为98.74%;较实施例3的阳性检出率明显下降,低于95%。而五种试剂盒的阴性检出率较为接近。说明试剂盒中rbd和/或ntd蛋白的质量比主要影响阳性检出率,在质量比范围内时,阳性检出率能在96%以上。rbd蛋白/ntd蛋白质量比为(1:10):1、ace2蛋白/axl蛋白的质量比为(1:10):1为可接受范围,实施例3中,rbd蛋白浓度为20μg/ml、ntd蛋白浓度为4μg/ml、ace2蛋白浓度为100ng/ml、axl蛋白浓度为20ng/ml、ace2抗体蛋白浓度为1ng/ml、axl抗体蛋白浓度为1ng/ml、rbd蛋白/ntd蛋白质量比为5:1、ace2蛋白/axl蛋白的质量比为5:1为已知最优条件。本实施例中,sars-cov-2中和抗体的检测试剂盒包括组分a和组分b,组分a包括包被于固相载体的rbd蛋白和包被于固相载体的ntd蛋白,以及ace2抗体和/或axl抗体,组分b包括示踪物标记的ace2蛋白和示踪物标记的axl蛋白。sars-cov-2中和抗体的检测试剂盒也可以包括组分a、组分b和组分c,组分a包括包被于固相载体的rbd蛋白和包被于固相载体的ntd蛋白,组分b包括示踪物标记的ace2蛋白和示踪物标记的axl蛋白,组分c包括ace2抗体和/或axl抗体。其中,组分a中包被于固相载体的rbd蛋白和包被于固相载体的ntd蛋白可以在同一溶液体系内,也可以彼此分离。同理,组分b中的示踪物标记的ace2蛋白和示踪物标记的axl蛋白可以是在同一溶液体系内,也可以彼此分离。但为防止ace2抗原与ace2抗体结合,或axl抗原与axl抗体结合,本方案中的ace2抗体和/或axl抗体不与组分b中的示踪物标记的ace2蛋白和示踪物标记的axl蛋白在同一溶液体系内。本实施例为方便医护人员使用,组分a中的包被于固相载体的rbd蛋白和包被于固相载体的ntd蛋白,以及ace2抗体和/或axl抗体在同一溶液体系内,且组分b中的示踪物标记的ace2蛋白和示踪物标记的axl蛋白,仅需一次a组试剂加入,即可将样本与包被于固相载体的rbd蛋白和包被于固相载体的ntd蛋白,以及ace2抗体和axl抗体相互反应。目前可产生新型冠状病毒中和抗体的疫苗多采用完整灭活病毒作为抗原、表达完整s蛋白或rbd蛋白的腺病毒载体作为抗原、表达完整s蛋白或rbd蛋白的mrna作为抗原或同时含有rbd与ntd的重组蛋白作为抗原,无仅使用ntd蛋白作为抗原的疫苗。因此,本实施例中未设计仅有ntd蛋白偶联磁微粒、axl蛋白和axl抗体的对比实验。本实施例中选用的检测原理为化学发光法,但同样适用于酶联免疫吸附试验、胶体金免疫层析、荧光免疫层析法、免疫渗滤法、免疫荧光法、单分子免疫、多重免疫分析等其他可使用上述包含了新型冠状病毒中和抗体的2个作用靶点—rbd蛋白和ntd蛋白,及其相应受体蛋白ace2和axl,和受体蛋白抗体anti-ace2、anti-axl的免疫学检测体系或方法。尽管已用具体实施例来说明和描述了本发明,然而应意识到,在不背离本发明的精神和范围的情况下可以作出许多其它的更改和修改。因此,这意味着在所附权利要求中包括属于本发明范围内的所有这些变化和修改。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1