一种检测沙门氏菌的试纸条及其制备方法
1.本技术属于沙门氏菌检测技术领域,尤其涉及一种检测沙门氏菌的试纸条及其制备方法。
背景技术:
2.食源性病原体已成为重要的食品安全问题。在所有这些食源性病原体中,沙门氏菌是无论是在发展中国家还是发达国家中,都是人和动物宿主中食源性疾病暴发的主要原因。随着生活水平的提高,消费者越来越关注其饮食的食品安全性和营养品质。因此有必要对食物中可能存在的沙门氏菌进行及时有效的检测,以防止食物中毒。
3.食源性沙门氏菌一般由受污染食物进入人体,通过侵染小肠上皮细胞,再利用自身携带的多种毒力因子作用导致人罹患沙门氏菌病。沙门氏菌在胃肠道内会面临一系列对其生长和生存不利的逆境条件,如胃酸、高渗透压、高浓度胆盐、金属离子、营养限制和肠道菌群的竞争作用。然而,沙门氏菌能够通过调节自身基因的表达来应对这些逆境,进一步黏附、定殖和入侵宿主细胞,最终导致人患病。
4.检测食源性沙门氏菌的常用方法包括基于培养的方法,聚合酶链反应(pcr)和酶联免疫吸附测定(elisa)。这些方法有些需要3到5天才能获得结果,有些需要训练有素的技术人员和复杂的dna提取程序,或者缺乏足够的敏感性。此外,基质辅助激光解吸/电离飞行时间质谱(maldi
‑
tof
‑
ms)也用于分析食源性病原体。但是这种方法需要大型设备和高素质的技术人员。因此,开发快速,灵敏,操作简单和现场检测食源性病原体的方法至关重要。
技术实现要素:
5.基于此,本技术提供了一种检测沙门氏菌的试纸条及其制备方法,为一种快速、灵敏,操作简单的现场检测食源性沙门氏菌的产品。
6.本技术第一方面提供了一种检测沙门氏菌的试纸条的制备方法,包括:
7.底板、样品垫、胶体金垫、硝酸纤维素膜和吸水垫;
8.顺着待测样品的层析方向,所述样品垫、所述胶体金垫、所述硝酸纤维素膜和所述吸水垫依次部分重叠相互连接,所述样品垫、所述胶体金垫、所述硝酸纤维素膜和所述吸水垫设置在所述底板的表面;
9.所述胶体金垫喷涂有胶体金标记的沙门氏菌多克隆抗体;
10.所述硝酸纤维素膜上设有包被了灭活的沙门氏菌抗原的检测线,以及包被了鼠抗兔二抗或羊抗兔二抗的质控线;所述检测线靠近所述胶体金垫,所述质控线靠近吸水垫。
11.另一实施例中,所述沙门氏菌多克隆抗体的制备方法包括:将灭活的沙门氏菌与弗氏完全佐剂混合制成疫苗,将所述疫苗间隔免疫实验兔,采集所述实验兔的血清并从所述血清中提取和纯化沙门氏菌多克隆抗体,制得所述沙门氏菌多克隆抗体。
12.另一实施例中,所述胶体金标记的沙门氏菌多克隆抗体的制备方法包括:将胶体金、所述沙门氏菌多克隆抗体、复溶液和碳酸钾混合反应,然后加入bsa封闭液,最后离心去
除上清,得到的沉淀与所述复溶液混合,制得胶体金标记的沙门氏菌多克隆抗体;
13.其中,每1ml胶体金加入10~40μl2mg/ml所述沙门氏菌多克隆抗体、20μl所述复溶液以及2μl 0.2m所述碳酸钾;
14.所述复溶液包括蔗糖、海藻糖、peg2000、牛血清白蛋白、吐温
‑
20和pbs;所述蔗糖的终浓度为5%,所述海藻糖的终浓度为2%,所述peg2000的终浓度为1%,所述牛血清白蛋白的终浓度为1%,所述吐温
‑
20的终浓度为0.25%,所述pbs的终浓度为0.01mol/ml。
15.具体的,利用碳酸钾调节胶体金标记的沙门氏菌多克隆抗体的ph值。
16.具体的,所述胶体金垫的制备方法包括:
17.a、利用柠檬酸三钠还原氯金酸制备胶体金;
18.b、将步骤a制备的胶体金置于磁力搅拌器按每1ml胶体金加入10~40μl的2mg/ml的沙门氏菌兔源多克隆抗体、20μl复溶液以及2μl碳酸钾;
19.c、将步骤b混合物连续室温搅拌1小时后加入100μl 10%的bsa封闭液,继续室温搅拌1小时,10000rpm,4℃离心15分钟,去上清,得到沉淀再加20μl复溶液4℃保存;
20.d、将步骤c的产物利用喷金仪喷涂于胶体金标垫上;
21.其中,所述复溶液其终浓度为含有5%蔗糖、2%海藻糖、1%peg2000、1%牛血清白蛋白、0.25%吐温
‑
20的0.01mol/mlpbs。
22.另一实施例中,所述胶体金的制备方法包括:将质量百分比为0.01%的氯金酸溶液加热至沸腾,然后加入质量百分比为1%的柠檬酸三钠反应,制得胶体金。
23.另一实施例中,所述胶体金标记的沙门氏菌多克隆抗体的喷涂量为8μl/cm。
24.另一实施例中,所述检测线的制备方法包括:将108cfu/ml的灭活的沙门氏菌喷涂于所述硝酸纤维素膜上形成所述检测线;所述灭活的沙门氏菌的喷涂量为1μl/cm。
25.另一实施例中,所述质控线的制备方法包括:将终浓度为1mg/ml的鼠抗兔二抗,或将终浓度为1mg/ml的羊抗兔二抗喷涂于所述硝酸纤维素膜上形成所述质控线;所述鼠抗兔二抗或所述羊抗兔二抗的喷涂量为1μl/cm。
26.具体的,终浓度为1mg/ml的鼠抗兔二抗,或将终浓度为1mg/ml的羊抗兔二抗的制备方法包括:利用0.01mol/mlpbs溶解羊抗兔二抗使其终浓度为1mg/ml,或利用0.01mol/mlpbs溶解鼠抗兔二抗使其终浓度为1mg/ml。
27.具体的,所述硝酸纤维素膜的制备方法,包括:
28.a)将108cfu/ml灭活的沙门氏菌抗原划线于硝酸纤维素膜上;
29.b)在硝酸纤维素膜上步骤a)所划线平行距离5mm处用鼠抗兔二抗或羊抗兔二抗划线于此;
30.c)将划线完成的硝酸纤维素膜置于烘箱37℃干燥备用。
31.具体的,所述灭活的沙门氏菌的制作步骤如下:
32.a))将沙门氏菌甘油冻存的菌种解冻并接种于200ml的lb液体培养基中;
33.b))将步骤a))所述lb液体培养基于摇床220rpm,37℃培养15小时;
34.c))将步骤b))所述培养15小时后的菌液8000rpm,4℃离心10分钟,去上清,用0.01mol/mlpbs清洗沉淀,重复以上操作三次;
35.d))将步骤c))所述最后产物重悬于0.01mol/mlpbs,加入1%的甲醛溶液,在摇床220rpm,37℃培养过夜。第二天将终产物取部分涂于营养琼脂平板,若无菌落产生说明灭活
完成;同步骤c))将菌液清洗三次。
36.e))利用紫外分光光度计将灭活菌液在600nm处的吸光度稀释至1,即此时菌落数为108/ml,得到灭活的沙门氏菌。
37.另一实施例中,所述灭活的沙门氏菌的制备方法包括:将沙门氏菌菌种复苏并接种于液体培养基中进行扩增培养,将扩增后的所述沙门氏菌采用pbs离心洗涤,去除所述液体培养基,得到沙门氏菌沉淀;最后将所述沙门氏菌沉淀用pbs重悬并添加1%的甲醛溶液灭活培养,采用pbs将所述沙门氏菌菌液离心清洗,去除所述甲醛溶液,得到的沙门氏菌菌液涂布在营养琼脂平板,无菌落长出得到灭活的沙门氏菌。
38.另一实施例中,所述检测线与所述质控线相互平行,两者相距3~6mm。
39.本技术第二方面提供了所述检测沙门氏菌的试纸条的制备方法,包括:
40.步骤1、将胶体金标记的沙门氏菌多克隆抗体喷涂在胶体金垫上;
41.将灭活的沙门氏菌喷涂于硝酸纤维素膜上形成检测线,将鼠抗兔二抗或羊抗兔二抗喷涂于所述硝酸纤维素膜上形成质控线;所述检测线靠近所述胶体金垫,所述质控线靠近吸水垫;
42.步骤2、以待测样品的层析方向,将样品垫、所述胶体金垫、所述硝酸纤维素膜和所述吸水垫依次重叠预置面积相互连接,所述样品垫、所述胶体金垫、所述硝酸纤维素膜和所述吸水垫固定在所述底板的表面。
43.本技术的目的针对现有技术中检测食源性沙门氏菌方法存在的费时费力的问题。本技术提供了一种检测沙门氏菌的试纸条,为一种竞争法检测大分子沙门氏菌的方法,胶体金垫喷涂有胶体金标记的沙门氏菌多克隆抗体;硝酸纤维素膜上设有包被了灭活的沙门氏菌抗原的检测线,以及包被了鼠抗兔二抗或羊抗兔二抗的质控线。只需要一种沙门氏菌多克隆抗体即可快速,高灵敏地检测沙门氏菌。本技术的试纸条原理为:检测线包被的灭活沙门氏菌抗原(t线包被抗原)和待测样品中的抗原竞争结合胶体金标记的沙门氏菌多克隆抗体(金标抗体),若待测样品中无沙门氏菌存在,金标抗体在泳动过程中先和t线包被抗原结合,形成肉眼可见红线,多余金标抗体继续泳动和质控线(c线)包被的鼠抗兔二抗或羊抗兔二抗结合,也形成一条肉眼可见红线,此结果为阴性;若待测样品中有沙门氏菌存在,则样品待测样品中的沙门氏菌、t线包被抗原和金标抗体竞争结合,t线包被抗原被抑制,待测样品中的沙门氏菌和金标抗体结合后继续泳动,直到和c线的二抗再次结合,此时,t线不显色,而c线显红色,结果为阳性;若结果中c线不显色,则试纸条失效。
44.根据试验结果可知,通过本技术提供的试纸条可对样品中的沙门氏菌进行有效定性以及定量。通过对不同细菌(蜡样芽孢杆菌、创伤弧菌、大肠杆菌、幽门螺旋杆菌、变异链球菌、单增李斯特菌、金黄色葡萄球菌)分别进行检测,结果表明本技术提供的试纸条具有较高的特异性。同时本技术所提供的试纸条还具有检测操作简单、灵敏度高、检测速度快的优点。
附图说明
45.为了更清楚地说明本技术实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
46.图1为本技术实施例提供的检测沙门氏菌的试纸条的结构示意图;
47.图2为本技术实施例提供的检测沙门氏菌的试纸条的测试实物图;
48.图3为本技术实施例提供的检测沙门氏菌的试纸条检测不同浓度沙门氏菌的侧视图。
具体实施方式
49.本技术提供了一种检测沙门氏菌的试纸条及其制备方法,用于解决现有技术检测食源性沙门氏菌的方法中存在的费时费力的技术缺陷。
50.下面将对本技术实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本技术一部分实施例,而不是全部的实施例。基于本技术中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本技术保护的范围。
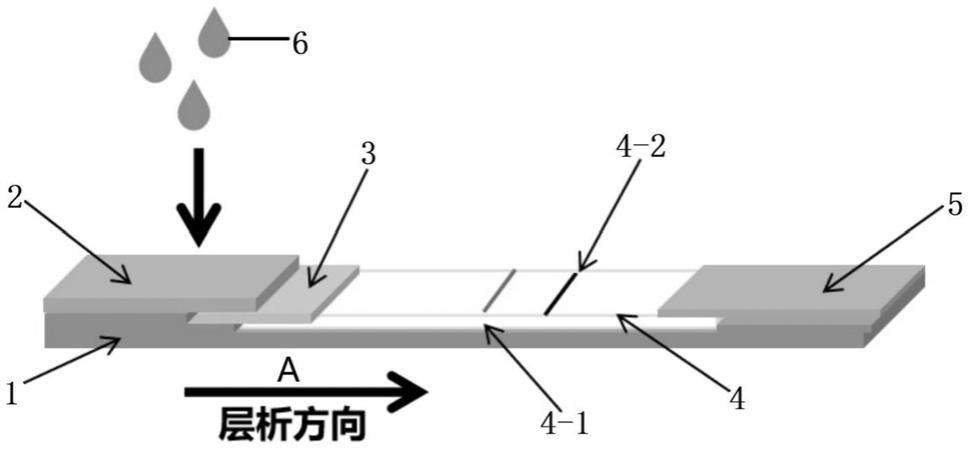
51.其中,以下实施例所用原料或试剂均为市售或自制。
52.实施例1
53.本技术实施例提供了一种检测沙门氏菌的试纸条,具体制备方法包括:
54.1、制备胶体金:
55.在圆底烧瓶中加入100ml 0.01%的氯金酸加热至沸腾。均匀搅拌下迅速加入2ml 1%的柠檬酸三钠。待溶液由灰黑变为橙红色,继续搅拌13分钟直至红色不变,冷却,4℃储存于暗瓶中。
56.2、胶体金偶联兔源沙门氏菌多克隆抗体,按照如下步骤制得:
57.2.1、制备沙门氏菌兔源多克隆抗体:
58.将沙门氏菌菌种由专用培养基活化并扩大培养。培养后呈现特征性菌落,将沙门氏菌菌株扩大培养,所得菌液用0.3%甲醛灭活24h并将其浓度调至109cfu/ml。灭活的菌液经平板培养不长菌后将所制备的沙门氏菌作为沙门氏菌全菌抗原,将其分装4℃储存备用。所制备全菌抗原与弗氏完全佐剂混合制作成疫苗免疫新西兰白兔,背部皮下注射,1ml/只。第一次免疫后间隔18d用所制备抗原与弗氏不完全佐剂混合制备的疫苗完成第二次免疫。之后每隔两周用相同方法免疫一次。每次免疫后7d通过兔耳静脉采血检测抗体生成情况。经测试合格的实验兔,耳静脉大量采血,分离血清,4℃保存。利用辛酸硫酸铵法将所得血清中的抗体纯化,通过sds聚丙烯酰胺凝胶电泳验证纯化结果。将纯化成功的沙门氏菌兔源多克隆抗体分装4℃保存。
59.2.2、最适ph值为:每1ml胶体金添加2ml碳酸钾;最适沙门氏菌兔源多克隆抗体添加量为:每1ml胶体金添加10μl 2mg/ml的沙门氏菌兔源多克隆抗体。在磁力搅拌器上按每1毫升胶体金加入10μl2mg/ml的沙门氏菌兔源多克隆抗体、20ml复溶液以及2ml 0.2m碳酸钾。室温连续搅拌1小时后加入100μl 10%的bsa封闭液,继续室温搅拌1小时,10000rpm,4℃离心15分钟,去上清,得到沉淀再加20ml复溶液4℃保存。
60.其中,上述的复溶液包括蔗糖、海藻糖、peg2000、牛血清白蛋白、吐温
‑
20和pbs;蔗糖终浓度为5%、海藻糖终浓度为2%、peg2000终浓度为1%、牛血清白蛋白终浓度为1%、吐温
‑
20终浓度为0.25%和pbs终浓度为0.01mol/ml。
61.3、制备检测线所用灭活的沙门氏菌菌液:
62.将沙门氏菌甘油冻存的菌种解冻并接种于200ml的lb液体培养基中;上述lb液体
培养基于摇床220rpm,37℃培养15小时;将上述培养15小时后的菌液8000rpm,4℃离心10分钟,去上清,用0.01mol/mlpbs清洗沉淀,重复以上操作三次,清洗去多余液体培养基;最后产物重悬于0.01mol/ml pbs,加入1%的甲醛溶液,在摇床220rpm,37℃培养过夜。第二天将终产物取部分涂于营养琼脂平板,若无菌落产生说明灭活完成;将菌液清洗三次,洗去多余甲醛,制得灭活的沙门氏菌。利用紫外分光光度计将灭活的沙门氏菌菌液在600nm处的吸光度稀释至1,即此时菌落数为108cfu/ml的灭活的沙门氏菌菌液。
63.制备质控线所用羊抗兔二抗:用0.01mol/mlpbs溶解羊抗兔二抗使其终浓度为1mg/ml。
64.4、利用喷金仪分别将上述灭活的沙门氏菌菌液与羊抗兔二抗划线于硝酸纤维素膜(nc膜)上,两线平行且距离为5毫米。喷涂量为每厘米1微升。检测线靠近胶体金垫,质控线靠近吸水垫。
65.灭活的沙门氏菌菌液与羊抗兔二抗划线完成后将nc膜置于烘箱,37℃干燥过夜。
66.利用喷金仪将上述胶体金偶联兔源沙门氏菌多克隆抗体喷涂于金标垫上,喷涂量为每厘米8微升。
67.请参阅图1,图1为本技术实施例提供的检测沙门氏菌的试纸条的结构示意图。底板1、样品垫2、胶体金垫3、硝酸纤维素膜4和吸水垫5;以待测样品6的层析方向a,样品垫2、胶体金垫3、硝酸纤维素膜4和吸水垫5依次部分重叠相互连接,样品垫2、胶体金垫3、硝酸纤维素膜4和吸水垫5固定设置在底板1的表面;胶体金垫3喷涂有胶体金标记的沙门氏菌多克隆抗体;硝酸纤维素膜4上设有包被了灭活的沙门氏菌抗原的检测线4
‑
1,以及包被了鼠抗兔二抗或羊抗兔二抗的质控线4
‑
2;检测线4
‑
1靠近胶体金垫3,质控线4
‑
2靠近吸水垫5。
68.本技术实施例的样品垫2为现有常规可制备试纸条的样品垫。上述底板、样品垫、胶体金垫、硝酸纤维素膜和吸水垫的尺寸为现有常规的试纸条的尺寸。
69.根据图1的待测样品6的层析方向a,将上述制得的样品垫2、胶体金垫3、硝酸纤维素膜4和吸水垫5依次重叠预置面积相互连接,样品垫2、胶体金垫3、硝酸纤维素膜4和吸水垫5固定在底板1的表面,组装形成检测沙门氏菌的试纸条。
70.实施例2
71.本技术实施例提供了采用实施例1的检测沙门氏菌的试纸条进行菌液检测试验,具体方法包括:
72.取70μl不含细菌的去离子水和浓度为108cfu/ml的实施例1的沙门氏菌菌液分别滴加于试纸条的样品垫上,10分钟后观察结果。结果如图2所示,图2为本技术实施例提供的检测沙门氏菌的试纸条的测试实物图。
73.图2可知,图2a为108cfu/ml的实施例1的沙门氏菌菌液滴加在试纸条的检测区后的试验结果,图2b为不含细菌的去离子水滴加在试纸条的检测区后的试验结果,a图仅在质控线显示条带则说明实施例1样品中含沙门氏菌,b图的检测线及质控线各出现一条红色条带,说明去离子水样品中不含有沙门氏菌,判断为阴性。可见,本技术实施例的试纸条可用于沙门氏菌的检测。
74.参照上述方法,将本技术实施例1的试纸条分别检测不同细菌(蜡样芽孢杆菌、创伤弧菌、大肠杆菌、幽门螺旋杆菌、变异链球菌、单增李斯特菌和金黄色葡萄球菌),结果均为阴性,结果表明本技术提供的检测沙门氏菌的试纸条具有较高的特异性。
75.实施例3
76.本技术实施例提供了采用实施例1的检测沙门氏菌的试纸条进行不同浓度菌液检测试验,具体方法包括:
77.将108cfu/ml的沙门氏菌菌液用0.01mol/ml的pbs分别稀释至107、106、105、104、103、102、101cfu/ml。
78.将上述菌液及去离子水分别取70μl滴加于试纸条样品垫上,10分钟后观察结果,结果如图3所示。
79.参见图3,结果表明随着沙门氏菌浓度增加检测线t线颜色逐渐变淡,在菌悬液达到106cfu/ml时肉眼无法观察到显色。可见,本技术实施例的试纸条可检测106cfu/ml以上的沙门氏菌。
80.以上所述仅是本技术的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本技术原理的前提下,还可以作出若干改进和润饰,这些改进和润饰也应视为本技术的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1