一种造血细胞的线粒体功能的检测方法
1.本发明涉及生物技术领域,具体涉及一种造血细胞的线粒体功能的检测和评价方法。
背景技术:
2.造血细胞谱系分化是造血系统的发生和形成过程中的不可或缺的步骤,由此产生的造血细胞参与生命体的营养转运、免疫、止血和伤口愈合等生命活动。研究人员通过移植和菌落分析证明了造血干细胞(hematopoietic stem cell,hscs)是所有血细胞和免疫细胞的起源。哺乳动物的造血系统从多潜能的造血干细胞开始,首先分化成为多能祖细胞(pluripotent progenitor cells,mpps),mpps不具备自我更新能力。mpps会很快分化成为造血祖细胞(hemopoietic progenitor cells,hpcs),这些hpcs具有较强的多向分化能力。随后,分化过程的第一个分叉发生在共同髓系祖细胞(common myeloid progenitor cells,cmps)和共同淋巴系祖细胞(common lymphatic progenitor cells,clps),其中cmps具有髓系、红系和巨核细胞分化潜能,clps仅具有淋巴细胞分化潜能。分化过程的第二个分支点在cmps分离粒系
‑
巨噬系祖细胞(granulocyte macrophage progenitor cells,gmps)和巨核系
‑
红系祖细胞(megakaryocyte
‑
erythroid progenitor cells,meps),而clps直接进一步分化成为较为成熟的b细胞、t细胞和nk细胞。而gmps会再分化为成熟的粒细胞和单核细胞,meps产生巨核细胞和红细胞。
3.线粒体是细胞内的最重要的细胞器之一,它参与产生atp、维持钙的平衡、调控活性氧的产生,以及参与信号传递、炎症和细胞死亡等。线粒体功能的改变,如氧化磷酸化损伤、能量代谢异常、抑制凋亡、自噬障碍、促进免疫逃避和信号通路改变等,可能影响疾病的发生。人类疾病如血液疾病、神经肌肉性疾病、心血管疾病、糖尿病、肿瘤等的发生与发展都与线粒体活动密切相关。造血细胞谱系分化不同阶段的细胞在线粒体功能方面存在差异,线粒体质量(mitochondrial mass,mm)、线粒体膜电位(mitochondrial membrane potential,mmp)、线粒体活性氧(reactive oxygen species,ros)和线粒体自噬水平等可以作为主要指标来反映线粒体在参与细胞活动、应激及衰老等一系列生理病理过程中发挥的作用。
4.研究者普遍认为在造血干细胞分化和谱系发育过程中mm是增加的。对于hsc而言,通过tsc1介导的mtor通路来抑制线粒体生物发生和ros水平,从而维持hsc的静息状态和功能,这一过程伴随着mm的降低和ros的降低。在小鼠模型中,lsk(lin
‑
sca1
+
c
‑
kit
+
)细胞中mm增加会形成长期再生能力。研究发现,小鼠hsc中的mm与偏髓系分化祖细胞相似,但低于红系祖细胞。与此同时,研究人员发现相对于健康细胞,肿瘤细胞表现出高的mmp,并且mmp较高的细胞更容易继续分裂和形成肿瘤,而较低的mmp细胞通过将胚胎干细胞亚群移植到小鼠,更有效地分化为其他细胞类型。ros对dna、脂质和蛋白质等有损害作用,指出线粒体呼吸链功能障碍和低效的氧化磷酸化(oxidative phosphorylation,oxphos)可能导致更多的电子泄漏和ros生成的进一步增加,导致有害循环,最终对细胞造成不可逆转的损害。研
究发现ros似乎在干细胞生物学中发挥积极和必要的信号作用,少量ros的产生是细胞活化的重要信号分子,它们在各种各样的细胞过程中充当信号信使。同时,通过解除电子传递链(electron transport chain,etc)的耦合来降低线粒体活性可刺激自噬并驱动hsc的自我更新,保持其适当分化和功能血液重建的能力。此外,自噬在老年小鼠中维持hsc功能,并很可能在ipsc重新编程期间参与代谢开关。
5.目前应用较多的造血细胞的线粒体功能检测方法主要包括线粒体质量检测、线粒体膜电位检测、线粒体活性氧检测和线粒体自噬检测等。其中线粒体质量的检测可以采用荧光探针mitotracker green fm结合流式细胞术的方法。mitotracker green fm包含标记线粒体的弱巯基反应性的氯甲基官能团,其在水溶液中几乎不发荧光,只有当聚集在线粒体的脂质环境才能发荧光,背景荧光几乎可忽略。mitotracker green fm定位于线粒体的能力不受线粒体膜电位影响,使其可能作为定量线粒体质量的一种工具。线粒体膜电位的检测主要釆用的是罗丹明123(rhod123)、四甲基罗丹明甲酯(tetramethylrhodamine methyl ester,tmrm)、四甲基罗丹明乙酯(tetramethylrhodamine ethyl ester,tmre)、四氯四乙基苯并咪唑羰花菁碘化物(jc
‑
1)和mitotracker red cmxros等荧光染料探针方法与流式细胞术相结合的方法。线粒体活性氧的水平可采用荧光探针dchf
‑
da染料测定;dchf
‑
da本身没有荧光,可以自由穿过细胞膜,进入细胞后,细胞内的酯酶水解生成dchf,而dchf不能出入细胞膜从而使探针很容易被标记到细胞内。在活性氧的存在下,dchf被氧化生成荧光物质dcf,其荧光强度与细胞内活性氧水平成正比,检测dcf的荧光就可以知道活性氧的水平。用荧光探针mitosox可以检测线粒体活性氧,这种检测方法检测具有简便、灵敏、背景低、线性范围宽、用时短和检测效率高的优势。线粒体自噬可以通过荧光染料mitophagy dye结合流式细胞术进行检测,mtphagy dye通过化学键结合在细胞内的线粒体上,保持较弱的荧光。通过诱导线粒体自噬,线粒体自噬体会与溶酶体融合,mtphagy dye的荧光强度会增大。
6.流式细胞仪主要应用于细胞表型、细胞周期、细胞凋亡和细胞增殖等检测分析,在血液学和干细胞研究中的应用十分广泛。但是,在目前的有关造血细胞的线粒体功能研究方面的应用具有局限性,主要集中在单一类型或少数几种类型的造血细胞中的线粒体功能上,缺乏完整地对不同类型的正常和病理造血细胞在同一实验条件、同一系统标准内进行的线粒体代谢功能的检测和同时比较。在应用流式细胞术检测线粒体功能时,未能形成包括抗体搭配、仪器设置、检测时间选择、光电倍增管电压设定和荧光补偿调节在内的完整的实验方案。由于缺乏对系统的不同分化阶段的造血细胞的线粒体功能的同时比较研究,未能形成基于流式细胞术对造血干细胞、造血祖细胞和成熟血细胞的线粒体功能的同时检测和同时评价方法,制约着对模式生物造血系统发育和造血细胞分化的研究进步。
技术实现要素:
7.本发明的目的在于克服现有技术在应用方面的不足,建立基于流式细胞术的造血细胞的线粒体功能的评价方法,形成包括抗体搭配、仪器设置、检测时间选择、光电倍增管电压设定和荧光补偿调节在内的完整的实验方案。
8.本发明采用的技术方案为:
9.本发明提供了一种造血细胞的线粒体功能的检测方法,该方法包括:对包括造血
干细胞、造血祖细胞和成熟血细胞在内的正常造血细胞和/或病理造血细胞的线粒体质量、线粒体膜电位、线粒体活性氧和线粒体自噬水平进行同时检测和同时评价。
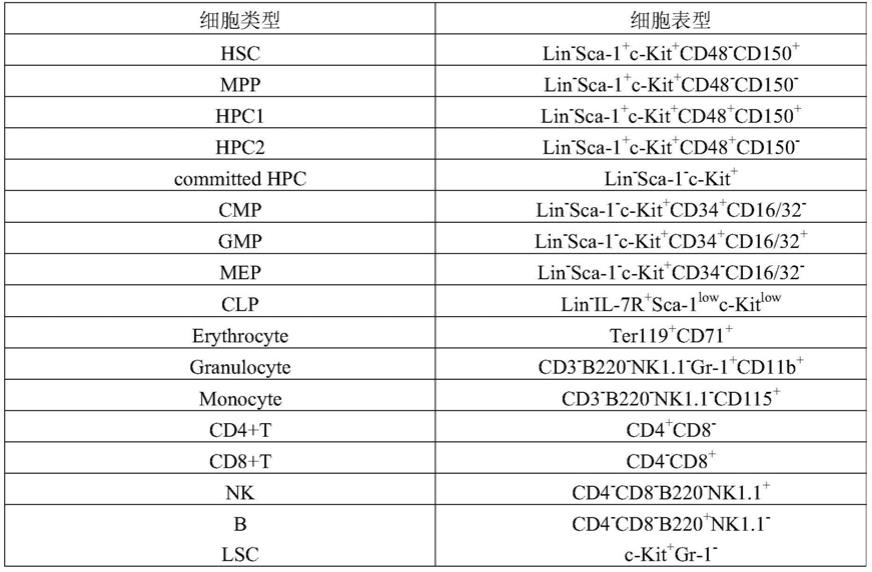
10.所述的正常造血细胞包括:hsc、mpp、hpc、cmp、gmp、mep、clp、单核细胞、粒细胞、红细胞、b细胞、t细胞和nk细胞的一种或两种以上的组合物。(其中hsc、mpp和hpc合称为hspc,cmp、gmp和mep合称为committed hpc,b细胞、t细胞和nk细胞合称为淋巴细胞。)
11.所述的病理造血细胞包括:白血病干细胞(lsc)和白血病细胞(non
‑
lsc),与病理细胞形成对照的是正常原始造血细胞(lsk)和正常成熟造血细胞(non
‑
lsk)。
12.所述同时检测包括:采用同一台流式细胞仪,同一时间点检测、荧光染料孵育时间相同,即线粒体质量mitotracker green、线粒体膜电位mitotracker red、线粒体活性氧mitosox red和线粒体自噬mitophagydye分别37℃下避光孵育20
‑
30min;线粒体功能检测荧光染料的光电倍增管电压在各个流式模板中分别保持一致。
13.所述的同时评价包括:使用flowjo
tm v10.6.1(bd biosciences,美国)软件获取流式数据并按多参数荧光补偿调节原则扣除各个荧光通道间彼此的光谱重叠干扰。
14.本发明所具有的有益效果:
15.本发明方法比较了正常造血细胞与病理造血细胞的线粒体功能,通过对线粒体质量、线粒体膜电位、线粒体活性氧和线粒体自噬实验方案的优化,形成对造血干细胞、造血祖细胞和成熟血细胞在内的正常造血细胞以及病理造血细胞的线粒体功能的同时检测和同时评价,为系统地研究线粒体代谢功能提供了一套完整的方法和基础参考值。
16.本发明方法还可以同时结合单细胞测序技术,对造血干祖细胞线粒体自噬通路异质性进行了初步分析,为今后研究线粒体功能在血液疾病、心血管疾病、肿瘤和衰老中的作用奠定了基础。
附图说明:
17.图1为造血细胞分化等级图;
18.图2为造血细胞的线粒体功能研究流程图;
19.图3为不同分化阶段造血细胞超微结构特征a.hsc,hpc and lineage committed hpcs b.mature myeloidcells c.mature lymphoid cells。
20.图4为小鼠造血细胞tsne、flowsom分群聚类结果图;其中a.hspc tsne分析b.hspc flowsom热图c.hspc flowsom聚类分析d.committed hpc tsne分析e.committed hpc flowsom热图f.committed hpc flowsom聚类分析g.粒细胞和单核细胞tsne分析h.粒细胞和单核细胞flowsom热图i.粒细胞和单核细胞flowsom聚类分析j.红细胞tsne分析k.红细胞flowsom热图l.红细胞flowsom聚类分析m.淋巴细胞tsne分析n.淋巴细胞flowsom热图o.淋巴细胞flowsom聚类分析。
21.图5为不同分化阶段造血细胞的mm和mmp水平图;其中a造血细胞的mm特征a.髓系造血细胞b.淋系造血细胞c.造血祖细胞d.成熟造血细胞b造血细胞群体的ssc数值a.髓系造血细胞b.淋系造血细胞c.造血祖细胞d.成熟造血细胞c造血细胞的mmp水平a.髓系造血细胞b.淋系造血细胞c.造血祖细胞d.成熟造血细胞。
22.图6为不同分化阶段造血细胞的ros和mitophagy水平图,其中a造血细胞的ros水平a.髓系造血细胞b.淋系造血细胞c.成熟造血细胞b造血细胞的mitophagy特征a.髓系造
血细胞b.淋系造血细胞c.造血祖细胞d.成熟造血细胞。
23.图7为小鼠骨髓造血干祖细胞单细胞测序分析图;a.hsc tsne分群结果b.hsc自噬相关基因表达情况c.hsc自噬相关基因表达热图d.committed hpc tsne分群结果e.committed hpc自噬相关基因表达情况f.committed hpc自噬相关基因表达热图。
24.图8为同一分化阶段造血细胞异质性;其中a造血细胞超微结构观察a.hpc b.mep c.gmp d.erythyocyte e.cd4+t f.b细胞b造血细胞群体的rsd a.髓系造血细胞b.淋系造血细胞c.造血祖细胞d.成熟造血细胞。
25.图9为病理细胞与正常造血细胞的线粒体功能水平图,其中a.ros b.mmp c.mitophagy。
26.图10为16种小鼠造血细胞流式分选示意图a.造血干细胞(hsc),造血祖细胞(hpc1 and hpc2)和多能祖细胞(mpp);b.定向造血祖细胞(cmp,gmp和mep);c.红细胞(erya和eryb);d.粒细胞;e.单核细胞;f.淋系祖细胞(clp);g.b细胞,cd4+t细胞,cd8+t细胞和nk细胞。
具体实施方式
27.线粒体是细胞进行生物氧化和能力转化的主要场所,机体通过呼吸系统和循环系统摄入氧并转运至细胞,最终在线粒体内通过脂肪酸、三羧酸循环、酮发生和氧化磷酸化等生成atp,以供给机体生命活动所需要的能量,机体耗能的九成以上来自于线粒体氧化磷酸化作用,因此线粒体被誉为细胞的“动力工厂”。此外,线粒体还是细胞内信号的平台、天生免疫的调节器和干细胞活动的调节器。线粒体通过产生atp、维持钙的平衡、调控活性氧的产生,参与信号传递、炎症和细胞死亡等,具有参与能量代谢、信号传导和细胞衰老等重要作用。线粒体还可以通过调节不同类型免疫细胞的代谢和生理状态来协调免疫,在免疫细胞中线粒体也可以调节细胞的发育、激活、增殖、分化和死亡。
28.在血液系统疾病的基础和临床研究中,促进白血病细胞的凋亡是白血病治疗的主要措施之一,细胞凋亡“线粒体通路”开辟了以线粒体为靶点治疗白血病的领域。腺嘌呤脱氧核苷酸类似物等可以改变线粒体膜的通透性,线粒体内凋亡相关活性物质释放,启动凋亡的caspase级联反应。肿瘤细胞本身的氧化损伤增加,易于产生活性氧诱导的凋亡,阻断线粒体的电子呼吸链、促进活性氧的产生可以成为抗肿瘤药治疗白血病的新策略。因此,正常和病理造血细胞的线粒体活性氧和线粒体自噬等线粒体功能的同时检测和同时评价方法的建立对白血病的发病机制和临床治疗研究具有重要意义。骨髓增生异常综合征(mds)是一种克隆性、异质性血液系统疾病,其主要临床特点是难治性贫血和在疾病晚期易向白血病转化。有关mds患者中线粒体的异常是目前研究mds发病机制的热点。研究表明,线粒体途径介导的细胞凋亡在mds的凋亡发生中发挥重要作用,相关研究依赖于对包括线粒体质量、线粒体膜电位在内的造血细胞的线粒体功能的同时检测和同时评价。
29.本发明为探讨白血病细胞的线粒体氧化呼吸及代谢、基于线粒体动力学的急性髓细胞白血病的白血病细胞凋亡机制、线粒体去极化诱导的淋巴瘤细胞凋亡和线粒体自噬在骨髓增生异常综合征贫血发病机制等造血系统恶性疾病相关研究奠定了基础。
30.下面结合具体实施例对本发明作进一步说明,但不限定本发明的保护范围。
31.材料和方法
32.实验动物
33.从雌性c57bl/6j(b6)同类系小鼠骨髓中获取不同类型造血细胞(图1),从mll
‑
af9 aml小鼠模型的骨髓中获取mll
‑
af9 gfp
+
白血病细胞,图2显示了造血细胞线粒体研究的流程图。
34.小鼠骨髓细胞的分离获取
35.b6
‑
ly5.1或mll
‑
af9 aml小鼠脱颈处死,在医用酒精中浸泡消毒5min,从两条腿上解剖出胫骨和股骨,将它们放入装有预冷pbs(phosphate buffer saline)溶液的6mm或10mm培养皿中。
36.使用锋利的手术剪刀,从骨骼中移除肌肉。对于每根骨头,使用5毫升注射器和25号针头吸取3ml冰冷的pbe(phosphate buffer electrolyte)。
37.将针头插入骨头的一端,然后将骨髓从小孔中取出,放入5ml管中。
38.彻底混合细胞悬浮液,将细胞通过30
‑
70μm尼龙筛网过滤器后放入新的5ml管中,以去除细胞团块。
39.用血细胞计数器或自动计数器计算有核细胞的数量。将细胞悬浮在冰上备用。
40.lineage阴性细胞的富集纯化
41.全骨髓细胞离心弃上清液,加入80微升lineage磁珠,冰上避光孵育15min,使用4ml pbs清洗一次,4摄氏度,1500rpm/min离心弃上清,12ml pbs重悬细胞。
42.分别使用3ml pbs润洗4个ls分选柱,将细胞悬液均分4份并分别加入到4个ls分选柱,收集到的即为lineage阴性富集细胞悬液。
43.流式分选染色及上机
44.每50μl染色系统包含约1
×
107个细胞,向细胞中分别加入hspc、committed hpc、clp单核细胞、粒细胞、红细胞和淋巴细胞抗体组合(表s2),并在冰上孵育细胞60
‑
90分钟。孵育后,加入3ml pbs 1500rpm/min离心5min,弃上清,同方法洗涤细胞两次。加入500μlpbs重悬后,经30
‑
70μm的尼龙网过滤制成待测样本。流式上机前加入终浓度1μg/ml的dapi来排除死细胞。
45.电镜检测
46.淋巴细胞分离液分离有核细胞,部分细胞用2.5%的戊二醛固定,进行常规超微结构观察。然后对样本进行锇酸固定、脱水、浸透、包埋处理。切片厚度为600nm,常规标本切片用铀染液染10min,铅染液染5
‑
6min,电镜组化不进行染色。使用日立h
‑
600(日本)透射电镜观察处理后的样本,根据细胞结构分析细胞类型和成熟阶段。
47.线粒体质量检测
48.6只c57小鼠的骨髓细胞被分为a、b、c 3组,a组过lineage阴选磁柱,用于检测hspc/clp、committed hpc细胞mm;b组加入红细胞裂解液裂解2min,用于检测粒/单核、淋巴细胞mm;c组不处理,用于检测红细胞mm。
49.a组细胞需设置12管,分别为阴性管、mitotracker green单阳管、fmo对照管2管(hspc/clp、committed hpc各一个对照管)和全阳样本管8管(hspc/clp、committed hpc各四个副孔)。b组细胞需设置12管,分别为阴性管、mitotracker green单阳管、fmo对照管2管(粒/单核细胞、淋巴细胞各一个对照管)和全阳样本管8管(粒/单核细胞、淋巴细胞各四个副孔);c组细胞需设置7管,分别为阴性管、mitotracker green单阳管、fmo对照管和全阳样
本管4管。
50.各组细胞计数、分装并且调整每管样本细胞浓度均为5x106细胞/毫升。
51.分别将hspc/clp、committed hpc、粒/单核细胞、红细胞和淋巴细胞抗体组合(表s2)加入对应的细胞管,4度孵育30min,加入3ml pbs,1500rpm/min离心5min,弃上清。
52.将500μl浓度为100nm的mitotracker green工作液分别加入mitotracker green单阳管和全阳样本管,37℃下避光孵育20min后,加入3ml pbs 1500rpm/min离心5min,弃上清,同方法洗涤细胞两次。
53.加入500μlpbs重悬后,经30
‑
70μm的尼龙网过滤制成待测样本,上机前每管加入3μl 7
‑
aad染色液,一个小时内完成检测。所有流式模板中mitotracker green使用fitc荧光检测通道,光电倍增管电压保持一致为300v。
54.线粒体膜电位检测
55.6只c57小鼠的骨髓细胞被分为a、b、c 3组,a组过lineage阴选磁柱,用于检测hspc/clp、committed hpc细胞mmp;b组加入红细胞裂解液裂解2min,用于检测粒/单核、淋巴细胞mmp;c组不处理,用于检测红细胞mmp。
56.a组细胞需设置10管,分别为阴性管、mitotracker red单阳管、fmo对照管2管(hspc/clp、committed hpc各一个对照管)、全阳样本管6管(hspc/clp、committed hpc各三个副孔)。b组细胞需设置10管,分别为阴性管、mitotracker red单阳管、fmo对照管2管(粒/单核细胞、淋巴细胞各一个对照管)、全阳样本管6管(粒/单核细胞、淋巴细胞各三个副孔);c组细胞需设置6管,分别为阴性管、mitotracker red单阳管、fmo对照管、全阳样本管3管。
57.各组细胞计数,分装,调整每管样本细胞浓度均为5x106细胞/毫升。
58.分别将hspc/clp、committed hpc、粒/单核细胞、红细胞和淋巴细胞抗体组合(表s3)加入对应的细胞管,4度孵育30min,加入3ml pbs,1500rpm/min离心5min,弃上清。
59.将500μl浓度为30nm的mitotracker red工作液分别加入mitotracker red单阳管和全阳样本管,37℃下避光孵育20min,加入3ml pbs 1500rpm/min离心5min,弃上清,同方法洗涤细胞两次。
60.加入500μlpbs重悬后,经30
‑
70μm的尼龙网过滤制成待测样本,上机前每管加入3μl 7
‑
aad染色液,一个小时内完成检测。所有流式模板中mitotracker red使用pe荧光检测通道,光电倍增管电压保持一致为390v。侧向角散射光(side scatter,ssc)电压需保持一致为280v,用于统计各类细胞ssc信号的相对标准偏差(relative standard deviation,rsd)。
61.白血病细胞与正常细胞
62.取3只mll
‑
af9 aml白血病小鼠(a组)和三只c57小鼠(b组)的骨髓细胞,两组细胞分别使用红细胞裂解液裂解2min。
63.a和b组细胞各需设置6管,分别设置阴性管、mitotracker red单阳管、fmo对照管和全阳样本管3管(三个副孔)。
64.两组细胞计数、分装并且调整每管样本细胞浓度均为5x106细胞/毫升。
65.分别将白血病干细胞抗体组合(apc anti c
‑
kit,apc
‑
cy7 anti gr
‑
1)和造血干祖细胞抗体组合(apc
‑
cy7
‑
lineage markers,apc anti c
‑
kit,bv785 anti sca
‑
1)加入对应的细胞管,4度孵育30min,加入3ml pbs,1500rpm/min离心5min,弃上清。
66.将500μl浓度为30nm的mitotracker red工作液分别加入mitotracker red单阳管和全阳样本管,37℃下避光孵育20min,加入3ml pbs 1500rpm/min离心5min,弃上清,同方法洗涤细胞两次。
67.加入500μlpbs重悬后,经30
‑
70μm的尼龙网过滤制成待测样本,上机前每管加入3μl 7
‑
aad染色液,一个小时内完成检测。
68.线粒体活性氧检测
69.6只c57小鼠的骨髓细胞被分为a、b、c 3组,a组过lineage阴选磁柱,用于检测hspc/clp、committed hpc细胞ros;b组加入红细胞裂解液裂解2min,用于检测粒/单核、淋巴细胞ros;c组不处理,用于检测红细胞ros。
70.a组细胞需设置14管,分别为阴性管、ros单阳管、fmo对照管3管(hspc、committed hpc、clp各一个对照管)、全阳样本管9管(hspc、committed hpc、clp各三个副孔)。b组细胞需设置14管,分别为阴性管、ros单阳管、fmo对照管3管(粒细胞、单核细胞、淋巴细胞各一个对照管)、全阳样本管9管(粒细胞、单核细胞、淋巴细胞各三个副孔);c组细胞需设置6管,分别为阴性管、ros单阳管、fmo对照管、全阳样本管3管。
71.各组细胞计数,分装,调整每管样本细胞浓度均为5x106细胞/毫升。
72.分别将hspc、committed hpc、clp、单核细胞、粒细胞、红细胞和淋巴细胞抗体组合(表s4)加入对应的细胞管,4度孵育30min,加入3ml pbs,1500rpm/min离心5min,弃上清。
73.将500μl浓度为5μm的mitosox red工作液分别加入ros单阳管和全阳样本管,37℃下避光孵育20min,加入3ml pbs 1500rpm/min离心5min,弃上清,同方法洗涤细胞两次。
74.加入500μlpbs重悬后,经30
‑
70μm的尼龙网过滤制成待测样本,上机前每管加入3μl 7
‑
aad染色液,一个小时内完成检测。所有流式模板中的mitosox red电压需保持一致。
75.白血病细胞与正常细胞
76.取3只mll
‑
af9 aml白血病小鼠(a组)和三只c57小鼠(b组)的骨髓细胞,两组细胞分别使用红细胞裂解液裂解2min。
77.a和b组细胞各需设置6管,分别设置阴性管、mitotracker red单阳管、fmo对照管和全阳样本管3管(三个副孔)。
78.两组细胞计数、分装并且调整每管样本细胞浓度均为5x106细胞/毫升。
79.分别将白血病干细胞抗体组合(apc anti c
‑
kit,apc
‑
cy7 anti gr
‑
1)和造血干祖细胞抗体组合(apc
‑
cy7
‑
lineage markers,apc anti c
‑
kit,bv785 anti sca
‑
1)加入对应的细胞管,4度孵育30min,加入3ml pbs,1500rpm/min离心5min,弃上清。
80.将500μl浓度为5μm的mitosox red工作液分别加入mitotracker red单阳管和全阳样本管,37℃下避光孵育20min,加入3ml pbs 1500rpm/min离心5min,弃上清,同方法洗涤细胞两次。
81.加入500μlpbs重悬后,经30
‑
70μm的尼龙网过滤制成待测样本,上机前每管加入3μl 7
‑
aad染色液,一个小时内完成检测。所有流式模板中mitosox red使用percp
‑
cy5.5荧光检测通道,光电倍增管电压保持一致为580v。
82.线粒体自噬检测
83.6只c57小鼠的骨髓细胞被分为a、b、c 3组,a组过lineage阴选磁柱,用于检测hspc/clp、committed hpc细胞的线粒体自噬;b组加入红细胞裂解液裂解2min,用于检测
粒/单核、淋巴细胞的线粒体自噬;c组不处理,用于检测红细胞的线粒体自噬。
84.a组细胞需设置12管,分别为阴性管、mitophagy单阳管、fmo对照管2管、全阳样本管8管(hspc/clp、committed hpc各四个副孔)。b组细胞需设置12管,分别为阴性管、mitophagy单阳管、fmo对照管2管、全阳样本管8管(粒/单核细胞、淋巴细胞各四个副孔);c组细胞需设置7管,分别为阴性管、mitophagy单阳管、fmo对照管、全阳样本管4管。
85.各组细胞计数,分装,调整每管样本细胞浓度均为5x106细胞/毫升。
86.分别将hspc/clp、committed hpc、粒/单核细胞、红细胞和淋巴细胞抗体组合(表s5)加入对应的细胞管,4度孵育30min,加入3ml pbs,1500rpm/min离心5min,弃上清。
87.将500μl浓度为100nm的mitophagydye工作液分别加入mitophagy单阳管和全阳样本管,37℃下避光孵育20min,加入3ml pbs 1500rpm/min离心5min,弃上清,同方法洗涤细胞两次。
88.加入500μlpbs重悬后,经30
‑
70μm的尼龙网过滤制成待测样本,上机前每管加入3μl 7
‑
aad染色液,一个小时内完成检测。所有流式模板中的mitophagydye电压需保持一致。
89.白血病细胞与正常细胞
90.取3只mll
‑
af9 aml白血病小鼠(a组)和三只c57小鼠(b组)的骨髓细胞,两组细胞分别使用红细胞裂解液裂解2min。
91.a和b组细胞各需设置6管,分别设置阴性管、mitotracker red单阳管、fmo对照管和全阳样本管3管(三个副孔)。
92.两组细胞计数、分装并且调整每管样本细胞浓度均为5x106细胞/毫升。
93.分别将白血病干细胞抗体组合(apc anti c
‑
kit,apc
‑
cy7 anti gr
‑
1)和造血干祖细胞抗体组合(apc
‑
cy7
‑
lineage markers,apc anti c
‑
kit,bv785 anti sca
‑
1)加入对应的细胞管,4度孵育30min,加入3ml pbs,1500rpm/min离心5min,弃上清。
94.将500μl浓度为100nm的mitophagy工作液分别加入mitophagy单阳管和全阳样本管,37℃下避光孵育20min,加入3ml pbs 1500rpm/min离心5min,弃上清,同方法洗涤细胞两次。
95.加入500μlpbs重悬后,经30
‑
70μm的尼龙网过滤制成待测样本,上机前每管加入3μl 7
‑
aad染色液,一个小时内完成检测。所有流式模板中mitophagy dye使用pe
‑
cy5荧光检测通道,光电倍增管电压保持一致为660v。
96.单细胞测序分析
97.小鼠骨髓造血干细胞、髓系定向祖细胞单细胞测序数据下载于ncbi数据库(gse108155,gse72857),经seqgeq测序分析软件进行生物信息学分析。我们分析了十种线粒体自噬相关基因在血液细胞中的表达情况。
98.数据分析
99.所有流式数据由bd ariaiii流式细胞仪(bd biosciences,美国)采集,并且通过flowjo
tm v10.6.1(bd biosciences,美国)软件分析,获得流式图、各通道平均荧光强度(mean)和各通道标准差(sd)数据。应用tsne降维分析方法获得hspc tsne结果,在t
‑
sne图中,蛋白质表达模式相似的细胞紧密地组织在一起,表型相似的细胞群将表示为高度互联的节点集,使不同细胞亚群实现可视化。最终细胞分类可以以覆盖在t
‑
sne图上的颜色维度的形式或者以热图的形式可视化。t
‑
sne图中细胞的邻近程度反映了它们在高维空间中的
距离。
100.表s1各类造血细胞的免疫表型
[0101][0102][0103]
说明:lineage markers包括b220,ter
‑
119和gr
‑
1。
[0104]
表s2流式分选抗体组合方案
[0105][0106]
表s3 mitotracker green线粒体质量检测抗体组合方案
[0107][0108]
表s4 mitotracker red线粒体膜电位检测抗体组合方案
[0109][0110][0111]
表s5 mitosox red线粒体活性氧检测抗体组合方案
[0112][0113]
表s6 mitophagy检测抗体组合方案
[0114][0115]
表s7抗体信息
[0116]
[0117][0118]
[0119]
本研究结果表明,与hpc1、hpc2和定向造血祖细胞(committed hpc和clp)相比,hsc具有相对较低的线粒体代谢活性,具体表现为较低的线粒体质量、线粒体膜电位、线粒体活性氧和相对较高的线粒体自噬水平。与hsc相比,定向祖细胞的较高的线粒体代谢水平可能有利于这些祖细胞向髓系和淋系方向进行分化,并且与淋系分化过程相比,髓系分化可能需要更高的有氧代谢水平。与hpc1、committed hpc和clp相比,hpc2在线粒体数量和功能方面分享了更多的干细胞特征。与造血干祖细胞相比,成熟血细胞的线粒体代谢具有较大的异质性,其中粒细胞和单核细胞存在相似的代谢特征。同时,通过对造血干祖细胞的自噬相关基因进行分析,初步表明这些细胞在线粒体自噬相关的pink1/park2、bnip3/nix和fundc1通路选择中存在异质性。
[0120]
同一分化阶段的造血细胞研究中发现,与淋系分化相比,髓系分化过程中的造血细胞的形态和功能异质性更为明显。此外,与正常造血细胞相比,白血病干细胞(leukemia stem cell,lsc)具有更高的有氧代谢水平,同时通过高水平的线粒体自噬来维持干细胞功能。分化的白血病细胞的ros、mmp水平则偏高,而线粒体自噬水平偏低。这一研究结果为系统地研究生理和病理状态下不同类型造血细胞的线粒体代谢功能提供了一套完整的方法和基础参考值,也为基于线粒体代谢的肿瘤和衰老相关研究提供了标准和借鉴。具体实验结果如下:
[0121]
不同分化阶段造血细胞的形态多样性与线粒体功能的异质性
[0122]
图3a为不同分化阶段的小鼠骨髓造血干祖细胞的超微结构特征,从图中可知,大部分造血细胞的细胞核不规则,异染色质较多。hsc体积最小,细胞质含量少,线粒体和其它细胞器均较少;hpc细胞质含量变化不明显,mitophagy多见;cmp细胞质含量多,线粒体和其它细胞器增多;gmp体积大,细胞质和内质网丰富,可以观察到mitophagy;mep体积大,细胞质丰富,线粒体增大;clp细胞体积小,细胞核呈圆形,线粒体较多。由此可见,在细胞谱系分化过程中,居于造血分化初始阶段的干祖细胞在mm和mitophagy水平方面存在差异。
[0123]
图3b为不同分化阶段的小鼠骨髓髓系成熟细胞的超微结构观察结果,从图中可以看到,与原始造血细胞相比,大部分成熟细胞体积大、染色质凝集明显、细胞质较多。granulocyte细胞质多并且含大量初级颗粒;monocyte表面有细小突起,细胞核不规则,胞质丰富,含空泡和大量线粒体,并且颗粒较少;erythyocyte中的早期幼红细胞的细胞质较多,细胞核规则并且线粒体较多;晚期幼红细胞的细胞核固缩明显,线粒体和其它细胞器较少,并且可见脱核。髓系成熟细胞的超微结构差异表明在髓系造血分化过程中,不同种类成熟血细胞的线粒体特征存在明显的异质性。
[0124]
图3c为不同分化阶段的小鼠骨髓淋系成熟细胞的超微结构观察结果,从图中可以观察到,不同类型淋系细胞体积差异不明显,染色质凝集,胞浆较少,线粒体较clp减少,胞质颗粒和其他细胞器很少,并且mitophagy现象少见。与造血干祖细胞和髓系成熟细胞的超微结构分析结果不同的是,淋系成熟细胞的线粒体功能异质性较低,这可能是由于淋系细胞在有氧代谢和细胞功能维持方面的需求相近造成的。基于超微结构观察到的现象,为了研究不同分化阶段的造血细胞的线粒体功能,基于流式细胞表型标志的造血细胞分化群体特征被用于进一步分析。
[0125]
造血细胞谱系分化群体特征与线粒体功能异质性
[0126]
为了研究造血细胞的分化群体特征与线粒体功能异质性的关系,t
‑
分布邻域嵌入
算法(t
‑
distributed stochastic neighbor embedding,tsne)和流式自组织特征映射(flow self
‑
organizing feature map,flowsom)被用于表征不同分化阶段的造血细胞的群体特征。tsne分析可以识别高维度的蛋白标记关联性,将细胞的高维相似性可视化,提供了一种流式细胞群体数据分析的新方法。tsne分析结果反映了hspc群组中hsc、hpc1、hpc2和mpp,以及committed hpc群组中cmp、gmp和mep的抗原表达分布情况(图4a、图4d),与经典的流式二维逐级圈门所得细胞群比例相符。
[0127]
如图4b、图4e所示,hspc细胞群体经flowsom分为8组,热图颜色密度表示给定抗原的平均表达,经归一化后形成热图。热图显示了每个检测到的细胞群的每个蛋白质标记的中位表达强度,并根据蛋白表达强度差异对集群进行聚类。在将数据样本集呈递给flowsom之前,在fsc
‑
ssc和dapi
‑
ssc散点图上手动圈选了活细胞流式门。本研究只提取了活细胞门内的细胞,让flowsom做进一步的分析,在分析中使用了五个表面标记,网格的颜色表示荧光标记物强度。网格中依据蛋白表达分配得到的集群pop7、pop6、pop2+pop4和pop0+pop1+pop3+pop5分别对应于经典流式圈门方法中的hsc、mpp、hpc1和hpc2细胞群。committed hpc细胞群体经flowsom分为8组,依据蛋白表达分配得到的集群pop1+pop2+pop3+pop4、pop6和pop0+pop5分别对应于经典流式圈门方法中的cmp、gmp和mep细胞群。如图4c、图4f所示flowsom提供的细胞群体聚类分析的可视化表示方法,通过节点颜色、节点间相对位置,表征节点所代表细胞的抗原表达分布情况。节点扇形面积越大,该抗原表达越强。tsne和flowsom分析表明,造血干祖细胞可以基于表型特征被分为不同的特征群体,这一分类结果为研究不同类型的造血干祖细胞的线粒体功能异质性奠定了基础。
[0128]
与基于细胞表面标志的造血干祖细胞分类结果相似,包括髓系细胞(粒细胞和单核细胞)、红细胞和淋系细胞(t、b、nk细胞)在内的小鼠骨髓成熟造血细胞也可以根据细胞表型标志进行区分,来表征存在功能差异的不同类别的造血细胞。tsne分析结果反映了小鼠骨髓细胞群组中髓系细胞的粒细胞和单核细胞(图4g)、红细胞(图4j)以及淋系细胞的t、b、nk细胞(图4m)的抗原表达分布情况,与经典的流式二维逐级圈门所得细胞群比例相符。
[0129]
如图4h、图4k和图4n所示,髓系细胞、红细胞和淋系细胞群体经flowsom分为8组,热图颜色密度表示给定抗原的平均表达,经归一化后形成热图。热图显示了每个检测到的细胞群的每个蛋白质标记的中位表达强度,并根据蛋白表达强度差异对集群进行聚类。在将数据样本集呈递给flowsom之前,在fsc
‑
ssc和dapi
‑
ssc散点图上手动圈选了活细胞流式门。本研究只提取了活细胞门内的细胞,让flowsom做进一步的分析,在分析中使用了五个表面标记,网格的颜色表示荧光标记物强度。在髓系细胞流式分析模型中,网格中依据蛋白表达分配得到的集群pop6和pop4分别对应于经典流式圈门方法中的粒细胞和单核细胞群(图4h)。在红细胞流式分析模型中,依据蛋白表达分配得到的集群pop5对应于经典流式圈门方法中的红细胞群(图4k)。在淋系细胞流式分析模型中,网格中依据蛋白表达分配得到的集群pop4、pop0、pop2和pop1对应于经典流式圈门方法中的cd4+t、cd8+t、b和nk细胞群(图4n)。如图4i、图4l、图4o所示flowsom提供的细胞群体聚类分析的可视化表示方法。tsne和flowsom分析表明,基于表型抗原特征可以对不同类型造血细胞进行分类,以分类后的细胞群体为对象可以研究不同分化阶段造血细胞的包括线粒体功能在内的功能特点。
[0130]
不同分化阶段造血细胞的线粒体质量异质性
[0131]
tsne和flowsom分析说明,不同分化阶段的造血细胞可以基于表型特征被分为不
同的特征群体,为了研究不同分化群体的线粒体功能异质性,mm、mmp、ros和mitophagy等指标被用于进一步分析。图5a为不同谱系分化阶段的造血细胞的mm检测结果,显示了造血干祖细胞、髓系定向祖细胞/淋系定向祖细胞和成熟血细胞的mm水平。在髓系造血细胞分化过程中,原始造血干祖细胞(hsc和mpp)的mm低于祖细胞(hpc1、hpc2和committed hpc),也低于除了红细胞之外的髓系成熟血细胞(粒细胞和单核细胞),红细胞的mm低于髓系各类造血细胞(图5aa)。这一结果反映了在缺氧的骨髓微环境中,hsc主要通过糖酵解而不是氧化磷酸化的代谢方式来满足细胞的能量需求,因此hsc的mm保持低水平。这有利于hsc保持较低的ros水平,并维持自我更新和多向分化潜能。在淋系造血细胞分化过程中,原始造血干祖细胞(hsc和mpp)的mm低于祖细胞(hpc1、hpc2和clp),成熟淋巴细胞(t、b、nk细胞)的mm低于各类造血干祖细胞(图5ab)。
[0132]
在原始造血细胞中,hsc的mm显著低于祖细胞(图5aa、图5ab),具有髓系分化倾向性的hpc1的mm显著高于具有淋系分化倾向性的hpc2(图5ac),这一结果与髓系定向祖细胞(committed hpc)、淋系定向祖细胞(clp)的mm水平差异具有一致性。与hpc1、committed hpc和clp相比,hpc2的mm与hsc最相近。这可能说明在造血细胞分化过程中,髓系分化比淋系分化需要的有氧代谢水平更高,hpc2在线粒体数量和功能方面分享了更多的hsc的特征。在成熟血细胞中,粒细胞和单核细胞的mm较高,cd8+t和红细胞的mm较低(图5ad)。研究中检测的红细胞主要为成熟红细胞,这些细胞通过无氧呼吸获得能量,细胞内基本不存在线粒体。粒细胞和单核细胞分化源自gmp,具有相似的线粒体数量和功能,其他几种线粒体功能检测也印证了这一结果。
[0133]
为了探索造血细胞的细胞器数量的表征方式,挖掘一种简单的表征造血细胞的mm的指标,ssc被用于进一步分析。ssc代表细胞的颗粒度,即细胞内细胞器的复杂程度,能够潜在地反映细胞内的细胞器的种类和数量水平。图5b为不同谱系分化阶段的造血细胞的ssc结果,显示了造血干祖细胞、髓系定向祖细胞/淋系定向祖细胞和成熟血细胞的ssc数值水平。在髓系造血细胞分化过程中,原始造血干祖细胞(hsc和mpp)ssc低于hpc1,也低于除了红细胞之外的髓系成熟血细胞(粒细胞和单核细胞),红细胞ssc低于髓系各类造血细胞,说明原始细胞和红细胞内细胞器水平较低(图5ba)。gmp ssc明显高于cmp和mep,反映了gmp细胞内较高的颗粒度,细胞异质性较高,这可能与它的粒细胞分化方向密切相关。在淋系造血细胞分化过程中,原始造血干祖细胞(hsc和mpp)ssc低于祖细胞hpc1,但与hpc2和clp接近。成熟淋巴细胞(t、b、nk细胞)ssc低于各类造血干祖细胞(图5bb)。
[0134]
在原始造血细胞中,hsc ssc高于mpp、hpc2和各类定向祖细胞(cmp、mep和clp),但低于hpc1和gmp(图5ba、图5bb)。具有髓系分化倾向性的hpc1 ssc显著高于具有淋系分化倾向性的hpc2(图5bc),但髓系定向祖细胞(committed hpc)和淋系定向祖细胞(clp)的ssc水平比较接近。在成熟血细胞中,粒细胞和单核细胞ssc较高,b细胞和cd8+t细胞ssc较低(图5bd)。从上述结果可以得出,造血细胞的ssc水平与mm特征基本一致,能够较好地反映mm水平。
[0135]
不同分化阶段造血细胞的线粒体膜电位水平异质性
[0136]
为了研究不同分化阶段的造血细胞的mm与线粒体功能的关系,mmp被进一步探讨。图5c为不同谱系分化阶段的造血细胞的mmp检测结果,显示了不同类型的造血细胞的mmp水平。在髓系造血细胞分化过程中,原始造血干祖细胞(hsc和mpp)的mmp低于祖细胞(hpc1、
hpc2和committed hpc),也低于除了红细胞之外的髓系成熟血细胞(粒细胞和单核细胞),红细胞mmp低于髓系各类造血细胞(图5ca)。这一结果反映出hsc的生长环境相对低氧,仅有极少的线粒体处于活化状态,因此具有较低的mmp。在淋系造血细胞分化过程中,原始造血干祖细胞(hsc和mpp)内mmp低于祖细胞(hpc1、hpc2和clp),成熟淋巴细胞(t、b、nk细胞)的mmp低于各类造血干祖细胞(图5cb)。这一结果可能是因为成熟淋巴细胞的生存周期较短,线粒体功能受损会导致线粒体去极化和膜电位降低,进而引起细胞膜通透性改变和细胞凋亡。
[0137]
在原始造血细胞中,hsc的mmp显著低于祖细胞(图5ca、图5cb),具有髓系分化倾向性的hpc1的mmp显著高于具有淋系分化倾向性的hpc2(图5cc),这一结果与髓系定向祖细胞(committed hpc)、淋系定向祖细胞(clp)的mmp水平差异具有一致性。与hpc1、committed hpc相比,hpc2的mmp与hsc最相近。在成熟血细胞中,粒细胞和单核细胞的mmp较高,cd8+t细胞的mmp较低(图5cd)。从上述结果可以得出,造血细胞的mmp与mm、ssc水平基本一致,反映出低水平的mm和线粒体功能受损是造血细胞的mmp较低的原因。
[0138]
不同分化阶段造血细胞的活性氧(ros)水平异质性
[0139]
图6a为不同谱系分化阶段的造血细胞的ros检测结果,显示了不同类型的造血细胞的ros水平。在髓系造血细胞分化过程中,造血干祖细胞(hspc,hsc、mpp、hpc1和hpc2)的ros含量低于髓系定向祖细胞(committed hpc,cmp、gmp和mep),也低于成熟血细胞(粒细胞、单核细胞和红细胞)。这一结果反映了hsc的mm水平较低,不通过氧化磷酸化方式为细胞提供能量,因此细胞的ros水平保持在低位。hsc从静息状态向增殖/分化状态的转变过程,伴随着mtor活性的增加,引起细胞代谢率和ros水平的上升。ros水平的上升可能是hsc在增殖和分化过程中为满足更高能量需求而产生的结果。另一方面,胞内ros水平与hsc的分化密切相关,较高的ros水平会导致hsc的dna损伤,分化可能是hsc避免这种损伤堆积的机制之一。在淋系造血细胞分化过程中,造血干祖细胞的ros含量仍处于低位,其次为成熟淋巴细胞。
[0140]
在原始造血细胞中,hsc的ros水平显著低于祖细胞(图6aa、图6ab),mep的ros水平显著高于cmp、gmp两种髓系定向祖细胞。与mm和mmp的结果一致的是,具有髓系分化倾向性的hpc1的ros水平高于具有淋系分化倾向性的hpc2,这一结果也验证了髓系分化过程需要更多的线粒体,进而产生更多的ros。与hpc1、committed hpc相比,hpc2的ros水平与hsc最相近,从有氧代谢产物的角度佐证了在造血干祖细胞中,hpc2更多地分享了hsc在线粒体数量和功能方面的特征。在成熟血细胞中,粒细胞和nk细胞的ros水平较高,cd8+t细胞的ros水平较低(图6ac)。
[0141]
不同分化阶段造血细胞的线粒体自噬水平异质性
[0142]
基于ros、mm和mmp研究,为了进一步探索不同分化阶段的造血细胞的线粒体代谢水平,mitophagy检测被用于进一步分析。mitophagy选择性地清除受损的线粒体以调节线粒体的数量,是细胞调节胞内ros水平和dna损伤积聚的有效方法。图6b为不同谱系分化阶段的造血细胞的mitophagy检测结果,显示了不同类型的造血细胞的mitophagy水平。在髓系造血细胞分化过程中,原始造血干祖细胞(hsc和mpp)的mitophagy水平高于髓系成熟血细胞(粒细胞、单核细胞和红细胞),低于具有髓系分化倾向性的hpc1和髓系祖细胞mep。粒细胞和红细胞线的mitophagy水平低于髓系各类造血细胞(图6ba)。这一结果标明与成熟血
细胞相比,原始造血干祖细胞的较高的mitophagy水平有助于维持较低的细胞内mm和ros水平,进而维持静息状态和自我更新能力。在淋系造血细胞分化过程中,原始造血干祖细胞(hsc和mpp)的mitophagy水平不低于具有淋系分化倾向的hpc2和淋系祖细胞clp(图6bb)。
[0143]
在原始造血细胞中,hsc的mitophagy水平显著高于髓系成熟血细胞,低于部分淋系成熟血细胞(图6ba、图6bb),具有髓系分化倾向性的hpc1的mitophagy水平显著高于具有淋系分化倾向性的hpc2(图6bc),这一结果与髓系定向祖细胞(committed hpc)、淋系定向祖细胞(clp)的mitophagy水平差异具有一致性。与hpc2和clp相比,hpc1和committed hpc这两种与造血细胞髓系分化密切相关的祖细胞具有相对更高的mm和mmp,因此需要较高的mitophagy水平来维持细胞的分化能力。与hpc1、committed hpc和clp相比,hpc2的mitophagy比例与hsc最相近。这一结果表明在造血干祖细胞中,hpc2在mm、mmp、ros和mitophagy等方面更多地分享了hsc在线粒体功能方面的特征。在成熟血细胞中,b细胞的mitophagy水平高于各类造血细胞,cd8+t细胞的mitophagy水平低于各类造血细胞(图6bb,图6bd)。
[0144]
单细胞测序技术检测造血干祖细胞中线粒体自噬相关基因的表达
[0145]
为了深入了解小鼠造血干祖细胞的自噬相关基因表达程序,来源于ncbi数据库的10xgenomics单细胞基因表达分析结果被与流式细胞术、电子显微镜技术相结合进行基因表达水平的探讨。数据库来源的造血干细胞和髓系定向祖细胞流式分选表型与本实验中一致(图10a、图10b)。通过对这些数据集的生物信息学整合,对造血干祖细胞进行分群聚类。髓系祖细胞功能多样性表示它们对单核细胞、粒细胞和红细胞具有不同程度的转录特异性。它们的转录分布表明它们比造血干细胞具有更多的异质性和亚群特异性。聚类分析显示了内部显著的异质性。
[0146]
自噬相关基因如atg7、bcl
‑
2、bcl2l13、drp1、fundc1、nbr1、optn、park2、pink1和tax1bp1的表达在造血干细胞不同群体、髓系定向祖细胞不同群体及其他血液细胞群体中存在明显的差异(图7)。其中bcl2l13、nbr1、optn、park2、pink1和tax1bp1主要参与pink1/park2通路,bcl
‑
2主要参与bnip3/nix通路,drp1和fundc1主要参与fundc1通路。这一结果表明造血干祖细胞的mitophagy异质性不仅体现在mitophagy发生的数量上,也可能体现为不同细胞发生mitophagy的优势通路的异质性。
[0147]
以造血干细胞为例(图7a、图7b),atg7、bcl2、drp1、fundc1、nbr1、optn、pink1和tax1bp1基因在三个hsc群体中都有表达分布,但pop2、pop3的drp1、tax1bp1基因表达分别明显强于其他两群,并且park2基因在pop1中表达较少,说明在三个hsc群体中可能存在不同的mitophagy优势通路。tax1bp1作为自噬受体在受损线粒体选择性自噬清除过程中将泛素底物连接到自噬体膜上。pink1是一种丝氨酸/苏氨酸激酶,能够特异性的在去极化的线粒体上定位,通过磷酸化泛素来激活parkin,并通过招募自噬受体来诱导mitophagy的发生。drp1主要通过fundc1通路介导线粒体的分裂和mitophagy。这一结果表明,pink1/park2、bnip3/nix和fundc1通路在hsc线粒体自噬过程中普遍存在,pop2、pop3群体中,pink1/park2和fundc1通路同时发挥作用,分别招募drp1、tax1bp1等自噬受体参与mitophagy过程。pop1以fundc1和bnip3/nix为可能的优势通路。热图(图7c)显示出相同的基因表达分布结果,并体现出与pop1相比,pop2和pop3具有更为密集的自噬相关基因表达。
[0148]
在定向祖细胞群体中(图7d、图7e),通过对特征基因cd34和cd16/32表达情况的识
别,确定committed hpc包含gmp、mep和cmp三个细胞群体。atg7、drp1、fundc1、nb1、pink1和tax1bp1基因在三个committed hpc群体中都有表达分布,但mep的bcl2l13、park2,cmp的bcl2的基因表达分别明显强于其他两群,并且gmp的park2,mep的bcl2基因表达较少,说明mep以pink1/park2和fundc1为优势通路,cmp以bnip3/nix通路为优势通路,gmp以fundc1为可能的优势通路。热图(图7f)显示出相同的结果,并显示出与gmp相比,mep和cmp具有更密集的自噬相关基因表达。
[0149]
热图(heatmap)综合反映基因或蛋白表达水平、表达标记基因的细胞亚群的分布及细胞亚群中表达标记基因的细胞数量,是进行标记基因呈现的主要方式。
[0150]
在研究不同分化阶段造血细胞的线粒体功能的基础上,为了探索基于细胞表面标志分类得到的同一分化阶段的造血细胞的功能异质性,超微结构和流式细胞分析被用于进一步的研究。通过对根据相同表型分类得到的造血细胞的同一视野范围的电子显微镜观察可知,hpc(图8aa)、mep(图8ab)、gmp(图8ac)和erythyocyte(图8ad)细胞体积大小不等,细胞质含量和线粒体数量差别较大,表明在这几类髓系造血细胞内部,线粒体功能存在较大的异质性。然而,成熟淋巴细胞cd4+t(图8ae)和b(图8af)细胞形态差别不明显,表现出较低的线粒体功能异质性。
[0151]
为了更加完整地探究同一分化阶段的造血细胞的线粒体功能,基于ssc的rsd被用于评价一个细胞群体内部的组成成分之间的差异程度。图8ba、8bb分别显示了按谱系分化的造血干祖细胞、髓系定向祖细胞/淋系定向祖细胞和成熟血细胞群体的rsd水平。在髓系造血细胞分化过程中,原始造血干祖细胞(hsc和mpp)群体的rsd低于祖细胞(hpc1、hpc2和committed hpc),也低于各类髓系成熟血细胞(粒细胞、单核细胞和红细胞),红细胞群体rsd高于髓系各类造血细胞(图8ba)。hsc和mpp的sscrsd较小,说明相对于较成熟细胞,原始细胞群体内部ssc分布偏离平均值较小,具有较低的异质性。hpc1、mep、gmp和erythyocyte的rsd较高,反映了较高的细胞结构和功能的异质性,与超微结构观察结果是一致的。在淋系造血细胞分化过程中,原始造血干祖细胞(hsc和mpp)群体rsd低于祖细胞(hpc1、hpc2和clp),成熟淋巴细胞(t、b、nk细胞)群体rsd低于各类造血干祖细胞(图8bb),反映了它们在细胞组成和结构上较低的异质性,与超微结构观察的结果相符。不同类型的造血细胞的rsd变化情况与它们的mm和mmp特征具有一致性。
[0152]
在原始造血细胞中,hsc群体的rsd显著低于祖细胞(图8ba、图8bb),具有髓系分化倾向性的hpc1的群体的rsd显著高于具有淋系分化倾向性的hpc2(图8bc),这一结果与髓系定向祖细胞(committed hpc)、淋系定向祖细胞(clp)的mmp差异具有一致性。在成熟血细胞中,红细胞群体rsd较高,淋系细胞群体rsd较低(图8bd)。同一分化阶段的造血细胞的形态多样性和线粒体功能异质性表明细胞表型标志在表征造血细胞的功能方面存在局限性,具有相同细胞表型标志的细胞群体内部的细胞间存在形态和功能上的异质性,这一结果说明以细胞群体为对象的研究可能比单细胞研究更好地揭示一类细胞的功能特点。因此,rsd等指标和电子显微镜技术为研究同一分化阶段的造血细胞的线粒体功能提供了思路和方法。
[0153]
病理细胞与正常造血细胞的线粒体功能异质性
[0154]
图9a
‑
c为急性髓细胞白血病模型小鼠的骨髓病理细胞与正常小鼠造血细胞的线粒体功能检测结果,分别反映了lsc、non
‑
lsc、lsk和non
‑
lsk的ros、mmp和mitophagy水平。结果显示,与non
‑
lsc相比,lsc的ros、mmp和mitophagy水平偏高,并且具有统计学差异。与
lsk相比,lsc的ros、mmp和mitophagy水平偏高,并且具有显著统计学差异。这一结果表明lsc具有更高的有氧代谢水平,同时通过高水平的mitophagy来清除过多的线粒体,维持干细胞功能。与non
‑
lsk相比,non
‑
lsc的ros、mmp水平偏高,而mitophagy水平偏低,并且具有显著统计学差异。这一现象说明non
‑
lsc内线粒体容易堆积,同时较弱的mitophagy和较高的胞内ros水平不利于细胞功能的维持,容易引发细胞凋亡。与non
‑
lsk相比,lsk的ros、mitophagy水平偏低,而mmp偏高,并且具有极显著统计学差异。这一现象标明lsk内ros等有害物质积累较少,通过较低的mitophagy水平就可以维持细胞的功能。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1