一步法筛查和/或诊断克隆性疾病的试剂组合物及其应用的制作方法
1.本发明涉及一种一步法筛查和/或诊断克隆性疾病的试剂组合物及其应用,属于血液病检测技术领域。
背景技术:
2.此处的克隆性疾病是泛指一类细胞异常相关的疾病,不只限于恶性肿瘤,还包括慢性感染、遗传学异常等因素引起的某种细胞一致性增生,如夜间阵发性睡眠性血红蛋白尿(paroxysmal nocturnal hemoglobinuria,pnh)、再生障碍性贫血(aplastic anemia,aa)、纯红aa、少见的正常人多态性,以及常见癌前病变、免疫缺陷等。恶性肿瘤一直是影响人类健康的重要疾病之一,各种急性白血病(acute leukemia,al)、淋巴瘤、转移癌、慢性髓系肿瘤、pnh等恶性肿瘤类克隆性疾病总计发病率达到千分之一以上,并且随着人群总体寿命的延长,人口老龄化,这些肿瘤的发病率呈现逐年上升的趋势。目前虽然有了靶向治疗等方法,但是恶性肿瘤依旧是死亡率较高的疾病,对于肿瘤和其他克隆性疾病患者,明确诊断才能精准治疗。此外,很多肿瘤是可以早期筛查,早期诊断,早期治疗获得寿命延长甚至治愈的,因此目试剂组合物前临床急需高灵敏度筛查和检测恶性肿瘤以及癌前病变的技术。癌前病变如单克隆b淋巴细胞增多症(monoclonal b
‑
cell lymphocytosis,mbl)和意义未明的单克隆免疫球蛋白血症(monoclonal gammopathy of undetermined significance,mgus),甚至某些少见的正常人多态性如fcγ受体iiiβ基因突变,和其他免疫缺陷,发病率比恶性克隆性疾病还高,mbl在欧美国家40岁以上人群发病率3.5
‑
17%,每年有1%的高白细胞mbl进展为慢性淋巴细胞白血病或者b淋巴瘤;mgus在50岁以上人群中发病率3%,70岁以上人群中发病率5%;fcγ受体iiiβ基因突变在人群中发病率0.1%
‑
0.2%左右。
3.流式细胞术从上个世纪70年代研发,上个世纪末进入血液病诊断领域以来,随着技术的进步,以及相应免疫学和肿瘤学的进展,检测领域越来越广阔,已经成为临床和科研中不可或缺的一项重要技术。尤其是在恶性肿瘤的诊断中,因为其快速、灵敏、特异、相对便宜,已经成为白血病、淋巴瘤、转移癌、pnh等克隆性疾病的首要检测手段,其中很多被列入金标准,有的甚至是唯一检测方法;随着临床治疗效果的提高,新技术的不断涌现,人群寿命的延长,对于疾病早期筛查、癌前病变的健康管理,恶性肿瘤早诊断早治疗成为全社会最关注的问题,而流式细胞术检测对于绝大多数肿瘤和癌前病变的筛查和检测,都能够发挥至关重要的作用。
4.但是流式细胞术目前整体应用现状并不理想,由于其技术难度高、检测方案复杂、检测流程缺乏标准化、人工参与度高、人员培养困难等,都是影响该技术广泛推广和应用的瓶颈。尤其急需解决的问题是,流式细胞术的本质是需要使用抗体去检测疾病,抗体的正确选择和高灵敏度的观察,是防止漏诊的关键。因此找到一个通用的、高效的检测方案和分析方法,是解决这些问题的关键点。
5.为解决该问题,科研人员已做过研究性的探索,包括欧洲流式联盟(euroflow)从2012年开始不断推出的方案,但是euroflow方案依然存有如下缺陷:1、是一个基于第一步
筛查的两步法方案,这样就导致了第一步的判断非常重要,如果人员第一步判断失误,就会导致第二步抗体选择错误;2、两步法的第一步相对简单,不可能覆盖所有的疾病筛查,因此容易漏诊;3、两步法工作量大,方案个体差异大,不利于前处理、自动上样等过程实现自动化以及flowjo等多维软件分析和人工智能的发展;4、重点在于急性白血病和淋巴瘤等常见血液肿瘤的诊断,对于转移癌没有涉及,对罕见肿瘤、癌前病变检测效率不高;5、绝大多数临床患者都是以贫血、白细胞减少、三系减少等症状就诊,对于这种没有任何临床信息,甚至其他检测即使做了也无法提供有效信息的情况,难以解决。
6.经查,现有技术中未发现更为简便可行的能应用于流式细胞术筛查几乎所有克隆性疾病(包括肿瘤、aa、纯红aa、少见的正常人多态性,以及常见癌前病变、免疫缺陷等)的技术。
技术实现要素:
7.本发明的一个目的在于提供一种试剂组合物,适用于在有或者没有任何临床信息的情况下,通过一步法、高效率筛查和/或诊断绝大多数克隆性疾病。
8.本发明的另一目的在于提供所述的试剂组合物在筛查和/或诊断克隆性疾病中的应用。
9.本发明中所述的“克隆性疾病”,是广义上流式细胞术可以检测到和提示的各种细胞异常相关的疾病,不只限于肿瘤,还包括pnh、aa、纯红aa、少见的正常人多态性,以及常见癌前病变、免疫缺陷等。
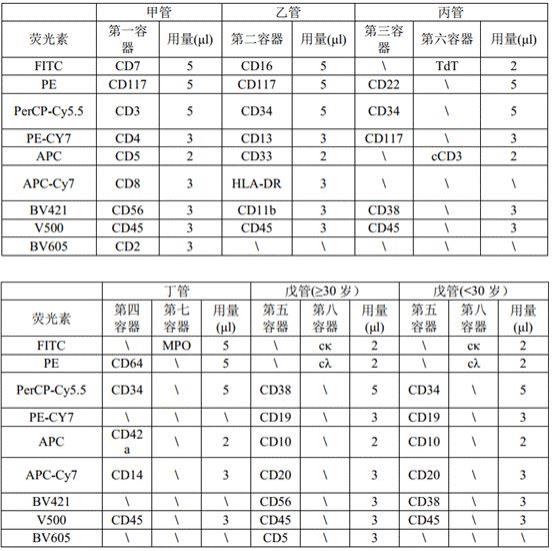
10.一方面,本发明提供了一种试剂组合物,该试剂组合物包括第一组抗体、第二组抗体、第三组抗体、第四组抗体、第五组抗体、第六组抗体、第七组抗体和第八组抗体,其中:第一组抗体包括:抗cd7抗体、抗cd117抗体、抗cd3抗体、抗cd4抗体、抗cd5抗体、抗cd8抗体、抗cd56抗体、抗cd45抗体和抗cd2抗体;第二组抗体包括:抗cd16抗体、抗cd117抗体、抗cd34抗体、抗cd13抗体、抗cd33抗体、抗hla
‑
dr抗体、抗cd11b抗体和抗cd45抗体;第三组抗体包括:抗cd22抗体、抗cd34抗体、抗cd117抗体、抗cd38抗体和抗cd45抗体;第四组抗体包括:抗cd64抗体、抗cd34抗体、抗cd42a抗体、抗cd14抗体和抗cd45抗体;第五组抗体包括a组抗体和/或b组抗体;其中,a组抗体包括:抗cd38抗体、抗cd19抗体、抗cd10抗体、抗cd20抗体、抗cd56抗体、抗cd45抗体和抗cd5抗体;b组抗体包括:抗cd34抗体、抗cd19抗体、抗cd10抗体、抗cd20抗体、抗cd38抗体和抗cd45抗体;第六组抗体包括:抗胞核tdt抗体和抗胞浆(cytoplasmatic,c)cd3抗体;第七组抗体包括:抗胞浆mpo抗体(抗cmpo抗体);第八组抗体包括:抗胞浆κ抗体(抗cκ抗体)和抗胞浆λ抗体(抗cλ抗体);所述试剂组合物为能用于一步法筛查和/或诊断克隆性疾病的流式细胞术检测用组合物,应用时使用5管并行的方案,其中第一组抗体、第二组抗体分别用于不同管样本,第三组抗体与第六组抗体用于同一管样本,第四组抗体与第七组抗体用于同一管样本,第五组抗体与第八组抗体用于同一管样本。本发明中,第五组抗体中的a组抗体是用于对来自30
岁以上的个体的样本进行检测,b组抗体用于对来自小于30岁的个体的样本进行检测。
11.本发明的试剂组合物,可应用于流式细胞术一步法筛查和/或诊断多种克隆性疾病,筛查和诊断的克隆性疾病例如可包括恶性肿瘤、pnh、aa、纯红aa、癌前病变、正常人多态性、免疫缺陷等。具体应用时,使用5管并行的方案,每管都使用系别抗体或者原始、幼稚细胞抗体分别和ssc和/或cd45组合设置各系细胞及原始幼稚细胞门,并用相关标志组合予以修正,可以有效设门选出各种系别、各种阶段的细胞(尤其是慢性髓系肿瘤或者其他肿瘤细胞比例比较低的时候),甚至包括罕见肿瘤和癌前病变、正常人多态性,从而提高检测效率,形成规范化,降低漏诊概率,并为将来实现自动化、人工智能化提供方便。
12.根据本发明的具体实施方案,本发明的试剂组合物中,抗cκ抗体和抗cλ抗体为多克隆抗体,其他各抗体均为单克隆抗体。
13.根据本发明的具体实施方案,本发明的抗体组合物中,各抗体均为荧光素标记的抗体。优选地,第一组抗体中,抗cd7抗体、抗cd117抗体、抗cd3抗体、抗cd4抗体、抗cd5抗体、抗cd8抗体、抗cd56抗体、抗cd45抗体和抗cd2抗体的荧光素标记顺序为fitc、pe、percp
‑
cy5.5、pe
‑
cy7、apc、apc
‑
cy7、bv421、v500和bv605。第二组抗体中,抗cd16抗体、抗cd117抗体、抗cd34抗体、抗cd13抗体、抗cd33抗体、抗hla
‑
dr抗体、抗cd11b抗体和抗cd45抗体的荧光素标记顺序为fitc、pe、percp
‑
cy5.5、pe
‑
cy7、apc、apc
‑
cy7、bv421和v500。第三组抗体中,抗cd22抗体、抗cd34抗体、抗cd117抗体、抗cd38抗体和抗cd45抗体的荧光素标记顺序为pe、percp
‑
cy5.5、pe
‑
cy7、bv421和v500。第四组抗体中,抗cd64抗体、抗cd34抗体、抗cd42a抗体、抗cd14抗体和抗cd45抗体的荧光素标记顺序为pe、percp
‑
cy5.5、apc、apc
‑
cy7和v500。第五组抗体中,a组抗体中的抗cd38抗体、抗cd19抗体、抗cd10抗体、抗cd20抗体、抗cd56抗体、抗cd45抗体和抗cd5抗体的荧光素标记顺序为percp
‑
cy5.5、pe
‑
cy7、apc、apc
‑
cy7、bv421、v500和bv605;b组抗体中的抗cd34抗体、抗cd19抗体、抗cd10抗体、抗cd20抗体、抗cd38抗体和抗cd45抗体的荧光素标记顺序为percp
‑
cy5.5、pe
‑
cy7、apc、apc
‑
cy7、bv421和v500。第六组抗体中,抗胞核tdt抗体和抗胞浆cd3抗体的荧光素标记顺序为fitc和apc。第七组抗体中,抗cmpo抗体的荧光素标记为fitc。第八组抗体中,抗cκ抗体和抗cλ抗体的荧光素标记顺序为fitc和pe。本发明中通过对不同抗体搭配特定的荧光素,可以使得本发明的试剂组合物应用于一步法筛查和/或诊断克隆性疾病时,各通道的所有荧光素都能达到优异的染色效果。
14.根据本发明的具体实施方案,本发明的试剂组合物中,各抗体组分均可商购获得。各抗体应符合相关行业标准要求。
15.根据本发明的具体实施方案,本发明的试剂组合物中,第一组抗体为抗cd7抗体、抗cd117抗体、抗cd3抗体、抗cd4抗体、抗cd5抗体、抗cd8抗体、抗cd56抗体、抗cd45抗体和抗cd2抗体按照5:5:5:3:2:3:3:3:3的体积比混合的混合物。第二组抗体为抗cd16抗体、抗cd117抗体、抗cd34抗体、抗cd13抗体、抗cd33抗体、抗hla
‑
dr抗体、抗cd11b抗体和抗cd45抗体按照5:5:5:3:2:3:3:3的体积比混合的混合物。第三组抗体为抗cd22抗体、抗cd34抗体、抗cd117抗体、抗cd38抗体和抗cd45抗体按照5:5:3:3:3的体积比混合的混合物。第四组抗体为抗cd64抗体、抗cd34抗体、抗cd42a抗体、抗cd14抗体和抗cd45抗体按照5:5:2:3:3的体积比混合的混合物。第五组抗体中,a组抗体为:抗cd38抗体、抗cd19抗体、抗cd10抗体、抗cd20抗体、抗cd56抗体、抗cd45抗体和抗cd5抗体按照5:3:2:3:3:3:3的体积比混合的混合
物;b组抗体为抗cd34抗体、抗cd19抗体、抗cd10抗体、抗cd20抗体、抗cd38抗体和抗cd45抗体按照5:3:2:3:3:3的体积比混合的混合物。第六组抗体为抗胞核tdt抗体和抗胞浆cd3抗体按照2:2的体积比混合的混合物。第八组抗体为抗cκ抗体和抗cλ抗体按照2:2的体积比混合的混合物。上述各抗体的混合比例均是指各抗体在效价基本相当的情况下的混合比例。
16.本发明的另一方面提供了一种试剂盒,该试剂盒包括第一容器、第二容器、第三容器、第四容器、第五容器、第六容器、第七容器和第八容器,各容器分别容置本发明所述的试剂组合物的第一组抗体、第二组抗体、第三组抗体、第四组抗体、第五组抗体、第六组抗体、第七组抗体和第八组抗体。本发明中,所述第五组抗体包括a组抗体和b组抗体时,a组抗体与b组抗体可分别容置于不同的第五容器中。
17.根据本发明的具体实施方案,本发明的试剂盒还可包括:溶血素、破膜剂、缓冲液、与流式细胞仪配套使用的流式管中的一种或多种。这些试剂和耗材均可商购获得。其中所述破膜剂优选为包括a液、b液的破膜剂。各试剂材料可分别容置于不同的容器中。
18.本发明的试剂盒可用于一步法筛查和/或诊断克隆性疾病,包括绝大多数恶性肿瘤、pnh、aa、纯红aa、癌前病变、免疫缺陷、正常人多态性等克隆性疾病。
19.本发明的另一方面还提供了所述的试剂组合物在制备用于一步法筛查和/或诊断克隆性疾病的流式细胞上机样品中的应用。所述的克隆性疾病包括绝大多数恶性肿瘤、pnh、aa、纯红aa、癌前病变、免疫缺陷、正常人多态性等。
20.根据本发明的具体实施方案,所述制备用于一步法筛查和/或诊断克隆性疾病的流式细胞上机样品的过程包括步骤:(1)将待测样本分别加入到甲管、乙管、丙管、丁管和戊管五个流式管中,使呈单个细胞悬液状态,并保证细胞量1
×
106/管
‑1×
107/管;(2)向丁管和戊管中加入磷酸盐缓冲液(pbs)混匀,37度孵育,离心去除上清;(3)向步骤(1)处理得到的甲管中加入本发明所述的试剂组合物中的第一组抗体,向步骤(1)处理得到的乙管中加入本发明所述的试剂组合物中的第二组抗体,向步骤(1)处理得到的丙管中加入本发明所述的试剂组合物中的第三组抗体,向步骤(2)处理得到的丁管中加入本发明所述的试剂组合物中的第四组抗体,向步骤(2)处理得到的戊管中加入本发明所述的试剂组合物中的第五组抗体中的a组抗体或b组抗体,各流式管室温避光孵育;(4)向步骤(3)孵育后的丙管、丁管、戊管流式管中加入破膜剂a液,继续室温避光孵育;(5)向步骤(3)孵育后的甲管和乙管流式管中加入1
×
溶血素,向步骤(4)孵育后的丙管、丁管和戊管流式管中加入1
×
溶血素,继续室温避光孵育;(6)将步骤(5)孵育后的各流式管离心后去上清;(7)向步骤(6)去上清后的丙管中加入破膜剂b液和本发明所述的试剂组合物中的第六组抗体,向步骤(6)去上清后的丁管中加入破膜剂b液和本发明所述的试剂组合物中的第七组抗体,向步骤(6)去上清后的戊管中加入破膜剂b液和本发明所述的试剂组合物中的第八组抗体,室温避光孵育;(8)向步骤(6)去上清后的甲管和乙管以及步骤(7)孵育后的丙管、丁管、戊管流式管中,分别加入pbs缓冲液洗涤,离心后去上清,用pbs缓冲液重悬细胞,即得到流式细胞上机样品。
21.本发明中,对操作步骤的描述,除非特别注明或是从上下文的表述能明显确定存在先后关系的之外,描述的先后顺序并不用于限定这些步骤实际操作的先后顺序。
22.根据本发明的具体实施方案,本发明中,所述待测样本可为骨髓或外周血,也可以用于组织标本、体液标本等所有能制备出单个活细胞,适用于流式细胞术检测的样本。
23.根据本发明的具体实施方案,步骤(1)中,每管样本加入量体积不超过160μl(如果患者外周血细胞量少,根据需要可先加入体积超过160μl,离心去上清浓缩)。
24.根据本发明的具体实施方案,各试剂的用量可参照本领域现有技术的常规用量或是按照商家的推荐剂量。
25.根据本发明的具体实施方案,本发明的试剂组合物,第一组抗体的加入量为16
‑
64μl/管,第二组抗体的加入量为15
‑
60μl/管,第三组抗体的加入量为10
‑
40μl/管,第四组抗体的加入量为9
‑
36μl/管,第五组抗体的加入量为11
‑
44μl/管,第六组抗体的加入量为2
‑
8μl/管,第七组抗体的加入量为3
‑
10μl/管,第八组抗体的加入量为2
‑
8μl/管。
26.根据本发明的具体实施方案,上述步骤(2)的操作,可根据需要选择性地重复一或多次。根据本发明的具体实施方案,每次pbs的加入量为2
‑
3ml/管,所述离心条件可为1000
‑
2000rpm(或300
‑
450g)离心5分钟。
27.根据本发明的具体实施方案,步骤(2)孵育时间可为5
‑
30分钟。
28.根据本发明的具体实施方案,步骤(3)孵育时间可为10
‑
30分钟。
29.根据本发明的具体实施方案,步骤(4)中,孵育时间可为5
‑
20分钟。破膜剂a液的加入量按照商家的推荐剂量即可,通常为100μl/管。
30.根据本发明的具体实施方案,步骤(5)中,孵育时间可为5
‑
30分钟。1
×
溶血素的加入量为2
‑
3ml/管。
31.根据本发明的具体实施方案,步骤(6)中,通常需孵育10
‑
30分钟左右。所述离心条件可为1000
‑
2000rpm(或300
‑
450g)离心5分钟。
32.根据本发明的具体实施方案,步骤(7)中,破膜剂b液的加入量按照商家的推荐剂量即可,通常为50μl/管。
33.根据本发明的具体实施方案,步骤(8)中,洗涤用pbs缓冲液的加入量为2
‑
3ml/管。所述离心条件可为1000
‑
2000rpm(或300
‑
450g)离心5分钟。重悬用pbs缓冲液的加入量为0.5
‑
1ml/管。
34.根据本发明的具体实施方案,重悬细胞进行流式细胞上机检测时,甲管样本选择cd45、cd117、cd4和cd56抗体分别组合ssc设门,cd7、cd56和cd5分别组合cd45设门;乙管样本选择cd45、cd117和cd34抗体分别组合ssc设门,hla
‑
dr组合cd45设门;丙管样本选择cd45、tdt、cd22、cd34、cd117和cd38分别组合ssc设门,ccd3组合cd45设门;丁管cd45、cd34分别组合ssc设门,cd42a组合cd45设门;戊管cd45、cd19、cd20和cd38分别组合ssc设门,cd56组合cd45设门(30岁以下患者,cd45、cd19、cd20、cd34和cd38分别组合ssc设门),筛选原始细胞、髓系幼稚细胞、b细胞、成熟淋巴细胞、浆细胞、分化阶段的粒细胞、单核细胞、cd42a阳性的血小板或者巨核细胞、cd45dim或
‑
/cd56+的细胞(可能是转移癌细胞、恶性浆细胞、恶性母细胞性浆样树突状细胞、恶性幼稚巨核细胞、其他白血病或淋巴瘤等),进行分析。
35.另一方面,本发明还提供了一种一步法筛查和/或诊断克隆性疾病的装置,该装置
包括检测单元和分析单元,其中:所述检测单元包括用于通过流式细胞术检测来自待测个体的样本的试剂材料,用于获得样本的检测结果;所述试剂材料包括本发明所述的试剂组合物;所述分析单元用于分析检测单元的检测结果。
36.根据本发明的具体实施方案,本发明的一步法筛查和/或诊断克隆性疾病的装置中,所述检测单元的应用过程包括:利用本发明所述的试剂组合物对待测样本进行处理,制备得到流式细胞上机样品;进行流式细胞上机检测。所述分析单元的分析过程包括:对检测结果进行分析,以判别(包括辅助判别)绝大多数恶性肿瘤、克隆性疾病、癌前病变、免疫缺陷和/或正常人多态性等。
37.根据本发明的具体实施方案,本发明的装置用于一步法筛查和/或诊断克隆性疾病时,各流式管的设门分析可按照以下操作进行。
38.其中流式细胞上机检测时甲管按照以下方式设门:设置去黏连细胞门p1,设置活细胞门p2,得到单个活细胞;p2门内使用cd45/ssc设置各血细胞门(包括嗜酸性粒细胞);p2门内,使用cd117/ssc设门检测髓系幼稚细胞,使用cd117强表达/ssc设门检测肥大细胞,使用cd45/ssc设门观察淋巴细胞门内cd2/cd7、cd4/cd3、cd4/cd8、cd3/cd5形成的标志组合检测t细胞,使用cd45/ssc设门观察淋巴细胞门内cd3/cd56、cd4/cd8、cd2/cd7、cd3/cd5形成的标志组合检测nk细胞,使用ssc中等/cd4dim设门检测树突状细胞和单核细胞,使用cd45dim或
‑
/cd56+设门检测转移癌、浆细胞肿瘤(plasma cell neoplasm,pcn)、原始浆细胞样树突状细胞肿瘤(blastic plasmacytoid dendritic cell neoplasm,bpdcn)、急性白血病(acute leukemia,al)和慢性淋巴细胞增殖性疾病(chronic lymphoproliferative disorders,clpd)相关细胞;其中流式细胞上机检测时乙管按照以下方式设门:设置去黏连细胞门p1,设置活细胞门p2,得到单个活细胞;p2门内使用cd45/ssc设置各血细胞门;p2门内,使用cd117/ssc设门髓系幼稚细胞,使用cd117强表达(bri)/ssc设门检测肥大细胞,使用cd34/ssc和hla
‑
dr/cd45设门检测原始细胞,使用cd45/ssc设门检测分化阶段粒细胞,使用cd45/ssc设门并用hla
‑
dr/cd45和cd11b/hla
‑
dr修正检测单核细胞;其中流式细胞上机检测时丙管按照以下方式设门:依次设置去黏连细胞门p1、活细胞门p2,然后p2门内,使用cd45/ssc设置各血细胞门;p2门内,使用cd117/ssc设门检测髓系幼稚细胞,使用cd117强表达/ssc设门检测肥大细胞;使用cd34/ssc设门检测原始细胞;使用tdt/ssc设门检测淋系原始细胞;使用cd22/ssc设门检测b细胞;使用cd45/ccd3修正cd45/ssc设置的淋巴细胞门检测t细胞;其中流式细胞上机检测时丁管按照以下方式设门:依次设置去黏连细胞门p1、活细胞门p2;然后p2门内,使用cd45/ssc设置各血细胞门,使用cd42a/cd45设门观察血小板/巨核细胞,使用cd34/ssc设门观察原始细胞;其中流式细胞上机检测时戊管按照以下方式设门:采用a组抗体处理的戊管:设置去黏连细胞门p1,活细胞门p2,得到单个活细胞;p2门内使用cd45/ssc设置各血细胞门;p2门内,使用cd19/ssc设门检测b细胞(包括各阶段b细胞);使用cd20/ssc设门检测偏成熟阶段b细胞;使用cd38bri/ssc和/或cd38bri/cd45dim设门检测浆细胞;使用cd45dim或
‑
/cd56+设门检测转移癌、浆细胞肿瘤(pcn)、原始浆细胞样
树突状细胞肿瘤(bpdcn)以及急性白血病(al)和慢性淋巴细胞增殖性疾病(clpd)相关细胞;或者,采用b组抗体处理的戊管:设置去黏连细胞门p1,设置活细胞门p2,得到单个活细胞;p2门内使用cd45/ssc设置各血细胞门;p2门内,使用cd19/ssc设门检测b细胞(包括各阶段b细胞);使用cd20/ssc设门检测偏成熟阶段b细胞;使用cd38bri/ssc和/或cd38bri/cd45设门检测浆细胞;使用cd34/ssc设门检测原始细胞。
39.根据本发明的具体实施方案,本发明的一步法筛查和/或诊断克隆性疾病的装置中,所述分析单元还可包括根据设门分析检测结果进一步判断疾病的模块(本发明所述的判断包括筛查、提示、辅助诊断、诊断)。本发明通过在多标志组合设门内,将所显示的各群细胞与相应的正常细胞进行比较,找出肿瘤细胞,或者pnh等克隆性疾病,以及mbl、mgus等癌前病变;或者出现原始细胞和粒细胞和/或有核红比例明显减低,提示aa或者纯红aa;或者出现淋巴细胞亚群比例的异常,可疑存在免疫缺陷;单纯粒细胞完全丢失cd16,提示fcγ受体iiiβ基因突变的正常人多态性。具体而言,本发明可用于一步法快速、全面地筛查/诊断几乎所有克隆性疾病和其他异常,如:
①
各种急性白血病(acute leukemia,al):包括b系急性淋巴细胞白血病/淋巴母细胞淋巴瘤(acute lymphoblastic leukemia/lymphoblastic lymphoma,all/lbl)、t
‑
all/lbl、急性髓系白血病(acute myeloid leukemia,aml)、原始浆细胞样树突状细胞肿瘤(blastic plasmacytoid dendritic cell neoplasm,bpdcn)、急性系列不明白血病(acute leukemia of ambiguous lineage,alal),后者主要包括混合表型急性白血病(mixed phenotype acute leukemia,mpal)、急性未分化白血病(acute undifferentiated leukemia,aul)和非特指alal(acute leukemia of ambiguous lineage,not otherwise specified,alal,nos);
②
各种成熟淋巴细胞肿瘤:如b细胞慢性淋巴细胞增殖性疾病(chronic lymphoproliferative disorders,clpd)、t
‑
clpd、nk
‑
clpd、浆细胞肿瘤(plasma cell neoplasm,pcn);
③
慢性髓系肿瘤,包括骨髓增生异常综合征(myelodysplastic syndrome,mds)、髓系增殖性肿瘤(myeloproliferative neoplasms,mpn)、mds/mpn、肥大细胞增多症、嗜酸性粒细胞增多相关疾病等;
④
夜间阵发性睡眠性血红蛋白尿(paroxysmal nocturnal hemoglobinuria,pnh);
⑤
各种转移癌累及骨髓和/或外周血,包括上皮来源实体瘤和神经肌肉来源的实体瘤;
⑥
癌前病变如单克隆b淋巴细胞增多症(monoclonal b
‑
cell lymphocytosis,mbl)和意义未明的单克隆免疫球蛋白血症(monoclonal gammopathy of undetermined significance,mgus);
⑦
某些罕见的正常人多态性如fcγ受体iiiβ基因突变;
⑧
再生障碍性贫血(aplastic anemia,aa),包括纯红细胞aa;
⑨
其他免疫细胞亚群异常,包括原发性原发免疫缺陷病(primary immunodeficiency diseases,pids)或者药物、感染等引发的免疫细胞亚群异常。
40.根据本发明的具体实施方案,本发明在对五管样本进行分析时,其中每管通用的cd45/ssc用于初步筛查正常标本中常见的各群细胞(成熟淋巴细胞、单核细胞、分化阶段粒细胞、有核红细胞)比例是否正常,是否存在有高比例肿瘤细胞,进一步结合每管的其他标志进行判断。具体而言,各类疾病的判断可以按照以下方式进行:(1)急性白血病的判断:正常标本每管的cd45/ssc设门图片都主要由淋巴细胞门(lym)、单核细胞门(mono)、粒细胞门(gra)、有核红细胞门(nec)组成,像问号一样包绕cd45dim/ssc小的区域(原始细胞孔),但是急性白血病的时候该位置出现一群明显的细胞
群,比例≥20%。此时进一步根据所出现的情况做下述判断:
①
aml:甲管、乙管、丙管、丁管是诊断这类疾病的关键。甲管cd117/ssc设门检测到一群明显的肿瘤细胞,比例20%以上,这群细胞cd45/ssc图片上在原始细胞孔位置,不表达t系标志cd3、cd8。乙管在cd117/ssc、cd34/ssc、hla
‑
dr/cd45、cd45/ssc设门均能检测到与甲管相同肿瘤细胞,表达早期和髓系标志cd13和cd33。丙管在cd117/ssc、cd34/ssc、cd45/ssc设门均能检测到与甲乙管同一群肿瘤细胞,表达早期标志cd34、cd117、cd38、hla
‑
dr,不表达特异性t系标志ccd3和b系标志cd22。丁管在cd34、ssc和cd45/ssc设门均能检测到与前几管同一群肿瘤细胞,多数亚型表达mpo和/或cd64。戊管a组(30岁以上)cd45/ssc设门可以检测到与前几管同一群肿瘤细胞,表达cd38(cd38强表达为浆细胞标志,弱表达为早期标志或者b系侵袭性淋巴瘤标志),不表达b系标志cd20、cκ、cλ;戊管b组(小于30岁)cd45/ssc、cd34/ssc设门可以看到与前几管同一群肿瘤细胞,肿瘤细胞表达早期标志cd38,不表达b系标志cd20、cκ、cλ。
41.②
b
‑
all:丙管、戊管是筛查/诊断这类疾病的关键。甲管除了cd45/ssc的原始细胞孔出现一群肿瘤细胞比例20%以上,这群肿瘤细胞不表达甲管的其他全部标志。乙管中cd34/ssc、hla
‑
dr/cd45、cd45/ssc设门均检测到与甲管同一群肿瘤细胞,不表达髓系标志cd117、cd16、cd11b。丙管中cd45/ssc、cd34/ssc、tdt/ssc、cd22/ssc均能检测到一群明显的肿瘤细胞,与甲乙管检测到的为同一群细胞,表达早期标志cd38,不表达特异性t系标志ccd3和髓系标志cd117。丁管除了cd45/ssc和cd34/ssc检测到与前三管同一群原始细胞以外,不表达特异性髓系标志mpo、cd64、cd14、cd42a。戊管a组(30岁以上)cd45/ssc、cd19/ssc设门可以检测到与前四管同一群肿瘤细胞。戊管b组(小于30岁)cd45/ssc、cd19/ssc、cd34/ssc设门可以检测到与前四管同一群肿瘤细胞。均不表达成熟b系标志cκ或cλ。
42.③
t
‑
all:甲管、丙管是筛查/诊断这类疾病的关键。甲管除了cd45/ssc设门的原始细胞孔、cd45dim/cd7、cd45dim/cd5设门均能检测到一群肿瘤细胞,比例20%以上。乙管中cd45/ssc设门均检测到与甲管同一群肿瘤细胞,不表达髓系标志cd16、cd11b。丙管中cd45/ssc、ccd3/ssc、tdt/ssc、均能检测到一群明显的肿瘤细胞,与甲乙管检测到的为同一群细胞,表达早期标志cd38,不表达特异性b系标志cd22。丁管除了cd45/ssc检测到与前三管同一群原始细胞以外,不表达特异性髓系标志mpo、cd64、cd14、cd42a。戊管a组(30岁以上)cd45/ssc设门原始细胞孔内可以检测到与前四管同一群肿瘤细胞。戊管b组(小于30岁)cd45/ssc设门可以检测到与前四管同一群肿瘤细胞。
43.④
alal:根据上述方法找到肿瘤细胞,并且锁定标志表达情况,根据egil急性白血病系别判定方案(1995)和who诊断标准(2008/2017)进行判断,如果出现系别标志过多表达,达到mpal标准(满足egil诊断标准和who诊断标准之一即可),则考虑mpal;如果只表达1个以下非特异性系别标志,考虑aul;介于两者之间为非特指型alal。
44.⑤
b
‑
lbl和b
‑
all相似,t
‑
lbl和t
‑
all相似,差异只是髓外累及为主,骨髓肿瘤细胞比例<20%。
45.⑥
bpdcn:甲管、乙管、戊管a组是诊断此类疾病的关键。甲管和戊管a组的cd45dim或
‑
/cd56+设门会发现肿瘤细胞,甲管cd4/ssc和乙管的cd45dim/hla
‑
dr也可以发现同一群肿瘤细胞。可以在每管的cd45/ssc原始细胞孔检测到肿瘤细胞,肿瘤细胞表达cd4dim、cd56、hla
‑
dr。
46.⑦
急性巨核细胞白血病(aml
‑
m7):丁管是筛查/诊断此类疾病的关键。丁管cd45/cd42a发现肿瘤细胞群,与血小板不同的是细胞fsc大于淋巴细胞,fsc/ssc有明显重心,可以在每管的cd45/ssc原始细胞孔检测到肿瘤细胞。
47.(2)淋巴瘤的诊断:淋巴瘤分成高比例和低比例,绝大多数累及骨髓的都是低比例情况。具体可参照以下方式判断:
①
b
‑
clpd:戊管是筛查/诊断这类疾病的关键。甲管,肿瘤细胞高比例的b
‑
clpd会出现cd45/ssc设门淋巴细胞门比例升高,淋巴细胞门内,cd2/cd7、cd3/cd5、cd4/cd8、cd4/cd3、cd3/cd56图片中表达cd3、cd2、cd7、cd4、cd8、cd56的各群t和nk细胞占淋巴细胞比例减低,提示有一群成熟淋巴细胞不表达t和nk标志。乙管,肿瘤细胞高比例的b
‑
clpd会出现与甲管相同的cd45/ssc设门淋巴细胞门比例升高。丙管,肿瘤细胞高比例的b
‑
clpd会出现与甲乙管相同的cd45/ssc设门淋巴细胞门比例升高,cd22/ssc设门可见明显的肿瘤细胞群,不表达髓系标志cd117、t系标志ccd3和早期标志cd34、tdt、cd38(除非有浆细胞分化的小b淋巴瘤或者侵袭性b细胞淋巴瘤burkitt或者弥漫大b淋巴瘤)。丁管,肿瘤细胞高比例的b
‑
clpd会出现与前三管相同的cd45/ssc设门淋巴细胞门比例升高。戊管a组(30岁以上)cd19/ssc、cd20/ssc设门可以一群肿瘤细胞(之所以双设门,是防止5%左右的b
‑
clpd丢失其中一个标志,cd19、cd20特殊靶向治疗后该比例高达13
‑
100%),根据亚型的不同,分别表达cd5(慢性淋巴细胞白血病、套细胞淋巴瘤、cd5+其他小b淋巴瘤和弥漫大b淋巴瘤)、cd10(滤泡淋巴瘤、burkitt淋巴瘤、cd10+弥漫大b淋巴瘤)、cd38(有浆细胞分化的小b淋巴瘤或者侵袭性b细胞淋巴瘤burkitt或者弥漫大b淋巴瘤)或者均不表达(其他b细胞淋巴瘤),单克隆性表达cκ或者cλ,或者均不表达,不表达nk系标志cd56。戊管b组(小于30岁)cd19/ssc、cd20/ssc设门可以一群肿瘤细胞(之所以双设门,是防止5%左右的b
‑
clpd丢失其中一个标志,cd19、cd20特殊靶向治疗后该比例高达13
‑
100%),根据亚型的不同,分别表达cd10(滤泡淋巴瘤、burkitt淋巴瘤、cd10+弥漫大b淋巴瘤)、cd38(有浆细胞分化的小b淋巴瘤或者侵袭性b细胞淋巴瘤burkitt或者弥漫大b淋巴瘤)或者均不表达(其他b细胞淋巴瘤),单克隆性表达cκ或者cλ,或者均不表达,不表达早期标志cd34。
48.②
pcn:戊管是筛查/诊断这类疾病的关键。丙管cd38bri/ssc和/或cd45设门可以检测到浆细胞。戊管a组(30岁以上)是诊断浆细胞肿瘤的重点,cd38bri/ssc和/或cd45设门可以检测到浆细胞,大多数异常表达cd56,此时cd45/cd56设门会检测到同一群肿瘤细胞。正常浆细胞表达cd19、cd45,不表达cd56,因为是多克隆,所以cκ/cλ=0.5
‑
2。肿瘤性浆细胞不表达cd19和cd45,异常表达cd56,表单克隆性表达cκ或者cλ,或者均不表达,少数病例异常获得cd20。
49.③
t
‑
clpd:甲管是筛查/诊断这类疾病的关键。cd45/ssc设门淋巴细胞门比例正常或者升高,淋巴细胞门内,cd2/cd7、cd3/cd5、cd4/cd8、cd4/cd3、cd3/cd56图片中,关系发生异常。t
‑
clpd时会出现下述一个以上异常,其中必须有的是cd4、cd8的异常:
①
t细胞抗原(如cd2、cd3、cd5或者cd7)中的1个或者以上丢失;
②
正常表达的抗原荧光强度改变,包括增强和减弱;
③
cd4、cd8亚群发生改变,出现单阳性细胞群,或者cd4+/cd8+或者cd4
‑
/cd8
‑
细胞群占t细胞比例明显升高;
④
正常情况下少量表达或者不表达的抗原出现一致性表达:cd117和/或cd56全表达等。乙管、丙管、丁管、戊管,肿瘤细胞高比例的t
‑
clpd会出现与甲管相同的cd45/ssc设门淋巴细胞门比例升高。但是需要注意,t
‑
clpd可能会因为肿瘤细胞
cd45强度和ssc改变导致肿瘤细胞出现在cd45/ssc的淋巴细胞门以外,所以需要借助甲管的cd45/cd7和cd45/cd5、丙管的cd45/ccd3修正淋巴细胞门,确定所有表达这三个标志之一的细胞都在淋巴细胞门内。
50.④
nk
‑
clpd:与t
‑
clpd相似,甲管是筛查/诊断这类疾病的关键。cd45/ssc设置的淋巴细胞门比例正常或者升高,淋巴细胞门内,cd2/cd7、cd3/cd5、cd4/cd8、cd3/cd56图片中,关系发生异常。nk
‑
clpd时会出现下述一个以上异常,其中必须有的是cd8的异常:
①
cd2、cd7中的1个丢失;
②
正常表达的抗原荧光强度改变,包括增强和减弱;
③
cd8表达发生改变,出现全部阴性或者全部阳性;
④
正常情况下少量表达或者不表达的抗原出现一致性表达:如cd117全表达。乙管、丙管、丁管,肿瘤细胞高比例的nk
‑
clpd会出现与甲管相同的cd45/ssc设门淋巴细胞门比例升高。戊管a组使用ssc/cd56设门,肿瘤细胞比例高的可以检测到肿瘤细胞。需要注意的是,nk
‑
clpd可能会因为肿瘤细胞cd45强度和ssc改变导致肿瘤细胞出现在cd45/ssc的淋巴细胞门以外,所以需要借助甲管和戊管a组的cd56/ssc设门,寻找sscbri和/或cd56bri的肿瘤细胞,防止漏诊。
51.(3)慢性髓系肿瘤,包括mds、mpn、mds/mpn、肥大细胞增多症、嗜酸性粒细胞增多相关疾病等。甲管和乙管是诊断/筛查此类疾病的关键。与aml相似的地方是髓系原始细胞的设门和异常表达,不同的地方是因为原始细胞比例<20%,绝大多数<5%,所以不能每管都发现肿瘤细胞,异常的细胞也不止局限于髓系原始细胞,需要同时观察髓系发育阶段细胞,如分化阶段粒细胞(gra门)、单核细胞(mono门)、有核红细胞(nec门),少数类型如伴有5q
‑
染色体异常的mds还会出现丁管cd45/cd42a设门血小板和巨核细胞增多。甲管使用cd117/ssc设门,5
‑
30%的病例会出现t和nk标志1
‑
2个异常表达:cd7和/或cd56、cd2、cd5、cd4。乙管丙管cd34/ssc、cd117/ssc、乙管cd45/hla
‑
dr设门观察髓系原始细胞,cd13/cd34、cd33/cd34、cd13/cd33、cd13/hla
‑
dr、cd34/hla
‑
dr、cd33/hla
‑
dr、cd34cd117、cd38/cd34等会发现与正常髓系原始细胞不同的异常表达模式。乙管cd45/ssc设置的粒细胞门,cd16/cd13、cd13/cd11b、cd16/cd11b的组合表达模式会出现与正常骨髓不同的表达模式,并且可能会出现粒细胞门比例减低(正常占有核细胞50
‑
70%),以及因为粒细胞的ssc减低导致甲乙丙丁戊每管cd45/ssc的粒细胞门(gra)左移,与单核细胞门(mono)界限不清楚。乙管和丁管cd45/ssc设置的单核细胞门(mono)内细胞,会出现hla
‑
dr/cd11b和/或cd14/cd64组合表达模式与正常标本不同。戊管的贡献是,正常标本几乎都有或多或少正常增生的早期b祖细胞,而mds这类疾病b祖细胞明显减少。
52.肥大细胞肿瘤极为罕见,主要甲管、乙管、丙管的cd117bri/ssc设门发现肥大细胞比例升高,如果甲管出现cd2异常表达,诊断相对简单,如果没有异常表达cd2,一般会加做cd25和cd69,并结合临床表现和其他实验室检查明确诊断。
53.正常骨髓中嗜酸性粒细胞占有核细胞0.5
‑
5%,如果增多,需要注意慢性嗜酸性粒细胞白血病、pdgfra重排或者pdgfrb重排或者fgfri异常相关肿瘤等肿瘤性疾病,寄生虫或者过敏等原因引起的特发性嗜酸性粒细胞增多。鉴别要点是除了嗜酸性粒细胞增多,是否存在其他髓系或者淋系异常。如果存在,为肿瘤相关的嗜酸性粒细胞增多,如果单纯嗜酸性粒细胞增多,考虑为特发性。
54.(4)夜间阵发性睡眠性血红蛋白尿(paroxysmal nocturnal hemoglobinuria,pnh):乙管和丁管是筛查/诊断此类疾病的关键。甲管、丙管、戊管没有异常。乙管cd45/ssc
设置粒细胞门(gra)细胞部分丢失cd16,并且粒细胞cd16的丢失部分是特征性弱阳性而非完全阴性,同时丁管的cd45/ssc设置单核细胞门(mono)内的细胞部分丢失cd14。必要时结合cd55、cd59、flaer检测。
55.(5)各种转移癌累及骨髓和/或外周血,包括上皮来源实体瘤和神经肌肉来源的实体瘤:甲管、戊管a组是筛查此类疾病的关键。cd45dim或
‑
/cd56+设门检测到肿瘤细胞群,除了少数病例可以异常表达cd117,绝大多数病例不表达任何血细胞标志,包括cd38。比例高的病例可以通过cd45/ssc在粒细胞门下面找到cd45dim或
‑
/sscbri的肿瘤细胞,检测的五管涉及的各种系别和阶段标志都是阴性,进一步确诊需要加做gd2、cd326、cytokeratin,表达后两个标志考虑上皮来源的转移癌,后两者阴性考虑非上皮来源的可能性大,表达gd2多见于神经母细胞瘤。
56.(6)癌前病变:mbl和mgus:戊管是诊断/筛查此类疾病的关键。mbl的表型同b
‑
clpd,只是肿瘤细胞数少(外周血中低于5x109/l),没有淋巴瘤相关临床表现。mgus的免疫表型同pcn,只是比例低,尤其是浆细胞门内,存在正常的浆细胞,比例超过浆细胞的3
‑
5%,并且没有pcn的临床表现。
57.(7)某些罕见的正常人多态性如fcγ受体iiiβ基因突变:乙管是筛查/诊断此类疾病的关键。其他四管细胞免疫表型均正常。乙管cd45/ssc设门粒细胞门(gra)细胞全部丢失cd16,并且粒细胞cd16的丢失是完全阴性,除此之外,没有其他任何异常。
58.(8)再生障碍性贫血(aplastic anemia,aa),包括纯红细胞aa:如果甲管、乙管、丙管、丁管、戊管b组的cd34/ssc、cd117/ssc、hla
‑
dr/cd45dim、tdt/ssc均提示原始细胞比例极低,并且没有其他异常表达,每管cd45/ssc均提示粒细胞比例减低,并且乙管cd45/ssc设门观察粒细胞门(gra),以cd16+/cd11b+成熟阶段细胞为主,缺乏早期阶段细胞,每管cd45/ssc设门有核红细胞(nec)比例明显减低,排除取材原因,则提示aa。如果原始细胞和粒细胞均正常,尤其是还存在增生b祖细胞,但是有核红细胞比例明显减低(<1%),高度提示纯红再障。
59.(9)其他免疫细胞亚群异常,包括原发性原发免疫缺陷病(primary immunodeficiency diseases,pids)或者药物、感染等引发的免疫细胞亚群异常。甲管、丙管、戊管是诊断此类疾病的关键。正常成熟淋巴细胞门(lym)内,t细胞占比35
‑
85%,nk细胞5
‑
39%,b细胞占3
‑
20%,cd4/cd8=0.5
‑
2.5。如果比例发生严重失衡,并且根据之前clpd的诊断标准排除淋巴瘤,考虑免疫缺陷或者药物引起的免疫细胞亚群异常。
60.综上所述,本发明提供了一步法筛查和/或诊断克隆性疾病的试剂组合物及其应用。本发明优势在于:(1)基于对大量肿瘤、克隆性疾病、癌前病变、正常多态性、免疫缺陷等疾病的认识,设计了一套覆盖非常全面的一步法方案,最大程度降低了漏诊率。(2)在应用方面,使用复杂的多种标志组合设门,除了防止漏诊以外,还有助于发现两种疾病并存、特殊克隆及弱势克隆,对于深入了解肿瘤的复杂性,做出精确诊断,有非常重大的意义。(3)本发明采取一步法快速筛查/诊断,方案固定后可以预混抗体,大大降低了工作量,提高了工作效率,加快了报告时间,提高了实验室的效益,临床患者可以早期获得精确诊断采取合适治疗,从而提高缓解率和存活率,具有极大的社会意义。(4)长期以来制约流式细胞室发展的一个很重要的原因是方案个体化、手工操作过多,导致难以实现自动化、标准化、规范化,使用本发明的一步法筛查/诊断方案,为后续样本前处理机、流式细胞仪的自动上样、数据
分析的固定化,尤其是为将来人工智能的发展创造了条件。而实验室的自动化、规范化、智能化,是流式细胞术发展的必然方向。(5)便于积累数据和经验。流式细胞术是一个经验科学,相对规范化、统一化的方案,便于人员迅速形成条件反射,在短时间内获得大量经验,加快人员培养速度。(6)传统的两步法是基于对第一步的判断,而第一步筛查做的抗体有限,在肿瘤细胞比例低、存在两种或者更多肿瘤细胞的情况下,第二步完全依赖第一步的及时、正确的判断,这样对第一步的判断人员要求极高,很有可能出现判断失误导致无法做出正确诊断或者浪费大量抗体才能做出正确诊断的事情。故本发明是目前临床流式细胞术诊断急需的,非常适合广泛应用推广的一步法筛查/诊断克隆性疾病、癌前病变、正常人多态性、和免疫缺陷的检测和分析方案。(7)本发明中每管各有侧重点,绝大多数管都重复使用了原始细胞标志设门,从客观上做到了:
①
在mds、mpn、mds/mpn、肥大细胞肿瘤、嗜酸性粒细胞增多、t
‑
lbl、b
‑
lbl、mpal出现低比例弱势克隆等低比例恶性原始细胞的时候,做到精确锁定肿瘤细胞,每管互相验证,最大限度发现更多的异常,排除低比例可能出现的假象导致误诊;
②
有助于慢性髓系肿瘤与aa、纯红aa、pnh、fcγ受体iiiβ的鉴别,做到精确诊断。而保证每个系别、每个阶段至少两个标志,重要标志重复使用,客观上是为了最大限度防止恶性肿瘤尤其是急性白血病时容易出现系别标志紊乱表达造成误诊。从主观上,防止复杂的流式细胞术操作中的人为错误引起误诊和漏诊,如加错抗体、个别抗体质量不过关、仪器条件设置不当等。
附图说明
61.图1
‑
图5显示本发明一具体实施方案中正常骨髓标本流式细胞术设门分析结果。
62.图6
‑
图10显示本发明一具体实施方案中急性白血病(aml)病例的骨髓标本流式细胞术设门分析结果。
63.图11
‑
图15显示本发明一具体实施方案中fcγ受体iiiβ基因突变病例的骨髓标本流式细胞术设门分析结果。
64.图16
‑
图20显示本发明一具体实施方案中转移癌(神经母细胞瘤)合并mbl病例的骨髓标本流式细胞术设门分析结果。
具体实施方式
65.为了对本发明的技术特征、目的和有益效果有更加清楚的理解,现对本发明的技术方案进行以下详细说明,但不能理解为对本发明的可实施范围的限定。
66.实施例1 试剂的配制本实施例使用的抗体组合为,第一组分为:第一组抗体包括:抗cd7抗体、抗cd117抗体、抗cd3抗体、抗cd4抗体、抗cd5抗体、抗cd8抗体、抗cd56抗体、抗cd45抗体和抗cd2抗体,各抗体的荧光素标记顺序为fitc、pe、percp
‑
cy5.5、pe
‑
cy7、apc、apc
‑
cy7、bv421、v500和bv605;取以上九种单克隆抗体试剂按体积比5:5:5:3:2:3:3:3:3的体积比混合装于第一容器中;第二组分为:抗cd16抗体、抗cd117抗体、抗cd34抗体、抗cd13抗体、抗cd33抗体、抗hla
‑
dr抗体、抗cd11b抗体和抗cd45抗体,各抗体的荧光素标记顺序为fitc、pe、percp
‑
cy5.5、pe
‑
cy7、apc、apc
‑
cy7、bv421和v500;以上八种单克隆抗体试剂按照5:5:5:3:2:3:3:
3的体积比混合,装于第二容器中;第三组组分为:抗cd22抗体、抗cd34抗体、抗cd117抗体、抗cd38抗体和抗cd45抗体,各抗体的荧光素标记顺序为pe、percp
‑
cy5.5、pe
‑
cy7、bv421和v500;按照5:5:3:3:3的体积比混合的混合物,装于第三容器中;第四组分为抗cd64抗体、抗cd34抗体、抗cd42a抗体、抗cd14抗体和抗cd45抗体,各抗体的荧光素标记顺序为pe、percp
‑
cy5.5、apc、apc
‑
cy7和v500;按照5:5:2:3:3的体积比混合的混合物,装于第四容器中;第五组分包括a组分和/或b组分,其中a组分用于30岁以上检测对象,为抗cd38抗体、抗cd19抗体、抗cd10抗体、抗cd20抗体、抗cd56抗体、抗cd45抗体和抗cd5抗体,各抗体的荧光素标记顺序为percp
‑
cy5.5、pe
‑
cy7、apc、apc
‑
cy7、bv421、v500和bv605,按照5:3:2:3:3:3:3的体积比混合,装于第五容器中。b组分用于小于30岁的儿童或者青年,为抗cd34抗体、抗cd19抗体、抗cd10抗体、抗cd20抗体、抗cd38抗体和抗cd45抗体,各抗体的荧光素标记顺序为percp
‑
cy5.5、pe
‑
cy7、apc、apc
‑
cy7、bv421和v500,按照5:3:2:3:3:3的体积比混合,装于另一第五容器中;第六组分为抗胞核tdt抗体和抗ccd3抗体,各抗体的荧光素标记顺序为fitc和apc;按照2:2的体积比混合,装于第六容器中;第七组分为抗cmpo单克隆抗体,荧光素标记为fitc;装于第七容器中;第八组分为抗cκ抗体和抗cλ抗体多克隆抗体,各抗体的荧光素标记顺序为fitc和pe;按照2:2的体积比混合,装于第八容器中。
67.本实施例中的抗体为可商购获得,其中,tdt
‑
fitc、ccd3
‑
apc为美国beckman coulter公司产品,ccd79a
‑
apc为四正柏公司产品,cκ
‑
fitc、cλ
‑
pe多克隆抗体为丹麦dako公司产品,cd16
‑
fitc为美国becton dickinson公司pharmingen产品线克隆号为3g8的针对泛fcγ受体iii类抗原的单克隆抗体,其余荧光素直接标记抗体均为美国becton dickinson公司产品。
68.任选再配溶血素装于第九容器中,破膜剂a液装于第十容器中,破膜剂b液装于第十一容器中,pbs缓冲液装于第十二容器中,溶血素、破膜剂、pbs缓冲液为可商购获得,其中,细胞裂解液、破膜剂均为美国becton dickinson公司产品,pbs缓冲液为beckman coulter公司产品。
69.实施例2 标本的处理按照细胞计数结果,将肝素或edta抗凝的骨髓或外周血样本,加入到流式管甲管中,保证加入的细胞量约为2
×
106个,再按表1向流式管中加入32μl不同荧光素标记的九种胞膜单克隆抗体试剂,与细胞悬液充分混匀后常温避光孵育15分钟,加入3ml 1
×
溶血素,避光孵育10分钟裂解红细胞,1500rpm离心5分钟去上清后,加入3ml pbs混匀,1500rpm离心5分钟去上清后,加入0.5ml pbs缓冲液重悬细胞,即为处理好的标本,可供上机检测。
70.按照细胞计数结果,将肝素或edta抗凝的骨髓或外周血样本,加入到流式管乙管中,保证加入的细胞量约为2
×
106个,再按表1向流式管中加入29μl不同荧光素标记的八种胞膜单克隆抗体试剂,与细胞悬液充分混匀后常温避光孵育15分钟,加入3ml 1
×
溶血素,避光孵育10分钟裂解红细胞,1500rpm离心5分钟去上清后,加入3ml pbs混匀,1500rpm离心5分钟去上清后,加入0.5ml pbs缓冲液重悬细胞,即为处理好的标本,可供上机检测。
71.按照细胞计数结果,将肝素或edta抗凝的骨髓或外周血样本,加入到流式管丙管中,保证加入的细胞量约为2
×
106个,再按表1向流式管中加入19μl不同荧光素标记的第三容器五种胞膜单克隆抗体试剂,与细胞悬液充分混匀后常温避光孵育15分钟,加入100μl a液,室温避光孵育5分钟,加入3ml 1
×
溶血素混匀,避光孵育10分钟裂解红细胞,1500rpm离心5分钟去上清后加入50μl b液和2μl胞浆单克隆抗体试剂tdt
‑
fitc、2μl胞浆抗体cd3
‑
apc,室温避光孵育15分钟,最后加入3ml pbs缓冲液混匀,1500rpm离心5分钟后去上清,用0.5ml pbs缓冲液重悬细胞,即为处理好的标本,可供上机检测。
72.按照细胞计数结果,将肝素或edta抗凝的骨髓或外周血样本,加入到流式管丁管中,保证加入的细胞量约为2
×
106个,加入3ml pbs混匀置于37度水浴箱孵育5分钟,1500rpm离心5分钟去上清后,再次加入3ml pbs混匀置于37度水浴箱孵育5分钟,1500rpm离心5分钟去上清后,再次加入3ml pbs混匀,1500rpm离心5分钟去上清后,再按表1向流式管中加入18μl不同荧光素标记的第四容器五种胞膜单克隆抗体试剂,与细胞悬液充分混匀后常温避光孵育15分钟,加入100μl a液,室温避光孵育5分钟,加入3ml 1
×
溶血素混匀,避光孵育10分钟裂解红细胞,1500rpm离心5分钟去上清后加入50μl b液和5μl胞浆单克隆抗体试剂mpo
‑
fitc,室温避光孵育15分钟,最后加入3ml pbs缓冲液混匀,1500rpm离心5分钟后去上清,用0.5ml pbs缓冲液重悬细胞,即为处理好的标本,可供上机检测。
73.按照细胞计数结果,将肝素或edta抗凝的骨髓或外周血样本,加入到流式管戊管中,保证加入的细胞量约为2
×
106个,加入3ml pbs混匀置于37度水浴箱孵育5分钟,1500rpm离心5分钟去上清后,再次加入3ml pbs混匀置于37度水浴箱孵育5分钟,1500rpm离心5分钟去上清后,再次加入3ml pbs混匀,1500rpm离心5分钟去上清后,再按表1向流式管中加入22μl不同荧光素标记的第五容器a组七种胞膜单克隆抗体试剂(小于30岁加入19μl不同荧光素标记的第五容器b组六种胞膜单克隆抗体试剂),与细胞悬液充分混匀后常温避光孵育15分钟,加入100μl a液,室温避光孵育5分钟,加入3ml 1
×
溶血素,避光孵育10分钟裂解红细胞,1500rpm离心5分钟去上清后加入50μl b液和2μl胞浆多克隆抗体κ
‑
fitc和2μl胞浆多克隆抗体λ
‑
pe室温避光孵育15分钟,最后加入3ml pbs缓冲液混匀,1500rpm离心5分钟后去上清,用0.5ml pbs缓冲液重悬细胞,即为处理好的标本,可供上机检测。
74.表1:一步法筛查/诊断克隆性疾病的抗体组合物
实施例3 标本的检测将按照实施例2的方法处理好的标本,在美国becton dickinson公司3激光10色facs canto plus流式细胞仪上机检测,优选获取每管100万细胞(建议至少30万)后,使用diva 2.8软件或者kaluza等其他软件分析数据。
75.其中,流式细胞上机检测时按照以下方式设门:
①
固定设门:依次进行去除黏连细胞门、活细胞门、血细胞门;
②
多标志组合设门:从单个活细胞开始进行,为了防止漏掉肿瘤细胞,所有细胞的设门和界定,都需要与血细胞门在并列条件下进行;
③
在多标志组合设门内,显示各种标志组合的常见表达模式和发育模式,根据与正常细胞的不同,找出肿瘤细胞;或者出现正常标本中没有的幼稚t细胞或者幼稚nk细胞、原始幼稚巨核细胞或者转移癌细胞;或者出现粒细胞丢失cd16,或者出现免疫细胞亚群的比例失衡;或者缺乏原始细胞,发育阶段粒细胞比例减低,有核红比例减低,或者单纯有核红细胞比例明显减低(<1%)。具体地:1. 固定设门:由去黏连细胞门、活细胞门、血细胞门组成。呈串联关系。
76.去黏连细胞门:首先使用前向角光散射(forward scatter,fsc)的面积(area,a)和高度(height,h)设置去黏连细胞门(常用p1表示),通过fsc
‑
面积(area,a)/高度
(height,h)可以去除粘连细胞,原理是细胞是球形,a与h成正相关。(见图1
‑
图20中最上排从左至右第一张设门图片)。
77.活细胞门:p1内细胞,使用fsc/侧向角光散射(side scatter,ssc)设置活细胞门(常用p2表示),得到单个活细胞。fsc/ssc原理是活细胞大小和颗粒性呈近正态分布,围绕一个中心聚集成团,与死细胞、凋亡细胞、碎片及背景噪音有明显界限。(见图1
‑
图20中最上排从左至右第二张设门图片)血细胞门:单个活细胞门(p2门)内常规首先使用cd45/ssc设置各血细胞门,大致观察淋巴细胞、单核细胞、粒细胞、有核红细胞,以及是否存在明显的肿瘤细胞或者异常细胞。通过cd45/ssc将各群血细胞进行大致区分,原理是根据造血细胞cd45表达荧光强度不同(成熟淋巴细胞>单核细胞>粒细胞>有核红细胞),ssc大小差异(嗜酸性粒细胞>粒细胞>单核细胞>成熟淋巴细胞>有核红细胞)(见图1
‑
图20中最上排从左至右第三张设门图片)。目的是防止在误诊或者肿瘤演化之后,漏掉大的肿瘤细胞群,以及设定内对照。
78.2. 多标志组合设门:与cd45/ssc设门同步进行,从单个活细胞(p2)开始。
79.每管有不同的观察目的:甲管主要观察t、nk、髓系原始细胞,以及是否存在cd45dim或
‑
/cd56+的肿瘤细胞(转移癌、部分浆细胞肿瘤、bpdcn、部分急性巨核细胞白血病等),选择cd45/ssc、cd45dim或
‑
/cd56+、cd117/ssc、cd117bri/ssc、ssc/cd56、ssc/cd4设门,并使用cd45/cd7、cd45/cd5、ssc/cd56修正淋巴细胞门,ssc/cd4修正单核细胞门,并注意是否存在cd45dim/cd7+、cd45dim/cd5+、sscbri/cd56bri的细胞;乙管主管观察髓系原始细胞,以及粒细胞、单核细胞发育是否存在异常,使用cd45/ssc、cd117/ssc、cd117bri/ssc、cd34/ssc、hla
‑
dr/cd45设门,并使用cd11b/hla
‑
dr修正单核细胞门,如果没有cd11b+/hla
‑
dr+单核细胞在cd45/ssc设门的单核细胞门以外,不再另外设门;丙管主要观察原始细胞的系别,使用cd45/ssc、cd117/ssc、cd117bri/ssc、cd34/ssc、tdt/ssc、cd22/ssc、cd45/ccd3设门;丁管主要观察单核细胞是否为幼稚单核以及是否存在异常原始幼稚巨核细胞,使用cd45/ssc、cd42a/cd45、cd34/ssc设门;戊管主要观察b细胞和浆细胞是否存在异常,因为小于30岁几乎没有浆细胞肿瘤,而b
‑
all/lbl比较常见,因此采用a组b组不同试剂的两种方案,30岁以上成人使用cd45/ssc、cd45dim或
‑
/cd56+、cd19/ssc、cd20/ssc、cd38bri/ssc和/或cd38bri/cd45设门(小于30岁个体使用cd45/ssc、cd19/ssc、cd20/ssc、cd38bri/ssc和/或cd38bri/cd45、cd34/ssc设门)。
80.3. 根据观察标志组合精确锁定目的细胞关于急性白血病的诊断:正常骨髓中有比例不定的正常增生的b祖细胞(图5)和髓系原始细胞(图1
‑
图4),绝大多数情况下,比例低于有核细胞(p2)的5%,虽然儿童或者化疗后或者受到其他因素刺激,这些早期细胞可能会出现比例明显升高(尤其是b祖细胞,文献报道最高达到71%),从而导致误诊为肿瘤细胞的判断。但是通过本发明的标志组合设计,可以准确判断增生的细胞还是肿瘤细胞,增生细胞不论是b系还是髓系,都会在不同发育阶段,表达标志的出现与消失、表达强度、组合表达模式遵循严格的规律性。
81.(1)造血干细胞和髓系祖细胞免疫表型
①
造血干细胞(hsc):cd34+、cd38
‑
/弱表达。
82.②
定向祖细胞:cd34++、hla
‑
dr++、cd38++。
83.③
髓系祖细胞:cd34++、cd117+、hla
‑
dr++、cd13+、cd33+、mpo
‑
/+。
84.④
b系祖细胞:cd34++、cd38++、hla
‑
dr++、tdt+、cd19+、cd22+、cd10++。
85.正常骨髓中不存在t系祖细胞,t
‑
all的免疫表型为tdt+、cd34+、ccd3+、cd7+。
86.(2)粒系细胞免疫表型粒系细胞的分化抗原包括mpo、cd33、cd13、cd117、cd64、cd11b、cd16。mpo是粒系相对特异的标志;cd33、cd13表达于粒单系各阶段细胞,但随着细胞的发育,表达强度有所改变;cd34仅在原始粒细胞上表达,cd117和hla
‑
dr的表达起于原始粒细胞,但止于早幼粒细胞早期;cd11b表达于中幼粒细胞以后各阶段的中性粒细胞、嗜碱性粒细胞、嗜酸性粒细胞和单核细胞;cd16、cd10主要表达于成熟粒细胞。正常骨髓中粒细胞占有核细胞50
‑
70%,使用cd11b/cd13、cd16/cd13、cd16/cd11b观察粒细胞发育模式,呈现顺序性规律变化。
87.(3)单核系细胞免疫表型单核细胞系分化抗原包括cd33、cd13、cd4dim、hla
‑
dr、cd64、cd11b、cd14。cd33、cd13表达于单核系各阶段细胞,单核细胞表达cd4,但荧光强度明显弱于正常cd4+t细胞。hla
‑
dr也表达于单核系各阶段细胞。cd64、cd11b在幼单阶段开始表达,cd14强表达于成熟单核细胞,弱表达于幼稚单核细胞,不表达于原始细胞。正常骨髓中单核细胞占有核细胞2
‑
20%,基本上均为cd14+的成熟阶段单核细胞。
88.(4)巨核细胞系免疫表型巨核细胞的分化抗原包括cd41、cd42a、cd42b、cd61。本案发明人在前期研究中总结了2012年4月
‑
2017年4月诊断的120例急性巨核细胞白血病免疫表型(表2),发现cd42a是所有巨核标志中覆盖率最高的标志,达到100%,因此使用cd42a进行筛查。正常骨髓中巨核细胞比例极低,并且体积大,流式细胞术很少检测到。需要注意cd42a+可能为血小板黏附,本发明中可以重复37度孵育洗涤的方法,以尽可能除去血小板沾染造成的假阳性。与血小板的识别方法是fsc/ssc图上,血小板没有重心,且fsc小于正常淋巴细胞和有核红细胞,而巨核细胞fsc大于淋巴细胞,甚至大于粒细胞。
89.表2:120例急性巨核细胞白血病常见免疫学标志表达情况(5)b淋巴细胞系免疫表型泛b抗原有cd19、cd22(pe标记的胞膜或者胞浆)。cd34和tdt表达于早前b细胞和前b细胞,并随着细胞成熟,逐渐减弱直至消失;cd10、cd38在早前b细胞阶段呈现强表达,前b细胞呈现表达,并随着细胞成熟,逐渐减弱直至消失,分化为浆细胞时又出现cd38强表达(bri);与此同时,cd20开始表达并逐渐增强,成熟阶段b细胞表达轻链κ或者λ,两者比值0.5
‑
2。
90.(6)t淋巴细胞系免疫表型泛t抗原有ccd3、cd7、cd2和cd5。原始阶段t细胞表达tdt、cd34,胸腺皮质阶段t细胞表现为cd4/cd8双阳性、cd3阴性或者弱表达(dim)。成熟t4亚群表现为cd2、cd3、cd4、cd5、cd7阳性;t8亚群表现为cd2、cd3、cd5、cd7、cd8阳性;t细胞中5~10%为tcrγ/δ阳性t细胞,表达cd2、cd3bri、cd5、cd7,部分弱表达cd8,不表达cd4。
91.急性白血病免疫分型的初步判定指标:
①
恶性原始细胞占有核细胞20%以上,表达早期标志(cd34、hla
‑
dr、tdt)或者不表达成熟标志(粒细胞不表达cd11b、cd16,单核细胞不表达或者弱表达cd14,b细胞不表达正常分布的cκ、cλ,t细胞不表达正常分布和强度的cd4和cd8);
②
单一系别白血病细胞通常表达2个及以上该系别抗原:髓系:mpo、cd13、cd33、cd117、cd11b、cd14、cd64;b系:cd19、cd22、cd10、cd20;t系:cd2、ccd3、cd5、cd7、cd4、cd8、cd3。
③
3%
‑
5%的概率出现急性混合细胞白血病,肿瘤细胞表达上述两个系别及两系以上的抗原。
92.成熟淋巴细胞肿瘤包括成熟b淋巴细胞肿瘤、成熟t淋巴细胞肿瘤及成熟nk淋巴细胞肿瘤等,成熟髓系细胞肿瘤包括mds、mpn、mds/mpn等。
93.成熟b淋巴细胞肿瘤表达成熟b细胞标志和轻链κ或者λ,不表达不成熟标志(如tdt、cd34或者cd45弱表达)。肿瘤性b细胞免疫表型与正常成熟b细胞免疫表型的不同,主要表现为免疫球蛋白轻链限制性、异常抗原表达(如异常表达cd5、cd10、cd38等)、正常b细胞标志(cd19、cd20、cd22)表达强度异常、fsc或者ssc或者cd45表达强度改变等。轻链限制性判定:
①
κ:λ>3:1或者<0.3:1;
②
或者25%以上的b细胞不表达或者低水平表达膜免疫球蛋白。
94.正常浆细胞在骨髓中比例0.5%
‑
2%左右,发热、自身免疫性疾病、aa、骨髓纤维化等情况可以比例升高,表达cd45和cd19,不表达cd56、cd117,cκ/cλ=0.5
‑
2%。肿瘤性浆细胞限制性表达cκ或者cλ,丢失cd45和/或cd19,或者异常获得cd56、cd117等。
95.本发明中通过对戊管的检测,可以检测常见的b
‑
all/lbl、成熟b淋巴细胞肿瘤、浆细胞肿瘤。mbl和mgus分别是成熟b淋巴细胞肿瘤和浆细胞肿瘤的癌前病变,使用戊管可以筛查/诊断。这两种癌前病变分别表现为单克隆的b细胞和单克隆浆细胞,可能伴有异常表达,与相关肿瘤的差别在于临床表现和体征以及相关实验室检测没有达到诊断标准,并且常有正常的b细胞和浆细胞做背景,这类疾病发病率高(40岁以上成人mbl发病率3.5%
‑
17%,50岁以上mgus发病率3%,70岁以上mgus发病率5%),早期筛查、健康管理或者早期治疗,将极大程度改善生存率。
96.正常成熟t细胞表达胞膜和胞浆cd3、cd5、cd2、cd7,分别表达cd4或者cd8单阳性细胞,cd4/cd8比值为0.5
‑
2.5。骨髓和外周血中t细胞不表达幼稚细胞标志tdt和/或cd34。
97.异常成熟t细胞表型:
①
丢失t细胞抗原(如cd2、cd3、cd5或者cd7);
②
正常表达的抗原荧光强度改变;
③
cd4、cd8表达异常,如单阳性表达cd4或者cd8,cd4+/cd8+或者cd4
‑
/cd8
‑
比例明显升高等;
④
异常表达非t系抗原cd13、cd20、cd10、cd117等;
⑤
正常情况下少量表达或者不表达的抗原出现一致性表达,如hla
‑
dr、cd56、cd16等。cd4+/cd8+增多要警惕t
‑
all/lbl或者t细胞淋巴瘤,cd4
‑
/cd8
‑
细胞增多要警惕自身免疫性淋巴细胞增生综合征(autoimmune lymphoproliferative syndrome,alps)。
98.本发明中,甲管和丙管主要用于检测t细胞和nk细胞。正常淋巴细胞亚群中,t细胞占比35
‑
85%,cd4/cd8=0.5
‑
2.5,b细胞3
‑
20%,nk细胞5
‑
39%,如果这些比例严重失衡,提示存在免疫缺陷或者感染、药物等原因造成的免疫失衡。
99.流式细胞术检测慢性髓系肿瘤的灵敏度大约70%,特异性90%。本发明中,甲管、乙管、丙管、丁管都可以使用cd34和/或cd117/ssc设门观察低比例髓系原始细胞是否存在异常表达,正常髓系原始细胞不表达甲管中除了cd117以外的标志,乙管、丙管中cd34/hla
‑
dr、cd34/cd13、cd34/cd33、cd13/cd33、cd13/hla
‑
dr、cd33/hla
‑
dr、cd38/cd34都会呈现规律性的发育,不表达乙管、丙管、丁管中的cd16、cd11b、cd14、cd42a、ccd3、cd22,少量涂抹表达cd64、mpo,绝大多数不表达tdt。
100.mds、mpn、mds/mpn以及肥大细胞肿瘤、嗜酸性粒细胞增多症或者嗜酸性粒细胞增多相关的髓系肿瘤、pnh、aa、fcγ受体iiiβ基因突变,虽然具有不同特点,但是在方案设计和观察方式上大同小异,也是需要互相鉴别的疾病。从观察方式上,下述情况判断异常:
①
出现正常不表达的抗原:如异常表达淋系抗原cd7和/或cd56,少数情况下还出现cd2、cd4、cd5和cd19中1
‑
2个异常表达。多见于髓系原始细胞,但是各个成熟阶段的粒细胞和单核细胞均可出现伴系表达;
②
髓系原始、粒细胞或者单核细胞抗原表达改变:包括丢失、增强、减弱;
③
髓系原始细胞或者发育阶段粒细胞ssc减低,提示脱颗粒;
④
髓系发育异常,主要表现在乙管粒细胞的cd16/cd11b、cd11b/cd13、cd16/cd13发育模式异常,乙管丁管单核细胞的cd11b/hla
‑
dr、cd64/cd14表达模式异常;
⑤
mds表现为增生异常为主,可能出现淋巴细胞比例增多,和/或有核红细胞比例增多。mpn表现为至少一个髓系增生为主,mds/mpn表现为兼有mds和mpn的特点,少数有小巨核细胞或者巨大血小板比例增多。
101.pnh的特点是粒细胞部分丢失cd16,并且丢失的部分是cd16dim并非完全阴性,单核细胞部分丢失cd14。fcγ受体iiiβ基因突变的特点是单核细胞cd14表达正常,粒细胞cd16是完全丢失,并且不伴有其他发育模式异常。本发明中,乙管和丁管是筛查/诊断此类疾病的关键。乙管cd45/ssc设门检测粒细胞门(gra)细胞部分丢失cd16情况,同时丁管的cd45/ssc设置单核细胞门(mono)内的细胞部分丢失cd14情况。必要时结合cd55、cd59、flaer检测。
102.aa的特点是淋巴细胞比例升高,原始幼稚细胞比例明显减低,粒细胞缺乏早期阶段,有核红细胞比例降低。本发明中,如果甲管、乙管、丙管、丁管、戊管b组的cd34/ssc、cd117/ssc、hla
‑
dr/cd45dim、tdt/ssc均提示原始细胞比例极低,并且没有其他异常表达,每管cd45/ssc均提示粒细胞比例减低,并且乙管cd45/ssc设门观察粒细胞门(gra),以cd16+/cd11b+成熟阶段细胞为主,缺乏早期阶段细胞,每管cd45/ssc设门有核红细胞(nec)比例明显减低,排除取材原因,则提示aa。如果原始细胞和粒细胞均比例和发育正常,只有有核红细胞比例明显减低,<1%,高度提示纯红aa。
103.本发明的方案除可以筛查/诊断上述疾病外,还可以筛查和诊断转移癌。正常骨髓中不存在cd45dim或
‑
/cd56+细胞,通过上述检测排除浆细胞肿瘤、急性巨核细胞白血病、以及其他白血病淋巴瘤,则高度怀疑转移癌。本发明甲管、30岁以上成人戊管使用cd45dim或
‑
/cd56+组合可以筛查到90%的累及骨髓/外周血的转移癌。加做gd2、cd326、cytokeratin可以明确诊断。
104.bpdcn是一种罕见造血系统肿瘤,免疫表型为t、b、髓系特异性标志如ccd3、cd3、cd22、mpo、cd64、cd14、cd42a均阴性,表达hla
‑
dr、cd4dim、cd56,本发明可以高灵敏度筛查该肿瘤,甲管和戊管a组的cd45dim或/cd56+设门会发现肿瘤细胞,甲管cd4/ssc和乙管的cd45dim/hla
‑
dr也可以发现同一群肿瘤细胞,可以在每管的cd45/ssc原始细胞孔检测到肿瘤细胞,肿瘤细胞表达cd4dim、cd56、hla
‑
dr。必要时可加做cd123、cd303、cd304标志确诊。
105.简而言之,本发明在多标志组合设门内,成熟t、nk淋巴细胞分别与正常t细胞、nk细胞免疫表型做比较,如果找出异常和肿瘤细胞,则可疑为t或者nk淋巴瘤;骨髓中正常情
况下不存在幼稚t和nk细胞,如果发现幼稚t细胞和nk细胞,高度可疑t
‑
all/lbl或nk
‑
all/lbl;幼稚b细胞将所显示的b细胞发育模式和表达情况与正常细胞进行比较,找出肿瘤细胞,考虑b
‑
all/lbl;成熟b细胞和浆细胞浆将所显示的细胞免疫表型与正常细胞进行比较,找出异常和可疑肿瘤细胞,进一步观察这些异常细胞的轻链表达情况,如果存在轻链限制性,则为单克隆性细胞,高度怀疑b细胞淋巴瘤、浆细胞肿瘤或者癌前病变(mbl或者mgus);髓系原始幼稚细胞将所显示的多种抗原组合表达情况与正常髓系幼稚细胞进行比较,找出肿瘤细胞,比例≥有核细胞20%考虑aml;发育阶段粒细胞和单核细胞将所显示的发育模式和抗原组合表达情况与正常细胞进行比较,找出发育模式异常,异常髓系幼稚细胞比例低于20%,且粒系、单核系发育模式异常,考虑mds或者mds/mpn,髓系增生为主的考虑mpn;常规流式细胞术方法检测正常骨髓中不存在cd45
‑
/cd56+细胞和原始幼稚巨核细胞,发现并重复确定真实存在,则高度怀疑相应肿瘤,如转移癌或者急性巨核细胞白血病;cd16丢失情况可以见于阵发性睡眠性血红蛋白尿(pnh)和髓系肿瘤等克隆性疾病,也可以见于fcγ受体iiiβ基因突变的正常人多态性,根据丢失的情况,结合相关标志进行判断。原始细胞比例明显减低,粒细胞比例减低成熟阶段为主,提示aa,单纯有核红细胞比例明显减低提示纯红aa。该方案中包括了成熟淋巴细胞亚群,如果出现与正常不同,则高度怀疑免疫异常,根据临床病史和其他检测确定原因,如原发免疫缺陷病(primary immunodeficiency diseases,pids)或者药物、感染等引发的免疫细胞亚群异常。具体地,各种急性白血病、各种成熟淋巴细胞肿瘤、慢性髓系肿瘤、夜间阵发性睡眠性血红蛋白尿、各种转移癌累及骨髓和/或外周血包括上皮来源实体瘤和神经肌肉来源的实体瘤、癌前病变、罕见的正常人多态性、再生障碍性贫血及其他免疫细胞亚群异常的具体判断方式,可参照前述描述进行。
106.本实施例中,首先选择20例正常骨髓标本进行测试,所有的正常骨髓髓系原始细胞和增生b祖细胞虽然比例不同,但是抗原出现时间、表达强度及两两组合都成规律性的分化模式,粒细胞和单核细胞、成熟淋巴细胞、浆细胞表达均严格遵循正常比例、发育规律、表达模式。
107.本实施例提供正常骨髓和急性白血病(aml)、fcγ受体iiiβ基因突变、转移癌伴有mbl各一例作为示例。图1
‑
图5为正常标本甲到戊管免疫分型,分别按照上述描述严格设门与观察。图6
‑
图10为急性白血病aml患者甲到戊管免疫分型,图11
‑
图15为fcγ受体iiiβ基因突变患者甲到戊管免疫分型,图16
‑
图20为转移癌伴mbl患者甲到戊管免疫分型。
108.具体而言,图1
‑
图5:同一病例的正常骨髓标本,5管共同分析。
109.具体而言,图1显示正常骨髓标本甲管分析。依次设置:
①
fsc
‑
a/h设置p1为去黏连细胞门,得到p1内为单个细胞;
②
在p1内显示fsc/ssc设置p2为活细胞门,得到p2内为单个活细胞;
③
p2门内使用cd45/ssc设置血细胞门,分别得到淋巴细胞(lym)、粒细胞(gra)、单核细胞(mono)、有核红细胞(nec)、嗜酸性粒细胞门(eo);
④
p2门内使用cd117/ssc设置髓系幼稚细胞门;
⑤
p2门内使用cd117bri/ssc设置肥大细胞门;
⑥
p2门内使用cd45/cd7、cd45/cd5观察是否有cd7+或者cd5+细胞在cd45/ssc设置的淋巴细胞门(lym)以外,尤其注意cd45dim/cd7+、cd45dim/cd5+细胞,该正常标本无;
⑦
p2门内使用ssc/cd56观察是否有sscbri和/或cd56bri细胞在cd45/ssc设置的淋巴细胞门(lym)以外,该正常标本无;
⑧
p2门内使用ssc中等/cd4dim设置树突状细胞和单核细胞门,正常标本中树突状细胞很少,基本上与cd45/ssc设置的单核细胞门(mono)重合;
⑨
p2门内使用cd45dim或
‑
/cd56+设门,筛查
cd45dim或
‑
/cd56+肿瘤细胞,该正常标本无;
⑩
同时显示cd117+和lym细胞,将淋巴细胞作为内对照,观察cd117+髓系幼稚细胞表达情况,正常髓系原始细胞不表达cd2、cd3、cd4、cd5、cd7、cd8、cd56;淋巴细胞门(lym)内cd2/cd7、cd4/cd3、cd4/cd8、cd3/cd5、cd3/cd56形成的各种标志组合:该标本中,淋巴细胞内t细胞为主,cd3和cd5阳性表达基本一致,又分为cd4+/cd8
‑
和cd4
‑
/cd8+两部分,比值1(正常范围0.5
‑
2.5),cd2和cd7表达基本一致,包括cd3+/cd5+t细胞和cd3
‑
/cd56+的nk细胞。nk细胞比例占淋巴细胞15%,表达cd3
‑
/cd5
‑
/cd2+/cd7+/cd4
‑
/cd8部分dim。
110.具体而言,图2显示正常骨髓标本,乙管分析。依次设置:
①
fsc
‑
a/h设置p1为去黏连细胞门,得到p1内为单个细胞;
②
在p1内显示fsc/ssc设置p2为活细胞门,得到p2内为单个活细胞;
③
p2门内使用cd45/ssc设置血细胞门,分别得到淋巴细胞(lym)、粒细胞(gra)、单核细胞(mono)、有核红细胞(nec)、嗜酸性粒细胞门(eo);
④
p2门内使用cd117/ssc设置髓系幼稚细胞门;
⑤
p2门内使用cd117bri/ssc设置肥大细胞门;
⑥
p2门内使用cd34bri/ssc中等和hla
‑
dr/cd45dim设置原始幼稚细胞门;
⑦
p2门内使用cd11b/hla
‑
dr修正单核细胞门,确定cd11b+/hla
‑
dr+细胞均在cd45/ssc设置的单核细胞门(mono)以内;
⑧
同时观察cd34+和cd117+原始幼稚细胞,正常标本中cd34+/ssc中等仅见于原始粒细胞,cd34阳性细胞比例低于cd117+和hla
‑
dr+/cd45dim的髓系幼稚细胞,并且cd13/cd33,cd34/cd13、cd33/cd34、hla
‑
dr/cd34、cd13/hla
‑
dr,cd33/hla
‑
dr、cd34/cd117呈现与该标本相似的特征性延续性表达,几乎不表达cd11b;
⑨
观察cd45dim/hla
‑
dr+幼稚细胞,确定与cd117+髓系幼稚细胞基本一致(部分病例可能因为b祖细胞多而比cd117+细胞多),没有髓系原始细胞丢失cd34和/或cd117,cd33/cd13、cd34/cd117、cd33/cd117呈现特征性延续表达;
⑩
观察cd45/ssc设置的粒细胞门(gra)内的细胞,正常骨髓标本cd11b/cd13、cd16/cd13、cd16/cd11b、cd33/cd13均呈现与该标本类似的特征性的延续性表达。
111.具体而言,图3显示正常骨髓标本,丙管分析。依次设置:
①
fsc
‑
a/h设置p1为去黏连细胞门,得到p1内为单个细胞;
②
在p1内显示fsc/ssc设置p2为活细胞门,得到p2内为单个活细胞;
③
p2门内使用cd45/ssc设置血细胞门,分别得到淋巴细胞(lym)、粒细胞(gra)、单核细胞(mono)、有核红细胞(nec)、嗜酸性粒细胞门(eo);
④
p2门内使用cd117/ssc设置髓系幼稚细胞门;
⑤
p2门内使用cd117bri/ssc设置肥大细胞门;
⑥
p2门内使用cd34+/ssc中等设置原始细胞门;
⑦
p2门内使用tdt/ssc设置淋系原始细胞门;
⑧
p2门内使用cd22/ssc设置b细胞门;
⑨
p2门内使用cd45/ccd3观察是否有ccd3+细胞在cd45/ssc设置的淋巴细胞门(lym)以外,尤其注意cd45dim/ccd3+细胞,该正常标本没有;
⑩
同时观察cd34+和cd117+细胞,cd38+髓系原始细胞为主,cd34+为cd117+细胞亚群,不表达ccd3、cd22、tdt;
⑪
同时观察淋巴细胞门(lym)和tdt+细胞,正常骨髓标本tdt+细胞均为cd34dim/cd22+/cd38+的b系原始细胞,不表达cd117、ccd3;
⑫
同时观察cd22+b细胞和cd34+/ssc中等的髓系原始细胞,cd22+b细胞中,大多数为cd34
‑
/tdt
‑
/cd38
‑
的中后期阶段细胞,少数为cd34dim/tdt+/cd38+细胞,cd34+/ssc中等的主要为cd117+/ccd3
‑
/cd22
‑
/tdt
‑
的髓系原始细胞,其cd34/cd38表达呈现特征性表达,主要为cd38阳性,少数cd38dim涂抹表达。
112.具体而言,图4显示正常骨髓标本丁管分析。依次设置:
①
fsc
‑
a/h设置p1为去黏连细胞门,得到p1内为单个细胞;
②
在p1内显示fsc/ssc设置p2为活细胞门,得到p2内为单个活细胞;
③
p2门内使用cd45/ssc设置血细胞门,分别得到淋巴细胞(lym)、粒细胞(gra)、单
核细胞(mono)、有核红细胞(nec)细胞门、嗜酸性粒细胞门(eo);
④
p2门内使用cd34+/ssc中等设置原始细胞门;
⑤
p2门内使用cd42a/cd45设置血小板/巨核细胞门;
⑥
p2门内使用mpo/cd64、cd14/cd64修正cd45/ssc设置的粒细胞门(gra)和单核细胞门(mono),确定粒细胞mpo+/cd64+,并且达到一定强度,单核细胞cd14+/cd64bri;
⑦
观察单核细胞门内主要为cd14+/cd64bri细胞,确定没有cd14阴性细胞;
⑧
观察cd34+细胞,确定不表达mpo、cd64、cd42a、cd14;
⑨
观察cd45dim/cd42a+细胞,无重心,fsc/ssc小,不表达mpo、cd64。
113.具体而言,图5显示正常骨髓标本,30岁以上患者的戊管分析。依次设置:
①
fsc
‑
a/h设置p1为去黏连细胞门,得到p1内为单个细胞;
②
在p1内显示fsc/ssc设置p2为活细胞门,得到p2内为单个活细胞;
③
p2门内使用cd45/ssc设置血细胞门,分别得到淋巴细胞(lym)、粒细胞(gra)、单核细胞(mono)、有核红细胞(nec)、嗜酸性粒细胞门(eo);
④
p2门内使用cd19/ssc设置b细胞门;
⑤
p2门内使用cd20/ssc设置成熟b细胞门;
⑥
p2门内使用cd38bri/ssc和/或cd38bri/cd45设置浆细胞门;
⑦
p2门内使用cd45dim或
‑
/cd56+设门确定无此类细胞;
⑧
cd19+b细胞门内,可见正常增生b祖细胞,cd45/ssc、cd38/cd10、cd20/cd10、cd38/cd20、cd45/cd19呈现特征性延续性表达,不表达cd5、cd56,早期阶段不表达cκ、cλ,成熟阶段分散表达;
⑨
cd20+成熟b细胞门,cκ/cλ=1.1,不表达cd5、cd56,可以弱表达cd10、cd38,直至阴性,为正常成熟b细胞;
⑩
cd38bri浆细胞门内,cκ/cλ=1.2,表达cd19、cd45,不表达cd5、cd56、cd10、cd20,为正常浆细胞。
114.具体而言,图6
‑
图10为同一急性白血病aml患者甲到戊管免疫分型。
115.具体而言,图6显示aml患者骨髓标本甲管分析。依次设置:
①
fsc
‑
a/h设置p1为去黏连细胞门,得到p1内为单个细胞;
②
在p1内显示fsc/ssc设置p2为活细胞门,得到p2内为单个活细胞;
③
p2门内使用cd45/ssc设置血细胞门,分别得到淋巴细胞(lym)、粒细胞(gra)、单核细胞(mono)、有核红细胞(nec)、嗜酸性粒细胞门(eo);
④
p2门内使用cd117/ssc设置髓系幼稚细胞门,占有核细胞20.9%,比例明显升高,并在cd45/ssc设门的原始细胞孔位置;
⑤
p2门内使用cd117 bri/ssc设置肥大细胞门;
⑥
p2门内使用cd45/cd7、cd45/cd5修正淋巴细胞门(lym),确定无cd45dim/cd7+、cd45dim/cd5+细胞;
⑦
p2门内使用ssc/cd56确定无sscbri和/或cd56bri细胞;
⑧
p2门内使用ssc中等/cd4dim设置树突状细胞和单核细胞门,基本上与cd45/ssc设置的单核细胞门(mono)重合;
⑨
p2门内使用cd45dim或
‑
/cd56+设门,确定无cd45dim或
‑
/cd56+肿瘤细胞;
⑩
同时显示cd117+和lym细胞,将淋巴细胞作为内对照,观察cd117+髓系幼稚细胞表达情况,淋巴细胞亚群基本正常,cd117+恶性髓系幼稚细胞比例升高,不表达cd2、cd3、cd4、cd5、cd7、cd8、cd56。
116.具体而言,图7显示aml骨髓标本,乙管分析。依次设置:
①
fsc
‑
a/h设置p1为去黏连细胞门,得到p1内为单个细胞;
②
在p1内显示fsc/ssc设置p2为活细胞门,得到p2内为单个活细胞;
③
p2门内使用cd45/ssc设置血细胞门,分别得到淋巴细胞(lym)、粒细胞(gra)、单核细胞(mono)、有核红细胞(nec)、嗜酸性粒细胞门(eo);
④
p2门内使用cd117/ssc设置髓系幼稚细胞门,可见明显比例升高的恶性髓系幼稚细胞,在cd45/ssc的原始细胞孔位置;
⑤
p2门内使用cd117 bri/ssc设置肥大细胞门;
⑥
p2门内使用cd34/ssc中等和hla
‑
dr/cd45dim设置原始幼稚细胞门;
⑦
p2门内使用cd11b/hla
‑
dr修正单核细胞门,确定cd11b+/hla
‑
dr+细胞均在cd45/ssc设置的单核细胞门(mono)以内;
⑧
同时观察cd34+和cd117+原始幼稚细胞,恶性髓系幼稚细胞表达cd117、cd13、cd33、hla
‑
dr,部分表达cd34,不表达cd16、cd11b;
⑨
cd45dim/hla
‑
dr+细胞设门再次证实恶性髓系幼稚细胞表达;
⑩
观察cd45/ssc设置的粒细胞门(gra)内的细胞,cd11b/cd13、cd16/cd13、cd16/cd11b、cd33/cd13均呈现与正常不同的发育模式异常。
117.具体而言,图8显示aml骨髓标本,丙管分析。依次设置:
①
fsc
‑
a/h设置p1为去黏连细胞门,得到p1内为单个细胞;
②
在p1内显示fsc/ssc设置p2为活细胞门,得到p2内为单个活细胞;
③
p2门内使用cd45/ssc设置血细胞门,分别得到淋巴细胞(lym)、粒细胞(gra)、单核细胞(mono)、有核红细胞(nec)细胞门、嗜酸性粒细胞门(eo);
④
p2门内使用cd117/ssc设置恶性髓系幼稚细胞门;
⑤
p2门内使用cd117bri/ssc设置肥大细胞门;
⑥
p2门内使用cd34+/ssc中等设置原始细胞门;
⑦
p2门内使用tdt/ssc设置淋系原始细胞门;
⑧
p2门内使用cd22/ssc设置b细胞门;
⑨
p2门内使用cd45/ccd3确定无ccd3+细胞在cd45/ssc设置的淋巴细胞门(lym)以外,无cd45dim/ccd3+细胞;
⑩
恶性髓系幼稚细胞表达cd117,cd38,部分表达cd34,不表达cd22、tdt、ccd3;
⑪
同时观察淋巴细胞门(lym)和tdt+细胞,未见明显异常;
⑫
观察cd22+b细胞,未见明显异常。
118.具体而言,图9显示aml骨髓标本,丁管分析。依次设置:
①
fsc
‑
a/h设置p1为去黏连细胞门,得到p1内为单个细胞;
②
在p1内显示fsc/ssc设置p2为活细胞门,得到p2内为单个活细胞;
③
p2门内使用cd45/ssc设置血细胞门,分别得到淋巴细胞(lym)、粒细胞(gra)、单核细胞(mono)、有核红细胞(nec)细胞门、嗜酸性粒细胞门(eo),该标本中可见与正常标本相比,原始细胞孔位置多出一群原始细胞,设置cd45dim/sscdim的blast门,该肿瘤细胞与图6
‑
图8的恶性髓系原始细胞位置一致,部分表达mpo、cd64、cd34,不表达cd14、cd42a;
④
p2门内使用cd34+/ssc中等设置原始细胞门;
⑤
p2门内使用cd42a/cd45设置血小板/巨核细胞门;
⑥
p2门内使用mpo/cd64、cd14/cd64修正cd45/ssc设置的粒细胞门(gra)和单核细胞门(mono);
⑦
观察单核细胞门内主要为cd14
‑
/cd64+异常幼稚单核细胞;
⑧
观察cd34+细胞,不表达mpo、cd64、cd42a、cd14;
⑨
观察cd45dim/cd42a+细胞,血小板为主。
119.具体而言,图10显示aml骨髓标本,小于30岁的患者的戊管分析。依次设置:
①
fsc
‑
a/h设置p1为去黏连细胞门,得到p1内为单个细胞;
②
在p1内显示fsc/ssc设置p2为活细胞门,得到p2内为单个活细胞;
③
p2门内使用cd45/ssc设置血细胞门,分别得到淋巴细胞(lym)、粒细胞(gra)、单核细胞(mono)、有核红细胞(nec)、嗜酸性粒细胞门(eo),以及明显的blast细胞,表达cd38,部分表达cd34,不表达cd19、cd20、cd10、cκ、cλ;
④
p2门内使用cd19/sscdim设置b细胞门;
⑤
p2门内使用cd20/sscdim设置成熟b细胞门;
⑥
p2门内使用cd38bri/ssc和/或cd38bri/cd45设置浆细胞门;
⑦
p2门内使用cd34/ssc设原始细胞门;
⑧
cd19+b细胞门内,成熟b细胞为主,为正常多克隆细胞;
⑨
cd20+成熟b细胞门内,为正常成熟b细胞;
⑩
cd38bri浆细胞门内,为正常浆细胞。
120.具体而言,图11
‑
图15为同一fcγ受体iiiβ基因突变患者骨髓标本甲到戊管免疫分型。
121.具体而言,图11显示fcγ受体iiiβ基因突变患者骨髓标本甲管分析。依次设置:
①
fsc
‑
a/h设置p1为去黏连细胞门,得到p1内为单个细胞;
②
在p1内显示fsc/ssc设置p2为活细胞门,得到p2内为单个活细胞;
③
p2门内使用cd45/ssc设置血细胞门,分别得到淋巴细胞(lym)、粒细胞(gra)、单核细胞(mono)、有核红细胞(nec)、嗜酸性粒细胞门(eo);
④
p2门内使用cd117/ssc设置髓系幼稚细胞门;
⑤
p2门内使用cd117bri/ssc设置肥大细胞门;
⑥
p2门
内使用cd45/cd7、cd45/cd5修正cd45/ssc设置的淋巴细胞门(lym),确定无cd45dim/cd7+、cd45dim/cd5+细胞;
⑦
p2门内使用ssc/cd56观察,确定无sscbri和/或cd56bri细胞在cd45/ssc设置的淋巴细胞门(lym);
⑧
p2门内使用ssc中等/cd4dim设置树突状细胞和单核细胞门,与cd45/ssc设置的单核细胞门(mono)基本一致;
⑨
p2门内使用cd45
‑
/cd56+设门,无cd45dim或
‑
/cd56+肿瘤细胞;
⑩
同时显示cd117+和lym细胞,将淋巴细胞作为内对照,观察cd117+髓系幼稚细胞表达情况,淋巴细胞和髓系幼稚细胞均未见明显异常。
122.具体而言,图12显示fcγ受体iiiβ基因突变患者骨髓标本,乙管分析。依次设置:
①
fsc
‑
a/h设置p1为去黏连细胞门,得到p1内为单个细胞;
②
在p1内显示fsc/ssc设置p2为活细胞门,得到p2内为单个活细胞;
③
p2门内使用cd45/ssc设置血细胞门,分别得到淋巴细胞(lym)、粒细胞(gra)、单核细胞(mono)、有核红细胞(nec)、嗜酸性粒细胞门(eo);
④
p2门内使用cd117/ssc设置髓系幼稚细胞门;
⑤
p2门内使用cd117bri/ssc设置肥大细胞门;
⑥
p2门内使用cd34bri/ssc中等和hla
‑
dr/cd45dim设置原始幼稚细胞门;
⑦
p2门内使用cd11b/hla
‑
dr修正单核细胞门,确定cd11b+/hla
‑
dr+细胞均在cd45/ssc设置的单核细胞门(mono)以内;
⑧
同时观察cd34+和cd117+原始幼稚细胞,未见明显异常;
⑨
观察cd45dim/hla
‑
dr+幼稚细胞,确定与cd117+髓系幼稚细胞基本一致,未见明显异常;
⑩
观察cd45/ssc设置的粒细胞门(gra)内的细胞,cd11b/cd13和cd33/cd13为正常的延续性表达,但是粒细胞全部丢失cd16。
123.具体而言,图13显示fcγ受体iiiβ基因突变患者骨髓标本,丙管分析。依次设置:
①
fsc
‑
a/h设置p1为去黏连细胞门,得到p1内为单个细胞;
②
在p1内显示fsc/ssc设置p2为活细胞门,得到p2内为单个活细胞;
③
p2门内使用cd45/ssc设置血细胞门,分别得到淋巴细胞(lym)、粒细胞(gra)、单核细胞(mono)、有核红细胞(nec)、嗜酸性粒细胞门(eo);
④
p2门内使用cd117/ssc设置髓系幼稚细胞门;
⑤
p2门内使用cd117bri/ssc设置肥大细胞门;
⑥
p2门内使用cd34+/ssc中等设置原始细胞门;
⑦
p2门内使用tdt/ssc设置淋系原始细胞门;
⑧
p2门内使用cd22/ssc设置b细胞门;
⑨
p2门内使用cd45/ccd3确定无ccd3+细胞在cd45/ssc设置的淋巴细胞门(lym)以外,无cd45dim/ccd3+细胞;
⑩
同时观察cd34+和cd117+细胞,未见明显异常;
⑪
同时观察淋巴细胞门(lym)和tdt+细胞,未见明显异常;
⑫
同时观察cd22+b细胞和cd34+/ssc中等的髓系原始细胞,未见明显异常。
124.具体而言,图14,fcγ受体iiiβ基因突变患者骨髓标本丁管分析。依次设置:
①
fsc
‑
a/h设置p1为去黏连细胞门,得到p1内为单个细胞;
②
在p1内显示fsc/ssc设置p2为活细胞门,得到p2内为单个活细胞;
③
p2门内使用cd45/ssc设置血细胞门,分别得到淋巴细胞(lym)、粒细胞(gra)、单核细胞(mono)、有核红细胞(nec)细胞门、嗜酸性粒细胞门(eo);
④
p2门内使用cd34+/ssc中等设置原始细胞门;
⑤
p2门内使用cd42a/cd45设置血小板/巨核细胞门;
⑥
p2门内使用mpo/cd64、cd14/cd64修正cd45/ssc设置的粒细胞门(gra)和单核细胞门(mono);
⑦
观察单核细胞门内主要为cd14+/cd64bri细胞,确定没有cd14阴性细胞;
⑧
观察cd34+细胞,未见明显异常;
⑨
观察cd45dim/cd42a+细胞,fsc/ssc小,不表达mpo、cd64。
125.具体而言,图15,fcγ受体iiiβ基因突变患者骨髓标本,小于30岁的患者的戊管分析。依次设置:
①
fsc
‑
a/h设置p1为去黏连细胞门,得到p1内为单个细胞;
②
在p1内显示fsc/ssc设置p2为活细胞门,得到p2内为单个活细胞;
③
p2门内使用cd45/ssc设置血细胞门,分别得到淋巴细胞(lym)、粒细胞(gra)、单核细胞(mono)、有核红细胞(nec)、嗜酸性粒细胞门
(eo);
④
p2门内使用cd19/sscdim设置b细胞门;
⑤
p2门内使用cd20/sscdim设置成熟b细胞门;
⑥
p2门内使用cd38bri/ssc和/或cd38bri/cd45设置浆细胞门;
⑦
p2门内使用cd34/ssc设置原始细胞门;
⑧
cd19+b细胞门内,可见正常增生b祖细胞;
⑨
cd20+成熟b细胞门,为正常成熟b细胞;
⑩
cd38bri浆细胞门内,为正常浆细胞;
⑩
cd34+细胞门内,cd38为主的髓系原始细胞。
126.具体而言,图16
‑
图20为同一转移癌(神经母细胞瘤)伴有mbl患者骨髓标本甲到戊管免疫分型。
127.具体而言,图16显示转移癌(神经母细胞瘤)伴有mbl患者骨髓标本甲管分析。依次设置:
①
fsc
‑
a/h设置p1为去黏连细胞门,得到p1内为单个细胞;
②
在p1内显示fsc/ssc设置p2为活细胞门,得到p2内为单个活细胞;
③
p2门内使用cd45/ssc设置血细胞门,分别得到淋巴细胞(lym)、粒细胞(gra)、单核细胞(mono)、有核红细胞(nec)、嗜酸性粒细胞门(eo);
④
p2门内使用cd117/ssc设置髓系幼稚细胞门;
⑤
p2门内使用cd117bri/ssc设置肥大细胞门;
⑥
p2门内使用cd45/cd7、cd45/cd5确定无cd7+或者cd5+细胞在cd45/ssc设置的淋巴细胞门(lym)以外,无cd45dim/cd7+、cd45dim/cd5+细胞;
⑦
p2门内使用ssc/cd56观察,有明显sscbri/cd56bri肿瘤细胞,在cd45/ssc设置的淋巴细胞门(lym)以外;
⑧
p2门内使用ssc中等/cd4dim设置树突状细胞和单核细胞门,基本上与cd45/ssc设置的单核细胞门(mono)一致;
⑨
p2门内使用cd45dim或
‑
/cd56+设门,发现cd45
‑
/cd56+肿瘤细胞,占有核细胞49.8%,加做gd2、cd326、cytokeratin(ck)后证实表达gd2,不表达cd326和ck,为神经肌肉来源肿瘤细胞,神经母细胞瘤可能性大;
⑩
同时显示cd117+和lym细胞,将淋巴细胞作为内对照,观察cd117+髓系幼稚细胞表达情况,t和nk淋巴细胞以及髓系原始细胞未见明显异常。
128.具体而言,图17显示转移癌(神经母细胞瘤)伴有mbl患者骨髓标本,乙管分析。依次设置:
①
fsc
‑
a/h设置p1为去黏连细胞门,得到p1内为单个细胞;
②
在p1内显示fsc/ssc设置p2为活细胞门,得到p2内为单个活细胞;
③
p2门内使用cd45/ssc设置血细胞门,分别得到淋巴细胞(lym)、粒细胞(gra)、单核细胞(mono)、有核红细胞(nec)、嗜酸性粒细胞门(eo),可见cd45阴性/ssc大的肿瘤细胞,设肿瘤细胞门(tumor),不表达cd34、cd117、hla
‑
dr、cd16、cd11b、cd13、cd33;
④
p2门内使用cd117/ssc设置髓系幼稚细胞门;
⑤
p2门内使用cd117bri/ssc设置肥大细胞门;
⑥
p2门内使用cd34/ssc中等和hla
‑
dr/cd45dim设置原始幼稚细胞门;
⑦
p2门内使用cd11b/hla
‑
dr修正单核细胞门,确定cd11b+/hla
‑
dr+细胞均在cd45/ssc设置的单核细胞门(mono)以内;
⑧
同时观察cd34+和cd117+原始幼稚细胞,未见明显异常;
⑨
观察cd45dim/hla
‑
dr+幼稚细胞,确定与cd117+髓系幼稚细胞基本一致,未见明显异常;
⑩
观察cd45/ssc设置的粒细胞门(gra)内的细胞,未见明显发育异常与异常表达。
129.具体而言,图18显示转移癌(神经母细胞瘤)伴有mbl患者骨髓标本,丙管分析。依次设置:
①
fsc
‑
a/h设置p1为去黏连细胞门,得到p1内为单个细胞;
②
在p1内显示fsc/ssc设置p2为活细胞门,得到p2内为单个活细胞;
③
p2门内使用cd45/ssc设置血细胞门,分别得到淋巴细胞(lym)、粒细胞(gra)、单核细胞(mono)、有核红细胞(nec)、嗜酸性粒细胞门(eo)、肿瘤细胞门(tumor),肿瘤细胞不表达tdt、cd22、ccd3、cd38、cd34、cd117;
④
p2门内使用cd117/ssc设置髓系幼稚细胞门;
⑤
p2门内使用cd117bri/ssc设置肥大细胞门;
⑥
p2门内使用cd34+/ssc中等设置原始细胞门;
⑦
p2门内使用tdt/ssc设置淋系原始细胞门;
⑧
p2门内使用cd22/ssc设置b细胞门;
⑨
p2门内使用cd45/ccd3确定无ccd3+细胞在cd45/ssc设置的
淋巴细胞门(lym)以外,无cd45dim/ccd3+细胞;
⑩
同时观察cd34+和cd117+细胞,未见明显异常;
⑪
同时观察淋巴细胞门(lym)和tdt+细胞,未见明显异常;
⑫
同时观察cd22+b细胞和cd34bri/ssc中等的髓系原始细胞,未见明显异常。
130.具体而言,图19显示转移癌(神经母细胞瘤)伴有mbl患者骨髓标本丁管分析。依次设置:
①
fsc
‑
a/h设置p1为去黏连细胞门,得到p1内为单个细胞;
②
在p1内显示fsc/ssc设置p2为活细胞门,得到p2内为单个活细胞;
③
p2门内使用cd45/ssc设置血细胞门,分别得到淋巴细胞(lym)、粒细胞(gra)、单核细胞(mono)、有核红细胞(nec)细胞门、嗜酸性粒细胞门(eo)、肿瘤细胞门(tumor),肿瘤细胞不表达mpo、cd64、cd14、cd34、cd42a;
④
p2门内使用cd34+/ssc中等设置原始细胞门;
⑤
p2门内使用cd42a/cd45设置血小板/巨核细胞门;
⑥
p2门内使用mpo/cd64、cd14/cd64修正cd45/ssc设置的粒细胞门(gra)和单核细胞门(mono),确定粒细胞mpo+/cd64+,并且达到一定强度,单核细胞cd14+/cd64bri;
⑦
观察单核细胞门内主要为cd14+/cd64bri细胞,确定没有cd14阴性细胞;
⑧
观察cd34+细胞,确定不表达mpo、cd64、cd42a、cd14;
⑨
观察cd45dim/cd42a+细胞,fsc/ssc小,不表达mpo、cd64。
131.具体而言,图20显示转移癌(神经母细胞瘤)伴有mbl患者骨髓标本,30岁以上患者的戊管分析。依次设置:
①
fsc
‑
a/h设置p1为去黏连细胞门,得到p1内为单个细胞;
②
在p1内显示fsc/ssc设置p2为活细胞门,得到p2内为单个活细胞;
③
p2门内使用cd45/ssc设置血细胞门,分别得到淋巴细胞(lym)、粒细胞(gra)、单核细胞(mono)、有核红细胞(nec)、嗜酸性粒细胞门(eo);
④
p2门内使用cd19/sscdim设置b细胞门;
⑤
p2门内使用cd20/sscdim设置成熟b细胞门;
⑥
p2门内使用cd38/ssc和/或cd38/cd45设置浆细胞门;
⑦
p2门内使用cd45dim或
‑
/cd56+设门,可见明显肿瘤细胞,不表达cκ、cλ、cd10、cd19、cd20、cd38、cd5;
⑧
cd19+b细胞门内,成熟b细胞表达cd20,单克隆表达cκ,不表达cλ、cd5、cd10、cd38、cd56,为单克隆成熟b细胞;
⑨
cd20+成熟b细胞门内,为单克隆成熟b细胞;
⑩
cd38bri浆细胞比例极低,未见明显异常。
132.利用本实施例的方法进行临床验证:河北燕达陆道培医院从2020年9月开始使用,到2021年6月底,完成4995例一步法病例筛查/诊断克隆性疾病和其他疾病检测,诊断mds、mpn、mds/mpn共计655例,aa180例,aml653例、t
‑
all/lbl51例,b
‑
all/lbl267例,mapl41例,mm149例,b
‑
clpd或者mbl293例,t
‑
clpd72例,nk
‑
clpd36例,转移癌15例,fcγ受体iiiβ基因突变7例,噬血综合征伴有免疫缺陷12例,pnh22例,bpdcn2例。使用同时进行的形态学、遗传学、临床表现等方法同步验证,并进行1
‑
9个月的随访,检测肿瘤细胞的灵敏度为10
‑4,覆盖率和特异性接近100%。假阳性率和假阴性率均接近0,本发明在恶性肿瘤病例仅不能覆盖一例cd56阴性的上皮来源的转移癌,但是通过cd45/ssc找出非造血细胞,因为比例10%,未造成漏诊。虽然确定肿瘤后,部分需要加做抗体进行亚型诊断和明确诊断,如t和nk细胞淋巴瘤需要加做trbc1、cd57、cd30、ki67、tcrγδ;如果是tcrγδ淋巴瘤,还需要加做tcrvδ1、tcrvδ1;cd4+t淋巴瘤加做cd26、cd25、cd279;cd4/cd8双阳性需要加做tcl1、cd1a、cd99;nk淋巴瘤需要加做cd57、cd30、ki67、tcrγδ、cd159a、cd159c、cd94、cd161、cd158a、cd158b、cd158e;b细胞淋巴瘤需要加做ki67、cd23、cd79b、fmc7、cd103、cd200;浆细胞肿瘤需要加做ki67、cd229、cd138;转移癌需要加做cd326、cytokeratin、cd81、cd9;bpdcn需要加做cd123、cd303、cd304,但是与河北燕达陆道培医院过去几年里两步法个体化方案相比,收费标准以外额外加做抗体的比例降低了23%(由原来加做6.5%降低到5%);完成同样多的标
本检测,人力节约了33%;5
‑
8年资人员进行初步分析诊断的漏诊率由最初的5%
‑
10%,降低到1%以下。由此可见本发明对于整个临床诊断领域来说,都是一个提高效率、节约成本、降低漏诊率的重要的检测与分析方案。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1