一种外泌体识别装置及方法与流程
1.本发明涉及外泌体鉴定技术领域,具体提供一种外泌体识别装置及方法。
背景技术:
2.这里的陈述仅提供与本发明有关的背景信息,而不必然构成现有技术。
3.外泌体,一种直径约30
‑
100nm的双层膜囊泡状结构小体,可由机体内多种细胞主动分泌产生,广泛分布于各种体液中。由于外泌体的特殊结构和功能,使得它具有许多潜在的应用价值,作为新一代的生物标志物和治疗载体,将在基础研究,临床诊断治疗以及药物输送中将会发挥巨大的优势。因此开展建立高选择性的肿瘤特异性外泌体分离技术具有重要意义。已有的离心和超滤等方法选择性差,而基于生物蛋白抗体的技术,存在造价高和稳定性差的缺点。
4.而外泌体分离提取之后,进行进一步检测或者作为治疗药物使用之前,需要质量控制,确定我们收集的样本就是外泌体,且无来自细胞碎片的污染。这样的外泌体才有作为疾病标志物的价值,这样的外泌体用于外泌体治疗才能保证有效性和安全性。质量控制常规的方法包括纳米颗粒跟踪分析(nta)、动态光散射、透射电镜、免疫电镜、westernblot、免疫流式、elisa等方法。nta和动态光散射相对而言较简单,但仅仅评估了粒径大小分布情况,对于外泌体鉴定的意义有限,且需要复杂的仪器设备,从实验室推广到临床使用较为困难。透射电镜可以观察外泌体形态,是一种相对较好的鉴定方法,但是费时费力,而且依赖大型仪器(电子显微镜),也很难完成从实验室向临床的推广。
5.分子印迹技术是20世纪末出现的一种高选择性分离技术,其基本思想是源于人们对抗体
‑
抗原专一性的认识,利用具有分子识别能力的聚合物材料——分子印迹聚合物来分离、筛选、纯化化合物的一种仿生技术。分子印迹聚合物有着卓越的分子识别性能和稳定性,在许多方面得到了广泛的应用,但是将分子印迹技术应用于外泌体分离和检测还未有相关报道。
技术实现要素:
6.本发明的目的在于提出一种检测快捷、样本需要量少并且设备小的外泌体识别装置及方法。
7.本发明提供一种外泌体识别装置,其特征在于,包括基底,所述基底上有加样区,游离抗体区,固定抗体区,质控抗体区和废液区;
8.所述加样区包括进液通道;
9.所述游离抗体区,用于容纳抗体,并且所述加样区通过流道与所述游离抗体区的进液口相连通;
10.所述固定抗体区,固定有磁性纳米颗粒表面印迹外泌体材料;固定抗体区的出液口通过流道与所述质控抗体区的进液口相连通;
11.所述质控抗体区的出液口通过流道与所述废液区的进液口相连通。
12.优选的,所述磁性纳米颗粒表面印迹外泌体材料为磁性纳米粒子与印迹外泌体蛋白结合的材料。
13.优选的,所述磁性纳米粒子为四氧化三铁。
14.优选的,所述印迹外泌体蛋白通过如下步骤制备:配制分离胶和浓缩胶,对浓缩胶进行电泳和分离,转模,即得。
15.优选的,转模后配制ec显影液,提前打开凝胶成像仪,ec反应液滴加到目的条带处,用凝胶成像系统检测目的条带。
16.本发明所述流道、所述游离抗体区、所述固定抗体区和所述质控抗体区的底面均为亲水底面;所述流道、所述游离抗体区、所述固定抗体区和所述质控抗体区的侧壁均为疏水侧壁。
17.优选的,所述亲水底面为亲水材料制作的底面,包括滤纸;所述疏水侧壁为疏水材料制作的侧壁,包括蜡。
18.本发明还提供一种外泌体识别方法,所述外泌体识别方法在外泌体识别装置中进行,包括如下步骤:
19.步骤1:装配外泌体鉴定装置,向所述外泌体鉴定装置内配置相应的抗体;
20.步骤2:根据每条臂的检测指标选择抗体;
21.步骤3:将外泌体样本与裂解液混合,得到混合液;
22.步骤4:将混合液注入加样区;
23.步骤5:等待检测反应,观察检测现象。
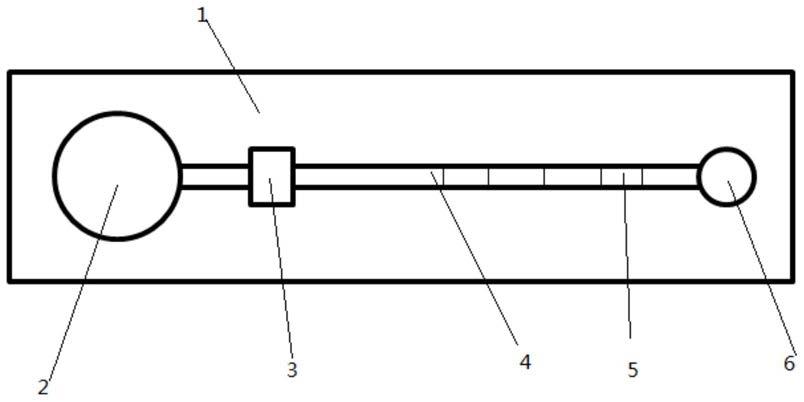
24.优选的,在所述步骤1中,所述抗体为性纳米颗粒表面印迹外泌体材料。
25.上述技术方案中的一个或一些技术方案具有如下优点或有益效果:
26.1)本发明将适配体技术与分子印迹技术结合,合成了蛋白分子印迹材料,并对材料的吸附量,吸附动力学,吸附等温线以及吸附选择性性能进行了评价,结果表明结合适配体核酸扩增的分子印迹的吸附动力学,吸附等温线不同于普通印迹材料,展现了优异的结合与识别性能,适合用于外泌体识别。
27.2)本发明将适配体以及核酸扩增技术与分子印迹技术结合,研究制备外泌体分子印迹材料,可以实现外泌体的识别和俘获。
28.3)本发明将蛋白分子印迹材料引入微流控芯片,应用于癌症病人血样中癌细胞来源外泌体的捕获,并通过后续对肿瘤细胞来源外泌体的内含突变核酸片段的检测,为构建基于外泌体的微流控芯片癌症液体活检体外诊断系统奠定基础。
附图说明
29.构成本发明一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
30.图1为本发明实施例所述的外泌体识别装置示意图。
31.其中:1.基底;2.加样区;3.游离抗体区;4.固定抗体区;5.质控抗体区;6.废液区。
具体实施方式
32.下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施
例仅是本发明的一部分实施例,而不是全部实施例。基于本发明的实施例,本领域技术人员在没有做出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。
33.实施例1
34.本实施例制备一种印迹外泌体蛋白,包括如下步骤:
35.(1)配制浓缩胶和分离胶
36.(1.1)配制sds
‑
page浓缩胶(5%),用洗洁精将玻璃板反复洗干净,喷上乙醇,自然晾干,保证板上晾干后无水渍。用夹板夹住玻璃板后,用封口膜在板底部做一个封口处理,确保不漏液。先配制好未加temed的浓缩胶,把异丙醇倒掉,干净滤纸吸去残余溶剂,浓缩胶加temed后加到两块玻璃板夹层中,插入干净的梳子。如果有气泡,把梳子拔出来,再加适当的浓缩胶,确保无气泡产生。放置30min左右浓缩胶凝固,可放置1
‑
2h后使用,待胶内部孔成型稳定后使用,效果更好。也可放4℃过夜,第二天再用。
37.(1.2)配制sds
‑
page分离胶(10%),方法同步骤(1.1)。
38.(2)sds凝胶电泳
39.(2.1)取30ul外泌体溶液,加10ul巯基乙醇4
×
上样缓冲液,于沸水中煮7
‑
10min,可放冰箱
‑
20℃保存备用。
40.(2.2)配制1
×
电泳缓冲液,电泳液配方为丙烯酰胺29.2g,n
‑
n亚甲基双丙烯酰胺0.8g,定容至100ml。先把内槽倒满,拔掉梳子。外泌体上样约20ug,根据bradford法测的蛋白浓度计算上样体积。上样后把内槽放到电泳槽内,从内槽缓慢加电泳液至刻度线的1/2以上。然后开始电泳,浓缩胶用80v电压跑30min,让样品和maker都达到分离胶上沿。换成110v电压跑1.5h左右,让溴酚蓝跑过15kda处的maker后可以关闭电源。卸下凝胶,回收电泳液。
41.bradford法测定蛋白浓度包括如下步骤:
42.(1)取外泌体溶液100ul,加入100ul ripa裂解液,1ul磷酸酶抑制剂,混合均匀。
43.(2)冰上放置30min使外泌体充分裂解。
44.(3)用30%功率超声10s,间隔10s后,超声破碎4min。
45.(4)18000rpm,4℃,离心20min,得到上清液。
46.(5)使用bsa标准品配制标准曲线,
47.取5ul样品,加入200ul的g250,加入96孔板,每个浓度点平行做5次。暗处孵育5min后,使用酶标仪测定od595值。
48.(3)转膜
49.(3.1)配制转膜液,放冰箱
‑
20℃预冷30min,所述转模液为30%质量分数的甘氨酸溶液。
50.(3.2)剪比凝胶略大的pdvf膜,放于甲醇中活化15s,将海绵、滤纸、凝胶和pdvf膜都浸泡在转膜液中。
51.(3.3)电转夹负极下置,依次放置1张海绵、1张滤纸、凝胶、pvdf膜、1张滤纸、1张海绵,注意放置凝胶后,用滚子赶走凝胶与滤纸之间的气泡。盖上正极盖子并夹紧,注意每层间不能有气泡。将电转夹放入电转槽内,正负极对应。
52.(3.4)电转槽内放入大小合适的冰袋,将电转槽放于冰上。恒流模式250ma,转膜2h左右,即得到外泌体蛋白。蛋白质的分子量范围在7.4(40s核糖体蛋白s28,q99pf7)~559.5(ahnak蛋白,a0a3l7hvn8)kda,主要分布在200kda以内。等电点分布在3.9(酸性富含亮氨酸
的核磷蛋白32家族成员a,a0a3l7hq41)~11.1(组蛋白h2a 1型,g3hdt6),集中分布在4~10。
53.(4)显影
54.(4.1)电转后将pvdf膜置于含5%脱脂奶粉的tbst中,然后置于摇床轻摇封闭约1h,tbst配置方法为:先称量40g氯化钠,加蒸馏水定容至400ml,再加入tbs缓冲液,定容至400ml;
55.(4.2)用tbst配制二抗,用含5%脱脂奶粉的tbst配一抗;
56.(4.3)封闭结束后,将pvdf膜置于一抗溶液中,摇床轻摇孵育,室温孵育2h或4℃过夜孵育;
57.(4.4)用tbst洗pvdf膜5次,每次5min;
58.(4.5)pvdf膜浸没于二抗中,摇床轻摇孵育2h;
59.(4.6)用tbst洗pvdf膜5次,每次5min;
60.(4.7)配制ec显影液,提前打开凝胶成像仪,ec反应液滴加到目的条带处,用凝胶成像系统检测目的条带。
61.实施例2
62.本实施例提供一种磁性纳米颗粒表面印迹外泌体材料的制备方法,包括如下步骤:
63.称取10mg表面功能化的磁性fe3o4纳米颗粒分散在8ml磷酸盐缓冲液(0.1m,ph7.4)中,加1ml乙醇超声分散。称取8.15mg aam,4mgmba,10mg nipaam于2ml磷酸盐缓冲液中,超声5min。把磁性颗粒和溶液充分混合,搅拌30min,抽真空后通氮气,加适量健康血清提取的外泌体备用溶液,滴加3ul maa,30ul aps(10%,w/v),15ul temed(10%,w/w),氮气保护,机械搅拌下反应24h,得到溶菌酶表面印迹磁性纳米颗粒。
64.引入适配体的磁性纳米颗粒表面印迹外泌体材料的制备
65.称取10mg表面功能化的磁性fe3o4纳米颗粒分散在8ml磷酸盐缓冲液(0.1m,ph7.4)中,加1ml乙醇超声分散。称取8.15mg aam,4mg mba,10mg nipaam于2ml磷酸盐缓冲液中,超声5min。把超声溶解后的混合液倒入三口烧瓶内,机械搅拌30min,使磁性材料与单体及交联剂充分预混合。抽真空后通氮气,加入100ul外泌体溶液,滴加3ul maa,30ul aps(10%,w/v),15ul temed(10%,w/w),100ul适配体溶液(100um),适配体(aptamer)的终浓度为1um。氮气保护,机械搅拌下反应24h,得到磁性纳米颗粒。
66.实施例3
67.如图1所示,本实施例提供外泌体鉴定装置的制备方法,首先制备得到亲水底面,
68.在本实施例中,流道、游离抗体区3、固定抗体区4、质控抗体区5和废液区6的底面均为亲水底面;流道、游离抗体区3、固定抗体区4、质控抗体区5和废液区6的侧壁均为疏水侧壁;亲水底面和疏水侧壁的设计,保证添加至加样区2的外泌体样本会顺着流道的方向扩散流动,疏水侧壁则会保证外泌体样本不会随意自由扩散,为外泌体样本提供导流的作用,使得倒入的外泌体样本自动流动到指定区域完成检测。
69.在本实施例中,亲水底面为亲水材料或者亲水化学试剂制作的底面,包括滤纸;疏水侧壁为疏水材料或者疏水化学试剂制作的侧壁,包括蜡。
70.在本实施例中,加样区2、游离抗体区3、固定抗体区4、质控抗体区5、废液区6和流
道均通过印刷或者光刻技术印刷或者光刻于基底1的表面上。
71.其中,光刻法:基底1浸泡在su
‑
82010光刻胶中,然后用标准光刻程序处理,包括旋涂,预烘烤,uv曝光,后烘烤,开发和硬烘烤步骤。用su
‑
8光刻胶阻挡层形成的基底1上微通道可以达到高精度(≈100μm)并且耐一些有机溶剂。
72.光刻法,可以参考文献:adv.healthcare mater.2018,1801084。
73.印刷法:包括聚合物印刷,喷墨蚀刻/印刷,蜡印刷,蜡筛选,柔版印刷等,近年来最常用于制造纸微流体装置,优点:简单的操作程序,低成本,短周期。蜡印刷是最广泛采用的技术,仅涉及印刷和烘烤,蜡也是相对廉价的疏水材料。
74.在本实施例中,基底1为纸质制基底1、玻璃基底1、聚二甲硅氧烷基底1或者聚甲基丙烯酸甲酯基底1,在本实施例中,采用纸质作为基底1;微流控纸芯片(paper
‑
basedmicrofluidic analytical devices,μpads)是一种新兴的使用纸张作为原料的基于微流控分析技术的分析平台,相较于用硅、玻璃、高聚物等材料制作的微流控芯片而言,具有成本低、加工简易、使用和携带方便等优点;这些优点使得μpads在临床诊断、食品质量控制和环境监测等应用领域具有很大的应用前景,因此,本实施例也采用纸如滤纸作为基底1,可以有效的降低设备的成本。
75.在本实施例中,纸质基底1为滤纸、聚偏二氟乙烯膜或者硝化纤维素膜。
76.在本实施例中,外泌体鉴定装置还包括一个透明的外壳,外壳罩设于基底1表面,外壳上正对加样区2设有加样口,保证无菌操作,在每条“臂”上,用文字说明该“臂”检测的是哪一种蛋白;另外,也可以使用不透明外壳,仅在需要观察的区域(固定抗体区、质控抗体区)使用透明材料制作一个“观察窗”,并在“观察窗”边注明该“臂”检测的指标,方便操作人员观察。
77.实施例4
78.本实施例提出一种外泌体鉴定方法,所述外泌体鉴定方法在实施例3制得的外泌体鉴定装置中进行,包括以下步骤:
79.步骤1:装配外泌体鉴定装置,向所述外泌体鉴定装置内配置相应的抗体;
80.步骤2:根据每条臂的检测指标选择抗体;
81.步骤3:将外泌体样本与裂解液混合,得到混合液;
82.步骤4:将混合液注入加样区;
83.步骤5:等待检测反应,观察检测结果。
84.在本实施例中,抗体是游离的,直接涂抹即可,液体经过会跟着液体流动;在本实施例中,本发明的检测原理为:当外泌体样本流经游离抗体区3时,抗体会识别其中的相应指标,与之结合后,一同随着微流体方向移动;
85.当外泌体样本进入固定抗体区4后,抗体识别相应的指标,将其捕获。
86.当外泌体样本进入质控抗体区5后,因为“游离抗体区3”中的抗体在设计时就是过量的,未结合到抗原上的抗体将不会被抗体捕获(因为抗体2是通过捕获抗原,从而捕获了吸附在抗原上的抗体1)。多余的这些抗体1(修饰了胶体金、荧光基团或者量子点),将会被抗体pc捕获,因为抗体pc设计时就是用于识别抗体1的。如果这个体系是正常的,质控抗体区5会显影(胶体金)或者可观察到荧光(荧光基团或量子点)。如果观察不到,则有可能抗体失效,或者显色/荧光异常(包括本身失效和与抗体的连接有问题)。
87.也就是说,如果指标是阳性,固定抗体区4和质控抗体区5均应显影/荧光。如果是阴性,质控抗体区5应显影/荧光,但固定抗体区4不应显影/荧光。如果出现质控抗体区5不显影/荧光的情况,则说明检测该指标的体系异常,结果无效,最后进入废液区完成废液收集。
88.以上所揭露的仅为本发明的优选实施例而已,当然不能以此来限定本发明之权利范围,因此依本发明申请专利范围所作的等同变化,仍属本发明所涵盖的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1