检测蛋白抗原的微流控芯片、方法、试剂盒和系统与流程
1.本发明涉及免疫检测技术领域,特别是涉及一种检测蛋白抗原的微流控芯片、方法、试剂盒和系统。
背景技术:
2.基于微液滴技术的数字化微流控分析技术是近年来发展快速分析技术,其最大的应用场景是应用于数字pcr(digital pcr,dpcr),其主要优势是微流控液滴技术产生液滴的速度可以在毫秒级别,几秒内就可以产生数以千计单分散性好的液滴,同时又可以精确地控制液滴的尺寸大小,达到纳升甚至飞升级别。液滴微流控实现可单个液滴的混合、传输和分析的独立控制,在单个实验中快速产生大量均一的液滴,使得大量平行反应能够在短时间内快速进行,并具有良好的重现性。由于液滴在微尺度上比表面积大,热和物质在液滴中的传递时间段,有利于反应快速进行。同时结合pcr的扩增技术及信号放大,可以很好地完成数字化核酸分析。
3.微流控免疫分析技术是将微流控技术与免疫分析方法联用的技术,即在微流控芯片上构建免疫分析平台,可以更好地发挥两种分析方法各自的优势。微流控分析所需试剂量极小,大大降低了例如抗体等昂贵免疫试剂的消耗;微纳尺度的流体操控与集成,提高了抗原与抗体反应的速度,有效缩短了反应时间。而免疫分析方法所具有的独特的生物识别机制,提高了微流控分析方法的特异性。
4.因此,近年来研究者尝试将液滴微流控芯片技术应用于免疫分析,但是蛋白分子与核酸dna或rna检测不同,蛋白分子的检测需要借助生物信号标记物进行结合反应检测信号的有无来判断物质的存在与否,主要还是利用夹心法检测抗原或抗体,检测过程包含了多次的加样与清洗,操作繁琐。
技术实现要素:
5.基于此,有必要提供一种简便的蛋白抗原的检测方法。
6.一种蛋白抗原的检测方法,包括以下步骤:
7.将待测样本与反应试剂混合后,采用微流控技术将所述待测样本与所述反应试剂的混合物制成多个液滴,其中,所述反应试剂包括标记有标记物的抗体和电解质提供剂,所述标记有标记物的抗体能与所述待测样本中的蛋白抗原特异性结合而形成抗原
‑
抗体复合物,在所述液滴中包裹有多个所述抗原
‑
抗体复合物,多个所述抗原
‑
抗体复合物能在所述电解质提供剂的作用下发生凝集反应;及
8.检测、分析凝集反应后各个所述液滴中凝集反应对应的信号的强度,以确定所述待测样本中所述蛋白抗原的量。
9.上述蛋白抗原的检测方法利用微流控技术形成包含多个抗原
‑
抗体复合物和电解质的液滴,多个抗原
‑
抗体复合物在液滴的微环境中由于电解质电离的离子的作用发生凝集反应,通过检测凝集反应对应信号的强度而确定待测样本中蛋白抗原的量。与传统的利
用微流控技术和夹心法检测蛋白抗原的方法相比,上述检测方法不需要多次清洗和多步加样,操作更简便;并且,上述检测方法利用液滴形成微环境,液滴在微尺度上比表面积大,热和物质在液滴中的传递时间短,有利于反应快速进行,免疫反应时间短,微小的反应变化更容易被放大而检测到,灵敏度高。
10.在其中一个实施例中,所述标记物为胶乳微球,在所述检测凝集反应后各个所述液滴中凝集反应对应的信号的强度的步骤中,检测的是各个所述液滴的浊度。
11.在其中一个实施例中,所述标记物为聚集诱导发光材料,在所述检测凝集反应后各个所述液滴中凝集反应对应的信号的强度的步骤中,检测的是各个所述液滴的发光强度。
12.在其中一个实施例中,在所述待测样本与所述反应试剂的混合物形成液滴之后,还包括检测所述待测样本与所述反应试剂形成的液滴的尺寸并根据所述尺寸筛选合格液滴的步骤。
13.在其中一个实施例中,所述反应试剂还包括可与所述标记物区分的荧光染料;所述检测所述待测样本与所述反应试剂形成的液滴的尺寸并根据所述尺寸筛选合格液滴的步骤包括:
14.检测所述待测样本与所述反应试剂形成的液滴的荧光分布情况;及
15.根据所述荧光分布情况筛选合格液滴。
16.在其中一个实施例中,所述检测方法为所述蛋白抗原的定量检测方法,所述检测方法还包括以下步骤:
17.将与所述待测样本相同体积的所述蛋白抗原的标准样本和所述反应试剂混合后,采用微流控技术将所述标准样本和所述反应试剂的混合物制成多个液滴;
18.检测并统计凝集反应后所述标准样本与所述反应试剂形成的各个液滴中凝集反应对应的信号的强度,得到标准样本的信号强度;
19.检测凝集反应后所述待测样本与所述反应试剂形成的各个液滴中凝集反应对应的信号的强度,计算所述待测样本与所述反应试剂形成的各个液滴的信号强度总和,得到待测样本的信号强度;及
20.根据所述标准样本中所述蛋白抗原的浓度、所述标准样本的信号强度和所述待测样本的信号强度,计算待测样本中蛋白抗原的浓度。
21.一种检测蛋白抗原的微流控芯片,包括液滴形成组件和液滴流道;所述液滴形成组件用于将样本与反应试剂形成的混合物制成多个液滴,所述液滴形成组件包括第一相流道和试剂流道,所述第一相流道上设置有第一相加样口和第一相出样口,所述第一相加样口与所述第一相出样口均连通;所述试剂流道上设置有试剂加样口和与所述试剂加样口连通的试剂出样口,所述试剂出样口靠近所述第一相出样口,以使经所述试剂出样口流出的溶液能被从所述第一相出样口流出的第一相包裹而形成液滴。
22.在其中一个实施例中,所述微流控芯片还包括筛选通道、检测池和废液池,所述筛选通道为三通管道,所述筛选通道的一端与所述液滴流道连通,所述筛选通道的其他两端分别与检测池和废液池连通。
23.一种蛋白抗原的检测试剂盒,包括上述的检测蛋白抗原的微流控芯片和反应试剂,所述反应试剂包括标记有标记物的抗体和电解质提供剂,所述标记有标记物的抗体能
与待测样本中的蛋白抗原特异性结合而形成抗原
‑
抗体复合物,所述电解质提供剂为多个所述抗原
‑
抗体复合物发生凝集反应提供条件。
24.一种蛋白抗原的检测系统,包括:
25.上述的微流控芯片;及
26.检测组件,所述检测组件用于检测所述微流控芯片中凝集反应后的液滴中凝集反应对应的信号强度。
附图说明
27.图1为一实施例的检测蛋白抗原的微流控芯片的示意图;
28.图2为图1所示的微流控芯片的试剂流道示意图;
29.图3为图1的所示的微流控芯片的a部的放大图;
30.图4为图1所示的微流控芯片的检测池;
31.图5为图1所示的微流控芯片的b部的放大图。
32.附图标记:
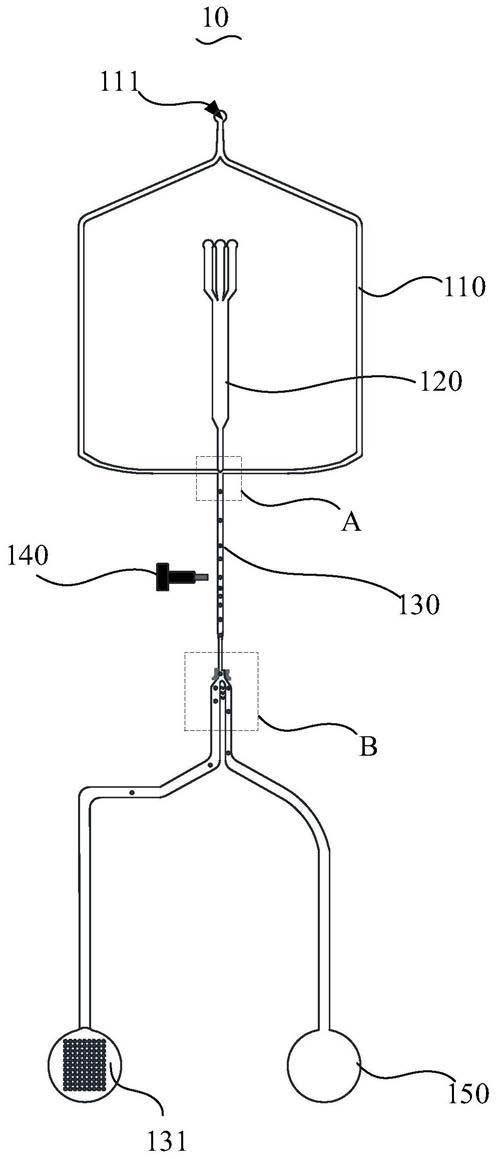
33.10、微流控芯片;110、第一相流道;120、试剂流道;111、第一相加样口;113、第一相出样口;121、试剂出样口;122、标记抗体支路;123、待测样本支路;124、辅助剂支路;125、混合支路;130、液滴流道;131、检测池;132、检测孔;140、第二检测件;141、筛选件;143、筛选通道;150、废液池。
具体实施方式
34.为了便于理解本发明,下面将对本发明进行更全面的描述,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使本发明公开内容更加透彻全面。
35.需要说明的是,当元件被表述“固定于”另一个元件,它可以直接在另一个元件上、或者其间可以存在一个或多个居中的元件。当一个元件被表述“连接”另一个元件,它可以是直接连接到另一个元件、或者其间可以存在一个或多个居中的元件。当使用术语“垂直的”、“水平的”、“左”、“右”、“上”、“下”、“内”、“外”、“底部”等指示方位或位置关系时,是为基于附图所示的方位或位置关系,仅为了便于描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本技术的限制。此外,术语“第一”、“第二”等仅用于描述目的,而不能理解为指示或暗示相对重要性。
36.除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。
37.本技术一实施方式提供了一种基于微流控液滴技术的蛋白抗原的检测方法,该蛋白抗原的检测方法包括步骤s100和步骤s200。具体地:
38.步骤s100、将待测样本与反应试剂混合后,采用微流控技术将待测样本与反应试剂的混合物制成多个液滴。
39.具体地,反应试剂包括标记有标记物的抗体和电解质提供剂,标记有标记物的抗体能与待测样本中的蛋白抗原特异性结合而形成抗原
‑
抗体复合物。电解质提供剂溶于水
后可解离出自由移动的离子而促进凝集反应。在液滴形成的包含多个抗原
‑
抗体复合物和一定浓度的电解质的微环境中,多个抗原
‑
抗体复合物在电解质提供剂解离出的离子的作用下发生凝集反应,从而改变液滴的物理性状(例如浊度增强或者发光强度增强)。因此,通过检测凝集反应后的液滴中凝集反应对应的信号的强度,可以确定液滴中是否有蛋白抗原以及蛋白抗原的多少。
40.在一些实施例中,采用微流控技术制备的液滴是呈油包水状的液滴。也即是将待测样本与反应试剂制成的混合液作为水相,并在该水相外包裹一层油相,从而形成油包水状的液滴。在制备时,采用油相夹流含有待测样本与反应试剂的混合液,从而使得混合液形成的液滴外包裹一层油相,制得油包水状的液滴。在一个可选地具体示例中,油相的材料为矿物油。可以理解的是,油相的材料不限于上述,还可以是其他油相材料。可以理解的是,反应试剂可以为溶液状,也可以为干粉状。在反应试剂为干粉状时,使用时加入相应的水即可。在另一些实施例中,采用微流控技术制备的液滴是含有待测样本与反应试剂的混合液制成的水滴,也即是只有水相。此时,在制备时,采用气相(例如,空气或惰性气体)夹流该混合液,从而形成液滴。
41.具体地,通过控制液滴的尺寸来控制液滴中包裹的抗原
‑
抗体复合物的数量。在一个具体示例中,合格液滴的直径为10μm~15μm。进一步地,合格液滴的直径为0.1μm~1μm。可以理解的是,合格液滴的尺寸不限于上述,可以根据具体蛋白抗原及对应的抗体进行选择和调整。需要说明的是,液滴的尺寸是指含有待测样本与反应试剂的混合液所形成的水相液滴的尺寸,并不包括包裹在混合液外的包裹相的厚度。
42.在一些实施例中,在待测样本与反应试剂的混合物形成液滴之后,还包括检测待测样本与反应试剂形成的液滴的尺寸并根据该尺寸筛选合格液滴的步骤。在其中一个实施例中,反应试剂还包括可与标记物区分的荧光染料。由于荧光染料的荧光分布与液滴的形状相关。也即是,液滴尺寸越大,荧光分布越广。因此,可以通过荧光染料的荧光分布情况来筛选合格尺寸的液滴。另外,还可以通过可与标记物区分的荧光染料的分布均匀与否来确定待测样本与反应试剂是否混合均匀。采用可与标记物区分的荧光染料,避免了该荧光染料对后续凝集反应所对应的信号产生干扰而无法检测凝集反应所对应的信号的强度。在一个具体示例中,荧光染料为荧光素。可以理解的是,荧光染料不限于荧光素,还可以其他可以标记物区分的荧光染料。对应地,检测待测样本与反应试剂形成的液滴的尺寸并根据该尺寸筛选合格液滴的步骤包括:检测待测样本与反应试剂形成的液滴的荧光分布情况并根据该荧光分布情况筛选合格液滴。在检测待测样本与反应试剂形成的液滴为合格液滴时,将合格液滴用于下一步检测;在检测待测样本与反应试剂形成的液滴为不合格液滴时,将不合格液滴弃除。
43.可以理解的是,在其他实施例中,筛选合格液滴的方法不限于上述的在液滴的水相中加入荧光染料的方法,还可以是其他方法。
44.步骤s200:检测、分析凝集反应后待测样本与反应试剂形成的各个液滴中凝集反应对应的信号的强度,以确定待测样本中蛋白抗原的量。
45.在其中一些实施中,抗体的标记物为胶乳微球。在液滴的微环境中,在电解质的作用下,多个抗原
‑
抗体复合物发生凝集而形成凝集团,从而改变了液滴的浊度。因此,在检测凝集反应后待测样本与反应试剂形成的各个液滴中凝集反应对应的信号的强度的步骤中,
检测的是待测样本与反应试剂形成的各个液滴的浊度。进一步地,检测的是待测样本与反应试剂形成的各个液滴的灰度值。
46.在其中一个实施例中,抗体的标记物为聚集诱导发光材料(aggregation
‑
induced emission,aie)。聚集诱导发光材料具有典型的“人多力量大”(越聚集发光越强)的特性。在液滴的微环境中,发光信号被聚集而进一步放大,可以进一步提高蛋白质分析检测灵敏度及特异性。因此,在检测凝集反应后待测样本与反应试剂形成的各个液滴中凝集反应对应的信号的强度的步骤中,检测的是待测样本与反应试剂形成的各个液滴的发光强度。在一个具体示例中,聚集诱导发光材料为聚合物、含氢化合物或碳氢化合物。可以理解的是,在其他实施例中,聚集诱导发光材料不限于上述。可以理解的是,待测样本与反应试剂形成的液滴中凝集反应对应的信号不限于上述的浊度或荧光强度,还可以是其他信号。
47.通过对凝集反应后待测样本与反应试剂形成的各个液滴中凝集反应对应的信号的强度及液滴个数进行检测,得到多个待测样本与反应试剂形成的液滴的信号强度,通过对比这些信号强度与不含抗原
‑
抗体复合物的液滴的信号强度之间的差别,以确定对应的液滴中是否含有抗原
‑
抗体复合物和/或含有的抗原
‑
抗体复合物的量。具体地,在待测样本与反应试剂形成的液滴对应的信号强度大于不含抗原
‑
抗体复合物的液滴的信号强度时,则说明该液滴中含有抗原
‑
抗体复合物;在待测样本与反应试剂形成的液滴对应的信号强度与不含抗原
‑
抗体复合物的液滴的信号强度相当时,则说明该液滴中不含抗原
‑
抗体复合物。因此,对应定性检测时,只要待测样本与反应试剂形成的多个液滴中有液滴的信号强度强于不含抗原
‑
抗体复合物的液滴的信号强度,则说明该待测样本中含有蛋白抗原。
48.在其中一个实施例中,上述检测方法为定性的检测方法。此时,检测凝集反应后待测样本与反应试剂形成的各个液滴中凝集反应对应的信号并分析以确定待测样本中蛋白抗原的量的步骤包括:检测凝集反应后待测样本与反应试剂形成的各个液滴中凝集反应对应的信号强度,获得待测样本与反应试剂形成的各个液滴对应的信号强度;根据待测样本与反应试剂形成的各个液滴对应的信号强度与不含抗原
‑
抗体复合物的液滴的信号强度的差别,判断待测样本与反应试剂形成的各个液滴中是否有液滴是否含有抗原
‑
抗体复合物,从而判断待测样本中是否有蛋白抗原。其中,待测样本与反应试剂形成的液滴对应的信号强度大于不含抗原
‑
抗体复合物的液滴的信号强度时,则说明该液滴中含有抗原
‑
抗体复合物;在待测样本与反应试剂形成的液滴对应的信号强度小于或等于不含抗原
‑
抗体复合物的液滴的信号强度时,则说明该液滴中不含抗原
‑
抗体复合物。可以理解的是,在本文中提及的“待测样本与反应试剂形成的液滴对应的信号强度大于不含抗原
‑
抗体复合物的液滴的信号强度”中的大于是指有一定可靠性的大于,而不是简单数值比较上的大于,也即是需要排除系统误差上的误判。在一些实施例中,上述检测方法为蛋白抗原的定量检测方法。此时,上述检测方法还包括检测标准样本的凝集反应对应的信号强度以确定待测样本中蛋白抗原的浓度的步骤。需要说明的是,标准样本中蛋白抗原的浓度已知。
49.在其中一个实施例中,检测标准样本的凝集反应对应的信号强度以确定待测样本中蛋白抗原的浓度的步骤包括:将与待测样本相同体积的标准样本和反应试剂混合后,采用微流控技术将标准样本和反应试剂的混合物制成多个液滴,其中,与标准样本混合的反应试剂的用量和种类与检测待测样本时的反应试剂相同;检测并统计标准样本与反应试剂形成的各个液滴中凝集反应对应的信号的强度,得到标准样本的信号强度(也即是标准样
本的凝集反应对应的信号强度);根据凝集反应后待测样本与所述反应试剂形成的各个液滴中凝集反应对应的信号的强度,计算待测样本与反应试剂形成的各个液滴的信号强度总和,得到待测样本的信号强度;及根据标准样本中蛋白抗原的浓度、标准样本的信号强度和待测样本的信号强度,计算待测样本中蛋白抗原的浓度。更具体地,待测样本中蛋白抗原的浓度等于待测样本的信号强度与标准样本的信号强度的比值乘以标准样本中蛋白抗原的浓度。
50.可以理解的是,在计算检测标准样本与反应试剂形成的各个液滴的信号强度总和时,可以只计算包裹有抗原
‑
抗体复合物的液滴的信号强度的总和。当然,此时,计算待测样本与反应试剂形成的各个液滴的信号强度总和也同样只计算包裹有抗原
‑
抗体复合物的液滴的信号强度的总和。
51.在另一个实施例中,上述检测方法为定量检测方法,上述检测方法还包括:将多个蛋白抗原的浓度呈梯度变化的标准样本分别与反应试剂混合后,采用微流控技术分别制成对应的多个液滴并检测其凝集反应对应的信号强度,构建蛋白抗原浓度与凝集反应对应的信号强度之间的关系曲线;及根据待测样本的凝集反应对应的信号强度及该关系曲线,计算待测样本中蛋白抗原的浓度。
52.上述蛋白抗原的检测方法利用微流控技术形成包含多个抗原
‑
抗体复合物和电解质的液滴,多个抗原
‑
抗体复合物在液滴的微环境中由于电解质电离的离子的作用发生凝集反应,通过检测凝集反应的对应信号强度而确定待测样本中蛋白抗原的量。与传统的利用微流控技术和夹心法检测蛋白抗原的方法(例如通过单一芯片上多个液滴形成反应器并利用液滴相互融合技术完成样本与捕获抗体及标记抗体的分步检测,最后通过离心收集磁珠来完成最终的信号检测,这种方法达不到数字化检测的效果)相比,上述检测方法不需要清洗和多步加样,操作更简便;并且,上述检测方法试剂用量少,成本更低。此外,上述检测方法利用液滴形成微环境,液滴在微尺度上比表面积大,热和物质在液滴中的传递时间短,有利于反应快速进行,免疫反应时间短,微小的反应变化更容易被放大而检测到,灵敏度高;再者,微流控技术可以快速产生大量均一的液滴,使得大量平行反应能够在短时间内快速进行,并具有良好的重现性。
53.请参阅图1,基于检测微流控技术形成的液滴中抗原
‑
抗体复合物在离子作用下发生凝集反应的信号能检测待测样本中蛋白抗原的量。本技术一实施方式还提供了一种蛋白抗原的检测系统,该检测系统包括检测蛋白抗原的微流控芯片10和检测组件。微流控芯片10包括液滴形成组件、液滴流道130和检测池131。
54.请一并参阅图2和图3,液滴形成组件用于将样本与反应试剂形成的混合物制成多个液滴。液滴形成组件包括第一相流道110和试剂流道120,第一相流道110上设置有第一相加样口111和两个间隔且开口相对的第一相出样口113,第一相加样口111与两个第一相出样口113均连通;试剂流道120上设置有试剂加样口和与试剂加样口连通的试剂出样口121,试剂出样口121靠近两个第一相出样口113,以使经试剂出样口121流出的溶液能被从第一相出样口113流出的第一相包裹而形成液滴。在其中一个实施例中,第一相的材料为油相或气相。更具体地,第一相流道110为三通管状的流道,第一相从其中一条支路流入,并从另外两条支路流出。第一相出样口113位于第一相流道110的用于流出第一相的支路的末端;试剂出样口121位于两个第一相出样口113所在的支路末端的连线的中垂线上。试剂出样口
121和第一相出样口113如此设置便于第一相均匀包裹从试剂出样口121流出的溶液。
55.在图示的实施例中,第一相流道110呈五边形,两个第一相出样口113位于五边形的同一条边上,第一相加样口111位于五边形的与第一出样口所在的边相对的相邻两边的交点和试剂出样口121的连线上,第一相出样口113、试剂出样口121及第一相加样口111大致在一条直线上。可以理解的是,在其他实施例中,第一相流道110的形状不限于上述,可以是其他形状,例如菱形,矩形等。第一相加样口111的位置也不限于上述。例如,第一相加样口111可以位于第一相出样口113所在边的中垂线靠左或右的位置。当然,此时可以将两个第一相出样口113的间隔处设置在靠右或靠左的位置以使由于两段流出通道的路径大致相同。可以理解的是,第一相加样口111的数量也不限于一个,还可以是多个。同样地,第一相出样口113的数量也不限于上述的两个,还可以是其他数量,只要能形成符合要求的液滴即可。
56.在图示的实施例中,试剂流道120为呈四通管状的流道,四通管道的四个支路中的流体的流向相同。因此,即使是从不同支路加入的溶液均能从用于流体流出的支路上流出。在图示的实施例中,试剂流道120的四条支路依次是标记抗体支路122(图中左边的支路)、待测样本支路123(图中中间的支路)、辅助剂支路124(图中右边的支路)和混合支路125(图中靠液滴流道130的支路)。待测样本支路123用于添加待测样本,标记抗体支路122用于添加标记有标记物的抗体,辅助剂支路124用于添加电解质提供剂和其他试剂,混合支路125用于混合从待测样本支路123流出的待测样本、从标记抗体支路122流出的标记有标记抗体和辅助剂支路124流出的电解质提供剂及其他试剂。可以理解的是,在其他实施例中,试剂流道120的支路的条数不限于上述的四条,还可以其他数量。例如,试剂流道120可以为没有支路的流道。此时,可以提前将待测样本与反应试剂混匀后加入到试剂流道120中。又例如,试剂流道120可以为三通管状的流道,此时,将待测样本和反应试剂分别从三通管的其中两个支路加入,剩余的一条支路用于含有待测样本与反应试剂的混合液流出。
57.可以理解的是,对于用于混合其他支路中流出的液体的混合支路125,可以通过增加试其的长度来提高反应试剂与待测样本的混合均一性。例如,将混合支路125设置为s形或波浪形。
58.请参阅图1和图4,液滴流道130用于接收液滴形成组件形成的液滴,液滴流道130与检测池131连通,以使液滴形成组件形成的液滴经液滴流道130进入检测池131。具体地,液滴流道130的出口与检测池131的入口连通。在图4所示实施例中,检测池131有多个间隔的检测孔132。从液滴流道130流出的多个液滴被分配到不同的检测孔132中。也即是,一个检测孔132对应一个液滴,从而实现不同液滴位于不同检测孔132中。在凝集反应结束后,检测不同检测孔132中的液滴中凝集反应对应的信号强度,从而得到各个液滴对应的凝集反应对应的信号强度。在一个具体的示例中,检测孔132以阵列的形式排列。在另一些实施例中,检测池131中也可以只有一个检测孔132,此时可以增长液滴形成位置到达检测孔132之间的路径距离,以满足液滴在流入检测孔132时以完成凝集反应。此时,在检测完凝集反应对应的信号后的液滴能被弃除,且检测池131中的检测孔132能够被清洗。
59.在一些实施例中,检测池131预置有与水相不相容且与第一相不同的第二相。例如,在第一相为气相时,第二相为油相。此时,在液滴落入检测池131时,可以有一个较为完整的液滴形状,便于后续检测。又例如,第一相为油相时,第二相为气相。
60.检测组件用于检测微流控芯片10中凝集反应后的液滴中凝集反应对应的信号强度。检测组件包括第一检测件,第一检测件用于检测检测池131中的液滴的凝集反应对应的信号强度。
61.请参阅图1和图5,在一些实施例中,上述微流控芯片10还包括筛选通道143;筛选通道143的一端与液滴流道130连通,以供液滴流道130中的液滴流入筛选通道143;筛选通道143的另一端分为两条支路,一条支路供合格液滴流动,另外一条支路供不合格液滴流动。
62.对应地,上述蛋白抗原的检测系统还包括液滴筛选组件。液滴筛选组件用于筛选出液滴形成组件形成的液滴中的合格液滴。具体地,液滴筛选组件包括第二检测件140和筛选件141。第二检测件140靠近液滴流道130,用于检测液滴形成组件形成的液滴中反应液滴大小的信号并将其反馈给筛选件141。在一个示例中,第二检测件140用于检测荧光信号并将荧光信号反馈给筛选件141。可以理解的是,第二检测件140还可以根据需要检测的信号对应更换。筛选件141靠近液滴流道130的出口,用于根据第二检测件140反馈的荧光信号筛选出合格液滴,并将合格液滴选入检测池131以供检测件检测。在一些实施例中,第二检测件140可以省略,此时筛选件141可以为根据液滴的带电情况进行分选的部件(类似于流式细胞技术及液滴分选技术)。
63.在一些实施例中,上述微流控芯片10还包括废液池150,废液池150用于承放筛选件141分入的不合格液滴。
64.在使用上述蛋白抗原的检测系统时,将待测样本和反应试剂加入上述微流控芯片10的液滴形成组件中使待测样本与反应试剂形成的混合物在液滴形成组件的作用下陆续形成包裹有抗原
‑
抗体复合物及一定浓度的电解质的液滴,液滴形成组件形成的液滴流入液滴通道130后,检测组件检测液滴中凝集反应对应的信号强度,统计检测组件中检测的液滴的凝集反应对应信号强度,并根据统计结果确定待测样本中蛋白抗原的量。
65.更具体地,对于图示的实施例,从第一相加样口111加入第一相,从试剂管道的用于加待测样本的加样口加入待测样本,从试剂管道的用于加标记有标记物的抗体的加样口加入标记有标记物的抗体,从试剂管道的用于电解质提供试剂和荧光染料的加样口加入电解质提供试剂与荧光染料的混合物。加入的待测样本、标记有标记物的抗体、电解质及荧光素在向靠近液滴流道130的方向(图中为竖直向下)流动的过程中混合,从试剂出样口121流出的混合液与第一相出样口113流出的第一相配合而形成液滴,形成的液滴流入液滴流道130中;液滴在液滴流道130中流动时被第二检测件140检测荧光强度,第二检测件140将检测到的液滴荧光强度反馈给筛选件141,筛选件141根据接收到的第二检测件140反馈的液滴荧光强度信息,将液滴分选入供合格液滴流动的通道或供不合格液滴流动的通道。进入供合格液滴流动的通道的液滴通过该通道进入检测池131的检测孔132;等检测孔132中的液滴完成凝集反应后,采用第一检测件检测检测孔132中液滴的凝集反应对应的信号强度。试剂出样口121不断地流出混合液而被第一相不断地包裹而陆续形成液滴,所形成的液滴按照上述路径进入废液池150或不同的检测孔132中;待再无液滴进入检测池131后,统计检测池131中的液滴的凝集反应对应的信号强度并分析(对信号强度的具体分析可参见上述基于微流控液滴技术的蛋白抗原的检测方法的步骤s200),从而确定待测样本中是否有蛋白抗原以及待测样本中蛋白抗原的量。
66.上述检测蛋白抗原的微流控芯片10使用便捷,不需要多次加样和清洗;并且,上述检测蛋白抗原的微流控芯片10利用液滴的微环境反应速度快、灵敏度高且重现性好。
67.基于上述,本技术一实施方式还提供一种蛋白抗原的检测试剂盒,该检测试剂盒包括上述任一实施例的检测蛋白抗原的微流控芯片和反应试剂。反应试剂包括标记有标记物的抗体和离子提供剂,标记有标记物的抗体能与待测样本中的蛋白抗原特异性结合而形成抗原
‑
抗体复合物,并在液滴中经离子提供剂的作用发生凝集反应。
68.在一些实施例中,反应试剂还包括可与抗体上的标记物区分的荧光染料。
69.在一些实施例中,上述检测试剂盒还包括标准品。
70.在其中一些实施例中,上述蛋白抗原的检测试剂盒为检测c反应蛋白(crp)的检测试剂盒。此时,上述检测试剂盒包括上述任一实施例的检测蛋白抗原的微流控芯片和反应试剂,其中,反应试剂包括胶乳微球或聚集诱导发光材料标记的c反应蛋白抗体、可与聚集诱导发光材料区分的荧光染料和电解质提供剂。
71.上述蛋白抗原的检测试剂盒包括上述检测蛋白抗原的微流控芯片和反应试剂,通过上述检测蛋白抗原的微流控芯片和反应试剂的配合,不必进行多次加样和清洗,使用方便,且上述蛋白抗原的检测试剂盒采用了上述检测蛋白抗原的微流控芯片,也具有相应的优势。
72.以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
73.以上所述实施例仅表达了本发明的几种实施方式,便于具体和详细地理解本发明的技术方案,但并不能因此而理解为对发明专利保护范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。应当理解的是,在本领域技术人员在本发明提供的技术方案的基础上,通过合乎逻辑的分析、推理或有限的试验得到的技术方案,均在本发明所附权利要求的保护范围内。因此,本发明专利的保护范围应以所附权利要求的内容为准,说明书及附图可以用于解释权利要求的内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1