衰老相关差异表达基因在制备细胞衰老诊断试剂盒中的应用
1.本发明属于生物医学技术领域,具体涉及衰老相关差异表达基因在制备细胞衰老诊断试剂盒中的应用。
背景技术:
2.细胞衰老是一种细胞周期停滞的永久状态。衰老细胞会随着机体衰老而累积,释放一系列促炎、促凋亡等因子,导致了与年龄相关的疾病和慢性疾病的发生,如动脉粥样硬化、2型糖尿病、关节炎、特发性肺纤维化和肝病等。因此,衰老细胞的鉴定、表征和药理消除在衰老研究领域受到关注。
3.细胞衰老是器官及个体衰老的基础,其过程受遗传和环境等多种复杂因素影响。长期以来,科学界对调控衰老的具体分子机制尚不明确,对细胞衰老的鉴定、诊断及干预的靶点也缺乏系统的标志物。
4.细胞衰老是正常衰老和衰老病理的核心发育程序,在转录后水平受到强烈调控。近年来,m6a rna的甲基化在年龄相关疾患的发生发展及其治疗和预后的关联变得非常紧密,包括肥胖、免疫调节及肿瘤等,可调节与细胞增殖、迁移侵袭、细胞周期进程、细胞凋亡和自噬过程相关的靶基因的表达。在衰老的细胞中,我们发现,年轻细胞和衰老细胞差异表达的基因在rna甲基化水平具有不同的特征,这种差异特征,为衰老的鉴定提供了证据与方法,并为年龄相关疾患的干预提供了治疗的靶点。
5.sirt3位于线粒体内,基因敲除后能使小鼠发展多种衰老疾病,能够调节线粒体生物学中的几乎每种主要功能,包括ros解毒,atp生成等,多种研究显示sirt3的衰减或消融与多种衰老疾病的加速发展有关。目前未见报道e2f3在衰老过程中的调控作用,但m6a修饰参与mirna/e2f3介导的胃癌细胞增殖抑制。irs2在肿瘤的发生和治疗中发挥重要作用的因子,也有报道其在神经退行性疾病中发挥作用,但它们的m6a修饰与衰老之间的联系报道尚未有报道。
技术实现要素:
6.为了克服现有技术中存在的缺点与不足,本发明的目的在于提供衰老相关差异表达基因在制备细胞衰老诊断试剂盒中的应用。
7.本发明的目的通过如下技术方案实现:
8.衰老相关差异表达基因在制备细胞衰老诊断试剂盒中的应用。
9.进一步地,所述的衰老相关差异表达基因为如下基因的一种或多种组合:sirt3(ncbi登录号:nm_012239.6)、e2f3(ncbi登录号:nm_001949.5)、irs2(ncbi登录号:nm_003749.3)。
10.进一步地,所述的细胞衰老诊断试剂盒是通过分析细胞中衰老相关差异表达基因的蛋白表达情况,和/或m6a rna甲基化修饰水平,从而诊断细胞衰老情况,即,
11.(1)当分析结果为如下情况的一种或多种组合时,判断细胞进入衰老状态:
12.a.sirt3蛋白表达升高;
13.b.e2f3蛋白表达升高;
14.c.irs2蛋白表达升高或降低;
15.d.sirt3 m6a rna甲基化修饰水平升高;
16.e.e2f3 m6a rna甲基化修饰水平升高;
17.f.irs2 m6a rna甲基化修饰水平升高;
18.(2)当分析结果为如下情况的一种或多种组合时,判断细胞为复制性衰老细胞:
19.a.irs2蛋白表达降低;
20.b.irs2 m6a rna甲基化修饰水平升高;
21.(3)当分析结果为如下情况的一种或多种组合时,判断细胞为早衰细胞:
22.a.sirt3m6a rna甲基化修饰水平升高;
23.b.e2f3 m6a rna甲基化修饰水平升高;
24.其中,细胞中衰老相关差异表达基因的蛋白表达情况和m6a rna甲基化修饰水平,均以年轻细胞为对照,采用相对定量分析法确定。
25.所述的年轻细胞的定义为:群体倍增水平pdl小于或等于其寿命的50%的细胞;
26.所述的复制性衰老细胞的定义为:群体倍增水平pdl大于或等于其寿命的90%的细胞;
27.所述的早衰细胞为年轻细胞应激诱导的衰老细胞,应激因素包括但不限于氧化应激;
28.其中,pdl的计算公式为n=3.32(logn2-logn1)+x,n2为该代细胞收获的细胞总数,n1为上代接种的细胞数,x为上代细胞的pdl。
29.进一步地,所述的细胞衰老情况通过以下步骤诊断:
30.(1)提取待测细胞总蛋白,以年轻细胞为对照,进行待测细胞中衰老相关差异表达基因的蛋白半定量;
31.(2)提取待测细胞总rna;rna甲基化免疫共沉淀法(merip)富集m6a rna甲基化片段,洗脱,纯化,得到待测样品;取待测样品进行逆转录和实时荧光q-pcr定量;
32.(3)根据步骤(1)所得衰老相关差异表达基因的蛋白半定量结果和步骤(2)所得衰老相关差异表达基因的m6a rna甲基化水平检测结果诊断细胞衰老情况。
33.进一步地,所述的衰老诊断试剂盒中含有衰老相关差异基因蛋白提取试剂、蛋白特异性抗体和westernblot实验试剂、m6a rna甲基化片段富集试剂和扩增引物,以及m6a rna甲基化测序和分析试剂中的一种或多种组合。
34.其中,所述的扩增引物包括:
35.sirt3-f:5'-gaccaacatgctagaagtgcgg-3';
36.sirt3-r:5'-aagctcggcatctgttggttac-3';
37.e2f3-f:5'-aaacctttctcctctggcctcc-3';
38.e2f3-r:5'-caggggaggcagtaagttcaca-3';
39.irs2-f:5'-ctgtgagagcagtgggtgatga-3';
40.irs2-r:5'-tggagtctgaatgcctagccag-3'。
41.所述细胞是随年龄增加而逐渐衰老的细胞;优选为人胚肺成纤维细胞。
42.本发明基于人胚肺成纤维细胞复制性衰老及过氧化氢诱导的早衰模型,通过观察细胞衰老进程中一般生物学性状改变及衰老相关基因的表达特征和m6a rna甲基化特征,筛选得到可用于鉴定及诊断细胞衰老的基因:sirt3、e2f3、irs2。
43.本发明相较于现有技术具有如下的优点和有益效果:
44.本发明利用人胚肺成纤维细胞作为细胞衰老的模型。人胚肺成纤维细胞对外源h2o2的抵抗力低于子宫内膜干细胞和真皮成纤维细胞,更容易受氧化应激影响,并且其衰老特征的形成过程已经明确定义。因此,人胚肺成纤维细胞为研究衰老相关的潜在机制和标志物提供了有用的实验模型。
45.本发明基于人胚肺成纤维细胞建立了复制性衰老模型及过氧化氢诱导的早衰模型。所述模型是评价细胞早衰和细胞复制性衰老有力的工具。
46.本发明经过筛选与验证,首次发现sirt3、e2f3、irs2这3个基因的蛋白表达水平及m6a rna甲基化修饰水平,可用于鉴定及诊断细胞的衰老的状态,解决了目前在细胞衰老领域存在的诊断标志物欠缺问题,为细胞早衰及年龄相关疾患的早期预防和靶向治疗提供参考依据。
附图说明
47.图1为各组细胞形态学观察及β-半乳糖苷酶染色鉴定结果图;其中,a为光学显微镜下各组细胞形态学变化,200
×
,标尺:100μm;b为光学显微镜下sa-β-半乳糖苷酶染色结果,200
×
,标尺:100μm;c为sa-β-半乳糖苷酶染色的蓝染比例,均值
±
标准差,n=3,*p《0.05,**p《0.01,***p《0.0001,ns为差异无统计学意义(p》0.05),与22pdl或49pdl比较。
48.图2为衰老相关基因的蛋白表达情况图;其中,a为western blot检测4种基因的蛋白表达情况;b为imagej软件对甲基转移酶的蛋白条带进行定量分析,22pdl定量为1,计算相对定量结果;n=3,与22pdl和49pdl比较,*p《0.05,**p《0.01,***p《0.0001,ns为差异无统计学意义(p》0.05)。
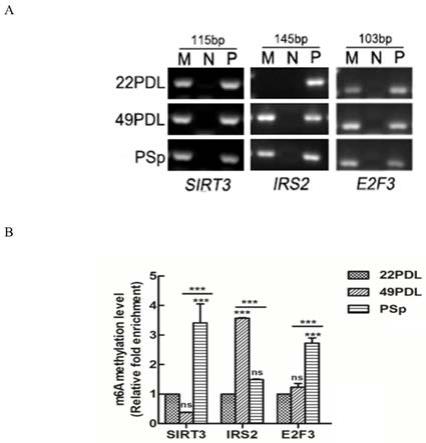
49.图3为衰老相关基因甲基化水平图;其中,a为凝胶电泳图,qpcr产物进行琼脂糖凝胶电泳,m表示“ip”,n表示阴性对照(negative)“igg”,p表示阳性对照(positive)“rna input”;b为merip-qpcr检测的衰老相关基因3’utr区域的m6a甲基化水平;22pdl为1,另外2组为相对于22pdl的甲基化水平,n=3,与22pdl和49pdl相比,*p《0.05,**p《0.01,***p《0.0001,ns为差异无统计学意义(p》0.05)。
具体实施方式
50.下面结合具体实施例,进一步阐述本发明,但引用实施例仅用于说明本发明而不用于限制本发明的范围。本领域专业人员在没有进行创造性劳动的前提下做出的基于本发明的其他实施例,都属于本发明的权利保护范围。
51.除有特别说明,本发明中用到的各种试剂、原料均为可以从市场上购买的商品或者可以通过公知的方法制得的产品。
52.下述实施例中所用的细胞为人胚肺成纤维细胞ccc-hpf-1来源于中国医学科学院基础医学研究所细胞资源中心。
53.实施例1
54.(1)细胞培养
55.细胞置于温度37℃、相对湿度95%及co2体积分数为5%的细胞培养箱中无菌培养。培养液为l-dmem低糖培养基。当细胞融合度达到90%时,按实际需要进行细胞传代(1:2,1:3或1:4),并进行细胞计数。群体倍增水平(population doubling levels,pdl)的计算公式为n=3.32(logn2-logn1)+x,其中n为继代培养细胞最终的pdl,n2为该代细胞收获的细胞总数,n1为上代接种的细胞数,x为上代细胞的pdl。
56.(2)早衰细胞模型和复制性衰老细胞模型
57.早衰细胞模型:利用年轻细胞组22pdl进行h2o2染毒,将相同数目的22pdl接种至细胞培养瓶中(1:3传代),待细胞增长至其50%融合度时,使用终浓度400μmol/lh2o2染毒4d,每天固定时间染毒一次,每次染毒2h。连续染毒4d获得细胞早衰起始组(premature senescence initiation group,psi);连续染毒4d后,换不染毒的l-dmem低糖培养基继续培养7d后获得细胞早衰持续组(premature senescence persistence group,psp)。
58.复制性衰老细胞模型:正常人胚肺成纤维细胞在体外连续传代培养至52pdl时,细胞停止增殖,呈现深度的复制性衰老状态。根据体外细胞培养年龄的定义:当培养细胞pdl小于或等于其寿命的50%时,获得年轻细胞;大于或等于90%时,获得衰老细胞;介于50%~90%之间时,获得中年细胞。本实验hefs复制性衰老模型中,细胞分组为年轻细胞组22pdl,中年细胞组35pdl,复制性衰老细胞组49pdl(参考文献“张文娟,纪卫东,杨淋清,等.细胞衰老过程中p53表观遗传学修饰[j].毒理学杂志,2009,23(1):1-4.”)。
[0059]
(3)衰老细胞表型鉴定
[0060]
利用β-半乳糖苷酶染色实验观察并验证细胞的衰老状态。操作步骤如下:
[0061]
1)吸除6孔板中培养细胞的细胞培养液,用pbs洗涤1次,加入1mlβ-半乳糖苷酶染色固定液,室温固定15min;
[0062]
2)吸除细胞固定液,用pbs洗涤细胞3次,每次3min;
[0063]
3)吸除pbs,每孔加入1ml染色工作液(β-半乳糖苷酶染色液a 10μl+β-半乳糖苷酶染色液b10μl+β-半乳糖苷酶染色液c 930μl+x-gal溶液50μl);
[0064]
4)用保鲜膜封住6孔板防止蒸发,置于37℃无二氧化碳培养箱中孵育过夜;
[0065]
5)在普通光学显微镜下观察细胞衰老情况。每组细胞选取显微镜下三处不同的视野观察,计算每个视野中细胞总数和蓝染细胞数,最后计算蓝染细胞数占细胞总数的比率。
[0066]
(4)western blot蛋白表达水平测定
[0067]
5.1细胞总蛋白的提取和蛋白定量
[0068]
细胞总蛋白提取:收集细胞,每100万细胞加入含1%pmsf的ripa裂解液60μl,轻轻吹打,置于冰上裂解10min,震荡,重复三次,4℃,15000rpm,离心5min,将上清液转移至新的1.5ml离心管,即得到相应蛋白样品。
[0069]
按照bca蛋白浓度测定试剂盒操作说明对上述制备的蛋白样品进行定量:
[0070]
蛋白标准品的准备:取0.8ml蛋白标准配制液加入到一管蛋白标准(20mg bsa)中,充分溶解后配制成25mg/ml的蛋白标准溶液。取适量25mg/ml蛋白标准,稀释至终浓度为1mg/ml;
[0071]
bca工作液的配制:按照50:1的体积比加入试剂a和试剂b,充分混匀;
[0072]
蛋白浓度检测:将标准品按0、1、2、4、8、12、16、20μl加到96孔板的标准品孔中,加
标准品稀释液补足到20μl;加入20μl样品,每组平行设置3个复孔;各孔加入200μl bca工作液,37℃放置30分钟;用酶标仪测定562nm处的吸光度;根据标准曲线和使用的样品体积计算出样品的蛋白浓度。
[0073]
5.2sds-page电泳分离蛋白
[0074]
1)制备sds-page电泳分离胶
[0075]
2)制备sds-page电泳浓缩胶
[0076]
3)将分离胶缓慢灌注于事先装配好的制胶板中,加至小玻板2/3宽处时加入无水乙醇封胶,室温静置30min,去除无水乙醇,灌注浓缩胶后迅速插入齿梳,静置30min-45min,待其凝固;
[0077]
4)电泳装置装配好后,在左边加入1μl marker后,依次在各上样孔加入20μg蛋白样品,最后在右边加入5μl marker作为指示蛋白;
[0078]
5)设定恒定电压为80v电泳20min后,待溴酚蓝指示蛋白迁移到浓缩胶和分离胶交界处时,调节电压120v,电泳60min,直至溴酚蓝指示蛋白到达胶底后停止电泳。
[0079]
5.3转膜(湿转)
[0080]
1)取下胶板,根据指示蛋白准确切取目的蛋白的胶带;
[0081]
2)准备与胶带面积相当的pvdf膜,pvdf膜在100%甲醇中激活10s,然后放进蒸馏水中漂洗3min,再转移至转膜液中平衡5min。同时将2张滤纸放入转膜液中浸泡5min;
[0082]
3)制作传统“三明治”夹心结构,层层对齐,不留气泡,将转膜系统置于盛有转膜缓冲液的电泳仪中,设定恒定电压200ma,冰水浴转膜60min。
[0083]
5.4免疫反应
[0084]
1)湿转终止后,pvdf膜剪角以示正反,tbst漂洗2次,封闭液摇床缓慢轻摇封闭4h或4℃冰箱封闭过夜;
[0085]
2)将pvdf膜取出,置于按照适宜比例稀释后的一抗抗体中,室温下摇床缓慢轻摇孵育2h或4℃孵育过夜;
[0086]
3)用tbst冲洗pvdf膜3次,每次10min;
[0087]
4)根据一抗来源选取二抗类型,将二抗按照1:5000比例稀释,其中,sirt3、e2f3、irs2这三种蛋白对应的二抗为anti-rabbit igg(英国abcam公司ab6721),β-actin对应的二抗为anti-mouse igg(英国abcam公司ab6789),室温摇床缓慢轻摇1h;
[0088]
5)二抗孵育结束后,用tbst漂洗pvdf膜3次,每次10min。
[0089]
6)将pvdf膜放置显影板上,等量混合ecl显影液的a液和b液,均匀滴至pvdf膜表面,进行自动曝光,拍照保存;
[0090]
7)利用image-pro plus 6.0软件对蛋白条带进行半定量分析。
[0091]
(5)m6a rna甲基化免疫共沉淀
[0092]
6.1rna片段化
[0093]
1)用depc水将rna浓度调节至1μg/μl。每个200μl pcr管分装18μl(即18μg)的总rna。加入2μl的fragmentation buffer 10
×
(货号cs220011)。吹打,充分混合,上下颠倒混匀;(对于300μg的总rna,需要17管。)
[0094]
2)将pcr仪预热至94℃。在加热盖关闭的情况下,在pcr仪中一次孵育5个试管5min。从仪器中取出试管,然后立即向每支试管中加入2μl 0.5m edta(货号cs203175)。涡
旋并旋转试管,将其放在冰上。重复此步骤,直到所有rna都片段化;
[0095]
3)收集所有试管的内容物于新的1.5ml ep管中,加入1/10体积的3m乙酸钠(ph 5.2),糖原(最终100μg/ml)和2.5体积的100%乙醇。混合内容物,并于-80℃孵育过夜;
[0096]
4)在4℃,15,000g离心25min。丢弃上清液,注意不要破坏沉淀,由于存在糖原,很容易看到沉淀;
[0097]
5)用1ml 75%(vol/vol)乙醇洗涤沉淀,然后4℃,15,000g,离心15min;
[0098]
6)小心吸除上清液,待自然晾干,加入300μl depc水重悬沉淀。
[0099]
6.2制备用于免疫沉淀的磁珠
[0100]
1)制备样品1
×
ip缓冲液:将5
×
ip缓冲液用depc水稀释5倍,制备成5ml 1
×
ip缓冲液,即:4ml depc水+1ml 5
×
ip缓冲液,放置于新的15ml离心管中,置于冰上备用;
[0101]
2)标记适当数量的ep管:每组样品准备2个1.5ml微量离心管,一管用于抗m6a抗体和一管阴性对照正常小鼠igg;
[0102]
3)拿出magna chip蛋白a/g磁珠,充分分散和重悬直到看不见成团的珠子;
[0103]
4)步骤2中准备的ep管,每管加入50μl magna chip蛋白a/g磁珠;
[0104]
5)每管中加入磁珠体积10倍的量的第一步制备的1
×
ip缓冲液,即每50μl体积原始磁珠加入500μl merip稀释缓冲液,轻轻地吹打混匀使磁珠完全重悬;将试管放在磁力分离架上1min;
[0105]
6)小心吸除上清液,确保不要吸到任何磁珠。从磁力分离架上拆下ep管;
[0106]
7)重复步骤4)和步骤5),再洗一次;
[0107]
8)加入200μl 1
×
ip缓冲液,重悬50μl原始磁珠量的磁珠,向标记m6a的ep管中加入10μg抗m6a抗体,标记igg的ep管加入10μg igg作为后续的阴性对照;
[0108]
9)室温,旋转孵育30min;
[0109]
10)短暂离心后,将其放在磁力分离架上1min,然后去除上清液;
[0110]
11)从磁力分离架上取下ep管。向每个ep管中加入0.5ml的1
×
ip缓冲液,并轻柔吹打几次以完全重悬磁珠。将ep管放在磁力分离架上1min,然后去除上清液;
[0111]
12)重复步骤10),继续洗两次。确保上清去除干净,仅留下磁珠;
[0112]
13)磁力分离架上取下ep管,将其放在冰上。关闭ep管盖,以免磁珠变干。这些样本将在下面免疫沉淀部分的第3步中使用。
[0113]
6.3免疫沉淀(merip)
[0114]
1)取出30μg总rna(10%作为input),并将其放入标有“rna input”的新ep管中。将input样品放在-80℃保存。该样品将用于生成标准曲线或用于qpcr方法中的比较,或用于rna-seq中的输入对照;
[0115]
2)配置300μg总rna的1000μl merip反应混合物(表1):
[0116]
表1 merip反应混合液
[0117][0118]
3)向制备好的每个磁珠-抗体管中加入500μl merip反应混合物。轻轻吹打几次以完全重悬磁珠,放在冰上;
[0119]
4)将所有ep管放在4℃旋转孵育2h;
[0120]
5)短暂离心ep管,以除去ep管的盖子和侧面上的液体。放在磁力分离架上1min;
[0121]
6)吸除上清,小心不要碰到磁珠;
[0122]
7)从磁力分离架上取下ep管,每管加入500μl预冷的1
×
ip缓冲液,并轻轻吹打几次以完全重悬磁珠;
[0123]
8)将ep管放在磁力分离架上1min,然后弃去上清液;
[0124]
9)重复上述洗涤程序(步骤7)至步骤8))2次,共洗涤3次;
[0125]
10)将准备好的ep管放在冰上,立即进行下步洗脱。
[0126]
6.4洗脱
[0127]
1)制备20mm m6a盐:将10mg n6甲基腺苷-5'单磷酸钠盐(m6a)(货号cs220007)溶解在1.3ml depc水中。每管150μl分装后,储存于-20℃;
[0128]
2)制备洗脱缓冲液:每个管大概准备225μl,45μl 5
×
ip缓冲液(cs220009)+75μl步骤1中制备的20mm m6a盐+3.5μl rnase inhibitor(cs216138)+101.5μl depc水,将混合液混匀备用;
[0129]
3)加200μl洗脱缓冲液至预先制备好的磁珠中,轻轻吹打几次混匀,完全重悬磁珠;
[0130]
4)将所有ep管放在4℃下连续振荡洗脱1h;
[0131]
5)短暂离心ep管,以去除ep管盖和管壁的液体,放在磁力分离架上1min;
[0132]
6)将上清液转移至新的1.5ml ep管中,特别注意不要吸出磁珠,否则会增加背景噪音;
[0133]
7)重复上述步骤3)-步骤6),即洗脱两次,将来自同一样品的所有洗脱液合并,每种样品总洗脱体积应为200μl。
[0134]
6.5纯化rna片段
[0135]
1)根据rneasy mini试剂盒说明书,将上述200μl样品转移到新的15ml锥形管中。加入700μl buffer rlt,并充分混合;
[0136]
2)加入1400μl无水乙醇,然后吹打,充分混合,不要离心,立即进入下一步;
[0137]
3)将其中700μl样品转移到rneasy minelute旋转柱中并将其置于2ml收集管上,轻轻合上盖子,以≥8,000
×
g(≥10,000rpm)的速度离心15s,丢弃收集管中的液体,将另外700μl样品转移到离心管中,丢弃液体。重复该过程,直到所有样品上样完毕;
[0138]
4)将rneasy minelute旋转柱放在新的2ml收集管中,将500μl buffer rpe加至离
心柱中。轻轻合上盖子,以≥8,000
×
g(≥10,000rpm)的速度离心15s,以洗涤离心柱膜。弃去收集管中的液体,在下步中重复使用此收集管;
[0139]
5)在rneasy minelute离心柱中加入50μl 80%乙醇,轻轻合上盖子,并以≥8000
×
g(≥10,000rpm)的速度离心2min,以洗涤离心柱膜,同时弃去收集管和其中的液体;
[0140]
6)将rneasy minelute旋转柱放在新的2ml收集管中(rna纯化试剂盒中提供),打开离心柱的盖子,15,000rpm离心5min,弃去收集管和其中的液体;
[0141]
7)将rneasy minelute旋转柱放在新的1.5ml收集管中(由rna纯化试剂盒提供)。将14μl无rnase的水直接添加到离心柱膜的中心,轻轻合上盖子,并15,000rpm离心1min以洗脱rna,洗脱的rna可储存于-80℃。所制的rna样品用于后续的qpcr。
[0142]
6.6逆转录
[0143]
1)根据说明书,将m6a样品和阴性对照igg合成cdna,每管28μl反应体系(表2)
[0144]
表2逆转录体系组成成分
[0145][0146][0147]
2)混匀后进行反转录反应,条件如下:
[0148]
37℃ 15min(反转录反应)
[0149]
85℃ 5sec(反转录酶的失活反应)
[0150]
4℃ forever
[0151]
合成的cdna置于-20℃冰箱内保存。
[0152]
6.7 qpcr及定量计算
[0153]
具体步骤如下:
[0154]
1)根据测序结果中展示的m6a rna甲基化修饰基因位点,在ucsc网站中查找相应的mrna对应的dna序列,用此序列在primer3中设计引物,引物序列见表3。
[0155]
表3引物序列
[0156][0157]
2)按照表4所示组分配制pcr反应液
[0158]
表4 pcr反应液
[0159][0160]
3)进行real time pcr反应
[0161]
step1:95.0℃ 30s
[0162]
step2:95.0℃ 5s
[0163]
step3:60℃ 30s
[0164]
+plate read
[0165]
step4:goto
②
,39more times
[0166]
step5:95.0℃for 10s
[0167]
step6:melt curve 65.0to 95.0℃,increment 0.5℃
[0168]
for 5s+plate read
[0169]
end
[0170]
4)输出ct值。
[0171]
6.8定量计算甲基化的富集倍数
[0172]
1)三个复孔求平均ct值,每个基因分别包括m6a、input、igg三种样;
[0173]
2)归一化:δct
m6a
=ct
m6a
–
(ct
input
–
log210);
[0174]
3)计算ip下来的rna中某基因占input中此基因的百分比:%input=2-δctm6a
[0175]
4)排除非特异性富集后,目的基因在igg中的比值:δδct
m6a
=δct
m6a-δct
igg
[0176]
5)最后计算甲基化富集倍数:fold enrichment=2-δδctm6a
。
[0177]
6.9pcr产物进行琼脂糖凝胶电泳
[0178]
1)配制2%浓度的胶:0.6g琼脂糖+30ml 1
×
tbe;
[0179]
2)煮沸,加入1μl核酸染料混匀,待液体变温后,倒入水平板中,插入梳子;
[0180]
3)待胶凝固后,放入水平电泳槽中,并加入1
×
tbe浸没dna胶;
[0181]
4)上样:dna样品中,按照相应比例加上样缓冲液loading buffer,每孔上样5μl,dna marker上样3μl;
[0182]
5)电泳:120v,25min。
[0183]
6)显影:胶放于凝胶成像仪中,打开紫外光,直接拍摄照片,并保存。
[0184]
实验结果及分析:
[0185]
(1)细胞形态学观察及β-半乳糖苷酶染色鉴定细胞衰老的发生
[0186]
如图1a所示,光学显微镜下显示随细胞代龄增加,细胞形态由纤长逐渐变大铺平,早衰起始组psi组细胞变大扁平,psp组细胞与49pdl相似,细胞核变大,有些细胞皱缩走向死亡。如图1b中sa-β-半乳糖苷酶染色结果显示,49pdl与psp组细胞内蓝染细胞数量最多,
sa-β-半乳糖苷酶表达增加,分别是22pdl的42.2和37.9倍,psp和49pdl之间无明显差异。psi组蓝染细胞数是22pdl的16.3倍,低于49pdl和psp;如图1c所示,随着代龄增加,sa-β-半乳糖苷酶表达也逐渐增加。
[0187]
(2)衰老相关基因的蛋白表达情况
[0188]
如图2所示,sirt3的蛋白表达随代龄增加而增加,早衰细胞中的表达也高于年轻组(p《0.05),差异有统计学意义(p《0.05),49pdl的蛋白表达高于psp(p《0.05);e2f3基因49pdl组的蛋白表达均高于psp组(p《0.05)。irs2基因中,psp的蛋白表达高于49pdl(p《0.05)。
[0189]
(3)衰老相关基因m6a rna甲基化水平
[0190]
rna片段化后,进行免疫沉淀,将含有m6a修饰的基因片段沉淀下来,然后进行实时荧光定量pcr检测。根据图3a所示,将qpcr产物进行琼脂糖凝胶电泳,条带在100bp-200bp间,“ip”与“input”样品有条带,更直观地说明设计的引物能成功地扩增出dna产物,阴性对照“igg”无扩增条带。
[0191]
通过qpcr检测计算甲基化富集倍数,如图3b所示,sirt3在psp组中的甲基化水平高于22pdl和49pdl,分别是22pdl和49pdl的3.4、9.0倍,差异有统计学意义(p《0.05);与22pdl相比,49pdl中irs2甲基化水平升高,是22pdl的3.6倍(p《0.05),psp组差异无统计学意义(p》0.05),另外,49pdl的甲基化水平高于psp组,差异有统计学意义(p《0.05);e2f3的甲基化水平psp组高于22pdl和49pdl,分别是其2.7和2.2倍(p《0.05)。
[0192]
sirt3是nad+依赖的组蛋白脱乙酰基酶家族,与sir2具有同源性,sir2被认为参与低等生物体中与卡路里限制相关的寿命延长,sirt3位于线粒体内,基因敲除后能使小鼠发展多种衰老疾病,能够调节线粒体生物学中的几乎每种主要功能,包括ros解毒,atp生成等,多种研究显示sirt3的衰减或消融与多种衰老疾病的加速发展有关。本发明首次发现,sirt3的高甲基化能够促进转录后翻译,从而引起细胞早衰。
[0193]
e2f3m6a修饰参与mirna/e2f3介导的胃癌细胞增殖抑制。本发明首次发现,早衰细胞中e2f3 m6a甲基化水平高于复制性衰老组,甲基化水平升高促进蛋白表达,是细胞发生早衰的原因。irs2是在肿瘤的发生和治疗中发挥重要作用的因子,也有报道其在神经退行性疾病中发挥作用。本发明首次发现,复制性衰老细胞中irs2高甲基化抑制其蛋白的表达,h2o2处理细胞后irs2的甲基化程度减轻从而蛋白表达升高,调控早衰的发生。
[0194]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受所述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1