一种检测氢键结构的固体核磁共振方法
1.本发明涉及固体核磁共振波谱学领域,尤其涉及基于固体核磁共振技术检测氢键的实验 技术。
背景技术:
2.氢键是一种广泛存在的非共价化学键,通常是指以氢原子为媒介在两个高电负性且半径 较小的原子之间形成的分子内或分子间相互作用,可以用x-h
…
y表示(x,y可以为f、o、 n等原子)。在分子缔合过程中,氢键发挥着重要的作用,影响物质的结构、功能和动力学特 征。例如,在超分子化学中,氢键能精准地控制和引导分子的结构;在生物大分子中,如核 糖核酸、蛋白质等,氢键是结构单元的基础,通过氢键可以形成复杂的二级、三级结构,从 而发挥正常的生理功能。氢键自发现以来引起了广泛的研究兴趣。在众多学科和学科分支中, 包括材料科学、化学(无机和有机化学、超分子化学、生物化学)、分子医学和药学等,氢键 的观测以及强度的检测都是研究中的重要内容。因此,对氢键的检测是至关重要的研究内容。
3.目前常见的氢键结构研究方法包括x-ray晶体衍射技术、中子衍射技术、红外光谱技术、 核磁共振技术等。其中x-ray晶体衍射技术要求样品形成规整的单晶结构,不适合难结晶样 品的研究,并且通常不能直接观测氢原子。中子衍射技术可探测分子振动模式,但应用普及 率较低。红外光谱可以对氢键键和方式进行研究,但不能提供特异性位点信息。核磁共振技 术可以提供丰富的结构信息,且应用范围广,但也面临着缺少普适性检测方法等难题。因此, 本发明发展了特异性检测n-h
…
n和n-h
…
o=c氢键的固体核磁共振方法。
4.固体核磁共振技术可以提供固体样品在原子尺度上的结构信息,具有样品形式多样、无 分子量限制、无损性检测等优点。固体核磁共振在溶解度较低的、与相变相关的蛋白-蛋白、 蛋白-核酸聚合物的研究中有突出的优势,可以获取其他技术手段无法得到的聚合物内部的 结构信息。目前,已有多个氢键结构分析的固体核磁共振技术,包括二维
15
n-15
n rfdr实验 和二维氢检测1h-15
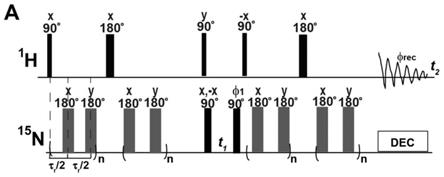
n hcn(par)nh实验等。二维rfdr实验通过采集
15
n-15
n二维谱,获取 距离较近的
15
n原子之间的关联信息,间接证明n-h
…
n氢键,但无法直接证明氢键的存在。 并且此方法采用
15
n检测,灵敏度低。二维氢检测1h-15
n hcn(par)nh实验利用质子辅助偶 极重耦机制(par)实现
15
n-15
n的传递,通过针对n-h
…
n的氢键长度、角度等参数的优化, 可以实现n-h
…
n氢键的检测。但是,par机制传递效率优化较为困难,实际应用难度较大。 因此,目前现有的可检测氢键的固体核磁共振方法依然面临准确性低、灵敏度低、实验设置 困难等技术瓶颈。基于此,本发明的目标是发展高灵敏、高准确度、且设置简单的特异性氢 键结构检测的固体核磁共振方法。
技术实现要素:
5.有鉴于此,本发明提供了一种检测氢键结构的固体核磁共振方法,包括如下步骤:(1) 用π/2脉冲激发rna样品的1h原子核;(2)在rna样品的x原子核上每隔半个转动周期 施
加π脉冲2个;(3)在rna样品的1h原子核上施加π脉冲;(4)在rna样品的x原子 核上每隔半个转动周期施加π脉冲2个;(6)rna样品的1h和x原子上施加90
°
脉冲;(7) 在x维记录化学位移t1;(8)在rna样品的1h和x原子核上施加90
°
脉冲;(9)重复第2、 3、4步操作;(10)采集1h的信号t2;所述x为
15
n或
13
c。
6.在本发明的具体实施例中,所述1h原子核上施加的π/2脉冲是1.9μs、π脉冲是3.8μs。
7.在本发明的具体实施例中于,所述
15
n原子核上施加的π脉冲为9.2μs。
8.在本发明的具体实施例中,所述
13
c原子核上施加的π脉冲为7.0μs。
9.在本发明的具体实施例中,所述用π/2脉冲激发rna样品的1h原子核和在rna样 品的x原子核上每隔半个转动周期施加2个π脉冲之间还包括步骤:施加1h-15
n cp;在
15
n 原子核上施加形状脉冲;利用missisippi脉冲序列对水的信号进行压制;施加
15
n-1
h cp。
10.在本发明的具体实施例中,所述施加1h-15
n cp的设定条件为:接触时间为1ms,
15
n的 连续锁场功率设为50khz,1h的锁场功率为90khz
11.在本发明的具体实施例中,所述在
15
n原子核上施加形状脉冲的激发时间为625μs。
12.在本发明的具体实施例中,所述施加
15
n-1
h cp的设定条件为:接触时间为300μs,
15
n 的连续锁场功率设为50khz,1h的锁场功率为90khz。
13.在本发明的具体实施例中,所述形状脉冲包括q3,gaussi,square,sinc,rsonb, reburp,crp,reburp。
14.本发明方法的主要优点如下:(1)采用氢检测技术,方法灵敏度高;(2)通过构建1h-15
n 二维谱观测相关信号,准确度高;(3)tedor脉冲参数设置简单,且对氢键角度、长度等无 限制;(4)获取氢原子与氢键中两个氮原子的化学位移相关,可在原子水平上直接观测氢键。 (5)通过选择性脉冲与tedor脉冲的组合,有效降低了谱图重叠情况;(6)n-h
…
n氢键 中通过化学键相连的n-h之间的距离约为而通过氢键相连的h,n原子之间的距离 约为因此,利用1h-15
n tedor实验,通过设置不同的混合时间,分别检测化学键相 连的nh基团,以及通过氢键相连的氢原子和氮原子,进行结构鉴定和表征。
附图说明
15.图1a是二维1h-15
n tedor脉冲序列示意图;其中,φ1=x,x,x,x,-x,-x,-x,-x;φrec=x,
ꢀ‑
x,x,-x,-x,x,-x,x;τr/2代表半个转动周期。
16.图1b是二维1h-13
c tedor脉冲序列示意图;其中,φ1=x,x,x,x,-x,-x,-x,-x;φrec=x,
ꢀ‑
x,x,-x,-x,x,-x,x;τr/2代表半个转动周期。
17.图1c是二维1h-15
n-hnh(fsl)-[1h,
15
n]-tedor脉冲序列示意图;其中,φ1=x,x,-x,-x; φ2=y,y,y,y,-y,-y,-y,-y;φrec=y,-y,-y,y,-y,y,y,-y;τr/2代表半个转动周期。
[0018]
图1d是二维1h-13
c-hnh(fsl)-[1h,
13
c]-tedor脉冲序列示意图;其中,φ1=x,x,-x,-x; φ2=y,y,y,y,-y,-y,-y,-y;φrec=y,-y,-y,y,-y,y,y,-y;τr/2代表半个转动周期。
[0019]
图2a是总演化时间为100μs(n=1)时,
13
c,
15
n同位素均匀标记的(ggggcc)5rna凝 胶的二维1h-15
n tedor谱图;
[0020]
图2b是总演化时间为400μs(n=4)时,
13
c,
15
n同位素均匀标记的(ggggcc)5rna凝 胶的二维1h-15
n tedor谱图。
[0021]
图2c是总演化时间为600μs(n=6)时,
13
c,
15
n同位素均匀标记的(ggggcc)5rna凝 胶的二维1h-15
n tedor谱图。
[0022]
图3a是总演化时间为200μs(n=2)时,
13
c,
15
n同位素均匀标记的(ggggcc)5rna凝 胶的二维1h-13
c tedor谱图。
[0023]
图3b是总演化时间为600μs(n=6)时,
13
c,
15
n同位素均匀标记的(ggggcc)5rna凝 胶的二维1h-13
c tedor谱图。
[0024]
图3c是g-c配对结构示意图。
[0025]
图4a是总演化时间为200μs(n=2)时,
13
c,
15
n同位素均匀标记的(ggggcc)5rna凝 胶的二维1h-15
n-hnh-(fsl)-[1h,
15
n]-tedor谱图。
[0026]
图4b是总演化时间为600(n=6)μs时,
13
c,
15
n同位素均匀标记的(ggggcc)5rna 凝胶的二维1h-15
n-hnh-(fsl)-[1h,
15
n]-tedor谱图。
[0027]
图4c是g-g配对结构示意图。
[0028]
图5a是总演化时间为600μs(n=6)时,混合标记的(ggggcc)5rna凝胶的二维 1
h-13
c-hnh-(fsl)-[1h,
13
c]-tedor谱图。
[0029]
图5b是g-g配对结构示意图。
具体实施方式
[0030]
以下将结合实施例对本发明做进一步说明,所举实施例并不用于限制本发明。对于本领 域技术人员来说,本技术可以有各种更改和变化。凡在本技术的精神和原理之内所作的任何 修改、等同替换、改进等,均应包含在本技术的权利要求范围之内。
[0031]
为了实现对分子内或分子间氢键的检测,本发明提出一系列在快速魔角转速(mas)条 件下,检测n-h
…
n和n-h
…
o=c氢键的固体核磁共振方法,即二维(2d)氢检测1h-x(x=
15
n 或
13
c)转移回波双共振(transferred-echo double resonance,tedor),(即1h-15
n tedor 和1h-13
c tedor),以及结合了选择性脉冲策略的tedor相关实验(即1h-15
n-hnh-(fsl)
ꢀ‑
[1h,
15
n]-tedor和1h-13
c-hnh-(fsl)-[1h,
13
c]-tedor)。
[0032]
tedor实验的关键设计是通过两个旋转回波双共振模块(redor,rotational echodouble resonance),实现1h至
15
n或
13
c磁共振信号的转移和
15
n或
13
c至1h磁共振信号的 转移,建立1h-15
n或1h-13
c二维化学位移相关谱,得到氢键中h原子与两侧原子之间的相 关信息,实现对氢键的直接观测。redor是在mas条件下的,异核偶极重耦的脉冲序列; 在mas条件下,相耦合自旋对的偶极耦合作用被mas平均。在检测核(如1h)的演化期中, 每半个转动周期在耦合核(x,x=
15
n或
13
c)的通道上施加一个π脉冲,可使得异核偶极耦 合作用不被mas平均,1h的单量子相干(1hx)演化为1h-x多量子相干(1hyxz)。最佳演化 时间与1h原子和x原子之间的距离相关。调控演化总时间,可以实现分别检测氢原子与氢 原子两侧x原子(x=
15
n或
13
c)的目的。在记录x的化学位移后,再通过一个redor模 块将1hyxz演化为1hx,进行1h的直接维采样。
[0033]
除了2d 1
h-x tedor外,本发明首次将选择性脉冲方法与tedor脉冲进行组合。选择 性脉冲可通过谱编辑的方式将特定的信号筛选出来。本发明中应用的谱编辑方法包括
基于交 叉极化(cross polarization,cp)过程中接触时间长短进行选择的cp实验以及基于频率进行 选择的脉冲序列。
[0034]
将cp脉冲、频率选择性脉冲(frequency selectivity,fsl)和tedor脉冲进行组合,设 计了1h-15
n-hnh-(fsl)-[1h,
15
n]-tedor脉冲和1h-13
c-hnh(fsl)-[1h,
13
c]-tedor。首先利 用hnh脉冲中1h-15
n cp完成磁共振信号的转移,随后对
15
n进行频率选择,只保留特定频 率的信号,从而将具有特定化学位移的
15
n信号筛选出来,进而通过短接触时间的1h-15
n cp, 将特定化学位移的
15
n信号传递给化学键相连的1h信号。因此,通过hnh(fsl)脉冲模块, 只保留了特定化学位移的亚氨基或氨基信号。最后通过1h-x tedor,构建1h-15
n或1h-13
c 二维谱,实现对n-h
…
n和n-h
…
o=c氢键的特异性检测。与1h-x tedor相比,这两个脉 冲可以实现对某一种亚氨基、氨基(如鸟嘌呤的亚氨基、尿嘧啶的亚氨基、鸟嘌呤的氨基、 胞嘧啶的氨基、腺嘌呤的氨基)参与的氢键的特异性检测,可有效避免其他信号的干扰,进 一步提高氢键检测的准确性。
[0035]
此外,此发明利用快速mas条件(40khz),1h的横向弛豫时间较中低mas条件明显 增长,有效减少在1h-x演化过程的信号损失,进而提高实验的灵敏度。
[0036]
本发明通过如下技术方案实现:
[0037]
一种检测氢键结构的固体核磁共振方法,包括以下步骤:
[0038]
(1)制备待测样品,样品中含有
15
n或
13
c标记;
[0039]
(2)进行脉冲序列的设定,设定步骤包括:
[0040]
对于2d 1
h-x tedor脉冲(x=
15
n或
13
c),进行如下操作:首先用π/2脉冲激发1h原 子核,随后每隔半个转动周期,在x核上施加π脉冲,进行一定数量的π脉冲后;再在1h 通道施加π脉冲压制1h化学位移各向异性和1h在1h-x演化期间的1h化学位移演化;随后 重复在x通道上每隔半个转动周期的π脉冲,数量与1h的π脉冲前x通道上的π脉冲数量 相等;完成后对氢进行锁场,压制溶剂信号;其次分别在1h和x原子上施加90
°
脉冲,然 后在x维记录化学位移(t1),记录完成后分别在1h和x原子上施加90
°
脉冲。完成以上针 对两组redor脉冲序列串的操作后,采集1h的信号,完现1h-x二维谱的构建;
[0041]
对于1h-15
n-hnh-(fsl)-[1h,
15
n]-tedor脉冲和1h-13
c-hnh-(fsl)-[1h,
13
c]-tedor脉 冲,进行如下操作:首先用π/2脉冲激发1h原子核,1h-15
n cp实现低灵敏度
15
n核的极化, 设定接触时间为1ms-10ms,之后利用形状脉冲,调节激发中心和脉冲时间等,选择特定化 学位移的
15
n信号,再将
15
n信号转移至
15
n化学键相连的1h原子核,设定接触时间为100 μs-1000μs。之后的1h-x tedor模块设计与上述其他实验一致。
[0042]
(3)使用固体核磁共振波谱仪对样品进行检测,得到样品的二维谱;
[0043]
(4)依据样品的二维谱,对比不同混合时间的谱图中的信号峰,判断是否存在nh
…
n 或n-h
…
o=c氢键。
[0044]
所述样品为生物大分子或含有氢键的其他物质,生物大分子包括dna、rna、核酸-蛋 白质复合物,含有n-h
…
n或n-h
…
o=c中氢键的其他物质包括但不限于含有n的软物质、 生物材料、高分子材料等。
[0045]
所述样品为固体样品、凝胶样品或沉降可溶样品等。
[0046]
rna样品的制备方法包括体外转录法、固相合成法或生物提取法。
[0047]
制备rna样品时,通过聚丙烯酰胺凝胶电泳对rna样品进行纯化。
[0048]
通过在1h上施加脉冲对水峰压制,以压制溶剂信号。
[0049]1h-15
n-hnh(fsl)-[1h,
15
n]-tedor和1h-13
c-hnh-(fsl)-[1h,
13
c]-tedor脉冲中所用 到的形状脉冲包括q3,gaussi,square,sinc,rsonb,reburp,crp,reburp。
[0050]
实施例1
[0051]
本实施例以重复扩增的(ggggcc)5序列形成的rna凝胶为模型进行脉冲序列的测试。 ggggcc序列是c9orf72基因中的一部分,其重复扩增与多种神经退行性疾病相关。有研 究显示,重复扩增的ggggcc rna会在特定条件下形成rna凝胶,其结构尚未确定。本 发明首次使用固体核磁方法对(ggggcc)5序列形成的rna凝胶进行分析。
[0052]
1.rna样品的制备
[0053]
(1)dna模板的构建
[0054]
本实施例通过体外转录方法得到(ggggcc)5rna,首先根据目标rna设计相应的dna 模板。dna模板由两条互补的dna单链组成,分别为正向链(r链)和反向链(f链),序 列如下:
[0055]
r链:
[0056]5’‑
ggccccggccccggccccggccccggcccctatagtgagtcgtattaa-3’[0057]
f链:
[0058]5’‑
ttaatacgactcactataggggccggggccggggccggggccggggcc-3’[0059]
dna单链经过离心、溶解、升温退火等过程,形成线性化的双链dna模板(终浓度为 25μm)。
[0060]
(2)体外转录制备rna样品
[0061]
本发明制备了两个rna样品,分别为
13
c,
15
n同位素均匀标记的(ggggcc)5rna和 分别加入
13
c标记的gtp与
15
n标记的gtp制备的混合标记的(ggggcc)5rna。
[0062]
13
c,
15
n同位素均匀标记的(ggggcc)5rna样品通过5ml的体外转录体系进行制备: 在50ml离心管中依次加入2600μl depc处理水,665μl 100mm 13
c,
15
n同位素标记的gtp, 335μl100 mm 13
c,
15
n同位素标记的ctp,500μl tris buffer(含400mm tris/hcl,ph8.0, 10mm spermidine,0.1%triton x-100),50μl 1m二硫苏糖醇(dtt),200μl 1m mgcl2,150μl 25μm dna模板,500μl 2mg/ml t7 rna聚合酶。37℃水浴中孵育24小时以保证 原料完全反应。
[0063]
混合标记的(ggggcc)5rna通过5ml的体外转录体系进行制备:在50ml离心管 中依次加入2600μl depc处理水,330μl 100mm 13
c同位素标记的gtp,330μl 100mm 15
n 同位素标记的gtp,340μl非同位素标记的ctp,500μl tris buffer(含400mm tris/hcl, ph8.0,10mm spermidine,0.1%triton x-100),50μl 1m二硫苏糖醇(dtt),200μl 1m mgcl2, 150μl 25μm dna模板,500μl 2mg/ml t7 rna聚合酶。37℃水浴中孵育24小时以保证 原料完全反应。得到的混合标记的(ggggcc)5rna样品中gtp为单独
13
c标记或单独
15
n 标记。
[0064]
(3)rna的纯化
[0065]
转录反应完成后通过12%聚丙烯酰胺(page)凝胶电泳进行纯化,电泳结束后在紫外灯 下切胶得到目标条带。将含有目标rna的条带浸泡于提取缓冲液中(20mm tris-hcl,300mmsodium acetate,1mm edta,ph 7.4),37℃下浸泡约12小时,收集溶液。
[0066]
(4)rna凝胶样品的制备
[0067]
通过超滤的方法将(ggggcc)5rna单体样品溶解于含5mm tris(ph=7.0),10mm
π脉冲,共施加2个;再在rna样品的1h原子核上施加π脉冲压制1h化学位移各向异性 和1h在1h-13
c演化期间的1h化学位移演化;随后重复在rna样品的
13
c原子核上每隔半 个转动周期施加π脉冲,共施加2个;
[0094]
完成以上针对两组redor脉冲序列串的操作后,采集1h的信号t2,完现1h-13
c二维 谱的构建。
[0095]
参考图1b所示,此实验中通过调节n的数值,控制π脉冲数量。当n=1时,
13
c核上共 施加8个π脉冲,总演化时间为100μs。n为大于1的整数时,
13
c核上共施加8n个π脉冲, 总演化时间为100nμs。
[0096]
该实验中直接维(f1:1h),间接维(f2:
13
c),在t1演化期和t2采集期分别取了958个点 和128个点。
[0097]1h原子核上施加的π/2脉冲为1.9μs,1h原子核上施加的π脉冲是3.8μs,
[0098]
13
c原子核上施加的π/2脉冲为3.5μs,
13
c原子核上施加的π脉冲为7.0μs。
[0099]
循环等待时间为2s。
[0100]
2d 1
h-15
n-hnh-(fsl)-[1h,
15
n]-tedor脉冲序列(图1c)设置如下:
[0101]
首先用π/2脉冲激发rna样品的1h原子核,
[0102]
施加1h-15
n cp,设定接触时间为1ms,
15
n的连续锁场功率设为50khz,1h的锁场功 率为90khz;
[0103]
之后在
15
n原子核上施加形状脉冲,设定激发中心为90ppm,激发时间为625μs,选择 出特定化学位移的
15
n信号;
[0104]
随后利用missisippi脉冲序列对水的信号进行压制;
[0105]
随后施加
15
n-1
h cp,设定接触时间为300μs,将
15
n信号转移至
15
n化学键相连的1h 原子核,
15
n的连续锁场功率设为50khz,1h的锁场功率为90khz。
[0106]
随后,每隔半个转动周期,在rna样品的
15
n原子核上施加π脉冲,共施加2个;
[0107]
再在1h原子核上施加π脉冲压制1h化学位移各向异性和1h在1h-15
n演化期间的1h化 学位移演化;
[0108]
随后,重复在
15
n原子核上每隔半个转动周期施加π脉冲,共施加2个;
[0109]
其次分别在1h和
15
n原子核上施加90
°
脉冲,然后在
15
n维记录化学位移t1,
[0110]
记录完成后分别在1h和
15
n原子核上施加90
°
脉冲。
[0111]
接下来重复redor脉冲序列串:每隔半个转动周期,在
15
n原子核上施加π脉冲,,共 施加2个;再在1h原子核上施加π脉冲压制1h化学位移各向异性和1h在1h-15
n演化期间 的1h化学位移演化;随后重复在
15
n原子核上每隔半个转动周期施加π脉冲,共施加2个;
[0112]
完成以上针对两组redor脉冲序列串的操作后,采集1h的信号t2,完现1h-15
n二维 谱的构建。
[0113]
此实验中通过调节n的数值,控制π脉冲数量。当n=1时,
15
n核上共施加8个π脉冲, 总演化时间为100μs。n为大于1的整数时,
15
n核上共施加8n个π脉冲,总演化时间为100n μs。
[0114]
该实验中直接维(f1:1h),间接维(f2:
15
n),在t1演化期和t2采集期分别取了958个 点和80个点。
[0115]1h原子核上施加的π/2脉冲为1.9μs,1h原子核上施加的π脉冲是3.8μs。
[0116]
15
n原子核上施加的π/2脉冲为4.6μs,
15
n原子核上施加的π脉冲为9.2μs。
[0117]
循环等待时间为2s。
[0118]
形状脉冲采用gaus1_180i.1000,
[0119]
2d 1
h-13
c-hnh-(fsl)-[1h,
13
c]-tedor脉冲序列(图1d)的设置如下:
[0120]
首先用π/2脉冲激发rna样品的1h原子核,
[0121]
施加1h-15
n cp,设定接触时间为1ms,
15
n的连续锁场功率设为50khz,1h的锁场功 率为90khz;
[0122]
之后在
15
n核上施加形状脉冲,设定激发中心为150ppm,激发时间为625μs,选择出特 定化学位移的
15
n信号;
[0123]
随后利用missisippi脉冲序列对水的信号进行压制;
[0124]
随后施加
15
n-1
h cp,设定接触时间为300μs,将
15
n信号转移至
15
n化学键相连的1h 原子核,
15
n的连续锁场功率设为50khz,1h的锁场功率为90khz。
[0125]
随后,每隔半个转动周期,在rna样品的
13
c原子核上施加π脉冲,共施加2个;
[0126]
再在rna样品的1h原子核上施加π脉冲,压制1h化学位移各向异性和1h在1h-13
c演 化期间的1h化学位移演化;
[0127]
随后重复,在rna样品的
13
c原子核上每隔半个转动周期施加π脉冲,共施加2个;
[0128]
完成后对氢进行锁场,锁场时间为500μs。1h的锁场功率为130khz,压制溶剂信号;
[0129]
接着,分别在1h和
13
c原子核上施加90
°
脉冲,
[0130]
然后在
13
c维记录化学位移t1,
[0131]
记录完成后,分别在rna样品的1h和
13
c原子核上施加90
°
脉冲。
[0132]
接下来重复redor脉冲序列串:每隔半个转动周期,在
13
c原子核上施加π脉冲,共 施加2个;
[0133]
再在1h原子核上施加π脉冲压制1h化学位移各向异性和1h在1h-13
c演化期间的1h化 学位移演化;
[0134]
随后重复在
13
c原子核上每隔半个转动周期施加π脉冲,共施加2个;
[0135]
完成以上针对两组redor脉冲序列串的操作后,采集1h的信号t2,完现1h-13
c二维 谱的构建。
[0136]
此实验中通过调节n的数值,控制π脉冲数量。当n=1时,
13
c核上共施加8个π脉冲, 总演化时间为100μs。n为大于1的整数时,
13
c核上共施加8n个π脉冲,总演化时间为100n μs。
[0137]
该实验中直接维(f1:1h),间接维(f2:
13
c),在t1演化期和t2采集期分别取了958个点 和128个点。
[0138]1h原子核上施加的π/2脉冲为1.9μs,1h原子核上施加的π脉冲是3.8μs。
[0139]
15
n原子核上施加的π/2脉冲为4.6μs,
15
n原子核上施加的π脉冲为9.2μs。
[0140]
13
c原子核上施加的π/2脉冲为3.5μs,
13
c原子核上施加的π脉冲为7.0μs。
[0141]
循环等待时间为2s。
[0142]
形状脉冲采用gaus1_180i.1000,
[0143]
3.谱图收集与结果分析
[0144]
本发明收集了
13
c,
15
n同位素均匀标记的(ggggcc)5rna凝胶的二维1h-15
n tedor谱 图(图2a-2c),结果如下:在总演化时间为100μs(短混合时间)时只能观察到1h/
15
n化 学位移为13ppm/147.6ppm和10.6ppm/142ppm的信号峰,均代表g碱基的n1-h1交叉峰, 即g碱基
内部的nh信号。而在总演化时间为400μs时,除了碱基内部交叉峰外,还可以观 察到碱基之间的相关信息,即1h/
15
n化学位移为13ppm/197ppm的信号峰,代表g碱基的 h1和c碱基的n3交叉峰,证明了g-c之间n-h
…
n氢键的存在。此外,当总演化时间延长 至600μs(短混合时间)时,受到弛豫的影响,碱基内部的信号衰减,g碱基的n1-h1交叉 峰消失,而远程信号(碱基之间的相关信号)仍然可以观察到。因此,使用1h-15
n tedor 实验可以对未知的rna凝胶体系中nh
…
n氢键进行表征。
[0145]
本发明收集了
13
c,
15
n同位素均匀标记的(ggggcc)5rna凝胶的二维1h-13
c tedor谱 图(图3a-3b),结果如下:在总演化时间为300μs(短混合时间)时只能观察到1h/
13
n化 学位移为13ppm/156ppm和13ppm/161ppm的信号峰,分别代表g碱基的c2-h1和c6-h1 交叉峰,均为g碱基内部的信号。而在总演化时间为700μs时,除了碱基内部交叉峰外,还 可以观察到碱基之间的相关信息,即1h/
13
c化学位移为13ppm/168ppm的信号峰,代表g 碱基的h1和c碱基的c4交叉峰,证明了g-c之间n-h
…
n氢键的存在(图3c)。因此, 使用1h-13
c tedor实验可以对rna凝胶体系中氢键进行表征。
[0146]
此外,本发明收集了
13
c,
15
n同位素均匀标记的(ggggcc)5rna凝胶的二维2d 1
h-15
n-hnh-(fsl)-[1h,
15
n]-tedor谱图(图4a-4b),结果如下:在总演化时间为200μs(短 混合时间)时只能观察到1h/
15
n化学位移为9ppm/80ppm和8ppm/80ppm的信号峰,均代 表g碱基的n2-h2交叉峰,即g碱基内部的nh2信号。而在总演化时间为600μs时,除了 碱基内部交叉峰外,还可以观察到碱基之间的相关信息,即1h/
15
n化学位移为9ppm/232.7 ppm的信号峰,代表g碱基的h2和配对g碱基的n7交叉峰,证明了g-g hoogesteen配对 之间n-h
…
n氢键的存在(图4c)。
[0147]
本发明收集了(ggggcc)5rna凝胶的二维2d 1
h-13
c-hnh-(fsl)-[1h,
13
c]-tedor谱图 (图5a),结果如下:在总演化时间为600μs(长混合时间)时观察到1h/
13
c化学位移为10.78 ppm/160.9ppm的信号峰,均代表g碱基的c6与配对g碱基h1交叉峰,证明了g-g配对 之间n-h
…
o=c氢键的存在(图5b)。
[0148]
相较于现有技术,本发明的有益效果如下:
[0149]
本发明将氢检测技术与转移回波双共振脉冲技术结合,设计了1h-x tedor脉冲序列, 建立了特异性检测n-h
…
n或n-h
…
o=c氢键的固体核磁共振方法。tedor通过基于偶极 耦合的异核重耦方法,实现相干转移,建立1h-x异核之间的化学位移关联。本实验的1h-xtedor方法,在1h的激发后,每半个旋转周期,在x的通道上施加π脉冲。经过多个旋转 周期后,实现偶极重耦。随后,通过旋转周期将耦合的1h-x相干,再转换为可检测1h磁共 振矢量,进行1h化学位移记录,完成二维实验。在tedor方法中,信号强度与两原子核之 间的距离以及含有x脉冲的旋转周期总时间相关。通过tedor脉冲实验,可实现n-h
…
n 或n-h
…
o=c氢键中,1h与两侧原子之间的化学位移相关,并且通过调节总时间,可分别鉴 定化学单键连接的n原子与h原子之间的化学位移相关性,以及通过氢键相连的x原子和h 原子之间的化学位移相关。
[0150]
此外,本发明首次将选择性脉冲,包括cp脉冲和频率选择性脉冲,与tedor脉冲进行 组合,有效地减少了谱图重叠现象。
[0151]
本发明方法的主要优点如下:(1)采用氢检测技术,方法灵敏度高;(2)通过构建1h-15
n 二维谱观测相关信号,准确度高;(3)tedor脉冲参数设置简单,且对氢键角度、长度
等无 限制;(4)获取氢原子与氢键中两个氮原子的化学位移相关,可在原子水平上直接观测氢键。 (5)通过选择性脉冲与tedor脉冲的组合,有效降低了谱图重叠情况;(6)n-h
…
n氢键 中通过化学键相连的n-h之间的距离约为而通过氢键相连的h,n原子之间的距离 约为因此,利用1h-15
n tedor实验,通过设置不同的混合时间,分别检测化学键相 连的nh基团,以及通过氢键相连的氢原子和氮原子,进行结构鉴定和表征。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1