一种尿酸的检测方法及其应用
1.本发明属于生物化学技术检测领域,尤其涉及一种尿酸的检测方法及其应用。
背景技术:
2.高尿酸血症是由于尿酸排泄不足或/和肾脏过载导致血清尿酸浓度过高引发的疾病。血中尿酸量过高是导致尿酸盐沉积,诱发痛风的关键风险因素。此外,高尿酸血症还与肾脏疾病、心血管疾病、糖尿病等疾病密切相关。尿酸是人体内嘌呤代谢的产物,三分之二尿酸通过尿液排出体外。在检测的体液样本中,尿液具有生物信息集成度高、样本采集无创、低生物风险性等优势,是多种代谢性疾病早期诊断的首选生物样本。
3.目前,尿液中尿酸的检测方法有电化学法、荧光光谱法、高效液相色谱法、液相色谱
–
质谱联用法等。这些方法具有较高的选择性和灵敏度,但存在样品预处理复杂、操作繁琐、检测时间长及成本高等缺点。因此,亟待开发一种快速、简便、低成本且高灵敏度的尿液中尿酸检测方法,将对高尿酸血症的早期预警具有重要意义。
技术实现要素:
4.针对以上技术问题,本发明提供了一种尿酸的检测方法及其应用,基于指示剂置换(indicator displacement assays,ida)策略,实现了尿液中尿酸的检测,该检测方法具有高灵敏度、高选择性、快速简易的特点,能够简便、高效地检测出待测样品中的尿酸。
5.为解决上述技术问题,本发明第一方面提供了一种尿酸的检测方法:将胍基杯[5]芳烃和荧光素钠制成混合溶液,将待测样品加入所述混合溶液中,通过荧光信号的改变来检测所述待测样品中尿酸的浓度。
[0006]
相对于现有技术而言,本发明以胍基杯[5]芳烃(gc5a)
·
荧光素钠(fl)为主客体对,加入的尿酸与fl竞争结合gc5a的空腔,将fl从gc5a
·
fl主客体络合物中置换出来,fl恢复在溶液中的发光性能,荧光信号增敏(switch
‑
on)。通过荧光强度与尿酸浓度的线性关系,可实现尿酸简便、高效的检测。其中胍基杯[5]芳烃即5,11,17,23,29
‑
五胍基
‑
31,32,33,34,35
‑
五(4
‑
甲基戊烷氧基)杯[5]芳烃,为上缘胍基修饰的杯[5]芳烃。
[0007]
结合第一方面,在hepes缓冲液中检测尿酸浓度时,所述胍基杯[5]芳烃与所述荧光素钠的最终浓度分别为0.8μmol/l和1μmol/l。
[0008]
本发明第二方面提供了上述检测方法在检测尿液中尿酸浓度中的应用。该检测方法几乎不受尿液中其他干扰成分的影响,能够用于尿液中尿酸的检测。
[0009]
结合第二方面,用上述检测方法检测尿液中尿酸可采用以下操作:取人工尿液,离心后收集上清液,用hepes缓冲液稀释后与含有胍基杯[5]芳烃和荧光素钠的溶液混合,逐步滴入以人工尿液为溶剂的尿酸溶液,测定荧光素钠的荧光强度,以尿酸浓度与荧光素钠的荧光强度值建立尿酸检测的线性关系,利用所述线性关系检测尿液中的尿酸浓度。
[0010]
优选地,所述以人工尿液为溶剂的尿酸溶液中尿酸的浓度范围为0~50μmol/l。在该浓度范围内,尿酸浓度与荧光强度呈良好的线性关系。
[0011]
优选地,所述含有胍基杯[5]芳烃和荧光素钠的溶液中,所述胍基杯[5]芳烃与所述荧光素钠的浓度分别为8μmol/l和4μmol/l。
[0012]
本发明第三方面提供了上述检测方法在利用拍摄工具进行尿酸浓度检测中的应用。利用上述检测方法借助拍摄工具进行尿酸浓度检测时,可通过紫外线(366nm)照射产生的荧光变化,经色彩处理提取其g值,建立g值与尿酸浓度的线性关系,从而实现便携式、可视化的尿液中尿酸浓度的检测。
[0013]
结合第三方面,用上述检测方法在利用拍摄工具进行尿酸检测可采用以下步骤:
[0014]
用hepes缓冲液配制gc5a
·
f1主客体对混合溶液,加入不同用量的尿酸,即得一系列浓度的尿酸溶液;将所述尿酸溶液在366nm紫外线下照射,用拍摄工具拍照,提取所得图片的绿色强度值(g值),以尿酸浓度与所述g值建立尿酸检测的线性关系;利用所述线性关系检测待测样品中的尿酸浓度。
[0015]
用上述检测方法利用拍摄工具对尿液进行尿酸浓度检测时可采用以下操作:
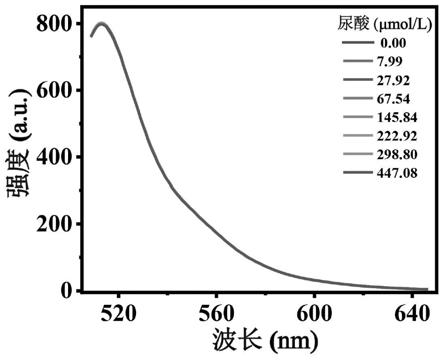
[0016]
取真实尿液离心并收集上清液,加入hepes缓冲液稀释,得稀释液,将胍基杯[5]芳烃和荧光素钠的混合溶液及不同用量的尿酸加入至所述稀释液中,混匀,即得一系列浓度的尿酸溶液;将所述尿酸溶液在366nm紫外线下照射,用拍摄工具在相同条件下拍照,提取所得图片的g值,以尿酸浓度与所述g值建立尿酸检测的线性关系;利用所述线性关系检测尿液中的尿酸浓度。
[0017]
拍照功能可通过数码相机、智能手机来实现,拍照后利用图像处理软件即可获取图片的g值,可实现尿酸的便携式、可视化检测,以适用于不同人群的尿液样本的分析。
[0018]
优选地,所述尿酸溶液中尿酸的浓度为0~0.8mmol/l,在该浓度范围时,尿酸浓度与g值呈良好的线性关系。
[0019]
优选地,所述尿酸溶液中所述胍基杯[5]芳烃与所述荧光素钠的浓度分别为10μmol/l和5μmol/l。
[0020]
本发明所提供的尿酸检测方法具有高灵敏度、高选择性、快速简易的特点,几乎不受尿液中其他干扰成分的影响,能够简便、高效地检测尿液中尿酸的浓度。利用该检测方法,可通过在紫外线(366nm)下样品的荧光变化实现尿酸的检测,经色彩处理提取其g值,建立尿酸浓度与g值之间的线性关系,从而应用于便携式、可视化的无创尿酸检测方法开发。
附图说明
[0021]
图1为实施例1中fl(1μmol/l)的荧光强度随着尿酸浓度增加的荧光谱图(λ
ex
=500nm,λ
em
=505
–
650nm);
[0022]
图2为实施例2中gc5a
·
fl(0.80μmol/l/1.00μmol/l)主客体对荧光强度随着尿酸浓度增加的变化趋势(λ
ex
=500nm,λ
em
=505
–
650nm);a为随着尿酸浓度(0~119.88μmol/l)的增加,fl荧光发射光谱曲线的变化;b为fl荧光强度与尿酸浓度的非线性拟合曲线(λ
em
=513nm);
[0023]
图3为实施例3中在hepes缓冲液中荧光强度比例值(i/i0)对尿酸浓度的线性拟合;
[0024]
图4为实施例4中选择性考察;a为在hepes缓冲液中,加入尿酸和干扰物时fl荧光强度变化;b为在人工尿液中,荧光强度比例值(i/i0)对尿酸浓度的线性拟合;
[0025]
图5为实施例4中志愿者真实尿液中荧光强度比例值(i/i0)对尿酸浓度的线性拟合;
[0026]
图6为实施例4中真实尿样中尿酸的检测结果;
[0027]
图7为实施例5中可视化检测流程和hepes缓冲液、真实尿液中g值对尿酸浓度的线性拟合;
[0028]
以上各图中,i0和i分别作为未加入和加入分析物时的荧光强度。
具体实施方式
[0029]
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合具体实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
[0030]
尿酸是人体内嘌呤代谢的产物,三分之二尿酸通过尿液排出体外。尿酸升高与痛风、肾脏疾病、心血管疾病、糖尿病等疾病密切相关。目前,尿液中尿酸的检测方法有电化学、荧光光谱法、高效液相色谱法、液相色谱
–
质谱联用法等,这些检测方法具有较高的选择性和灵敏度,但存在样品预处理复杂、操作繁琐、检测时间长及成本高等缺点。因此,亟待开发一种快速、简便、低成本且高灵敏度的尿液中尿酸检测方法,将对高尿酸血症的早期预警具有重要意义。
[0031]
为了能快速、简便且低成本地检测尿酸,本发明实施例提供了一种尿酸的检测方法:将gc5a和fl制成混合溶液,将待测样品加入混合溶液中,通过荧光信号的改变来检测所述待测样品中的尿酸浓度。gc5a属于一种大环分子,具有空腔,能够作为受体选择性键合客体分子(f1、尿酸),形成络合物。基于指示剂置换分析(indicator displacement assays,ida)原理,gc5a作为主体可逆地和客体fl结合,导致fl荧光强度的降低(switch
‑
off);当待分析物尿酸作为竞争客体引入到该络合物体系中时,尿酸可将fl从大环主体中竞争出来,呈现出荧光信号增敏(switch
‑
on),依据荧光强度变化与尿酸浓度的相关性,可实现对尿酸的传感检测。通过实验验证,gc5a对尿酸的识别几乎不受尿液中其他干扰成分的影响,能够用于尿液中尿酸的检测。一般来说,健康人群中也会有部分人由于代谢异常而呈现尿酸偏高,还有部分痛风患者由于自身调节加速尿酸代谢而使尿酸水平正常,并且饮水量、药物也会影响尿酸水平,因此,尿液中尿酸检测结果不能直接诊断疾病。但尿酸检测对健康风险预警、饮食指导等能够提供参考数据,因此检验尿液中的尿酸仍具有积极意义。
[0032]
为了便于在日常生活中实现尿酸可视化检测,本发明实施例提供了一种利用拍摄工具进行尿酸检测的方法,并提供了具体的利用拍摄工具进行尿酸检测的方法:
[0033]
利用拍摄工具对以hepes缓冲液为溶剂的待测样品进行尿酸浓度检测时可采用以下操作:用hepes缓冲液配制含有gc5a
·
f1主客体对混合溶液,将不同用量的尿酸加入混合溶液中,即得一系列浓度(100μmol/l,200μmol/l,300μmol/l,400μmol/l,500μmol/l,600μmol/l,800μmol/l)的尿酸溶液。将尿酸溶液于紫外线(366nm)下照射,经拍摄工具(如数码相机、智能手机等)拍照,将所得图片经色彩处理软件提取其绿色强度值(g值),g值与尿酸浓度呈线性关系。
[0034]
利用拍摄工具对尿液进行尿酸浓度检测时可采用以下操作:取真实尿液离心(12700rpm,15min),收集上清液,加入hepes缓冲液稀释,得稀释液,将gc5a
·
f1主客体对及
不同用量的尿酸加入到稀释液中,混匀,即得一系列浓度(100μmol/l,200μmol/l,300μmol/l,400μmol/l,500μmol/l,600μmol/l,800μmol/l)的尿酸溶液。将尿酸溶液在紫外线(366nm)下照射,用拍摄工具(如数码相机、智能手机等)在相同条件下拍照,将所得图片经色彩处理软件提取g值,以尿酸浓度与所述g值建立尿酸检测的线性关系。这种便携式、可视化的无创尿酸检测方法为实现家庭式尿酸检测提供了一个可行性策略。
[0035]
下面分多个实施例对本发明实施例进行进一步的说明。
[0036]
以下实施例中尿酸、fl、曙红y二钠盐(ey)、反式
‑4‑
[4
‑
(二甲胺基)苯乙烯基]
‑1‑
甲基吡啶碘化物(dsmi)、8
‑
羟基芘
‑
1,3,6
‑
三磺酸三钠盐(hpts)、光泽精(lcg)、吖啶橙(ao)、罗丹明b(rhb)、α
‑
环糊精(α
‑
cd)、β
‑
环糊精(β
‑
cd)、甲基
‑
β
‑
环糊精(me
‑
β
‑
cd)、羟丙基
‑
β
‑
环糊精(hp
‑
β
‑
cd)、磺丁基
‑
β
‑
环糊精(sbe
‑
β
‑
cd)、γ
‑
环糊精(γ
‑
cd)、葫芦脲[6](cb[6])、葫芦脲[7](cb[7])、葫芦脲[8](cb[8])、鸟嘌呤、黄嘌呤、次黄嘌呤、别嘌呤醇及肌酐均从美国sigma
‑
aldrich公司购入。n
‑
(2
‑
羟乙基)哌嗪
‑
n
′‑2‑
乙烷磺酸(hepes)和中性红(nr)购自天津希恩思生化科技有限公司。亚甲基蓝(mb)购自德国默克有限公司。牛血清白蛋白购自北京太阳生物科技有限公司。谷氨酸和天门冬氨酸购自上海源叶生物科技有限公司。尿素、氯化钠、氯化钾和磷酸钠(一元)购自天津丰川化学试剂科技有限公司。n,n
′‑
二甲基
‑
2,7
‑
二氮杂芘(me2dap)来自卡尔斯鲁厄理工学院纳米技术研究所(德国)。胍基杯[5]芳烃(gc5a)、5,11,17,23,29
‑
五(三甲基铵)
‑
31,32,33,34,35
‑
五(4
‑
甲基戊氧基)杯[5]芳烃(qac5a)、磺化偶氮杯[4]芳烃(sac4a)、5,11,17,23
‑
四胍
‑
25,26,27,28
‑
四丁氧基杯[4]芳烃(gc4a
‑
4c)、寡聚乙二醇修饰胍基杯芳烃(gc4aoeg)、磺化杯[4]芳烃(sc4a)、磺化杯[5]芳烃(sc5a)和磺化杯[6]芳烃(sc6a)均来自南开大学化学学院。
[0037]
实施例1
[0038]
本发明实施例考察了尿酸对f1的荧光信号干扰情况。
[0039]
1、溶液的配制
[0040]
称取2.38g hepes,加入约0.9l超纯水溶解,用氢氧化钠溶液(ph=13)调节溶液ph,超纯水补足至1l,得到hepes缓冲液(10mmol/l,ph7.4)。
[0041]
染料储备液的配制:取f1,精密称定,用hepes缓冲液配制成1mmol/l,即得染料客体储备液(f1储备液),并置于4℃保存,备用。
[0042]
尿酸储备液的配制:取尿酸,精密称定,用氢氧化钠溶液(ph=13)溶解,用hepes缓冲液稀释配制成10mmol/l,即尿酸储备液,并置于4℃保存,备用。
[0043]
2、荧光光谱实验条件
[0044]
使用varian cary eclipse荧光光谱仪(美国安捷伦科技公司),并配备型号为cary single
‑
cuvette peltier的控温装置,所用石英池(10
×
10
×
45mm3)的光程为10mm。滴定实验在室温(25℃)下进行。
[0045]
3、尿酸对f1的荧光信号干扰情况考察
[0046]
取f1储备液和尿酸储备液,用hepes缓冲液稀释含有2mmol/l尿酸和1μmol/l fl的滴定液,以确保滴定过程中荧光池中fl浓度不变。取f1储备液,用hepes缓冲液稀释为1μmol/l f1,置于荧光池中。将滴定液逐滴加到1μmol/lfl中,随着尿酸的加入(0~447.08μmol/l),fl荧光信号(λ
ex
=500nm,λ
em
=505~650nm)无变化,如图1所示,说明尿酸(447.08μmol/l)对fl荧光信号无干扰。
[0047]
实施例2
[0048]
本发明实施例考察了gc5a与尿酸的键合常数。
[0049]
1、溶液的配制
[0050]
hepes缓冲液、fl储备液及尿酸储备液同实施例1。
[0051]
大环主体储备液的配制:取gc5a,精密称定,用hepes缓冲液配制成50μmol/l,即大环主体储备液,并置于4℃保存,备用。
[0052]
2、荧光光谱实验条件
[0053]
同实施例1。
[0054]
3、gc5a与尿酸的键合常数的测定
[0055]
键合常数(associate constant,k
a
)是超分子化学主客体对间的物理常数,键合常数越大,说明大环主体和荧光分子或分析物间的键和能力强,主客体包结形成的络合物越稳定。
[0056]
采用荧光竞争滴定方式测定gc5a与尿酸的键合常数。取f1储备液、大环主体储备液和尿酸储备液,用hepes缓冲液稀释成含有2mmol/l尿酸和gc5a
·
fl(0.80μmol/l/1.00μmol/l)主客体对的滴定液,以确保滴定过程中荧光池中fl浓度不变。如图2a所示,在gc5a
·
fl(0.80μmol/l/1.00μmol/l)主客体对溶液中逐滴加入该滴定液。尿酸(0~120.30μmol/l)将fl从gc5a
·
fl主客体络合物中gc5a空腔中竞争出来,fl恢复在溶液中的发光性能,荧光信号增敏(switch
‑
on)。如图2b所示,将fl荧光强度值和尿酸浓度值采用主客体1:1竞争包结模型拟合公式(onehost_oneguest_onecompetitor)进行非线性拟合,拟合得gc5a与尿酸的键合常数(k
a
)为(2.87
±
0.23)
×
105m
‑1。键合常数的测定均在hepes缓冲溶液中(25℃)下进行。
[0057]
采用荧光滴定法和紫外
‑
可见光谱法对gc5a
·
fl的键合常数k
a
进行了验证。荧光滴定法使用varian cary eclipse荧光光谱仪(美国安捷伦科技公司),所用石英池(10
×
10
×
45mm3)的光程为10mm。为消除温度变化对测量结果的影响,采用型号为cary single
‑
cuvette peltier的控温装置,荧光滴定实验均在室温(25℃)下进行。紫外
‑
可见光谱法使用uv
‑
2600紫外分光光度仪(日本岛津(shimadzu)科技有限公司)。验证结果确定了gc5a
·
fl的键合常数k
a
为(5.00
±
1.00)
×
106m
‑1。
[0058]
对比例
[0059]
本对比例提供了用其他大环主体分子和染料客体在尿酸检测中的情况。
[0060]
1、溶液的配制
[0061]
hepes缓冲液和尿酸储备液同实施例1。
[0062]
大环主体储备液的配制:分别取大环主体分子环糊精(α
‑
、β
‑
、me
‑
β
‑
、sbe
‑
β
‑
、hp
‑
β
‑
、γ
‑
cd)、杯芳烃(sc4a、sc5a、sc6a、sac4a、qac5a、gc4a
‑
4c、gc4aoeg)和葫芦脲(cb[6]、cb[7]、cb[8]),精密称定,用hepes缓冲液分别配制成适宜浓度储备液,置于4℃保存,备用。
[0063]
染料储备液的配制:取染料mb、rhb、hpts、lcg、dsmi、ao、me2dap、nr、ey,精密称定,用hepes缓冲液配制成适宜浓度储备液,置于4℃保存,备用。
[0064]
2、荧光光谱条件
[0065]
同实施例1。
[0066]
3、等温量热滴定条件
[0067]
使用peaq
‑
itc等温量热仪(美国microcal公司),在标准大气压下测定。
[0068]
3、α
‑
cd与尿酸的键合常数
[0069]
通过等温滴定量热法测定α
‑
cd与尿酸的键合常数。将尿酸溶液自动注射到装有α
‑
cd溶液的反应池中,并自动搅拌混匀。由于α
‑
cd与尿酸反应热低且不稳定,未能测出α
‑
cd与尿酸的键合常数,即不能用于尿酸的检测。
[0070]
4、其他大环主体与尿酸键合常数的测定
[0071]
在hepes缓冲液中,通过荧光直接滴定方式测定染料客体与大环主体的键合常数。取染料储备液,用hepes缓冲液稀释后置于荧光池中;取大环主体储备液和染料储备液,用hepes缓冲液稀释作为大环主体滴定液,并且该大环主体滴定液中染料客体的浓度与荧光池中染料客体的浓度相同,以确保滴定过程中荧光池中染料客体浓度不变。随着大环主体滴定液的加入,由于主客体络合作用,荧光信号增强或减弱。将染料最大发射波长处(fl:513nm,mb:688nm,ey:537nm,hpts:435nm,lcg:505nm,dsmi:582nm,ao:510nm,rhb:576nm,nr:573nm,me2dap:449nm)的荧光强度与大环主体浓度值采用主客体1:1包结模型拟合公式(onehost_oneguest)进行拟合,即得主客体的键合常数。所有键合常数均为三次平行滴定实验拟合数据的平均值实验拟合数据的平均值
[0072]
通过荧光竞争滴定方式测定其他大环主体与尿酸的键合常数。选取合适的主客体对,β
‑
cd
·
mb(1.00mmol/l/10.00μmol/l)、hp
‑
β
‑
cd
·
mb(1.00mmol/l/10.00μmol/l)、sbe
‑
β
‑
cd
·
nr(1.00mmol/l/10.00μmol/l)、me
‑
β
‑
cd
·
nr(1.00mmol/l/10.00μmol/l)、γ
‑
cd
·
hpts(10.00mmol/l/10.00μmol/l)、cb[6]
·
dsmi(8.00μmol/l/1.00μmol/l)、cb[7]
·
ao(15.00μmol/l/0.50μmol/l)、cb[8]
·
me2dap(2.00μmol/l/1.00μmol/l)、sc4a
·
lcg(0.50μmol/l/0.50μmol/l)、sc5a
·
lcg(1.00μmol/l/1.00μmol/l)、sc6a
·
lcg(0.25μmol/l/1.00μmol/l)、gc4a
‑
4c
·
fl(8.00μmol/l/1.00μmol/l)、gc4aoeg
·
ey(4.00μmol/l/0.50μmol/l)、qac5a
·
ey(0.40μmol/l/0.50μmol/l)、sac4a
·
rhb(1.00μmol/l/0.80μmol/l)。将滴定液逐滴加到上述各主客体对溶液中,尿酸的终浓度范围为0~185.12μmol/l,荧光强度基本无变化,尿酸均未能将染料从大环空腔中置换出来,说明以上大环主体分子与尿酸的键合能力弱,不足以实现ida分析,即不能实现对尿酸的传感检测。
[0073]
实施例3
[0074]
本发明实施例提供了一种hepes缓冲液中尿酸的检测方法。
[0075]
1、溶液的配制
[0076]
hepes缓冲液、fl储备液及尿酸储备液同实施例1。gc5a大环主体储备液的配制同实施例2。
[0077]
2、荧光光谱条件
[0078]
同实施例1。
[0079]
3、hepes缓冲液中尿酸标准曲线的建立
[0080]
取f1储备液、大环主体储备液和尿酸储备液,用hepes缓冲液稀释成含有2mmol/l尿酸和gc5a
·
fl(0.80μmol/l/1.00μmol/l)主客体对的滴定液,以确保滴定过程中荧光池中fl浓度不变。在gc5a
·
fl主客体对(0.80μmol/l/1.00μmol/l)溶液中逐滴加入该滴定液,逐滴加入的尿酸可将fl从gc5a大环空腔中置换出来,fl荧光信号增强。在0~20μmol/l范围内,fl荧光强度比值(i/i0)与尿酸浓度呈线性关系(y=25943.68x+1.0285,r2=0.988),如
图3所示,其中i0为未加入尿酸时gc5a
·
fl主客体对的荧光强度,i为加入尿酸后体系稳定后的荧光强度。按照3σ/slope方法测定尿酸检出限(lod),其中“σ”为i0值(n=6)的标准偏差,“slope”是以尿酸浓度对fl荧光强度值作线性拟合得到的线性方程的斜率,根据公式(lod=3σ/slope)计算,得到在hepes缓冲液中尿酸的检测限为1.53μmol/l。在hepes缓冲液中,以gc5a
·
fl(0.80μmol/l/1.00μmol/l)为主客体对建立检测尿酸的标准曲线,可实现hepes缓冲液中尿酸的检测。
[0081]
实施例4
[0082]
本发明实施例提供了人工尿液和真实尿液中尿酸的检测方法。
[0083]
1、溶液的配制
[0084]
hepes缓冲液、fl储备液、gc5a储备液及尿酸储备液同实施例3。
[0085]
人工尿液的配制:将尿素(36.40g)、氯化钠(15.00g)、磷酸钠(一元溶液,9.60g)、氯化钾(9.00g)、肌酐(4.00g)和牛血清白蛋白(100mg)溶于2l超纯水中,用氢氧化钠调节人工尿液的ph至6.0,置于4℃保存,备用。
[0086]
真实尿液的处理:收集志愿者(年龄,22
±
1岁)和高尿酸血症患者(年龄,55
±
18岁)晨尿中段尿液,离心(12700rpm,15min),收集上清液,用hepes缓冲液稀释50倍,得待测真实尿液。
[0087]
2、荧光光谱条件
[0088]
同实施例1。
[0089]
3、传感体系选择性考察
[0090]
为了评估gc5a
·
fl主客体对传感体系对尿酸检测的选择性,我们考察了尿液中干扰成分对gc5a
·
fl主客体对的影响。尿液中干扰成分较多,如肌酐、尿素、离子、蛋白质、嘌呤类等,这些成分可能与gc5a键合,从而对尿酸检测产生干扰。为了验证该传感体系的选择性,在gc5a
·
fl(0.80μmol/l/1.00μmol/l)主客体对中分别加入尿酸和各干扰物(最终浓度,尿酸为10mmol/l;牛血清白蛋白为0.40mg/l;尿素、氯离子、谷氨酸、苯丙氨酸分别为0.30mmol/l;黄嘌呤、次黄嘌呤、别嘌呤醇、腺嘌呤、鸟嘌呤、肌酐分别为10mmol/l),测定荧光强度的变化。如图4a所示,尿液中的干扰物与gc5a的络合能力都比较弱,fl很难被竞争出来,荧光强度无明显变化。因此,在人工尿液、真实尿液中gc5a优先键合尿酸,对尿酸具有高选择性。
[0091]
4、人工尿液中尿酸标准曲线的建立
[0092]
同实施例3中hepes缓冲液中尿酸标准曲线、检测限的测定。如图4b所示,在人工尿液中,fl荧光强度变化的比值与尿酸浓度(0~50μmol/l)呈线性关系(y=8543.61x+1.0013,r2=0.987),且尿酸检测限为1.65
±
0.17μmol/l。因此,在人工尿液中,以gc5a
·
fl(8.00μmol/l/4.00μmol/l)为主客体对建立尿酸检测的标准曲线,可实现尿酸的传感检测。
[0093]
5、真实尿液中尿酸标准曲线的建立
[0094]
同实施例3中hepes缓冲液中尿酸标准曲线、检测限的测定。如图5所示,在六名志愿者待测真实尿液中,fl荧光强度变化比值与尿酸浓度(0~250μmol/l)均呈线性关系。因此,在以上志愿者真实尿液中,以gc5a
·
fl(10.00μmol/l/5.00μmol/l)为主客体对建立尿酸检测的标准曲线,说明真实尿液中干扰成分基本不影响尿酸的传感检测。
[0095]
6、志愿者和高尿酸血症患者待测尿液中尿酸的传感检测
[0096]
在志愿者和高尿酸血症患者待测尿液中(稀释),加入gc5a
·
fl(10.00μmol/l/5.00μmol/l)主客体对溶液,测定荧光强度值范围为201.99~437.65(图6a)。同时,采用高效液相色谱法测定尿液中尿酸含量。如图6b所示,荧光法和高效液相色谱法的测定结果呈正相关关系(皮尔逊相关系数,r=0.798,p<0.01),证实了荧光法检测尿酸结果的可靠性。如图6c所示,志愿者和高尿酸血症患者待测尿液中荧光强度存在明显分区。如图6d所示,高尿酸血症患者(413.06
±
18.18)与志愿者(330.89
±
44.71)待测尿液的荧光强度存在显著差异(***p<0.001),高尿酸血症患者(410.20
±
19.37)和伴有肾功能不全高尿酸血症患者(307.11
±
31.96)待测尿液的荧光强度有显著差异(***p<0.001),伴有肾功能不全高尿酸血症患者与志愿者之间的荧光强度无统计学差异(p>0.05)。本发明所建立的超分子主客体对传感体系,可实现尿液中尿酸的传感检测,具有灵敏度高、准确性强的优势,并根据所测待测尿液荧光强度值实现了志愿者与高尿酸血症患者(伴有肾功能不全的高尿酸血症患者除外)的区分,对早期高尿酸血症的预警具有重要意义。
[0097]
实施例5
[0098]
本发明实施例提供了利用智能手机进行尿酸检测的方法,以实现尿酸检测的常规化和便捷化。
[0099]
1、溶液的配制
[0100]
hepes缓冲液、gc5a储备液、f1储备液及尿酸储备液配制同实施例4。
[0101]
真实尿液的处理:收集志愿者和高尿酸血症患者晨尿中段尿液,离心(12700rpm,15min),收集上清液,用hepes缓冲液稀释200倍,得待测真实尿液。
[0102]
2、可视化检测
[0103]
在hepes缓冲液中,配制含有gc5a
·
fl(10.0μmol/l/5.0μmol/l)主客体对的一系列浓度(100μmol/l,200μmol/l,300μmol/l,400μmol/l,500μmol/l,600μmol/l,800μmol/l)的尿酸溶液。如图7所示,尿酸溶液在日光灯下无明显颜色差异;经紫外线(366nm)照射并用智能手机(iphone xr)拍照,将所得图片经色彩处理软件(color name)处理,提取绿色强度值(g值),以g值与尿酸浓度值建立尿酸检测的线性关系。同理,在志愿者和高尿酸血症待测尿液中也成功建立了尿酸检测的线性关系。该研究表明超分子主客体对传感体系结合智能手机可以实现尿液中尿酸的简便、灵敏检测,为开发便携式、可视化的家庭式无创尿酸检测方法提供了一个可行性策略。
[0104]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换或改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1