定量检测无细胞蛋白质合成系统目的蛋白产量及筛选高催化活性酶蛋白的方法
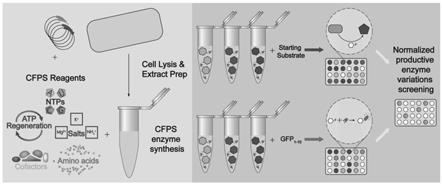
1.本发明涉及分子生物学与合成生物学技术领域,特别涉及一种定量检测无细胞蛋白质合成系统目的蛋白产量及筛选高催化活性酶蛋白的方法。
背景技术:
2.分割荧光蛋白是一种对荧光蛋白的改造技术:在特定位置将完整的荧光蛋白分割成两段或多段多肽,这些多肽链单独存在时都不会产生荧光,而当同时存在时则会自发组装形成完整的荧光蛋白并产生荧光。通过将分割的短链荧光蛋白多肽与靶标蛋白融合表达并检测其与另一段荧光蛋白多肽的组装情况,该技术已成功应用于体内或体外的蛋白可溶性表达分析、蛋白质在胞内的定位与运输监测、蛋白与蛋白相互作用检测等方面。
3.无细胞蛋白质合成(cell-free protein synthesis,cfps)系统利用细胞抽提物中的酶和辅助因子以及外源补充的底物和能量物质,以外源dna或mrna为模板实现目的蛋白的体外合成。与基于细胞的蛋白质表达平台相比,cfps主要具有三个优势:1)无需维持细胞存活与生长,cfps可以生产细胞体系难以生产或对细胞有潜在毒性的蛋白质;2)由于无需进行繁琐费时的克隆操作,该系统表达多种蛋白质具有更快的速度和更好的灵活性;3)该系统的开放性使得能够方便地对其进行更加直接、精细的调控。由于上述优势,cfps已经逐渐被应用于抗体的高通量表达与筛选、蛋白质修饰的快速表征、生物合成途径的原型设计与代谢工程改造等领域。对cfps系统表达的目的蛋白进行定量是应用cfps的基础,但由于cfps系统的细胞提取物中存在多种细胞内源的酶蛋白,故无法使用常用简便的蛋白质定量方法,如bradford法对表达的目的蛋白进行定量检测。而目前常用的检测cfps系统目的蛋白产量的方法为首先用放射性c元素标记表达的蛋白,之后再使用液滴闪缩计数与放射自显影实现蛋白定量,这种定量方法操作繁琐费时,需要娴熟的实验技巧与专业的设备条件。故目前仍缺少一种能够快速简便地实现对cfps系统表达的蛋白进行定量的方法。
4.从不同物种来源的酶同系物中筛选具有高催化活性的酶蛋白是提高生物合成途径目的产物产量与生产效率的常用方法,但这一过程因通常需要进行多种蛋白的表达与纯化而往往费时费力。基于以上背景,建立一种快速简便的定量检测cfps系统目的蛋白产量及快速筛选高催化活性酶蛋白的方法显得十分重要。
技术实现要素:
5.本发明的首要目的在于克服现有技术的缺点与不足,提供一种定量检测无细胞蛋白质合成系统目的蛋白产量的方法。
6.本发明的另一目的在于提供所述定量检测无细胞蛋白质合成系统目的蛋白产量的方法的应用。
7.本发明的又一目的在于提供一种快速筛选高催化活性酶蛋白的方法。
8.本发明的再一目的在于提供所述快速筛选高催化活性酶蛋白的方法的应用。
9.本发明的目的通过下述技术方案实现:
10.一种定量检测无细胞蛋白质合成(cfps)系统目的蛋白产量的方法,包括如下步骤:
11.(1)构建表达融合蛋白的质粒
12.将目的蛋白(酶蛋白)的基因序列和分割荧光蛋白短链多肽通过linker序列连接,得到目的蛋白-分割荧光蛋白短链多肽的dna序列,然后将dna序列插入到质粒载体上,得到表达融合蛋白的质粒;
13.(2)制备融合蛋白溶液
14.将步骤(1)中得到的表达融合蛋白的质粒转化进入大肠杆菌感受态细胞中,涂布于抗性平板上,筛选得到阳性转化子;然后将阳性转化子进行培养,经诱导表达和纯化,得到目的蛋白-分割荧光蛋白短链多肽的融合蛋白溶液;
15.(3)制备含融合蛋白的cfps反应液
16.将步骤(1)中得到的表达融合蛋白的质粒进行无细胞蛋白质合成反应,得到含有目的蛋白-分割荧光蛋白短链多肽的融合蛋白的cfps反应液;
17.(4)制备含有分割荧光蛋白长链多肽的发光液
18.将分割荧光蛋白长链多肽的dna序列插入到质粒载体上,得到表达分割荧光蛋白长链多肽的载体,然后将其转化进入大肠杆菌感受态细胞中,涂布于抗性平板上,筛选得到阳性转化子;再将阳性转化子进行培养、诱导表达,得到含有分割荧光蛋白长链多肽的发光液;
19.(5)制标准曲线
20.将步骤(2)中得到的目的蛋白-分割荧光蛋白短链多肽的融合蛋白溶液配制成至少5个浓度梯度的融合蛋白溶液,然后分别加入到步骤(4)中得到的含有分割荧光蛋白长链多肽的发光液中,在4℃条件下孵育8~16h,再检测其荧光强度值,并根据荧光强度值及融合蛋白溶液的浓度绘制标准曲线;
21.(6)检测无细胞蛋白质合成反应体系中目的蛋白的产量(含量)
22.将步骤(3)中得到的含有目的蛋白-分割荧光蛋白短链多肽的融合蛋白的cfps反应液加入到步骤(4)中得到的含有分割荧光蛋白长链多肽的发光液中,在4℃条件下孵育8~16h,然后检测其荧光强度,再根据步骤(5)中绘制的标准曲线计算得到目的蛋白的产量(可以先计算得到目的蛋白的浓度,再换成成产量)。
23.步骤(1)中所述的目的蛋白可以为不同物种来源的酶同系物,包括如核糖激酶(ribokinase,rbks)、核糖磷酸焦磷酸激酶(ribose-phosphate diphosphokinase,prs)或烟酰胺磷酸核糖转移酶(nampt)等;优选为来源于人、细菌或古菌的核糖激酶、核糖磷酸焦磷酸激酶或烟酰胺磷酸核糖转移酶。
24.步骤(1)中所述的目的蛋白的基因序列包括核糖激酶、核糖磷酸焦磷酸激酶或烟酰胺磷酸核糖转移酶的基因序列;优选为人源(homo sapiens)核糖激酶hrbks基因的(ncbi:np_071411.1),人源(homo sapiens)核糖磷酸焦磷酸激酶hprs基因(uniprot:p60891),携带丛毛单胞菌科细菌(comamonadaceae bacterium)来源的烟酰胺磷酸核糖转移酶cnampt基因(genbank:ryf34637.1),携带大肠杆菌(escherichia coli)来源的核糖激酶erbks基因(uniprot:p0a9j6),携带泉古菌(pyrobaculum calidifontis)来源的核糖磷
酸焦磷酸激酶pprs基因(ncbi:abo08552.1),携带人源(homo sapiens)的烟酰胺磷酸核糖转移酶hnampt基因(uniprot:p43490),红色亚栖热菌(meiothermus ruber)来源的烟酰胺磷酸核糖转移酶mnampt基因(ncbi:add29592.1),红环菌科细菌(rhodocyclaceae bacterium)来源rbnampt基因(genbank:mrr51108.1),短热单胞菌(thermomonas brevis)来源tbnampt基因(ncbi:wp_187571727.1),鲁弗斯小型栖热菌(meiothermus rufus)来源mrnampt基因(ncbi:wp_027882362.1)等。
25.步骤(1)中所述的分割荧光蛋白为由超折叠型绿色荧光蛋白sfgfp改造获得分割荧光蛋白;优选为分割荧光蛋白gfp
1-10d7/11m3 opt
,即该分割荧光蛋白由两部分组成,一部分为长链多肽gfp
1-10d7
(简称gfp
1-10
),另一部分为短链多肽gfp
11m3 opt
(简称gfp
11
)。
26.步骤(1)中所述的分割荧光蛋白短链多肽为16个氨基酸组成的gfp
11m3 opt
(gfp
11
),其核苷酸序列如seq id no.1所示。
27.步骤(1)中所述的linker序列是为了保证目的蛋白基因的活性表达而插入的序列,其核苷酸序列如seq id no.2所示。
28.步骤(1)中所述的质粒载体为本领域的常规载体pet23a、pet28a或pet30a;优选为pet28a载体(该dna序列插入到pet28a质粒的ndei与xhoi酶切位点之间)。
29.步骤(2)和(4)中所述的诱导表达为利用异丙基-β-d-硫代半乳糖苷(isopropylβ-d-thiogalactoside,iptg)进行诱导表达。
30.所述的异丙基-β-d-硫代半乳糖苷优选为按其在所述反应体系的终浓度为1mmol/l添加计算。
31.步骤(2)和(4)中所述的大肠杆菌优选为大肠杆菌bl21(de3)。
32.步骤(2)和(4)中所述的抗性平板为含有卡那霉素的抗性平板;优选为含有卡那霉素的lb固体平板。
33.步骤(3)中所述的无细胞蛋白质合成是为基于大肠杆菌的无细胞蛋白质合成系统(cfps)合成的。
34.步骤(4)中所述的分割荧光蛋白长链多肽为214个氨基酸组成的gfp
1-10d7
(gfp
1-10
),其核苷酸序列如seq id no.3所示。
35.步骤(4)中所述的含有分割荧光蛋白长链多肽的发光液优选为通过如下方法制备得到:将经过诱导表达获得的蛋白加入到尿素溶液中溶解,然后离心、取上清,并加入tng buffer,得到含有分割荧光蛋白长链多肽的发光液。
36.所述的尿素溶液的浓度优选为9mol/l。
37.所述的诱导表达获得的蛋白的用量为按每毫升尿素溶液配比75mg蛋白计算。
38.所述的离心的条件优选为:14000rpm离心20min。
39.所述的tng buffer的配方如下:100mm tris-hcl ph 7.4,100mm nacl,10%(v/v)甘油。
40.所述的尿素溶液与tng buffer的体积比优选为1:25。
41.步骤(5)中所述的目的蛋白-分割荧光蛋白短链多肽的融合蛋白的用量为按其在所述反应的终浓度为0.0125~2pmol/μl添加计算;优选为按其在所述反应的终浓度为0.0125~0.075pmol/μl添加计算。
42.步骤(5)和(6)中所述的孵育的时间优选为10~12h。
43.步骤(5)和(6)中所述的荧光强度值为在激发波长为488nm,发射波长为520nm下测定的荧光强度值。
44.步骤(6)中所述的含有目的蛋白-分割荧光蛋白短链多肽的融合蛋白的cfps反应液与含有分割荧光蛋白长链多肽的发光液的体积比优选为1:39。
45.所述定量检测无细胞蛋白质合成系统目的蛋白产量的方法在筛选高催化活性酶蛋白中的应用。
46.所述的酶蛋白包括核糖激酶、核糖磷酸焦磷酸激酶或烟酰胺磷酸核糖转移酶等;优选为来源于人、细菌或古菌的核糖激酶、核糖磷酸焦磷酸激酶或烟酰胺磷酸核糖转移酶。
47.一种快速筛选高催化活性酶蛋白的方法,包括如下步骤:
48.s1、构建表达融合蛋白的质粒
49.将不同来源的目的蛋白(酶蛋白)的基因序列分别和分割荧光蛋白短链多肽通过linker序列连接,得到目的蛋白-分割荧光蛋白短链多肽的dna序列,然后分别将dna序列插入到质粒载体上,得到表达融合蛋白的质粒;
50.s2、制备含融合蛋白的cfps反应液
51.将步骤s1中得到的表达融合蛋白的质粒分别进行无细胞蛋白质合成反应,分别得到含有不同来源的目的蛋白-分割荧光蛋白短链多肽的融合蛋白的cfps反应液;
52.s3、制备含有分割荧光蛋白长链多肽的发光液
53.将分割荧光蛋白长链多肽的dna序列插入到质粒载体上,得到表达分割荧光蛋白长链多肽的载体,然后将其转化进入大肠杆菌感受态细胞中,涂布于抗性平板上,筛选得到阳性转化子;再将阳性转化子进行培养、诱导表达,得到含有分割荧光蛋白长链多肽的发光液;
54.s4、测定目的产物的产量以及分割荧光蛋白自发结合后的荧光强度值
55.将部分步骤s2中得到的含有目的蛋白-分割荧光蛋白短链多肽的融合蛋白的cfps反应液分别加入到含有底物的催化反应体系中进行反应,然后测定不同来源的目的蛋白催化底物后生成的目的产物的产量;同时,将剩余部分的步骤s2中得到的含有目的蛋白-分割荧光蛋白短链多肽的融合蛋白的cfps反应液分别加入步骤s3中得到的含有分割荧光蛋白长链多肽的发光液中,在4℃条件下孵育8~16h,然后测定不同来源的目的蛋白-分割荧光蛋白短链多肽的融合蛋白与分割荧光蛋白长链多肽自发结合后的荧光强度值;最后分别计算不同来源的目的蛋白催化底物后生成的目的产物的产量与分割荧光蛋白自发结合后的荧光强度值的比值;
56.s5、筛选
57.根据步骤s4中得到的比值的大小判断不同来源的目的蛋白的活性的高低:若比值大的,说明该目的蛋白的催化活性相对较高;若比值小的,说明该目的蛋白的催化活性相对较低,以此筛选得到催化活性高的酶蛋白。
58.步骤s1中所述的不同来源的目的蛋白可以为不同物种来源的酶同系物,包括不同物种来源的核糖激酶、核糖磷酸焦磷酸激酶、烟酰胺磷酸核糖转移酶等;优选为来源于人、细菌或古菌的核糖激酶、核糖磷酸焦磷酸激酶、烟酰胺磷酸核糖转移酶。
59.步骤s1中所述的目的蛋白的基因序列包括核糖激酶、核糖磷酸焦磷酸激酶、烟酰胺磷酸核糖转移酶的基因序列;优选为人源(homo sapiens)核糖激酶hrbks基因的(ncbi:
np_071411.1),人源(homo sapiens)核糖磷酸焦磷酸激酶hprs基因(uniprot:p60891),携带丛毛单胞菌科细菌(comamonadaceae bacterium)来源的烟酰胺磷酸核糖转移酶cnampt基因(genbank:ryf34637.1),携带大肠杆菌(escherichia coli)来源的核糖激酶erbks基因(uniprot:p0a9j6),携带泉古菌(pyrobaculum calidifontis)来源的核糖磷酸焦磷酸激酶pprs基因(ncbi:abo08552.1),携带人源(homo sapiens)的烟酰胺磷酸核糖转移酶hnampt基因(uniprot:p43490),红色亚栖热菌(meiothermus ruber)来源的烟酰胺磷酸核糖转移酶mnampt基因(ncbi:add29592.1),红环菌科细菌(rhodocyclaceae bacterium)来源rbnampt基因(genbank:mrr51108.1),短热单胞菌(thermomonas brevis)来源tbnampt基因(ncbi:wp_187571727.1),鲁弗斯小型栖热菌(meiothermus rufus)来源mrnampt基因(ncbi:wp_027882362.1)等。
60.步骤s1中所述的分割荧光蛋白为由超折叠型绿色荧光蛋白sfgfp改造获得分割荧光蛋白;优选为分割荧光蛋白gfp
1-10d7/11m3 opt
(gfp
1-10d7/11
)。
61.步骤s1中所述的分割荧光蛋白短链多肽为16个氨基酸组成的gfp
11m3 opt
(gfp
11
),其核苷酸序列如seq id no.1所示。
62.步骤s1中所述的linker序列是为了保证目的蛋白基因的活性表达而插入的序列,其核苷酸序列如seq id no.2所示。
63.步骤s1中所述的质粒载体为本领域的常规载体pet23a、pet28a或pet30a;优选为pet28a载体(该dna序列插入到pet28a质粒的ndei与xhoi酶切位点之间)。
64.步骤s2中所述的无细胞蛋白质合成是为基于大肠杆菌的无细胞蛋白质合成系统(cfps)合成的。
65.步骤s3中所述的大肠杆菌优选为大肠杆菌bl21(de3)。
66.步骤s3中所述的抗性平板为含有卡那霉素的抗性平板;优选为含有卡那霉素的lb固体平板。
67.步骤s3中所述的诱导表达为利用异丙基-β-d-硫代半乳糖苷(isopropylβ-d-thiogalactoside,iptg)进行诱导表达。
68.所述的异丙基-β-d-硫代半乳糖苷优选为按其在所述反应体系的终浓度为1mmol/l添加计算。
69.步骤s3中所述的分割荧光蛋白长链多肽为214个氨基酸组成的gfp
1-10d7
(gfp
1-10
),其核苷酸序列如seq id no.3所示。
70.步骤s4中所述的底物为与目的蛋白对应的底物,如目的蛋白为烟酰胺磷酸核糖转移酶,其对应的底物为烟酰胺(nicotinamide,nam)与5'-磷酸核糖焦磷酸(prpp),产物为β-烟酰胺单核苷酸(β-nicotinamide mononucleotide,nmn)。
71.步骤s4中所述的反应的含有底物的催化反应体系优选为100μl反应体系:2mm底物,8mm atp(腺嘌呤核苷三磷酸),2.4mm mgcl2,含有目的蛋白-分割荧光蛋白短链多肽的融合蛋白的cfps反应液(10μl),10mm tris-hcl缓冲液(ph 8.0)。
72.步骤s4中,与底物反应的cfps反应液和与发光液反应的cfps反应液的体积比为1:1。
73.步骤s4中所述的反应的条件(即催化底物生成产物的反应条件)为:37℃静置反应1.5~3h。
74.步骤s4中所述的目的蛋白催化底物后生成的目的产物的产量可以采用本领域的常规方法进行测定,如荧光法或高效液相色谱法等。
75.步骤s4中所述的含有目的蛋白-分割荧光蛋白短链多肽的融合蛋白的cfps反应液与含有分割荧光蛋白长链多肽的发光液的体积比优选为1:39。
76.步骤s4中所述的孵育的时间优选为12h。
77.步骤s4中所述的荧光强度值为在激发波长为488nm,发射波长为520nm下测定的荧光强度值。
78.所述的快速筛选高催化活性酶蛋白的方法在筛选高催化活性酶蛋白中的应用。
79.所述的酶蛋白可以为不同物种来源的酶同系物,包括如不同物种来源的核糖激酶、核糖磷酸焦磷酸激酶、烟酰胺磷酸核糖转移酶等;优选为来源于人、细菌或古菌的核糖激酶、核糖磷酸焦磷酸激酶、烟酰胺磷酸核糖转移酶。
80.本发明相对于现有技术具有如下的优点及效果:
81.(1)本发明提供了一种适用于无细胞蛋白质合成系统的目的酶/蛋白定量方法,该方法使用分割荧光蛋白自发结合发出的荧光强度值可以快速地分析cfps系统中目的蛋白的表达量,无需繁琐的操作,具有简便快速的特点,有利于cfps系统中目的蛋白表达量的快速检测;同时,基于该方法可以用于快速筛选高催化活性的酶同系物,适用于合成生物学及代谢工程等各个领域检测cfps系统的目的蛋白产量与筛选酶同系物方面。
82.(2)本发明筛选高催化活性酶蛋白可通过比较各个酶同系物催化得到的产物量/分割荧光蛋白自发结合后的荧光强度值的比值实现:本发明利用大肠杆菌表达并纯化获得目的蛋白与分割荧光蛋白短链多肽的融合蛋白(目的蛋白-gfp
11
的融合蛋白),将不同含量的上述融合蛋白加入到含有分割荧光蛋白长链多肽(gfp
1-10
)的发光液中,检测孵育一定时间后的发光液的荧光强度值并建立融合蛋白含量与荧光强度值之间的标准曲线;然后利用cfps系统表达目的蛋白与分割荧光蛋白短链多肽的融合蛋白,将一部分含有上述融合蛋白的cfps反应液加入到含有分割荧光蛋白长链多肽的发光液中,检测孵育一定时间后的发光液的荧光强度值;同时,利用另一部分含有上述融合蛋白的cfps反应液进行催化反应并检测反应一段时间后的目的产物含量,计算各个酶蛋白催化得到的产物量/分割荧光蛋白自发结合后的荧光强度值的比值,从而筛选得到合成量高及比值(比活)最高的高催化活性酶蛋白。
83.(3)本发明利用cfps系统表达不同物种来源的烟酰胺磷酸核糖转移酶-gfp
11
的融合蛋白,将一部分含有上述融合蛋白的cfps反应液加入到含有gfp
1-10
的发光液中,检测孵育一定时间后的发光液的荧光强度值;同时将另一部分含有上述融合蛋白的cfps反应液加入到含有烟酰胺(nicotinamide,nam)与5'-磷酸核糖焦磷酸(5
’‑
phosphoribosyl-pyrophosphate,prpp)的底物溶液中反应并检测产物β-烟酰胺单核苷酸(β-nicotinamide mononucleotide,nmn)的产量,计算不同物种来源的nampt蛋白对应的nmn产量/分割荧光蛋白自发结合后的荧光强度值的比值,可筛选到具有最高比值的高催化活性酶蛋白。
84.(4)本发明通过计算各个酶蛋白催化得到的产物量/分割荧光蛋白自发结合后的荧光强度值的比值进行筛选,可以快速准确地筛选到具有高催化活性的酶蛋白,因为无需进行常规的大肠转化-表达-纯化流程,大大节省了时间与材料成本,提高了筛选速度;且由于通过计算不同酶同系物对应的产物产量/分割荧光蛋白自发结合后的荧光强度值的比值
al.improved efficiency of the desulfurization of oil sulfur compounds in escherichia coli using a combination of desensitization engineering and dszc overexpression[j].acs synthetic biology,2019,8(6):1441.doi:10.1021/acssynbio.9b00126)公开的方法进行目的蛋白hrbks-gfp
11
的表达与纯化,得到融合蛋白hrbks-gfp
11
。
[0097]
(4)委托基因合成公司合成gfp1-10基因(见参考文献“cabantous,st
é
phanie,waldo,等.in vivo and in vitro protein solubility assays using split gfp.[j].nature methods,2006.”中的“gfp
1-10d7”,简称“gfp1-10”)(seq id no.3)并插入到pet28a质粒的ndei与bamhi酶切位点之间,得到表达gfp
1-10
蛋白的质粒pet28a-gfp
1-10
。
[0098]
(5)将质粒pet28a-gfp
1-10
转化进入bl21(de3)感受态细胞,并在lbk卡那霉素抗性平板上进行阳性转化子筛选。
[0099]
(6)挑选步骤(5)中鉴定正确的转化子进行含有gfp
1-10
蛋白的发光液的制备:
[0100]
a.接种鉴定正确的转化子于5ml lb培养基(含卡那霉素)中过夜培养;
[0101]
b.稀释20倍,测定种子液的od
600
,并转接至100ml lb培养基(含卡那霉素)中,控制起始od
600
=0.05;37℃,200rpm培养至od
600
=0.6~0.8时添加终浓度1mm iptg(异丙基-β-d-硫代半乳糖苷)诱导gfp
1-10
蛋白表达;
[0102]
c.iptg诱导培养5h后7800rpm、7min离心收集菌体至已称过重量的50ml的离心管中,弃上清;
[0103]
d.10ml tng buffer(100mm tris-hcl ph 7.4,100mm nacl,10%(v/v)甘油)重悬沉淀,超声破碎细胞后11000rpm,离心30min,弃上清;
[0104]
e.再用10ml tng buffer重悬沉淀,超声破碎5min,之后11000rpm离心20min,弃上清,此步骤重复一次;
[0105]
f.弃掉最后的上清液后用干净的纸巾擦掉50ml离心管内壁水滴,但注意不要碰到沉淀,之后再次称量“50ml离心管+gfp
1-10
蛋白”总重,计算得到gfp
1-10
蛋白的重量;
[0106]
g.按每75mg gfp
1-10
蛋白加入1ml 9mol/l尿素溶液溶解,之后将溶液分装至1.5ml离心管内,14000rpm离心20min,取1ml上清液至新的50ml 离心管并加入25ml tng buffer,得到含有gfp
1-10
蛋白的发光液,之后将发光液分装至10ml离心管中并于-80℃保存。
[0107]
(7)吸取195μl步骤(6)中制备的发光液于96孔酶标板中,之后向其中加入5μl浓度为0.5~8pmol/μl不等的步骤(3)中制备的融合蛋白hrbks-gfp
11
,混匀后置于4℃孵育并检测不同孵育时间条件下加入了hrbks-gfp
11
蛋白的发光液的荧光强度(激发波长为488nm,发射波长为520nm)。
[0108]
在孵育时长为8h、10h、12h、14h与16h条件下,对所添加hrbks-gfp
11
的蛋白浓度与对应荧光强度分别进行相关性分析,发现两者之间的相关系数r的平方值分别为0.9972、0.9983、0.9984、0.9974与0.9955(图2),说明两者具有高度的线性相关性(0.8<|r|<1)且成功建立了两者之间的标准曲线,也说明融合了gfp
11
的目的蛋白与gfp
1-10
自发结合发出的荧光量可以用来表征目的蛋白的含量。
[0109]
实施例2hrbks-gfp
11
、hprs-gfp
11
与cnampt-gfp
11
融合蛋白在相同孵育时间条件下的荧光强度值与蛋白浓度标准曲线的建立
[0110]
(1)参照实施例1中步骤(1)质粒pet28a-hrbks-gfp
11
的构建方式,构建获得携带人
源(homo sapiens)核糖磷酸焦磷酸激酶hprs基因(uniprot:p60891)以及携带丛毛单胞菌科细菌(comamonadaceae bacterium)来源的烟酰胺磷酸核糖转移酶cnampt基因(genbank:ryf34637.1)的质粒载体pet28a-hprs-gfp
11
与pet28a-cnampt-gfp
11
。
[0111]
(2)将质粒pet28a-hprs-gfp
11
与pet28a-cnampt-gfp
11
分别转化进入bl21(de3)感受态细胞,并在lbk卡那霉素抗性平板上进行阳性转化子筛选。
[0112]
(3)分别挑选步骤(2)中鉴定正确的转化子并参照文献(li l,liao y,luo y,et al.improved efficiency of the desulfurization of oil sulfur compounds in escherichia coli using a combination of desensitization engineering and dszc overexpression[j].acs synthetic biology,2019,8(6):1441.)中公开的方法进行目的蛋白hprs-gfp
11
与cnampt-gfp
11
的表达与纯化,得到融合蛋白hprs-gfp
11
、cnampt-gfp
11
。
[0113]
(4)吸取195μl实施例1步骤(6)中制备的发光液于96孔酶标板中,之后分别向其中加入5μl浓度为0.5~6pmol/μl不等的步骤(3)中制备的融合蛋白hprs-gfp
11
、cnampt-gfp
11
与实施例1步骤(3)中制备的融合蛋白hrbks-gfp
11
,混匀后置于4℃孵育并检测孵育10h时加入了3种融合蛋白的发光液的各自的荧光强度(激发波长为488nm,发射波长为520nm)。
[0114]
在孵育10h时,对添加的3种融合蛋白hprs-gfp
11
、cnampt-gfp
11
和hrbks-gfp
11
的蛋白浓度与对应荧光强度分别进行相关性分析,发现两者之间的相关系数r的平方值分别为0.9998、0.9978与0.9987(图3),说明两者具有高度的线性相关性(0.8<|r|<1)且分别成功建立了适用于三种目的蛋白的标准曲线(hprs-gfp
11
的标准曲线:荧光强度值=872.72*蛋白浓度(pmol/μl)+20.079;cnampt-gfp
11
的标准曲线:荧光强度值=437.42*蛋白浓度(pmol/μl)-50.333;hrbks-gfp
11
的标准曲线:荧光强度值=572.31*蛋白浓度(pmol/μl)-14.026;),也说明对于不同的融合了gfp
11
的目的蛋白与gfp
1-10
自发结合发出的荧光量均可以用来表征目的蛋白的含量。
[0115]
实施例3利用cfps系统表达多种融合蛋白并分别检测与发光液孵育相同时间条件下的荧光强度值
[0116]
(1)参照实施例1中步骤(1)质粒pet28a-hrbks-gfp
11
的构建方式,构建获得携带大肠杆菌(escherichia coli)来源的核糖激酶erbks基因(uniprot:p0a9j6)、携带泉古菌(pyrobaculum calidifontis)来源的核糖磷酸焦磷酸激酶pprs基因(ncbi:abo08552.1)、携带人源(homo sapiens)的烟酰胺磷酸核糖转移酶hnampt基因(uniprot:p43490)与红色亚栖热菌(meiothermus ruber)来源的烟酰胺磷酸核糖转移酶mnampt基因(ncbi:add29592.1)的质粒载体pet28a-erbks-gfp
11
、pet28a-pprs-gfp
11
、pet28a-hnampt-gfp
11
与pet28a-mnampt-gfp
11
。
[0117]
(2)以pet28a-erbks-gfp
11
、pet28a-pprs-gfp
11
、pet28a-hnampt-gfp
11
、pet28a-mnampt-gfp
11
与实施例1步骤(1)中的pet28a-hrbks-gfp
11
以及实施例2步骤(1)中的pet28a-hprs-gfp
11
与pet28a-cnampt-gfp
11
这7种质粒为模板,参照文献(levine m z,gregorio n e,jewett m c,et al.escherichia coli-based cell-free protein synthesis:protocols for a robust,flexible,and accessible platform technology[j].journal of visualized experiments,2019,144(144):58882.doi:10.3791/58882)中公开的方法进行无细胞蛋白质合成反应,反应温度30℃,反应时间16h,分别得到7种含有融合蛋白(hrbks-gfp
11
、pprs-gfp
11
、hnampt-gfp
11
、mnampt-gfp
11
、hrbks-gfp
11
、hprs-gfp
11
、
cnampt-gfp
11
)的cfps反应液;
[0118]
(3)吸取195μl实施例1步骤(6)中制备的发光液于96孔酶标板中,之后分别向其中加入5μl步骤(2)中反应得到的cfps反应液,混匀后置于4℃孵育,并检测孵育12h时加入了7种表达了不同目的蛋白的cfps反应液的发光液的荧光强度(激发波长为488nm,发射波长为520nm),以不添加任何dna模板的空白cfps反应液为空白对照(blank conrtol)。
[0119]
在孵育12h时,添加表达了不同目的蛋白的cfps反应液的发光液具有不同的荧光强度,且均高于不添加任何dna模板的空白cfps反应液具有的荧光强度(图4),说明空白cfps反应液具有的背景荧光强度值不会目的蛋白的定量造成干扰。利用cfps系统表达的目的蛋白包括细菌、古菌与人源蛋白,具有较大的物种差异性,说明对于cfps系统表达的不同融合gfp
11
的目的蛋白与gfp
1-10
自发结合发出的荧光量均可以用来表征目的蛋白的含量,也进一步体现了本方法的通用性。
[0120]
实施例4利用cfps系统以不同浓度的dna模板表达目的蛋白并对目的蛋白产量进行定量分析
[0121]
(1)以添加浓度分别为0.5、1、2、3pmol/ml的pet28a-hprs-gfp
11
质粒为模板,参照文献(levine m z,gregorio n e,jewett m c,et al.escherichia coli-based cell-free protein synthesis:protocols for a robust,flexible,and accessible platform technology[j].journal of visualized experiments,2019,144(144):58882.)中公开的方法进行无细胞蛋白质合成反应,反应温度30℃,反应时间16h,分别得到含有融合蛋白hprs-gfp
11
的cfps反应液;
[0122]
(2)吸取195μl实施例1步骤(6)中制备的发光液于96孔酶标板中,之后分别向其中加入5μl步骤(1)中cfps反应液,混匀后置于4℃孵育,并检测孵育10h时加入了不同cfps反应液的发光液的荧光强度(激发波长为488nm,发射波长为520nm),并将荧光强度代入实施例2中所建立的hprs-gfp
11
蛋白浓度与荧光强度的标准曲线,换算得到不同模板浓度条件下cfps系统表达的hprs-gfp
11
蛋白产量。
[0123]
在一定范围内,cfps系统的蛋白产量随dna模板量的提高而提高。对于表达目的蛋白hprs-gfp
11
的cfps系统,在dna模板浓度0.5~3pmol/ml范围内目的蛋白产量随着dna模板量的提高而提高(图5),当dna模板浓度为3pmol/ml时目的蛋白产量达到最高为0.214mg/ml,说明对于cfps系统不同的反应条件均可以利用融合gfp
11
的目的蛋白与gfp
1-10
自发结合发出的荧光量来表征目的蛋白的产量,利用放射性同位素标记与放射自显影进行cfps系统蛋白定量至少需要4d的时间,而检测荧光量只需要约5min的时间,进一步说明利用分割荧光蛋白荧光量可以快速简便地表征cfps系统的目的蛋白产量。
[0124]
实施例5融合表达gfp
11
对目的蛋白催化活性及在生物合成途径中催化能力的影响
[0125]
(1)以实施例(2)中的质粒pet28a-cnampt-gfp
11
为模板,使用引物p1与p2扩增得到cnampt基因片段。使用内切酶ndei与xhoi对质粒pet28a-cnampt-gfp
11
进行酶切得到载体片段pet28a(ndei,xhoi)。
[0126]
p1:5
′‑
ggtgccgcgcggcagccatatgacccgcaatccgacctc-3
′
;
[0127]
p2:5
′‑
tggtggtggtggtggtgctcgagttataacggggccctgctcacaa-3
′
;
[0128]
(2)将上述两种dna片段胶回收纯化后,利用gibson assembly试剂盒进行连接并转化进入bl21(de3)感受态细胞,并在lbk卡那霉素抗性平板上进行阳性转化子筛选。
[0129]
(3)挑选步骤(2)中鉴定正确的表达cnampt蛋白的转化子并参照文献(li l,liao y,luo y,et al.improved efficiency of the desulfurization of oil sulfur compounds in escherichia coli using a combination of desensitization engineering and dszc overexpression[j].acs synthetic biology,2019,8(6):1441.)中公开的方法进行目的蛋白cnampt的表达与纯化。
[0130]
(4)
①
在96孔酶标板中进行单酶催化的烟酰胺(nicotinamide,nam)的生产反应,反应总体积为100μl,包括2mm烟酰胺(nam)、2mm 5'-磷酸核糖焦磷酸(5
’‑
phosphoribosyl-pyrophosphate,prpp)、8mm atp(腺嘌呤核苷三磷酸)、2.4mm mgcl2以及10mm tris-hcl缓冲液(ph 8.0),1.74pmol/μl的cnampt蛋白或实施例2中得到的cnampt-gfp
11
蛋白。反应温度37℃,静置反应3h后检测产物β-烟酰胺单核苷酸(β-nicotinamide mononucleotide,nmn)的产量并分析融合gfp
11
对cnampt催化活性的影响。
[0131]
②
用荧光法检测nmn的含量:
[0132]
a、绘制标准曲线:称取0.067g nmn标品,加入纯水充分溶解混匀并定容至5ml得到40mmol/l的nmn标准品母液,取40mmol/l的nmn标准品母液进行稀释,得到浓度为10、20、40、80、160、320、640和1280μmol/ml的nmn标准液。向96孔板酶标板每孔中加入25μl不同浓度的nmn标准液,然后依次加入2m koh 10μl,20%(v/v)苯乙酮10μl。排枪混匀后冰浴2min,之后加入85%(v/v)甲酸45μl,于37℃下静置反应10min。反应结束后,排枪吸取60μl反应液转移至黑色平底96孔荧光板。使用酶标仪,检测荧光强度(激发波长382nm,发射波长445nm),建立荧光强度与nmn浓度之间的标准曲线。
[0133]
b、向96孔板酶标板每孔中加入25μl含有nmn的待测溶液,依次加入2m koh 10μl,20%(v/v)苯乙酮10μl。排枪混匀后冰浴2min,之后加入85%(v/v)甲酸45μl,于37℃下静置反应10min。反应结束后,排枪吸取60μl反应液转移至黑色平底96孔荧光板。使用酶标仪,检测荧光强度(激发波长382nm,发射波长445nm),通过标准曲线将荧光强度值换算成nmn的浓度。
[0134]
(5)在96孔酶标板中进行双酶催化的nmn的生产反应,反应总体积为100μl,包括2mm nam、2mm 5-磷酸核糖(ribose-5-phosphate,r5p)、8mm atp、2.4mm mgcl2以及10mm tris-hcl缓冲液(ph 8.0),1.74pmol/μl的cnampt蛋白或实施例2中得到的cnampt-gfp
11
蛋白以及1.36pmol/μl实施例2中得到的hprs-gfp
11
蛋白。反应温度37℃,静置反应3h后检测nmn的产量(测定方法同上述步骤(4))并分析融合gfp
11
对cnampt在生物合成途径中催化能力的影响。
[0135]
同样浓度的cnampt或cnampt-gfp
11
蛋白催化2mm底物反应3h生成产物nmn的产量分别为1774μm与1508μm(图6a),相比于不带有gfp
11
的纯cnampt蛋白,cnampt-gfp
11
的催化能力稍有下降,但不影响cnampt-gfp
11
在生物合成途径中与hprs-gfp
11
联合催化生产nmn(图6b),说明融合表达gfp
11
会略微影响酶蛋白的催化活性但并不会影响酶蛋白在生物合成途径中的催化能力。
[0136]
实施例6高催化活性nampt蛋白的快速筛选及验证
[0137]
(1)参照实施例1中步骤(1)质粒pet28a-hrbks-gfp
11
的构建方式,构建获得携带人源(homo sapiens)hnampt基因(uniprot:p43490)、红色亚栖热菌(meiothermus ruber)来源mnampt基因(ncbi:add29592.1)、红环菌科细菌(rhodocyclaceae bacterium)来源
rbnampt基因(genbank:mrr51108.1)、短热单胞菌(thermomonas brevis)来源tbnampt基因(ncbi:wp_187571727.1)以及鲁弗斯小型栖热菌(meiothermus rufus)来源mrnampt基因(ncbi:wp_027882362.1)的质粒载体pet28a-hnampt-gfp
11
、pet28a-mnampt-gfp
11
、pet28a-rbnampt-gfp
11
、pet28a-tbnampt-gfp
11
、pet28a-mrnampt-gfp
11
。
[0138]
(2)以步骤(1)中的5种质粒以及实施例2步骤(1)中的pet28a-cnampt-gfp
11
共6种质粒为模板,参照文献(levine m z,gregorio n e,jewett m c,et al.escherichia coli-based cell-free protein synthesis:protocols for arobust,flexible,and accessible platform technology[j].journal of visualized experiments,2019,144(144):58882.)中公开的方法进行无细胞蛋白质合成反应,反应温度30℃,反应时间16h,分别得到含有融合蛋白(hnampt-gfp
11
、mnampt-gfp
11
、rbnampt-gfp
11
、tbnampt-gfp
11
、mrnampt-gfp
11
、cnampt-gfp
11
)的cfps反应液。
[0139]
(3)吸取195μl实施例1步骤(6)中制备的发光液于96孔酶标板中,之后分别向其中加入5μl步骤(2)中cfps反应液,混匀后置于4℃孵育,并检测孵育8h时加入了6种表达了不同物种来源nampt蛋白的cfps反应液的发光液的荧光强度(激发波长为488nm,发射波长为520nm),分别得到相应的分割荧光蛋白自发结合后的荧光强度值。
[0140]
(4)在96孔酶标板中进行不同物种来源nampt催化的nmn的生产反应,反应总体积为100μl,包括2mm nam、2mm prpp、8mm atp、2.4mm mgcl2以及10mm tris-hcl缓冲液(ph 8.0),10μl步骤(2)中cfps反应液。反应温度37℃,静置反应1.5h后利用高效液相色谱检测产物nmn的产量,并计算不同物种来源的nampt蛋白(烟酰胺磷酸核糖转移酶)对应的nmn产量/分割荧光蛋白自发结合后的荧光强度值(步骤(3)获得)的比值,筛选到具有最高比值nampt蛋白。其中,
[0141]
高效液相色谱法检测nmn含量:色谱柱为xbridge@amide 3.5μm,流动相为52.5%的乙腈,17.5%的甲醇,29.9%的水以及0.1%的甲酸(均为体积百分数),流速为0.5ml/min,柱温30℃,紫外检测波长为254nm。
[0142]
(5)将质粒pet28a-hnampt-gfp
11
与pet28a-mnampt-gfp
11
分别转化进入bl21(de3)感受态细胞,并在lbk卡那霉素抗性平板上进行阳性转化子筛选。
[0143]
(6)挑选步骤(5)中鉴定正确的表达hnampt-gfp
11
与mnampt-gfp
11
蛋白的转化子并参照文献(li l ,liao y,luo y,et al.improved efficiency of the desulfurization of oil sulfur compounds in escherichia coli using a combination of desensitization engineering and dszc overexpression[j].acs synthetic biology,2019,8(6):1441.)公开的方法进行目的蛋白hnampt-gfp
11
与mnampt-gfp
11
的表达与纯化。
[0144]
(7)在96孔酶标板中进行纯化酶催化的nmn的生产反应,反应总体积为100μl,包括2mm nam、2mm prpp、8mm atp、2.4mm mgcl2以及10mm tris-hcl缓冲液(ph 8.0),1pmol/μl的hnampt-gfp
11
或mnampt-gfp
11
或实施例2中得到的cnampt-gfp
11
蛋白。反应温度37℃,静置反应1.5h后利用荧光法检测产物nmn的产量(检测方法同实施例5步骤(4))。
[0145]
cnampt蛋白的nmn产量/分割荧光蛋白自发结合后的荧光强度值的比值在6种不同物种来源的nampt蛋白中最高(图7a),说明该种蛋白可能具有最高的催化能力。利用纯化酶蛋白进行催化能力的验证,同样浓度的cnampt-gfp
11
、mnampt-gfp
11
、hnampt-gfp
11
蛋白催化2mm底物反应1.5h生成产物nmn的产量分别为670μm、114μm与5.5μm(图7b)。结果表明cnampt
确实具有最高的催化活性,成功实现了高催化活性酶蛋白的快速筛选。不考虑纯化酶的验证过程,利用本发明建立的方法从6种不同物种来源的nampt蛋白中筛选高催化活性的酶蛋白仅需要约26h的时间,而按照传统的大肠体内表达,纯化,反应的模式则至少需要3d的时间。
[0146]
结合实施例1、2、3、4、5、6中的结果,说明分割荧光蛋白自发结合后的荧光强度值可以用来表征cfps系统的目的蛋白产量,且使用基于分割荧光蛋白的荧光分析法可以快速简便地检测在不同条件下的cfps系统的目的蛋白产量及快速筛选高催化活性酶蛋白。
[0147]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1