基于队列的cTfh细胞对乙肝疫苗长期免疫效果的实验方法与流程
基于队列的ctfh细胞对乙肝疫苗长期免疫效果的实验方法
技术领域
1.本发明涉及乙肝疫苗技术领域,具体为基于队列的ctfh细胞对乙肝疫苗长期免疫效果的实验方法。
背景技术:
2.乙型病毒性肝炎的病原为乙肝炎病毒,缩写为hbv,乙型肝炎病毒为dna病毒。基因组是双链、环形、不完全闭合dna。病毒最外层是病毒的外膜或称衣膜(envelope),其内层为核心部分(core),核蛋白即是核心抗原(hbcag),不能在血清中检出。hbsag阳性者的血清在电子显微镜下可见3种颗粒,直径为22nm的圆形和丝状颗粒,还有较少的直径为42。的球形颗粒,又称为dane氏颗粒,是完整的hbv颗粒。
3.鉴定与乙肝疫苗长期免疫关联ctfh细胞亚群不同抗原激发体液免疫应答中辅助b细胞的ctfh细胞亚群不同,不同细胞的辅助功效又有差异,据此项目推测这可能是导致不同疫苗引起长期免疫效果差异的关键因素之一,因此要阐明ctfh细胞与乙肝疫苗长期免疫效果关系,首先需明确效应ctfh细胞亚群,为此,分别通过接种人群关联研究、体外实验加以阐述,同时在体外混合淋巴实验中增加其它糖蛋白抗原对照,验证效应亚群对乙肝疫苗抗原反应的特异性,实验手段上以流式细胞术和实时定量pcr分别从蛋白和基因水平相互印证,确保鉴定的效应ctfh细胞亚群结果的真实性与特异性,明确ctfh细胞与乙肝疫苗长期免疫效果关联及调控作用,鉴定乙肝疫苗长期免疫应答中发挥辅助作用的ctfh细胞亚群,并阐明ctfh细胞调控乙肝疫苗长期免疫的分子机制,为进一步探明乙肝疫苗长期免疫调节机制奠定基础,目以ctfh细胞为研究切入点,突破既往相关研究长期禁锢于th1、th2细胞的局限,基于免疫学最新发现,选准靶细胞,提高研究针对性和研究效率。
技术实现要素:
4.针对现有技术的不足,本发明提供了基于队列的ctfh细胞对乙肝疫苗长期免疫效果的实验方法,明确ctfh细胞与乙肝疫苗长期免疫效果关联及调控作用,鉴定乙肝疫苗长期免疫应答中发挥辅助作用的ctfh细胞亚群,并阐明ctfh细胞调控乙肝疫苗长期免疫的分子机制,为进一步探明乙肝疫苗长期免疫调节机制奠定基础。
5.为实现以上目的,本发明通过以下技术方案予以实现:基于队列的ctfh细胞对乙肝疫苗长期免疫效果的实验方法,包括酶联免疫分析、流式样品的制备与表达量的检测、免疫磁珠法富集小鼠脾脏中cd4+t细胞、实时荧光定量pcr检测。
6.优选的,所述酶联免疫分析包括如下步骤:
7.(1)取预先冻存好的血清放置于4℃冰箱,进行解冻30分钟,3000rpm条件下离心20min,从而使颗粒状杂质沉淀,获得澄清均匀的血清。检测试剂盒室温平衡30min后从铝箔袋中取出所有的板条,截取所需要的部分,剩余板条密封放回4℃。
8.(2)加样:50μl/孔各加入浓度依次为:80、40、20、10、5、2.5miu/ml hbsab的标准品,样品孔中加入待测样品50μl,空白孔不用添加。加样过程中需要将样品加入酶标板孔的
底部,注意避免碰触孔壁,随后轻柔地水平晃动摇匀。
9.(3)加酶:除空白孔以外每孔加入辣根过氧化氢酶(hrp)标记的检测抗体50μl。
10.(4)孵育:取封板膜,设置孵育箱为37℃,并放置60min。
11.(5)洗涤液配制:取20
×
浓缩洗涤液,用超纯水稀释至1
×
后备用。
12.(6)洗涤:撕开封板膜,甩出板内的液体,每孔加入350μl 1
×
洗涤液,静置1min后弃液体,纸上拍干液体,如此重复洗板5次。
13.(7)显色:底物液a和b在使用前按1:1体积充分混合,混合后15min内使用,每孔加入100μl底物混合物,轻轻震荡混匀,用封板膜盖住反应板避光,37℃孵育15min。
14.(8)终止:每孔加50μl的终止液,终止孔内的反应。
15.(9)测定:设置酶标仪为450nm波长,测量每孔的吸光度(od值)。
16.(10)计算样品浓度:通过标准样的测量值制作标准曲线,计算回归方程,再利用方程算出每孔样品hbsab浓度值。
17.优选的,所述流式样品的制备与表达量的检测包括如下步骤:
18.(1)取1
×
106外周血单核细胞于1.5ml离心管中,用1ml buffer溶液重悬细胞。
19.(2)室温下300rcf进行10min离心溶液。
20.(3)弃上清,再用100μl buffer重悬细胞。
21.(4)加流式抗体,用移液枪或者移液管轻轻吹打混匀,避光室温孵育30min。
22.(5)孵育结束后加入1ml buffer溶液进行细胞重悬。
23.(6)室温下300rcf进行10min离心。
24.(7)弃去上清,用400μl的2%多聚甲醛固定细胞,上机检测。
25.优选的,所述免疫磁珠法富集小鼠脾脏中cd4+t细胞包括如下步骤:
26.(1)取pbmcs细胞以50μl/ml计算量加入easysep
tm mouse t cell enrichment cocktail,充分混匀,室温(15-25℃)孵育10min。
27.(2)漩涡震荡easysep
tm d magnetic particles 30s,确保溶液无聚集物。
28.(3)再向流式管加入100μl的magnetic particles,充分混匀,室温(15-25℃)孵育5min。
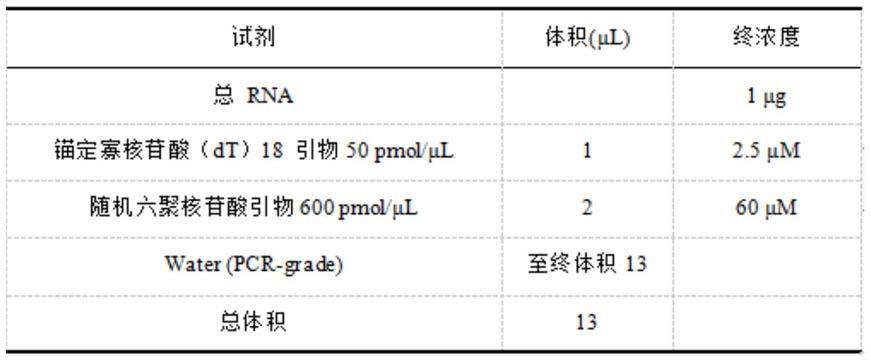
29.(4)再向流式管(容积为3ml)中加入缓冲溶液,使液体总量达到2.5ml。
30.(5)用移液枪上下混匀细胞2-3次,将整个流式管插入磁铁内,放置5min。
31.(6)轻轻地将载有磁铁的流式管倾倒,注入新的管中,将磁极和管子倒置2-3s,然后返回直立位置。不需摇晃或擦掉任何可能悬挂在管口上的液滴,此即磁珠富集后得到的cd4+t细胞,鉴定纯度。
32.优选的,所述实时荧光定量pcr检测包括如下步骤:
33.(1)引物合成:取mrna目的引物,并根据使用说明书,用depc配置成浓度为100μm,放入-20℃冰箱储存备用,使用时上下游引物各取10μl,depc取80μl稀释至10μm,以达到工作反应的浓度。
34.(2)细胞内总rna提取
35.s1.将t细胞转移到到1.5ml ep管中,4℃,2000rpm,离心5min,收集细胞,弃培养基。
36.s2.向细胞中加入1ml trizol反应液,用移液器后移液管缓慢地吹打裂解细胞几
次,室温,静置5min,从而使得细胞得到充分裂解。
37.s3.每管加入0.2ml氯仿(200μl氯仿/ml trizol),剧烈震荡混匀,室温静置10min;放置于4℃预冷的离心机中,12000rpm,离心15min。
38.s4.轻轻地吸取上层水相大约400μl并转移至新的ep管中,加入同体积的异丙醇,轻轻上下颠倒混匀,室温静置5到10min后,4℃,转移至离心机离心10min,12000rpm。
39.s5.弃上清,加入1ml已经配置好的75%的乙醇(0.1%depc水配制,现配现用)洗涤rna,悬浮沉淀,4℃,7500rpm,离心5min。
40.s6.弃上清,用滤纸或吸水纸吸干残留在管口液体,室温放置于通风橱中10min,从而风干rna,视沉淀物的量加入大约10μl~30μl的depc水溶解rna样品,56℃促溶10min后立即置于冰上。
41.s7.混匀,检测rna浓度、纯度,od260/od280比值在1.8~2.0间的rna纯度较好,再利用1%琼脂糖凝胶电泳检测rna完整性,剩余rna马上进行逆转录。
42.(3)mrna逆转录
43.冰上融化试剂并离心,按标制备20μl逆转录反应液(一次反应量)至终体积为13μl,轻轻地混匀反应混合物,用低速离心机短暂地离心-混匀-离心。
44.表1mrna逆转录反应体系1试剂体积终浓度(μl)总rna/1μg锚定寡核苷酸(dt)18引物50pmol/μl 1 2.5μm随机六聚核苷酸引物600pmol/μl 2 60μm water(pcr-grade)至终体积13/
45.总体积为13μl;
46.pcr仪65℃加热10min,之后立即将ep管插入冰中并添加表2剩余组分,轻混剩余试剂,反应程序为:25℃10min;50℃60min;85℃5min,;4℃hold。反应结束得到cdna后置于-20℃保存备用。
47.表2mrna逆转录反应体系2试剂体积(μl)终浓度5
×
逆转录buffer 4 8mm mgcl2 protector rnase inhibitor,40u/μl 0.5 20u dntp10mm each 2 1mm each逆转录酶20u/μl 0.5 10u
48.总体积为20μl;
49.(4)qpcr定量检测mrna
50.解冻并轻柔混匀sybr green master并短暂离心使管中试剂集中于底部,冰上保存。加入40μldepc稀释模板dna。全程冰上避光操作,轻柔混匀qpcr预混液并短暂离心,按照表3内容,准备qpcr反应液,短暂地离心-混匀-再离心,确认预混匀的反应液处于pcr反应板的底部,反应体系为10μl。反应程序是:95℃下进行预变性10min;95℃进行变性15s,56℃进行退火30s共40个循环
51.表3 mrna pcr反应体系组分体积(μl)faststart universal sybr green master 5 cdna 1引物1 depc 3
52.总体积为10μl;
53.pikoreal software分析实验结果:以gadph为内参基因,采用相对定量法(2
‑△
ct法)进行相对定量,每组实验重复3次。
54.有益效果
55.本发明提供了基于队列的ctfh细胞对乙肝疫苗长期免疫效果的实验方法,具备以
下有益效果:明确ctfh细胞与乙肝疫苗长期免疫效果关联及调控作用,鉴定乙肝疫苗长期免疫应答中发挥辅助作用的ctfh细胞亚群,并阐明ctfh细胞调控乙肝疫苗长期免疫的分子机制,为进一步探明乙肝疫苗长期免疫调节机制奠定基础,目以ctfh细胞为研究切入点,突破既往相关研究长期禁锢于th1、th2细胞的局限,基于免疫学最新发现,选准靶细胞,提高研究针对性和研究效率,分别通过接种人群关联研究、体外实验加以阐述,同时在体外混合淋巴实验中增加其它糖蛋白抗原对照,验证效应亚群对乙肝疫苗抗原反应的特异性,实验手段上以流式细胞术和实时定量pcr分别从蛋白和基因水平相互印证,确保鉴定的效应ctfh细胞亚群结果的真实性与特异性。
附图说明
56.图1为本发明表1 mrna逆转录反应体系1;
57.图2为本发明表2 mrna逆转录反应体系2;
58.图3为本发明表3 mrna pcr反应体系。
具体实施方式
59.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
60.请参阅图1-3,基于队列的ctfh细胞对乙肝疫苗长期免疫效果的实验方法,包括酶联免疫分析、流式样品的制备与表达量的检测、免疫磁珠法富集小鼠脾脏中cd4+t细胞、实时荧光定量pcr检测,所述酶联免疫分析包括如下步骤:
61.(1)取预先冻存好的血清放置于4℃冰箱,进行解冻30分钟,3000rpm条件下离心20min,从而使颗粒状杂质沉淀,获得澄清均匀的血清。检测试剂盒室温平衡30min后从铝箔袋中取出所有的板条,截取所需要的部分,剩余板条密封放回4℃。
62.(2)加样:50μl/孔各加入浓度依次为:80、40、20、10、5、2.5miu/ml hbsab的标准品,样品孔中加入待测样品50μl,空白孔不用添加。加样过程中需要将样品加入酶标板孔的底部,注意避免碰触孔壁,随后轻柔地水平晃动摇匀。
63.(3)加酶:除空白孔以外每孔加入辣根过氧化氢酶(hrp)标记的检测抗体50μl。
64.(4)孵育:取封板膜,设置孵育箱为37℃,并放置60min。
65.(5)洗涤液配制:取20
×
浓缩洗涤液,用超纯水稀释至1
×
后备用。
66.(6)洗涤:撕开封板膜,甩出板内的液体,每孔加入350μl 1
×
洗涤液,静置1min后弃液体,纸上拍干液体,如此重复洗板5次。
67.(7)显色:底物液a和b在使用前按1:1体积充分混合,混合后15min内使用,每孔加入100μl底物混合物,轻轻震荡混匀,用封板膜盖住反应板避光,37℃孵育15min。
68.(8)终止:每孔加50μl的终止液,终止孔内的反应。
69.(9)测定:设置酶标仪为450nm波长,测量每孔的吸光度(od值)。
70.(10)计算样品浓度:通过标准样的测量值制作标准曲线,计算回归方程,再利用方程算出每孔样品hbsab浓度值,所述流式样品的制备与表达量的检测包括如下步骤:
71.(1)取1
×
106外周血单核细胞于1.5ml离心管中,用1ml buffer溶液重悬细胞。
72.(2)室温下300rcf进行10min离心溶液。
73.(3)弃上清,再用100μl buffer重悬细胞。
74.(4)加流式抗体,用移液枪或者移液管轻轻吹打混匀,避光室温孵育30min。
75.(5)孵育结束后加入1ml buffer溶液进行细胞重悬。
76.(6)室温下300rcf进行10min离心。
77.(7)弃去上清,用400μl的2%多聚甲醛固定细胞,上机检测,所述免疫磁珠法富集小鼠脾脏中cd4+t细胞包括如下步骤:
78.(1)取pbmcs细胞以50μl/ml计算量加入easysep
tm mouse t cell enrichment cocktail,充分混匀,室温(15-25℃)孵育10min。
79.(2)漩涡震荡easysep
tm d magnetic particles 30s,确保溶液无聚集物。
80.(3)再向流式管加入100μl的magnetic particles,充分混匀,室温(15-25℃)孵育5min。
81.(4)再向流式管(容积为3ml)中加入缓冲溶液,使液体总量达到2.5ml。
82.(5)用移液枪上下混匀细胞2-3次,将整个流式管插入磁铁内,放置5min。
83.(6)轻轻地将载有磁铁的流式管倾倒,注入新的管中,将磁极和管子倒置2-3s,然后返回直立位置。不需摇晃或擦掉任何可能悬挂在管口上的液滴,此即磁珠富集后得到的cd4+t细胞,鉴定纯度,所述实时荧光定量pcr检测包括如下步骤:
84.(1)引物合成:取mrna目的引物,并根据使用说明书,用depc配置成浓度为100μm,放入-20℃冰箱储存备用,使用时上下游引物各取10μl,depc取80μl稀释至10μm,以达到工作反应的浓度。
85.(2)细胞内总rna提取
86.s1.将t细胞转移到到1.5ml ep管中,4℃,2000rpm,离心5min,收集细胞,弃培养基。
87.s2.向细胞中加入1ml trizol反应液,用移液器后移液管缓慢地吹打裂解细胞几次,室温,静置5min,从而使得细胞得到充分裂解。
88.s3.每管加入0.2ml氯仿(200μl氯仿/ml trizol),剧烈震荡混匀,室温静置10min;放置于4℃预冷的离心机中,12000rpm,离心15min。
89.s4.轻轻地吸取上层水相大约400μl并转移至新的ep管中,加入同体积的异丙醇,轻轻上下颠倒混匀,室温静置5到10min后,4℃,转移至离心机离心10min,12000rpm。
90.s5.弃上清,加入1ml已经配置好的75%的乙醇(0.1%depc水配制,现配现用)洗涤rna,悬浮沉淀,4℃,7500rpm,离心5min。
91.s6.弃上清,用滤纸或吸水纸吸干残留在管口液体,室温放置于通风橱中10min,从而风干rna,视沉淀物的量加入大约10μl~30μl的depc水溶解rna样品,56℃促溶10min后立即置于冰上。
92.s7.混匀,检测rna浓度、纯度,od260/od280比值在1.8~2.0间的rna纯度较好,再利用1%琼脂糖凝胶电泳检测rna完整性,剩余rna马上进行逆转录。
93.(3)mrna逆转录
94.冰上融化试剂并离心,按标制备20μl逆转录反应液(一次反应量)至终体积为13μ
l,轻轻地混匀反应混合物,用低速离心机短暂地离心-混匀-离心。
95.表1mrna逆转录反应体系1试剂体积终浓度(μl)总rna/1μg锚定寡核苷酸(dt)18引物50pmol/μl 1 2.5μm随机六聚核苷酸引物600pmol/μl 2 60μm water(pcr-grade)至终体积13/总体积为13μl;
96.pcr仪65℃加热10min,之后立即将ep管插入冰中并添加表2剩余组分,轻混剩余试剂,反应程序为:25℃10min;50℃60min;85℃5min,;4℃hold。反应结束得到cdna后置于-20℃保存备用。
97.表2mrna逆转录反应体系2试剂体积(μl)终浓度5
×
逆转录buffer 4 8mm mgcl2 protector rnase inhibitor,40u/μl 0.5 20u dntp10mm each 2 1mm each逆转录酶20u/μl 0.5 10u
98.总体积为20μl;
99.(4)qpcr定量检测mrna
100.解冻并轻柔混匀sybr green master并短暂离心使管中试剂集中于底部,冰上保存。加入40μldepc稀释模板dna。全程冰上避光操作,轻柔混匀qpcr预混液并短暂离心,按照表3内容,准备qpcr反应液,短暂地离心-混匀-再离心,确认预混匀的反应液处于pcr反应板的底部,反应体系为10μl。反应程序是:95℃下进行预变性10min;95℃进行变性15s,56℃进行退火30s共40个循环
101.表3 mrna pcr反应体系组分体积(μl)faststart universal sybr green master 5 cdna 1引物1 depc 3
102.此时总体积为10μl;
103.pikoreal software分析实验结果:以gadph为内参基因,采用相对定量法(2
‑△
ct法)进行相对定量,每组实验重复3次。
104.实施例:基于队列的ctfh细胞对乙肝疫苗长期免疫效果的实验方法,包括酶联免疫分析、流式样品的制备与表达量的检测、免疫磁珠法富集小鼠脾脏中cd4+t细胞、实时荧光定量pcr检测,所述酶联免疫分析包括如下步骤:
105.(1)取预先冻存好的血清放置于4℃冰箱,进行解冻30分钟,3000rpm条件下离心20min,从而使颗粒状杂质沉淀,获得澄清均匀的血清。检测试剂盒室温平衡30min后从铝箔袋中取出所有的板条,截取所需要的部分,剩余板条密封放回4℃。
106.(2)加样:50μl/孔各加入浓度依次为:80、40、20、10、5、2.5miu/ml hbsab的标准品,样品孔中加入待测样品50μl,空白孔不用添加。加样过程中需要将样品加入酶标板孔的底部,注意避免碰触孔壁,随后轻柔地水平晃动摇匀。
107.(3)加酶:除空白孔以外每孔加入辣根过氧化氢酶(hrp)标记的检测抗体50μl。
108.(4)孵育:取封板膜,设置孵育箱为37℃,并放置60min。
109.(5)洗涤液配制:取20
×
浓缩洗涤液,用超纯水稀释至1
×
后备用。
110.(6)洗涤:撕开封板膜,甩出板内的液体,每孔加入350μl 1
×
洗涤液,静置1min后弃液体,纸上拍干液体,如此重复洗板5次。
111.(7)显色:底物液a和b在使用前按1:1体积充分混合,混合后15min内使用,每孔加入100μl底物混合物,轻轻震荡混匀,用封板膜盖住反应板避光,37℃孵育15min。
112.(8)终止:每孔加50μl的终止液,终止孔内的反应。
113.(9)测定:设置酶标仪为450nm波长,测量每孔的吸光度(od值)。
114.(10)计算样品浓度:通过标准样的测量值制作标准曲线,计算回归方程,再利用方程算出每孔样品hbsab浓度值,所述流式样品的制备与表达量的检测包括如下步骤:
115.(1)取1
×
106外周血单核细胞于1.5ml离心管中,用1ml buffer溶液重悬细胞。
116.(2)室温下300rcf进行10min离心溶液。
117.(3)弃上清,再用100μl buffer重悬细胞。
118.(4)加流式抗体,用移液枪或者移液管轻轻吹打混匀,避光室温孵育30min。
119.(5)孵育结束后加入1ml buffer溶液进行细胞重悬。
120.(6)室温下300rcf进行10min离心。
121.(7)弃去上清,用400μl的2%多聚甲醛固定细胞,上机检测,所述免疫磁珠法富集小鼠脾脏中cd4+t细胞包括如下步骤:
122.(1)取pbmcs细胞以50μl/ml计算量加入easysep
tm mouse t cell enrichment cocktail,充分混匀,室温(15-25℃)孵育10min。
123.(2)漩涡震荡easysep
tm d magnetic particles 30s,确保溶液无聚集物。
124.(3)再向流式管加入100μl的magnetic particles,充分混匀,室温(15-25℃)孵育5min。
125.(4)再向流式管(容积为3ml)中加入缓冲溶液,使液体总量达到2.5ml。
126.(5)用移液枪上下混匀细胞2-3次,将整个流式管插入磁铁内,放置5min。
127.(6)轻轻地将载有磁铁的流式管倾倒,注入新的管中,将磁极和管子倒置2-3s,然后返回直立位置。不需摇晃或擦掉任何可能悬挂在管口上的液滴,此即磁珠富集后得到的cd4+t细胞,鉴定纯度,所述实时荧光定量pcr检测包括如下步骤:
128.(1)引物合成:取mrna目的引物,mrna目的引物由上海捷瑞公司设计、合成,并根据使用说明书,用depc配置成浓度为100μm,放入-20℃冰箱储存备用,使用时上下游引物各取10μl,depc取80μl稀释至10μm,以达到工作反应的浓度。
129.(2)细胞内总rna提取
130.s1.将t细胞转移到到1.5ml ep管中,4℃,2000rpm,离心5min,收集细胞,弃培养基。
131.s2.向细胞中加入1ml trizol反应液,用移液器后移液管缓慢地吹打裂解细胞几次,室温,静置5min,从而使得细胞得到充分裂解。
132.s3.每管加入0.2ml氯仿(200μl氯仿/ml trizol),剧烈震荡混匀,室温静置10min;放置于4℃预冷的离心机中,12000rpm,离心15min。
133.s4.轻轻地吸取上层水相大约400μl并转移至新的ep管中,加入同体积的异丙醇,轻轻上下颠倒混匀,室温静置5到10min后,4℃,转移至离心机离心10min,12000rpm。
134.s5.弃上清,加入1ml已经配置好的75%的乙醇(0.1%depc水配制,现配现用)洗涤rna,悬浮沉淀,4℃,7500rpm,离心5min。
135.s6.弃上清,用滤纸或吸水纸吸干残留在管口液体,室温放置于通风橱中10min,从而风干rna,视沉淀物的量加入大约10μl~30μl的depc水溶解rna样品,56℃促溶10min后立即置于冰上。
136.s7.混匀,检测rna浓度、纯度,od260/od280比值在1.8~2.0间的rna纯度较好,再
利用1%琼脂糖凝胶电泳检测rna完整性,剩余rna马上进行逆转录。
137.(3)mrna逆转录
138.冰上融化试剂并离心,按标制备20μl逆转录反应液(一次反应量)至终体积为13μl,轻轻地混匀反应混合物,用低速离心机短暂地离心-混匀-离心。
139.表1mrna逆转录反应体系1试剂体积终浓度(μl)总rna/1μg锚定寡核苷酸(dt)18引物50pmol/μl 1 2.5μm随机六聚核苷酸引物600pmol/μl 2 60μm water(pcr-grade)至终体积13/
140.总体积为13μl;
141.pcr仪65℃加热10min,之后立即将ep管插入冰中并添加表2剩余组分,轻混剩余试剂,反应程序为:25℃10min;50℃60min;85℃5min,;4℃hold。反应结束得到cdna后置于-20℃保存备用。
142.表2mrna逆转录反应体系2试剂体积(μl)终浓度5
×
逆转录buffer 4 8mm mgcl2 protector rnase inhibitor,40u/μl 0.5 20u dntp10mm each 2 1mm each逆转录酶20u/μl 0.5 10u
143.总体积为20μl;
144.(4)qpcr定量检测mrna
145.解冻并轻柔混匀sybr green master并短暂离心使管中试剂集中于底部,冰上保存。加入40μldepc稀释模板dna。全程冰上避光操作,轻柔混匀qpcr预混液并短暂离心,按照表3内容,准备qpcr反应液,短暂地离心-混匀-再离心,确认预混匀的反应液处于pcr反应板的底部,反应体系为10μl。反应程序是:95℃下进行预变性10min;95℃进行变性15s,56℃进行退火30s共40个循环
146.表3 mrna pcr反应体系组分体积(μl)faststart universal sybr green master 5 cdna 1引物1 depc 3
147.此时总体积为10μl;
148.pikoreal software分析实验结果:以gadph为内参基因,采用相对定量法(2
‑△
ct法)进行相对定量,每组实验重复3次。
149.需要说明的是,在本文中,诸如第一和第二等之类的关系术语仅仅用来将一个实体或者操作与另一个实体或操作区分开来,而不一定要求或者暗示这些实体或操作之间存在任何这种实际的关系或者顺序。而且,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。在没有更多限制的情况下。由语句“包括一个......限定的要素,并不排除在包括所述要素的过程、方法、物品或者设备中还存在另外的相同要素”。
150.尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1