一种芦荟多糖有效成分检测的电泳方法与流程
1.本发明属于生化分析领域,具体涉及一种芦荟多糖有效成分检测的电泳方法。
背景技术:
2.芦荟多糖是芦荟的主要成分之一,占芦荟原汁干燥物约18%-30%。而芦荟多糖主要活性成分是由线性β-(1,4)-d-甘露糖基单元连接而成的乙酰化甘露聚糖(acemannan)。它不仅能作为细胞内代谢的能量来源,又可作为调节免疫的配位体、细胞间传送的调节剂和附着于健康细胞上病原体的有效抑制剂等,具有显著的免疫调节、抗肿瘤等功能。
3.由于芦荟多糖有效成分乙酰化甘露聚糖分子量大、结构复杂,对其进行鉴别和检测过程复杂,成本较高,例如高效液相色谱法(hplc)需采用高效凝胶色谱柱和蒸发光检测器(或示差检测器)。而传统生产领域的多糖分析常采用水解后测还原糖法、苯酚-硫酸比色和蒽酮-硫酸比色等方法,但这些方法的多糖含量只是通过降解后的单糖残基确定,无法进行多糖结构鉴别。
技术实现要素:
4.为了克服现有技术的不足,本发明的目的在于提供一种芦荟多糖有效成分检测的电泳方法,能检查出芦荟多糖的有效成分含量,灵敏度高,检测过程简单,成本低。
5.本发明的目的采用如下技术方案实现:
6.一种芦荟多糖有效成分检测的电泳方法,包括如下步骤:
7.s1,将待测芦荟样品制成芦荟多糖溶液;
8.s2,取芦荟多糖溶液,进行染色处理,得到染色样品;
9.s3,对染色样品进行电泳处理,得到多糖电泳条带;
10.s4,记录多糖电泳条带,确定待测芦荟样品的芦荟多糖有效成分含量。
11.进一步地,步骤s1中,所述待测芦荟样品为新鲜的芦荟叶、芦荟多糖干粉和芦荟产品中的至少一种。
12.进一步地,将新鲜的芦荟叶制成芦荟多糖溶液步骤为:将新鲜的芦荟叶剥皮,打碎,得到芦荟多糖溶液;和/或,
13.将芦荟多糖干粉制成芦荟多糖溶液步骤为:按照1:30-60的料液比加入蒸馏水复溶,得到芦荟多糖溶液;和/或,
14.将芦荟产品制成芦荟多糖溶液步骤为:根据芦荟产品的形态和浓度,直接得到或进行调配处理后得到芦荟多糖溶液;所述调配处理步骤包括复溶、过滤、稀释和浓缩中的一种或几种。
15.进一步地,步骤s2中,所述染色处理步骤为荧光标记法或o-乙酰基显色法。
16.进一步地,所述荧光标记法具体为:取芦荟多糖溶液,加入异硫氰酸荧光素,然后用氢氧化钠调节ph值为9.0-10.0,反应1.5-2.5h。
17.进一步地,所述异硫氰酸荧光素与所述芦荟多糖溶液的质量比为0.05-0.1:1。
18.进一步地,加入异硫氰酸荧光素后,在100-150r/min的摇床上进行摇匀,所述反应的温度为37-45℃。
19.进一步地,所述o-乙酰基显色法具体为:取芦荟多糖溶液,加入碱性羟胺液,摇匀,于室温放置3-5min,加入盐酸溶液,摇匀,加入三氯化铁溶液,摇匀。
20.进一步地,步骤s3中,所述电泳为聚丙烯酰胺凝胶电泳,电泳试剂包括:
21.1)电泳缓冲液:硼酸-tris-edta缓冲液,ph值为7.5-9.0;
22.2)分离胶缓冲液:取质量比为2-3:0.05-0.1:5-8的丙烯酰胺、甲叉丙烯酰胺和蔗糖,用电泳缓冲液溶解;
23.3)浓缩胶缓冲液:取质量比为1-2:0.01-0.05的丙烯酰胺、甲叉丙烯酰胺,用电泳缓冲液溶解,用冰乙酸调ph值为6.0-7.0;
24.4)分离胶:取体积比为25-35:3-5的10%过硫酸铵、temed,用分离胶缓冲液溶解,配制得分离胶;
25.5)浓缩胶:取体积比为35-45:4-6的10%过硫酸铵、temed,用浓缩胶缓冲液溶解,配制得浓缩胶;
26.6)上样缓冲液:医用甘油。
27.进一步地,所述硼酸-tris-edta缓冲液包括质量比为5-7:10-15:3-5的硼酸、三羟甲基氨基甲烷和edta二钠。
28.相比现有技术,本发明的有益效果在于:
29.本发明的一种芦荟多糖有效成分检测的电泳方法,采用显色物质染色标记芦荟多糖有效成分,简化了常规多糖电泳过程中,多糖沉淀、染色、漂洗等步骤,缩短了实验时间,提高了多糖检测的灵敏度和准确度。相比高效液相色谱法,本发明的检测过程简单,成本较低,与传统的水解后测还原糖法、苯酚-硫酸比色和蒽酮-硫酸比色等方法相比,本发明可以进行多糖结构鉴别,灵敏度高。
30.进一步地,o-乙酰基显色法为将乙酰化甘露聚糖的乙酰基,在碱性羟胺溶液中,能生成含乙酰基的复合物,并与三氯化铁-盐酸溶液在酸性条件下作用,缩合成有色化合物,得到的多糖电泳条带可直接观测,操作简单。荧光标记法为通过fitc与芦荟多糖结合,在紫外灯下观察,多糖电泳条带的清晰度高,检测的准确度高。
31.本发明无需精密仪器,就可快速进行待测芦荟样品中芦荟多糖有效成分的鉴别及含量对比,简单方便经济,可在芦荟种植、芦荟产品生产过程中广泛应用。
附图说明
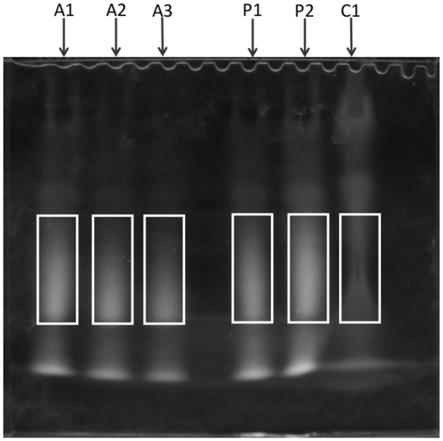
32.图1为实施例1中新鲜芦荟多糖、芦荟多糖干粉、芦荟产品的电泳图。
33.图2为实施例2中新鲜芦荟多糖、芦荟多糖干粉、芦荟产品的电泳图。
34.图3为实施例3中芦荟多糖电泳条带凝胶中多糖的离子色谱图。
35.图4为实施例3中芦荟多糖电泳条带凝胶中多糖的糖苷键检测图。
36.图5为实施例4中新鲜芦荟多糖、芦荟多糖干粉、芦荟产品的电泳图。
具体实施方式
37.下面,结合具体实施方式,对本发明做进一步描述,需要说明的是,在不相冲突的
前提下,以下描述的各实施例之间或各技术特征之间可以任意组合形成新的实施例。
38.实施例1
39.一种芦荟多糖有效成分检测的电泳方法,包括以下步骤:
40.(1)将年龄为12月、6月、3月的芦荟叶剥皮,打碎得到样新鲜芦荟多糖a1、a2、a3样品溶液;芦荟多糖干粉按照1:60和1:40的料液比,加入蒸馏水复溶,得到芦荟多糖干粉p1、p2样品溶液;芦荟产品按照1:1的比例,加入蒸馏水稀释,得到芦荟产品c1样品溶液。
41.(2)别取上述样品溶液5ml,加入fitc(异硫氰酸荧光素)试剂10mg,用氢氧化钠调节ph值为9.0,在150r/min的摇床上,45℃反应2h。
42.(3)取上述完成反应的溶液1ml,加入1ml医用甘油,混合均匀得到检测液,备用。
43.(4)将检测液进行聚丙烯酰胺凝胶电泳,电泳试剂包括:
44.1)电泳缓冲液:硼酸6.09g,tris 12.15g,edta二钠3.86g,加水溶解,定容至1000ml,调节ph值为7.5。
45.2)分离胶缓冲液:丙烯酰胺2.6g,甲叉丙烯酰胺0.07g,蔗糖6g,用电泳缓冲液溶解,定容200ml。
46.3)浓缩胶缓冲液:丙烯酰胺1.4g,甲叉丙烯酰胺0.037g,用30ml电泳缓冲液溶解,用冰乙酸调ph值为6.0。
47.4)分离胶:分别取分离胶缓冲液5ml、10%过硫酸铵27ul、temed4.0ul,混匀。
48.5)浓缩胶:分别取分离胶缓冲液4ml、10%过硫酸铵40ul、temed 5ul,混匀。
49.实验方法:
50.分离胶制作:按分离胶配方配制分离胶溶液,配制好后立即灌胶。灌胶后加纯水封胶。当分离胶凝固后,倒掉上层纯水,用吸水纸吸干。
51.浓缩胶制作:按浓缩胶配方配制浓缩胶溶液,配制好后立即灌胶,插入梳子,待浓缩胶凝固。
52.将凝胶放入垂直电泳槽,倒入缓冲液,拔掉梳子。
53.上样:分别上样新鲜芦荟多糖样品a1、a2、a3、p1、p2、c1,150v电压下电泳至条带到达胶底约1cm处,停止电泳。将凝胶置于紫外灯下观察,记录结果。
54.如图1所示,芦荟多糖有效成分乙酰化甘露聚糖会随着芦荟叶的年龄增加而增多,新鲜芦荟多糖样品电泳条带的荧光亮度从大到小依次是a1、a2、a3样品,与芦荟叶片年龄一致;芦荟多糖粉末p1、p2样品的荧光的亮度也与芦荟多糖粉末的浓度一致;芦荟产品c1样品也能显色荧光条带,证明本发明用于新鲜芦荟叶片、芦荟多糖粉末和芦荟产品中芦荟多糖有效成分检测的有效性。
55.实施例2
56.一种芦荟多糖有效成分检测的电泳方法,包括以下步骤:
57.(1)将新鲜芦荟叶剥皮,打碎得到样新鲜芦荟多糖a1样品溶液;芦荟多糖干粉按照1:40的料液比,加入蒸馏水复溶,得到芦荟多糖干粉p1样品溶液;芦荟产品按照1:1的比例,加入蒸馏水稀释,得到芦荟产品c1样品溶液。
58.(2)o-乙酰基显色:精确量取样品1ml置于试管中,加2ml新鲜配制的碱性羟胺液,摇匀,于室温放置4分钟,加入4mol/l盐酸溶液1ml,摇匀,加0.37mol/l三氯化铁溶液1ml,摇匀。
59.(3)取上述完成反应的溶液1ml,加入1ml医用甘油,混合均匀得到检测液,备用。
60.(4)将检测液进行聚丙烯酰胺凝胶电泳,试剂配制与实验方法同实施例1。
61.上样:分别上样样品p1、a1、c1,150v电压下电泳至条带到达胶底约1cm处,停止电泳。在可见光下记录结果。
62.o-乙酰基显色的原理是乙酰化甘露聚糖的乙酰基,在碱性羟胺溶液中,能生成含乙酰基的复合物,并与三氯化铁-盐酸溶液在酸性条件下作用,缩合成有色化合物(芦荟制品颜色一般为微黄色-棕色)。
63.如图2所示,新鲜芦荟多糖、芦荟多糖干粉、芦荟产品均显色出黄色条带,黄色条带位置与实施例1中多糖荧光条带位置一致,不仅验证了荧光条带中的主要成分含有o-乙酰基,也证明了此方法可用于电泳条带中芦荟多糖有效成分的显色。
64.实施例3
65.本实施例将实施例1得到的芦荟多糖电泳条带的凝胶取出,通过高效液相凝胶渗透色谱(hpgpc),离子色谱(ic5000+),气质联用(gc-ms),核磁共振光谱(nmr)等手段对样品进行单糖组成、甲基化及核磁的分析。
66.如图3和表1所示,使用离子测谱仪测定单糖组成,结果表明电泳条带中的多糖的单糖组成主要为甘露糖。
67.表1 凝胶中多糖的单糖组成
68.[0069][0070]
如表2所示,通过多糖样品甲基化等衍生后gc-ms测其连接方式,结果表明电泳条带中的多糖的连接方式主要为
→
4)-manp-(1
→
。
[0071]
表2 gc-ms检测连接方式结果表
[0072][0073]
表3 核磁检测糖苷键信号表
[0074][0075]
如表3所示,再进一步根据核磁一维二维图谱,对其糖苷键信号进行归属;糖苷键
→
4)-β-d-manp-(1
→
的异头氢与其自身的h4有相关信号峰;
[0076]
从而表明存在
→
4)-β-d-manp-(1
→
4)-β-d-manp-(1
→
的链接方式。
[0077]
同时,糖苷键
→
4)-β-d-manp-(1
→
的异头氢与其
→
4)-β-d-2ace-manp-(1
→
的h4有相关信号峰;
[0078]
表明存在
→
4)-β-d-manp-(1
→
4)-β-d-2ace-manp-(1
→
的链接方式。
[0079]
综上所述,该多糖的糖链为:
[0080]
→
4)-β-d-manp-(1
→
4)-β-d-manp-(1
→
4)-β-d-2ace-manp-(1
→
;
[0081]
其分子结构式为:
[0082][0083]
对芦荟多糖电泳条带凝胶中的多糖成分的结构鉴定结果证明,芦荟多糖的主要成分是乙酰化甘露聚糖,进一步验证了本发明的电泳方法可用于分析芦荟多糖有效成分。
[0084]
实施例4
[0085]
一种芦荟多糖有效成分检测的电泳方法,包括以下步骤:
[0086]
(1)将年龄为12月的2片芦荟叶剥皮,打碎得到样新鲜芦荟多糖a1、a2溶液;芦荟多糖干粉按照1:30的料液比,加入蒸馏水复溶2个样品,得到芦荟多糖干粉样品p1、p2;芦荟产品按照1:2和1:1的比例,加入蒸馏水稀释,得到芦荟产品样品d1、d2。
[0087]
(2)取样品溶液5ml,加入fitc试剂9mg,用氢氧化钠调节ph10.0,在100r/min的摇床上,37℃反应2h。
[0088]
(3)取上述完成反应的溶液1ml,加入1ml医用甘油,混合均匀得到检测液,备用。
[0089]
(4)将检测液进行聚丙烯酰胺凝胶电泳,电泳试剂包括:
[0090]
1)电泳缓冲液:硼酸6.09g,tris 12.15g,edta二钠3.86g,加水溶解,定容至1000ml,调节ph值8.0。
[0091]
2)分离胶缓冲液:丙烯酰胺2.6g,甲叉丙烯酰胺0.07g,蔗糖6g,用电泳缓冲液溶解,定容200ml。
[0092]
3)浓缩胶缓冲液:丙烯酰胺1.4g,甲叉丙烯酰胺0.037g,用30ml电泳缓冲液溶解,用冰乙酸调ph值为7.0。
[0093]
4)分离胶:分别取分离胶缓冲液5ml、10%过硫酸铵27ul、temed4.0ul,混匀。
[0094]
5)浓缩胶:分别取分离胶缓冲液4ml、10%过硫酸铵40ul、temed 5ul,混匀。
[0095]
实验方法:
[0096]
分离胶制作:按分离胶配方配制分离胶溶液,配制好后立即灌胶。灌胶后加纯水封胶。当分离胶凝固后,倒掉上层纯水,用吸水纸吸干。
[0097]
浓缩胶制作:按浓缩胶配方配制浓缩胶溶液,配制好后立即灌胶,插入梳子,待浓缩胶凝固。
[0098]
将凝胶放入垂直电泳槽,倒入缓冲液,拔掉梳子。
[0099]
上样:分别上样新鲜芦荟多糖样品a1、a2、d1、d2、p1、p2,120v电压下电泳至条带到达胶底约1cm处,停止电泳。将凝胶置于紫外灯下观察,记录结果。
[0100]
如图5所示,新鲜芦荟多糖样品a1、a2与芦荟多糖粉末样品p1、p2的芦荟多糖浓度分别一致,荧光的亮度一致;芦荟产品样品d1条带的荧光强度比d2小,结果与浓度一致。
[0101]
上述实施方式仅为本发明的优选实施方式,不能以此来限定本发明保护的范围,本领域的技术人员在本发明的基础上所做的任何非实质性的变化及替换均属于本发明所要求保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1