一种测定谷胱甘肽还原酶的试剂盒的制作方法
1.本发明涉及医学检验领域,具体涉及一种测定谷胱甘肽还原酶的试剂盒
背景技术:
2.谷胱甘肽还原酶(gr)是人体氧化还原体系中最为重要的酶之一,是维持细胞中还原型谷胱甘肽(gsh)含量的主要黄素酶,在gr催化下,氧化型谷胱甘肽与还原型辅酶ii(nadph)反应,接着转化为还原型谷胱甘肽,后者在放置血红蛋白的氧化分解、维持巯基蛋白的活性、保证巯基蛋白的还原性及细胞的完整性具有重要的作用。血清谷胱甘肽还原酶的临床意义主要有:(1)判断早期肝脏损伤的指标,其中早期损伤可分为生理性损伤如运动导致和病理性损伤,如急性肝炎、药物性肝损、中毒性肝炎、肝癌、肝硬化早期等;(2)血清谷胱甘肽还原酶活性明显升高时可用于指示原发性肝细胞癌和广泛转移性肝肿瘤;(3)在肝脏疾病治疗过程中,gr与丙氨酸氨基转移酶和天门冬氨酸氨基转移酶联合使用可以对肝脏受损状态进行动态监测;(4)恶性黄疸的鉴别诊断指标之一。
3.谷胱甘肽还原酶的临床或实验室检测方法有紫外酶法、酶联免疫法、紫外比色法、荧光光度法和电化学法等。现目前,市场上gr活性检测项目的反应体系普遍采用谷胱甘肽底物法(又称紫外酶法)。目前市售的gr检测试剂普遍存在抗血红蛋白干扰能力差的问题,在检测血红蛋白异常样本时的结果偏差较大,同时,由于新鲜样本中谷甘胱肽还原酶的存在形式主要为多聚酶,其异构形式形成分子集聚使酶活性下降,进而影响检测的准确性。
技术实现要素:
4.发明人意外发现,通过在检测试剂中添加一定量的表面活性剂及促凝剂组合,可以有效改善gr试剂的抗干扰问题,尤其是血液异常样本中血红蛋白干扰和多聚酶干扰。
5.为了实现上述目的,本发明采用如下技术手段:一种测定谷胱甘肽还原酶的试剂盒,包括试剂r1以及试剂r2,其特征在于:所述试剂r1中包括缓冲液、氧化型谷胱甘肽、表面活性剂以及egta;所述试剂r2中包括缓冲液、还原性辅酶ii四钠盐以及表面活性剂。
6.优选地,所述试剂r1中egta的浓度为2-4g/l,优选为2-3g/l。
7.优选地,所述试剂r1中的表面活性剂选自brij58、emulgen ls-114、tween-20或triton x-100中的至少一种;所述试剂r2中的表面活性剂选自brij58、emulgen ls-114、tween-20或triton x-100中的至少一种。
8.优选地,所述试剂r1以及试剂r2中的表面活性剂均为brij58。
9.优选地,所述试剂r1以及试剂r2中brij的浓度为0.05-0.5%,优选为0.05-0.2%。
10.优选地,所述试剂r1以及试剂r2中还包括防腐剂,所述防腐剂选自叠氮钠或proclin30中的至少一种。
11.优选地,所述试剂r1中缓冲液选自磷酸盐缓冲液、good’s缓冲液、丁二酸缓冲液以及咪唑缓冲液中的至少一种,优选为咪唑缓冲液;所述试剂r2中缓冲液选自碳酸钠缓冲液、pbs缓冲液、磷酸盐缓冲液中的至少一种,优选为碳酸钠缓冲液。
12.优选地,所述试剂r1中:缓冲液的浓度为10-15g/l,所述氧化型谷胱甘肽的浓度为0.4-0.8g/l,所述防腐剂的浓度为0.5-2g/l;所述试剂r2中:缓冲液的浓度为4-6g/l,防腐剂的浓度为0.5-2g/l,所述还原型辅酶ii四钠盐的浓度为0.5-1g/l。
13.优选地,所述试剂r1的ph值为6.0-9.0,所述试剂r2的ph值为8.0-11.0。
14.优选地,所述试剂r1的ph值为7.0-8.0,所述试剂r2的ph值为9.0-11.0;优选地,所述试剂r1的ph值为7.0,所述试剂r2的ph值为10.0。
15.本发明的有益效果在于:本发明通过试剂r1以及试剂r2中添加定量的聚氧乙烯醚brij58,可以大幅降低血红蛋白的干扰,抗干扰能力达到了5.0g/l,大幅提升了血红蛋白异常样本的检测准确度;同时通过在试剂r1中添加定量的egta,解决了因新鲜样本中谷胱甘肽还原酶主要以多聚酶形式存在而导致的酶活性降低的问题,进而有效提升了试剂盒的临床检测准确度。本发明通过特定的组分及浓度配比,最终获得了各项检测性能优异的试剂盒,适于临床应用及推广。
附图说明
16.图1为本发明实施例3线性范围验证图
17.图2为本发明实施例3临床相关性验证图
具体实施例
18.本文包括以下的实施例,用于以例证的方式更清楚、明确地阐述本发明的技术方案。本领域技术人员根据本文的公开应当理解,可以在所公开的特定的实施方式中进行许多改变但是仍然获得相似或类似的结果,而不偏离本发明的思想和范围。本发明的具体实施方式仅用于解释本发明,而非意图通过任何方式限制本发明。
19.实施例1 gr检测试剂盒的制备
20.本发明的谷胱甘肽还原酶检测试剂盒包括彼此独立的试剂r1和试剂r2双液体组分。
21.1.试剂r1的制备
22.按照下述配方进行配制,充分搅拌混匀后,放于2-8℃保存。
[0023][0024]
2.试剂r2的制备
[0025]
按照下述配方进行配制,充分搅拌混匀后,放于2-8℃保存。
[0026][0027][0028]
实施例2试剂盒的使用方法
[0029]
本实施例中,使用全自动生化分析仪(au480)配合本发明试剂盒进行样本检测,具体使用方法如下所述:
[0030]
(a)将待测样本、试剂r1以及试剂r2按10:250:50的比例混合,使其充分反应;
[0031]
(b)用全自动生化分析仪测定反应后的吸光度差值(au480:主波长340nm,副波长405nm,仪器读点14-27)
[0032]
(c)根据吸光度变化值计算出样本中gr的浓度。
[0033]
检验原理:由nadph供氢,谷胱甘肽还原酶(gr)催化氧化型谷胱甘肽(gssg)还原生成还原型谷胱甘肽(2gsh),nadph被氧化成nadp+,引起340nm波长处吸光度下降,此种下降速率与样本中gr的活性成正比。通过与同样处理的甘胆酸校准品比较,即可计算出样品中cg的含量。
[0034]
样本中gr(u/l)=cs
×
δat/δas(u/l)
[0035]
式中:δat以空白管吸光度作对照的样品管吸光度值,δas以空白管吸光度作对照的校准管吸光度值,cs校准液中gr的浓度。
[0036]
实施例3试剂盒的性能测试
[0037]
将实施例1中制备得到的谷胱甘肽还原酶检测试剂盒按照实施例2所述的使用方法进行性能测试。
[0038]
(1)准确度验证
[0039]
使用试剂盒对质控品进行准确度测试,设3个重复,通过全自动生化分析仪(au480)读取信号,计算测定均值与靶值的相对偏差进行准确度验证。检测结果如下表所示:
[0040]
表1准确度验证
[0041]
[0042][0043]
由上述实验结果可知,测试值与靶值的相对偏差分别为-0.84%以及0.99%,均小于1.0%,实验结果说明本发明所述谷胱甘肽还原酶检测试剂盒的准确度较好。
[0044]
(2)精密度验证
[0045]
选取临床特异性生长因子低值样本、中值样本以及高值样本,使用三组试剂盒分别对样本进行测试,每个样本分别重复测定10次,通过全自动生化分析仪(日立7180)读取信号,分别计算测定均值和标准差,计算变异系数进行精密度考察。检测结果如下表所示:
[0046]
表2精密度验证
[0047][0048]
由上述实验结果可知,在低值样本、中值样本以及高值样本检测时的变异系数分别为0.61%、0.36%以及0.24%。实验结果说明本发明所述的谷胱甘肽还原酶检测试剂盒具有较高的灵敏度。
[0049]
(3)线性范围验证
[0050]
选择临床超高值样本以及低值样本,随后利用高值样本以及低值样本按比例配置各浓度梯度样本,使用本发明所述试剂盒分别对样本进行测试,每个样本分别重复测定2次,通过全自动生化分析仪(au480)读取信号,分别计算测定均值进行线性范围考察。检测结果如下表所示:
[0051]
表3试剂盒线性范围验证
[0052] h-ll-h理论值均值相对偏差1估计值相对偏差2
h287.4288.65288.03288.030.00%288.16-0.05%3/4h+1/4l219.17218.48218.84218.830.00%218.99-0.07%1/2h+1/2l149.24151.25149.65150.250.40%149.810.29%1/4h+3/4l81.0380.780.4680.870.51%80.630.29%1/8h+7/8l45.546.3245.8645.910.11%46.04-0.29%1/16h+15/16l28.6328.7628.5628.700.46%28.75-0.18%l11.5910.9411.2711.270.00%11.45 [0053]
注:相对偏差1为均值与理论值的相对偏差,相对偏差2为均值与估计值的相对偏差。
[0054]
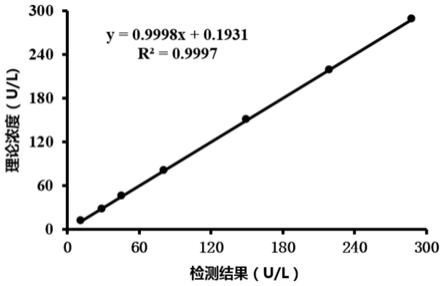
由上述实验结果可知,本发明所述试剂盒在样本浓度为11.29-287.4g/l线性范围内,检测值与理论值的相对偏差1以及检测值与估计值的相对偏差2均小于1.0%。同时,检测结果与样本浓度理论值进行相关性分析(如附图1所示):本发明所述试剂盒组检测值与理论值的相关性r2为0.9997。实验结果说明本发明所述的谷胱甘肽还原酶检测试剂盒在线性范围内具有较好的线性相关性。
[0055]
(4)抗干扰验证
[0056]
精密称取干扰物:胆红素f、胆红素c、vc、血红蛋白以及乳糜,分别加入临床样本中,每种干扰物分别制成5组浓度梯度的样本,使用上述5组试剂盒分别重复两次样本,计算平均值,以及均值与未加入干扰物初始测值的相对偏差,进行抗干扰验证。实验结果如下表所示:
[0057]
表4抗干扰验证
[0058]
[0059][0060]
*相对偏差:为加入干扰物检测均值与未加入干扰物初始测值的相对偏差。
[0061]
由上述实验结果可知,本发明所述试剂盒在检测样本中添加胆红素f、胆红素c、vc、血红蛋白以及乳糜干扰物质时,其检测值与未添加干扰物质的初始值相对偏差均小于1%。实验结果说明本发明所述的谷胱甘肽还原酶检测试剂盒具有较好的抗干扰性。
[0062]
(5)临床相关性
[0063]
选取48例临床样本,分别使用本发明实施例1所述试剂盒以及谷胱甘肽还原酶测定试剂盒-谷胱甘肽底物法(九强生物)进行检测,进行临床相关性验证,检测结果如下表所示:
[0064]
表5临床相关性验证
[0065]
[0066][0067]
*检测值1为市售试剂盒检测值;检测值2为本发明试剂盒检测值。
[0068]
将市售试剂盒(九强)的检测结果与本发明试剂盒的检测结果进行线性相关性分析,结果如图2所示,其r2=0.9863。实验结果说明,采用本发明实施例1所述方法制备得到的试剂盒与市售试剂盒有较好的相关性。
[0069]
实施例4添加物对试剂盒抗干扰能力的影响
[0070]
(1)为了验证在试剂r1以及试剂r2中添加表面活性剂对试剂盒抗血红蛋白干扰的影响,共设置5组试剂盒,具体设置如下:
[0071]
表5实验分组
[0072] abcder1-表面活性剂brij58/emulgen ls-114tween-20triton x-100r2-表面活性剂brij58/emulgen ls-114tween-20triton x-100
[0073]
*上述试剂盒除试剂r1及试剂r2中表面活性剂的种类与实施例1所述试剂盒不相同,其余制备方法完全一致。
[0074]
精密称取血红蛋白干扰物,加入临床样本中,制成5组浓度梯度的样本,使用上述5组试剂盒分别重复两次样本,计算平均值,以及均值与未加入干扰物初始测值的相对偏差,进行抗干扰验证。实验结果如下表所示:
[0075]
表6抗干扰验证
[0076][0077]
[0078]
*相对偏差:为加入干扰物检测均值与未加入干扰物初始测值的相对偏差。
[0079]
实验结果显示,当在试剂r1以及试剂r2中添加定量的聚氧乙烯醚brij58时,可以大幅降低血红蛋白的干扰,抗干扰能力达到了5.0g/l。
[0080]
(2)为了验证在试剂r1以及试剂r2中添加不同表面活性剂对试剂盒抗血红蛋白干扰的影响,共设置20组试剂盒,具体设置如下:
[0081]
表7实验分组
[0082] abcdr1-表面活性剂brij58brij58brij58brij58r2-表面活性剂/emulgen ls-114tween-20triton x-100 efghr1-表面活性剂////r2-表面活性剂brij58emulgen ls-114tween-20triton x-100 ijklr1-表面活性剂emulgen ls-114emulgen ls-114emulgen ls-114emulgen ls-114r2-表面活性剂brij58/tween-20triton x-100 mnopr1-表面活性剂tween-20tween-20tween-20tween-20r2-表面活性剂brij58/emulgen ls-114triton x-100 qrstr1-表面活性剂triton x-100triton x-100triton x-100triton x-100r2-表面活性剂brij58/emulgen ls-114tween-20
[0083]
*上述试剂盒除试剂r1及试剂r2中表面活性剂的种类与实施例1所述试剂盒不相同,其余制备方法完全一致。
[0084]
精密称取血红蛋白干扰物,加入临床样本中,制成5组浓度梯度的样本,使用上述20组试剂盒分别重复两次样本,计算平均值,以及均值与未加入干扰物初始测值的相对偏差,进行抗干扰验证。实验结果如下表所示:
[0085]
表8抗干扰验证
[0086][0087]
由上述实验结果可知,在试剂r1以及试剂r2中同时添加聚氧乙烯醚brij58时,试剂盒的抗血红蛋白干扰能力最强。其原理可能是:brij58可以对血红蛋白与谷胱甘肽还原酶的相互作用进行干扰,进而减小血红蛋白对gr与gssg特异性反应的影响,最终起到抗血红蛋白干扰的作用,提高了gr检测试剂盒的检测准确性。
[0088]
(3)为了验证在试剂r1以及试剂r2中添加不同浓度的brij58对试剂盒抗血红蛋白干扰的影响,共设置5组试剂盒,具体设置如下:
[0089]
表9实验分组
[0090] abcder1-brij 58浓度0.01%0.10.20.51.0r2-brij 58浓度0.01%0.10.20.51.0
[0091]
*上述试剂盒除试剂r1以及试剂r2中brij58的添加浓度与实施例1所述试剂盒不相同,其余制备方法完全一致。
[0092]
精密称取血红蛋白干扰物,加入临床样本中,制成5组浓度梯度的样本,使用上述5组试剂盒分别重复检测两次样本,计算平均值,以及均值与未加入干扰物初始测值的相对偏差,进行抗干扰验证。实验结果如下表所示:
[0093]
表10抗干扰验证
[0094][0095]
*相对偏差:为加入干扰物检测均值与未加入干扰物初始测值的相对偏差。
[0096]
由上述实验结果可知,在试剂r1以及试剂r2中添加聚氧乙烯醚brij58的浓度范围在0.05-0.5%内时,试剂盒的抗血红蛋白干扰能力最强。
[0097]
实施例5添加物对临床检测准确度的影响
[0098]
(1)为验证试剂r2中添加egta可以有效提升试剂盒的临床准确性,设置下述3组实验,具体设置如下:
[0099]
表11实验分组
[0100] abc促凝剂egta/edta
[0101]
*上述试剂盒除添加促凝剂的种类与实施例1所述试剂盒不相同,其余制备方法完
全一致。
[0102]
选取临床肝功异常样本(检测项目包括:天冬氨酸转氨酶-ast、丙氨酸转氨酶-alt、谷氨酰胺转移酶-ggt以及碱性磷酸酶alp),使用上述3组试剂盒分别重复检测两次样本,计算平均值,进行临床准确性验证。实验结果如下表所示:
[0103]
表12临床准确性验证
[0104][0105]
由上述实验结果可知,当试剂r1中添加egta(a组试剂盒)后,其谷胱甘肽还原酶的检测值普遍高于未添加egta的b组以及添加edta的c组试剂盒检测值。同时,部分样本的gr检测存在跳值现象,例如样本1、4、11、12以及14,所述5个样本在临床检测中ast、alt、ggt以及alp的测值均高于正常参考范围,为肝功异常样本,而在本实施例的检测中,仅有a组试剂盒的检测值可以准确指示所述5个样本为肝功异常样本。例如样本1,其ast、alt以及ggt的测值均显著高于正常参考范围,检测结果指示其为肝功异常样本,而所述3组试剂盒的gr测值分别为:162.6u/l、31.7u/l以及81.3,仅有a组试剂盒的测值未在参考范围内,b组以及c组的检测值均落在参考范围内。
[0106]
实验结果说明,通过在试剂r1中添加定量的egta可以有效提升试剂盒的临床检测准确度,其原因可能是,新鲜样本中谷胱甘肽还原酶的主要存在形式为多聚酶,多聚酶的异构形式容易形成分子聚集进而使酶活性降低,导致临床测值降低,而egta具有解聚作用,将gr多聚酶的异构形式解聚为单体酶,增强gr的活性,最终有效提升gr试剂盒检测的临床准确度。
[0107]
(2)为了验证在试剂r1中添加不同浓度的egta对试剂盒临床准确性的影响,共设置4组试剂盒,具体设置如下:
[0108]
表13实验分组
[0109] abcdegta浓度1g/l3g/l4g/l5g/l
[0110]
*上述试剂盒除egta的添加浓度与实施例1所述试剂盒不相同,其余制备方法完全一致。
[0111]
选取临床肝功异常样本(检测项目包括:天冬氨酸转氨酶-ast、丙氨酸转氨酶-alt、谷氨酰胺转移酶-ggt以及碱性磷酸酶alp),使用上述3组试剂盒分别重复检测两次样本,计算平均值,进行临床准确性验证。实验结果如下表所示:
[0112]
表14临床准确性验证
[0113][0114][0115]
由上述实验结果可知,样本4、6、9以及14,所述4个样本在上述4组试剂盒的检测值中存在跳值,其临床检测中ast、alt、ggt以及alp的测值均高于正常参考范围,为肝功异常样本,而在本实施例的检测中,仅有b组以及c组试剂盒的检测值可以准确指示所述5个样本为肝功异常样本。例如样本4,其ast、alt以及ggt的测值均显著高于正常参考范围,而所述4组试剂盒的gr测值分别为:69.8u/l、183.7u/l、159.3u/l以及51.0u/l,其中b组以及c组试剂盒的测值未在参考范围内,a组以及d组的检测值均落在参考范围内。实验结果说明,当试剂r2中egta的添加浓度在2-4g/l范围内时,试剂盒的临床准确度较高,尤其是在2-3g/l范围内时,检测的临床准确度最高。
[0116]
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在不脱离本发明的原理和宗旨
的情况下在本发明的范围内可以对上述实施例进行变化、修改、替换和变形。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1