一种利用荧光微塑料处理贻贝的方法
1.本发明涉及一种利用荧光微塑料处理贻贝的方法。
背景技术:
2.现如今,微塑料已经成为了一种新型污染物,普遍存在于海水、海底和海底沉积物中。存在于各种环境介质中的微塑料不仅会对生态环境造成不可逆转的影响,对人类和海生动物也有严重的危害。目前,国际上对于微塑料的处理处置尚没有很好的方法。
3.据大量研究资料表明,贻贝类生物体内的微塑料监测含量较高。双壳类软体生物——贻贝作为一种典型的滤食性底栖生物,可以有效地从海水中积累包括微塑料在内的化学污染物,并作为海水污染物的浓度和生物有效性的指示生物,为海洋污染提供一种综合的测量方法(beyeret al,2017)。
4.1986年起,美国国家海洋和大气管理局国家状况和趋势(ns&t)计划中的贻贝观察项目,开始监测美国沿海和河口地区污染物浓度的空间分布和时间趋势。该项目是世界上连续运行时间最长的海岸监测项目之一。近年来,在微塑料污染研究日益热门的形势下,越来越多的研究人员开始将贻贝作为监测环境污染的指示生物(quetal,2018;karlsson et al.,2017;lusher et al.,2017a;li et al,2016;wesch et al,2016;van cauwenberghe et al,2015)。然而,关于贻贝对微塑料的处理及摄食能力方面的研究总体寥寥无几,贻贝对微塑料降解效果的数据支持几乎是一片空白,因此无法对浙江近海海域中贻贝处理微塑料的状况进行准确评估。
技术实现要素:
5.本发明要解决的技术问题是提供一种利用荧光微塑料处理贻贝的方法,该方法方便于观察微塑料对贻贝的影响,能有效评估贻贝对微塑料的处理能力及影响效果。
6.为解决上述技术问题,本发明的技术方案是:
7.一种利用荧光微塑料处理贻贝的方法,包括以下步骤:
8.1)模拟海水配制:
9.将海盐加入蒸馏水中,搅拌至混合均匀后曝气2
‑
3天得到模拟海水;
10.2)荧光微塑料溶液配制:
11.将荧光微塑料加入步骤1)得到的模拟海水中,超声混合均匀后得到荧光微塑料溶液;
12.3)贻贝采集驯养:
13.3.1)现地采集或购买新鲜的贻贝;
14.3.2)将步骤3.1)采集或购买到的贻贝放入低温室内的玻璃缸中驯养3
‑
7天,玻璃缸中放置有步骤1)得到的模拟海水,驯养2
‑
3天时给贻贝喂食螺旋藻,及时检查贻贝的状态,取出死亡个体;
15.4)暴露实验设置:
16.4.1)设置1个对照组和1个实验组,对照组中贻贝的暴露液为步骤1)得到的模拟海水,实验组中贻贝的暴露液为步骤2)得到的荧光微塑料溶液;
17.4.2)对照组和实验组分别使用40只贻贝,将贻贝养殖于暴露液中暴露7天,每天分别从对照组、实验组的暴露液中取出500ml用于化学分析以及使用荧光显微镜观察荧光微塑料含量,分析荧光微塑料浓度的变化;每天取出死亡个体,记录个数后保存于冰箱;暴露第四天给对照组的实验组贻贝喂食螺旋藻;
18.4.3)暴露结束后,从对照组和实验组中分别随机取出5只贻贝,将贻贝室温下清洗后放入筛网中,盖上锡箔纸,自然沥干水分,然后测量贻贝的体长、带壳湿重并记录;
19.5)贻贝组织系统中荧光微塑料的提取分离:
20.5.1)准备,将解剖工具、消解用的玻璃瓶、培养皿用滤膜过滤过的过滤水冲洗,并做好标记;
21.5.2)解剖,将贻贝置于台面上,紧贴壳内壁用解剖刀分别割断两侧闭壳肌,掰开壳,用镊子取出软组织或者整个消化系统,解剖时避免误取其它组织,然后解剖性腺、内脏团、鳃、外套膜组织;
22.5.3)消解,将步骤5.2)解剖得到的组织置于锥形瓶中,加入消解液后超声5分钟,将锥形瓶置于振荡培养箱中消解24小时得到组织液;
23.5.4)分离过滤,将步骤5.3)得到的组织液抽滤至玻璃纤维滤膜,用过滤水冲洗过滤器,将玻璃纤维滤膜置于洁净干燥的玻璃培养皿中,做好标记后置于烘箱中干燥待测;
24.6)微塑料观察:
25.6.1)抽取实验组的暴露液100μl并制片,用荧光显微镜观察并采集图形,每天观察1次荧光微塑料浓度的变化;
26.6.2)将步骤步骤5.2)解剖得到的组织制片,用荧光显微镜观察其荧光微塑料含量;
27.6.3)将步骤步骤5.3)得到的组织液制片,用荧光显微镜观察其荧光微塑料含量;
28.7)生物组织酶活测定:
29.7.1)总超氧化物歧化酶t
‑
sod测定;
30.7.2)丙二醇mda测定;
31.7.3)过氧化氢酶cat测定。
32.进一步地,本发明所述步骤1)中,模拟海水的盐度为26
‰
。
33.进一步地,本发明所述步骤2)中,荧光微塑料的粒度为90
‑
110μm,荧光微塑料与模拟海水的比例为3mg:(1
‑
3)l。
34.进一步地,本发明所述步骤3.2)中,低温室的温度为14℃。
35.进一步地,本发明所述步骤4.2)中,暴露的温度为14℃,光照条件为12小时光照和12小时黑暗,冰箱的温度为
‑
80℃。
36.进一步地,本发明所述步骤4.3)中,清洗的操作为将贻贝的贝壳闭合,顺着贝壳表面放射肋的方向用牙刷刷洗。
37.进一步地,本发明所述步骤5.1)中,滤膜的孔径为1μm。
38.进一步地,本发明所述步骤5.3)中,消解液为浓度为100g/l的氢氧化钾溶液,振荡培养箱的温度为60℃,转速为90r/min。
39.进一步地,本发明所述步骤5.4)中,玻璃纤维滤膜的直径为47mm,孔径为0.7μm,烘箱的温度为50℃。
40.进一步地,本发明所述步骤6.1)中,观察时荧光显微镜使用蓝光i3、2档、40倍,增益9、饱和度1.55、曝光3.5、伽玛射线5.45。
41.与现有技术相比,本发明具有以下有益效果:
42.现有研究贻贝体内微塑料分布状况及各组织中微塑料的含量的相关实验过程较为复杂,而本发明根据贻贝类生物喜食微塑料的可能性较高,用相同粒径的荧光微塑料代替海洋中难降解的微塑料培养贻贝一段时间,利用荧光微塑料的荧光特性来观察培养贻贝,并且根据相关资料检测使用荧光显微镜观察贻贝类消化系统中的微塑料的类型及含量,能有效降低研究实验的复杂性,更加直观高效评估实验,根据贻贝对荧光微塑料的处理能力以及影响效果可以得知贻贝对海洋中的微塑料的处理效果表现。此外,本发明方法可以广泛应用于在海洋微塑料对海洋中的其他生物的影响,以及在其体内的分布状况、特点等方面的研究。
具体实施方式
43.下面将结合具体实施例来详细说明本发明,在此本发明的示意性实施例以及说明用来解释本发明,但并不作为对本发明的限定。
44.实施例1
45.按照以下步骤利用荧光微塑料处理贻贝:
46.1)模拟海水配制:
47.将海盐加入蒸馏水中,搅拌至混合均匀后曝气3天得到盐度为26
‰
的模拟海水;
48.2)荧光微塑料溶液配制:
49.将粒度为90
‑
110μm的荧光微塑料加入步骤1)得到的模拟海水中,荧光微塑料与模拟海水的比例为3mg:2l,超声混合均匀后得到荧光微塑料溶液;
50.3)贻贝采集驯养:
51.3.1)现地采集或购买新鲜的贻贝;
52.3.2)将步骤3.1)采集或购买到的贻贝放入温度为14℃的低温室内的玻璃缸中驯养6天,玻璃缸中放置有步骤1)得到的模拟海水,驯养2天时给贻贝喂食螺旋藻,及时检查贻贝的状态,取出死亡个体;
53.4)暴露实验设置:
54.4.1)设置1个对照组和1个实验组,对照组中贻贝的暴露液为步骤1)得到的模拟海水,实验组中贻贝的暴露液为步骤2)得到的荧光微塑料溶液;
55.4.2)对照组和实验组分别使用40只贻贝,将贻贝养殖于暴露液中暴露7天,暴露的温度为14℃,光照条件为12小时光照和12小时黑暗,每天分别从对照组、实验组的暴露液中取出500ml用于化学分析以及使用荧光显微镜观察荧光微塑料含量,分析荧光微塑料浓度的变化;每天取出死亡个体,记录个数后保存于
‑
80℃的冰箱;暴露第四天给对照组的实验组贻贝喂食螺旋藻;
56.4.3)暴露结束后,从对照组和实验组中分别随机取出5只贻贝,将贻贝室温下清洗后放入筛网中,清洗时将贻贝的贝壳闭合,顺着贝壳表面放射肋的方向用牙刷刷洗,盖上锡
箔纸,自然沥干水分,然后测量贻贝的体长、带壳湿重并记录;
57.5)贻贝组织系统中荧光微塑料的提取分离:
58.5.1)准备,将解剖工具、消解用的玻璃瓶、培养皿用孔径为1μm的滤膜过滤过的过滤水冲洗,并做好标记;
59.5.2)解剖,将贻贝置于台面上,紧贴壳内壁用解剖刀分别割断两侧闭壳肌,掰开壳,用镊子取出软组织或者整个消化系统,解剖时避免误取其它组织,然后解剖性腺、内脏团、鳃、外套膜组织;
60.5.3)消解,将步骤5.2)解剖得到的组织置于锥形瓶中,加入消解液后超声5分钟,消解液为浓度为100g/l的氢氧化钾溶液,将锥形瓶置于温度为60℃、转速为90r/min的振荡培养箱中消解24小时得到组织液;
61.5.4)分离过滤,将步骤5.3)得到的组织液抽滤至直径为47mm、孔径为0.7μm的玻璃纤维滤膜,用过滤水冲洗过滤器,将玻璃纤维滤膜置于洁净干燥的玻璃培养皿中,做好标记后置于50℃的烘箱中干燥待测;
62.6)微塑料观察:
63.6.1)抽取实验组的暴露液100μl并制片,用荧光显微镜观察并采集图形,每天观察1次荧光微塑料浓度的变化,观察时荧光显微镜使用蓝光i3、2档、40倍,增益9、饱和度1.55、曝光3.5、伽玛射线5.45;
64.6.2)将步骤步骤5.2)解剖得到的组织制片,用荧光显微镜观察其荧光微塑料含量;
65.6.3)将步骤步骤5.3)得到的组织液制片,用荧光显微镜观察其荧光微塑料含量;
66.7)生物组织酶活测定:
67.7.1)总超氧化物歧化酶t
‑
sod测定;
68.7.2)丙二醇mda测定;
69.7.3)过氧化氢酶cat测定。
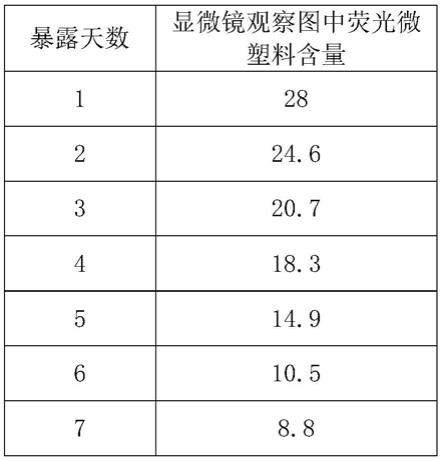
70.实施例1步骤6.1)的观察结果如表1所示。从表1可以看到,海水中的荧光微塑料含量随着天数的增加逐渐减少,由于取样误差及微塑料的富集等因素,显微镜观察图视野中荧光微塑料的个数变化不一,应将视野中荧光微塑料的大小和数量综合比较:
[0071][0072]
表1
[0073]
实施例1步骤6.2)、6.3)的观察结果显示:对照组中鳃组织和内脏团组织的显微镜观察图视野中均未发现荧光微塑料,而在实验组中鳃组织和内脏团组织的显微镜观察图视野中均发现了荧光微塑料。
[0074]
以上观察结果均说明贻贝对荧光微塑料进行了摄食,并在鳃组织和内脏团组织中分布有荧光微塑料。
[0075]
实施例2
[0076]
按照以下步骤利用荧光微塑料处理贻贝:
[0077]
1)模拟海水配制:
[0078]
将海盐加入蒸馏水中,搅拌至混合均匀后曝气2天得到盐度为26
‰
的模拟海水;
[0079]
2)荧光微塑料溶液配制:
[0080]
将粒度为90
‑
110μm的荧光微塑料加入步骤1)得到的模拟海水中,荧光微塑料与模拟海水的比例为3mg:1l,超声混合均匀后得到荧光微塑料溶液;
[0081]
3)贻贝采集驯养:
[0082]
3.1)现地采集或购买新鲜的贻贝;
[0083]
3.2)将步骤3.1)采集或购买到的贻贝放入温度为14℃的低温室内的玻璃缸中驯养3天,玻璃缸中放置有步骤1)得到的模拟海水,驯养2天时给贻贝喂食螺旋藻,及时检查贻贝的状态,取出死亡个体;
[0084]
4)暴露实验设置:
[0085]
4.1)设置1个对照组和1个实验组,对照组中贻贝的暴露液为步骤1)得到的模拟海水,实验组中贻贝的暴露液为步骤2)得到的荧光微塑料溶液;
[0086]
4.2)对照组和实验组分别使用40只贻贝,将贻贝养殖于暴露液中暴露7天,暴露的温度为14℃,光照条件为12小时光照和12小时黑暗,每天分别从对照组、实验组的暴露液中取出500ml用于化学分析以及使用荧光显微镜观察荧光微塑料含量,分析荧光微塑料浓度的变化;每天取出死亡个体,记录个数后保存于
‑
80℃的冰箱;暴露第四天给对照组的实验组贻贝喂食螺旋藻;
[0087]
4.3)暴露结束后,从对照组和实验组中分别随机取出5只贻贝,将贻贝室温下清洗后放入筛网中,清洗时将贻贝的贝壳闭合,顺着贝壳表面放射肋的方向用牙刷刷洗,盖上锡箔纸,自然沥干水分,然后测量贻贝的体长、带壳湿重并记录;
[0088]
5)贻贝组织系统中荧光微塑料的提取分离:
[0089]
5.1)准备,将解剖工具、消解用的玻璃瓶、培养皿用孔径为1μm的滤膜过滤过的过滤水冲洗,并做好标记;
[0090]
5.2)解剖,将贻贝置于台面上,紧贴壳内壁用解剖刀分别割断两侧闭壳肌,掰开壳,用镊子取出软组织或者整个消化系统,解剖时避免误取其它组织,然后解剖性腺、内脏团、鳃、外套膜组织;
[0091]
5.3)消解,将步骤5.2)解剖得到的组织置于锥形瓶中,加入消解液后超声5分钟,消解液为浓度为100g/l的氢氧化钾溶液,将锥形瓶置于温度为60℃、转速为90r/min的振荡培养箱中消解24小时得到组织液;
[0092]
5.4)分离过滤,将步骤5.3)得到的组织液抽滤至直径为47mm、孔径为0.7μm的玻璃纤维滤膜,用过滤水冲洗过滤器,将玻璃纤维滤膜置于洁净干燥的玻璃培养皿中,做好标记后置于50℃的烘箱中干燥待测;
[0093]
6)微塑料观察:
[0094]
6.1)抽取实验组的暴露液100μl并制片,用荧光显微镜观察并采集图形,每天观察1次荧光微塑料浓度的变化,观察时荧光显微镜使用蓝光i3、2档、40倍,增益9、饱和度1.55、曝光3.5、伽玛射线5.45;
[0095]
6.2)将步骤步骤5.2)解剖得到的组织制片,用荧光显微镜观察其荧光微塑料含量;
[0096]
6.3)将步骤步骤5.3)得到的组织液制片,用荧光显微镜观察其荧光微塑料含量;
[0097]
7)生物组织酶活测定:
[0098]
7.1)总超氧化物歧化酶t
‑
sod测定;
[0099]
7.2)丙二醇mda测定;
[0100]
7.3)过氧化氢酶cat测定。
[0101]
实施例3
[0102]
按照以下步骤利用荧光微塑料处理贻贝:
[0103]
1)模拟海水配制:
[0104]
将海盐加入蒸馏水中,搅拌至混合均匀后曝气2天得到盐度为26
‰
的模拟海水;
[0105]
2)荧光微塑料溶液配制:
[0106]
将粒度为90
‑
110μm的荧光微塑料加入步骤1)得到的模拟海水中,荧光微塑料与模拟海水的比例为3mg:3l,超声混合均匀后得到荧光微塑料溶液;
[0107]
3)贻贝采集驯养:
[0108]
3.1)现地采集或购买新鲜的贻贝;
[0109]
3.2)将步骤3.1)采集或购买到的贻贝放入温度为14℃的低温室内的玻璃缸中驯养7天,玻璃缸中放置有步骤1)得到的模拟海水,驯养3天时给贻贝喂食螺旋藻,及时检查贻贝的状态,取出死亡个体;
[0110]
4)暴露实验设置:
[0111]
4.1)设置1个对照组和1个实验组,对照组中贻贝的暴露液为步骤1)得到的模拟海水,实验组中贻贝的暴露液为步骤2)得到的荧光微塑料溶液;
[0112]
4.2)对照组和实验组分别使用40只贻贝,将贻贝养殖于暴露液中暴露7天,暴露的温度为14℃,光照条件为12小时光照和12小时黑暗,每天分别从对照组、实验组的暴露液中取出500ml用于化学分析以及使用荧光显微镜观察荧光微塑料含量,分析荧光微塑料浓度的变化;每天取出死亡个体,记录个数后保存于
‑
80℃的冰箱;暴露第四天给对照组的实验组贻贝喂食螺旋藻;
[0113]
4.3)暴露结束后,从对照组和实验组中分别随机取出5只贻贝,将贻贝室温下清洗后放入筛网中,清洗时将贻贝的贝壳闭合,顺着贝壳表面放射肋的方向用牙刷刷洗,盖上锡箔纸,自然沥干水分,然后测量贻贝的体长、带壳湿重并记录;
[0114]
5)贻贝组织系统中荧光微塑料的提取分离:
[0115]
5.1)准备,将解剖工具、消解用的玻璃瓶、培养皿用孔径为1μm的滤膜过滤过的过滤水冲洗,并做好标记;
[0116]
5.2)解剖,将贻贝置于台面上,紧贴壳内壁用解剖刀分别割断两侧闭壳肌,掰开壳,用镊子取出软组织或者整个消化系统,解剖时避免误取其它组织,然后解剖性腺、内脏团、鳃、外套膜组织;
[0117]
5.3)消解,将步骤5.2)解剖得到的组织置于锥形瓶中,加入消解液后超声5分钟,消解液为浓度为100g/l的氢氧化钾溶液,将锥形瓶置于温度为60℃、转速为90r/min的振荡培养箱中消解24小时得到组织液;
[0118]
5.4)分离过滤,将步骤5.3)得到的组织液抽滤至直径为47mm、孔径为0.7μm的玻璃纤维滤膜,用过滤水冲洗过滤器,将玻璃纤维滤膜置于洁净干燥的玻璃培养皿中,做好标记后置于50℃的烘箱中干燥待测;
[0119]
6)微塑料观察:
[0120]
6.1)抽取实验组的暴露液100μl并制片,用荧光显微镜观察并采集图形,每天观察1次荧光微塑料浓度的变化,观察时荧光显微镜使用蓝光i3、2档、40倍,增益9、饱和度1.55、曝光3.5、伽玛射线5.45;
[0121]
6.2)将步骤步骤5.2)解剖得到的组织制片,用荧光显微镜观察其荧光微塑料含量;
[0122]
6.3)将步骤步骤5.3)得到的组织液制片,用荧光显微镜观察其荧光微塑料含量;
[0123]
7)生物组织酶活测定:
[0124]
7.1)总超氧化物歧化酶t
‑
sod测定;
[0125]
7.2)丙二醇mda测定;
[0126]
7.3)过氧化氢酶cat测定。
[0127]
实施例4
[0128]
按照以下步骤利用荧光微塑料处理贻贝:
[0129]
1)模拟海水配制:
[0130]
将海盐加入蒸馏水中,搅拌至混合均匀后曝气3天得到盐度为26
‰
的模拟海水;
[0131]
2)荧光微塑料溶液配制:
[0132]
将粒度为90
‑
110μm的荧光微塑料加入步骤1)得到的模拟海水中,荧光微塑料与模
拟海水的比例为3mg:1.5l,超声混合均匀后得到荧光微塑料溶液;
[0133]
3)贻贝采集驯养:
[0134]
3.1)现地采集或购买新鲜的贻贝;
[0135]
3.2)将步骤3.1)采集或购买到的贻贝放入温度为14℃的低温室内的玻璃缸中驯养5天,玻璃缸中放置有步骤1)得到的模拟海水,驯养3天时给贻贝喂食螺旋藻,及时检查贻贝的状态,取出死亡个体;
[0136]
4)暴露实验设置:
[0137]
4.1)设置1个对照组和1个实验组,对照组中贻贝的暴露液为步骤1)得到的模拟海水,实验组中贻贝的暴露液为步骤2)得到的荧光微塑料溶液;
[0138]
4.2)对照组和实验组分别使用40只贻贝,将贻贝养殖于暴露液中暴露7天,暴露的温度为14℃,光照条件为12小时光照和12小时黑暗,每天分别从对照组、实验组的暴露液中取出500ml用于化学分析以及使用荧光显微镜观察荧光微塑料含量,分析荧光微塑料浓度的变化;每天取出死亡个体,记录个数后保存于
‑
80℃的冰箱;暴露第四天给对照组的实验组贻贝喂食螺旋藻;
[0139]
4.3)暴露结束后,从对照组和实验组中分别随机取出5只贻贝,将贻贝室温下清洗后放入筛网中,清洗时将贻贝的贝壳闭合,顺着贝壳表面放射肋的方向用牙刷刷洗,盖上锡箔纸,自然沥干水分,然后测量贻贝的体长、带壳湿重并记录;
[0140]
5)贻贝组织系统中荧光微塑料的提取分离:
[0141]
5.1)准备,将解剖工具、消解用的玻璃瓶、培养皿用孔径为1μm的滤膜过滤过的过滤水冲洗,并做好标记;
[0142]
5.2)解剖,将贻贝置于台面上,紧贴壳内壁用解剖刀分别割断两侧闭壳肌,掰开壳,用镊子取出软组织或者整个消化系统,解剖时避免误取其它组织,然后解剖性腺、内脏团、鳃、外套膜组织;
[0143]
5.3)消解,将步骤5.2)解剖得到的组织置于锥形瓶中,加入消解液后超声5分钟,消解液为浓度为100g/l的氢氧化钾溶液,将锥形瓶置于温度为60℃、转速为90r/min的振荡培养箱中消解24小时得到组织液;
[0144]
5.4)分离过滤,将步骤5.3)得到的组织液抽滤至直径为47mm、孔径为0.7μm的玻璃纤维滤膜,用过滤水冲洗过滤器,将玻璃纤维滤膜置于洁净干燥的玻璃培养皿中,做好标记后置于50℃的烘箱中干燥待测;
[0145]
6)微塑料观察:
[0146]
6.1)抽取实验组的暴露液100μl并制片,用荧光显微镜观察并采集图形,每天观察1次荧光微塑料浓度的变化,观察时荧光显微镜使用蓝光i3、2档、40倍,增益9、饱和度1.55、曝光3.5、伽玛射线5.45;
[0147]
6.2)将步骤步骤5.2)解剖得到的组织制片,用荧光显微镜观察其荧光微塑料含量;
[0148]
6.3)将步骤步骤5.3)得到的组织液制片,用荧光显微镜观察其荧光微塑料含量;
[0149]
7)生物组织酶活测定:
[0150]
7.1)总超氧化物歧化酶t
‑
sod测定;
[0151]
7.2)丙二醇mda测定;
[0152]
7.3)过氧化氢酶cat测定。
[0153]
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1