一种超敏且易用的多重单细胞蛋白质组学分析方法和应用
本发明属于生物分析,具体涉及一种超敏且易用的多重单细胞蛋白质组学分析方法和应用,用于单细胞或少量细胞的代谢组、蛋白质组或磷酸化修饰蛋白质组的多组学分析和鉴定。
背景技术:
1、作为生物学的基本单位,不同细胞间的异质性是构成完整生命体、进行复杂生命反应的基础。即使是同一类型的细胞,处在不同的细胞周期中或在微环境的影响下,其基因表达水平、蛋白质水平和代谢水平也会有所不同。但常规的组学分析通常将一类细胞甚至来自同一组织块、体液的多种细胞作为一个整体,导致这些差异被模糊为一体。近年来,癌症和干细胞等领域的研究进展使细胞异质性逐渐成为科研工作者关注的焦点,单细胞分选工具的进步也大大降低了单细胞研究门槛。在基因组和转录组水平上,单细胞测序技术已成为研究细胞异质性和识别不同表型细胞类型的强大工具。然而由于蛋白质/肽段的复杂性和其不可扩增的特质,单细胞蛋白质组学(single cell proteomics,scp)的发展仍处于起步阶段。
2、目前,用于定性和定量单个细胞中蛋白质的主要方法可以分为:1)荧光蛋白标记法;2)抗体法;3)质谱法;其中只有质谱法对单个细胞中蛋白质的检测全面、无偏且发现导向。而现有的基于质谱的单细胞蛋白质组学方法大多高度依赖于特殊的自制前处理装置、微流控芯片、或改造后需要特殊维护的液相色谱系统,例如xi shao等人开发的单细胞分析集成装置(ipad-1),zi-yi li等人开发的纳升级油-气液滴(oad)芯片,ying zhu等人开发的nanopots平台等,虽然能实现对单个细胞中蛋白质组进行提取、酶解和质谱检测,但前处理过程或需定制特殊的微型毛细管管路及进样阀,或需定制特殊的微流控芯片,在推广应用方面仍有很高的门槛。
3、现有技术中,采用荧光激活细胞分选术(facs)分离单细胞,其分选精确度及对活细胞造成的影响有待商榷;采用质量分析器为orbitrap的质谱仪器进行肽段检测,已报道的单个常规细胞蛋白质鉴定数目为500–1000种,其灵敏度及离子化效率的不足需要单细胞蛋白质组技术在鉴定和定量能力上的进一步发展,目前尚无一种单细胞蛋白质组学技术在不借助定制装置、耗材,或不改造液相色谱的前提下实现应用。
技术实现思路
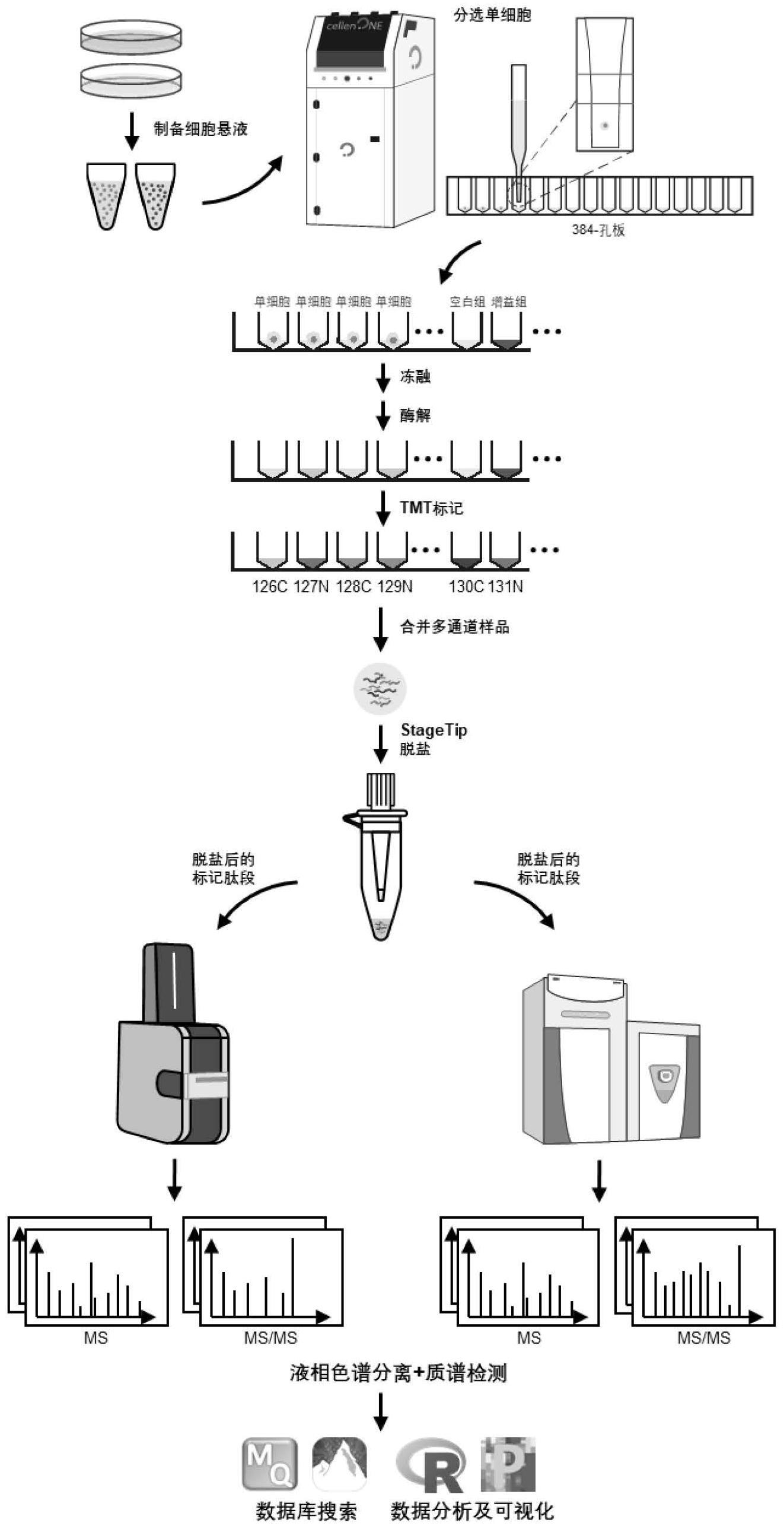
1、为了克服现有技术存在的不足,本发明的主要目的是提供一种超敏且易用的多重单细胞蛋白质组技术(ue-scp),单细胞分选通过温和而高精度的全自动单细胞分离系统实现,实验容器为商业化的384微孔板,在微孔板中完成单细胞的蛋白质裂解和蛋白质酶解后,多个单细胞的微量肽段样品分别经不同的稳定同位素亲和标签试剂标记,再混合脱盐后,上样至液相-质谱中进行检测,针对单细胞水平的蛋白质组学前处理和质谱检测进行全面优化,无需任何定制器械或耗材,兼容多种市售主流液质联用质谱仪,同时能显著提升单个细胞中鉴定和定量的蛋白质数量,拥有优良的定性和定量准确性,解决现有技术难以推广应用的问题。
2、本发明的另一目的是提供上述超敏且易用的多重单细胞蛋白质组学分析方法在单细胞或少量细胞的代谢组、蛋白质组或磷酸化修饰蛋白质组的多组学分析和鉴定中的应用。
3、为实现上述目的,本发明采用如下技术方案:
4、本发明提供一种超敏且易用的多重单细胞蛋白质组分析方法,包括以下步骤:
5、(1)制备单细胞悬液,通过全自动单细胞分离系统分选单细胞至加入裂解液的微孔板;
6、(2)用裂解液和冻融裂解单细胞,对释放的蛋白质依次进行酶解、稳定同位素亲和标记、合并、脱盐处理;
7、(3)脱盐得到的肽段进行色谱分离和质谱检测,并进行包括数据库检索、数据质控和数据整合分析的数据处理。
8、作为优选的技术方案,步骤(1)中,所述全自动单细胞分离系统为单细胞分离系统,和/或所述微孔板为eppendorf公司生产的384孔微孔板,该低蛋白质结合的384微孔板既能减少损失在容器中的蛋白质对结果造成的误差,又能提升前处理步骤的通量,但这并非对本发明的限制,其他品牌和型号的性质、功能相似的耗材均可以用于实施本发明。
9、作为优选的技术方案,步骤(2)中,所述裂解液包含浓度为0.01%–5%(w/v)的rapigest溶液,和/或以水、4-(2-羟乙基)-1-哌嗪乙磺酸(hepes)、teab或nh4hco3作为所述裂解液的溶剂。
10、作为优选的技术方案,步骤(2)中,所述裂解液包含纯水或十二烷基-β-d-麦芽糖苷(ddm),或还包含标准肽段irt,掺入量为1×10-7–2μl,以使其强度处于单细胞总蛋白质组强度的下四分位数与上四分位数之间为准。本发明在裂解液中加入了标准肽段irt作为数据质控标准之一,但这并非对本发明的限制,不掺入标准肽段亦可达到本发明所述效果,其他商品化标准肽段如沃特世公司的massprep或其他自行合成的标准肽段也可作为数据质控标准掺入。
11、作为优选的技术方案,步骤(2)中,采用终浓度为1–400ng/ul的胰蛋白酶,溶剂为1–100mm hepes进行蛋白质酶解,其中所述胰蛋白酶选自胞内蛋白酶赖氨酸-c、葡萄球菌v-8蛋白酶、胞内蛋白酶赖氨酸-n、天冬氨酸蛋白酶或胰凝乳蛋白酶中的一种或两种以上组合。
12、作为优选的技术方案,步骤(2)中,所述稳定同位素亲和标记采用的试剂为多通道稳定同位素亲和标记试剂,选自以下物质形成的组:赛默飞世尔科技有限公司(thermofisher scientific)生产的tmttm标记试剂、silac代谢标记系统、美国应用生物系统公司(abi)生产的itraq标签、mtraq标签以及合成的稳定同位素标记衍生化试剂。其中所述tmttm(含tmtprotm)标记试剂能同时对2–18个不同样本进行同位素标记,即在单次ms分析过程中可同时分析多达18个样本,可以配合更高分辨率质谱仪器,如赛默飞世尔科技有限公司的thermo scientific orbitrap eclipse质谱仪。使用更高灵敏度质谱仪器如布鲁克公司的timstof pro 2、timstof true scp质谱仪时,可以进一步提高单细胞数据的分析灵敏度和数据集深度。
13、作为进一步优选的技术方案,步骤(2)中,所述tmttm标记试剂的终浓度为1–20mm,所述合成的稳定同位素标记衍生化试剂为标记多肽n-端的异硫氰酸基嘧啶类同位素标记试剂([d0]/[d6]-dmpitc)。
14、作为优选的技术方案,步骤(2)中,所述肽段脱盐处理采用填充有1–5层c18填料的stagetip超滤或固相萃取柱纯化,其中,所述固相萃取柱包括但不限于硅胶反相分离柱、强阳离子交换固相萃取柱、弱阳离子交换固相萃取柱、赛默飞世尔科技有限公司thermoscientifictmhyperseptmspintip微量spe系列吸头、默克公司的系列微量层析柱或沃特世公司的oasis prime系列微孔板,提高处理通量的同时,提高从单个细胞中获得的定性及定量蛋白质数量,并匹配自动化流程。
15、作为优选的技术方案,步骤(3)中,采用纳升级液相色谱仪进行液相色谱梯度分离,采用捕集离子淌度飞行时间质谱仪timstof和/或复合四极杆静电场轨道阱质谱仪进行质谱检测;其中:
16、所述纳升级液相色谱仪使用自灌注的色谱柱,柱长为20–50cm,内径为20–200μm,填料为1–3μm的c18填料,流动相a为0.1wt%fa/99.9%h2o,流动相b为0.1wt%fa/99.9%acn,柱温为40–80℃,流速为20–400nl/min;
17、所述捕集离子淌度飞行时间质谱仪timstof采用dda-pasef模式采集数据,每个采集循环包括一次ms1扫描和3–20次pasef ms/ms扫描;每个被选中的母离子进行两次ms/ms扫描,分别采集定性和定量数据,两次扫描谱图自动合为一张pasef谱图,两次扫描的碰撞能量均随着迁移率的增加呈线性下降,首次扫描的碰撞能量在1/k0=1.6v.s/cm2时为100–75ev,在1/k0=0.6v.s/cm2时为38–50ev,二次扫描的碰撞能量在1/k0=1.6v.s/cm2时为64.00ev,在1/k0=0.6v.s/cm2时为32.00ev;离子积累时间为100ms,斜坡时间为109ms;离子迁移率范围为1/k0=0.70–1.40v.s/cm2;前体离子扫描范围为100–1700m/z,m/z<700的前体离子在ms/ms分析中采取2th的隔离窗口,m/z>700的前体离子采取3th的隔离窗口;单电荷前体离子通过一个多边形过滤器被排除;ms/ms前体离子的强度阈值为1000–1500a.u,目标值为10000–20000a.u,动态排除窗口为10–90s;
18、所述复合四极杆静电场轨道阱质谱仪采用数据依赖采集模式采集数据,电压为2kv,离子传输管的温度为320℃,一级质谱全扫描范围为300-1800m/z,扫描分辨率为30000–120000,自动增益控制目标值为1×106–9×106,离子注入时间为20–100ms;选择丰度在前5–30的前体离子进行二级质谱扫描,二级碎裂模式为高能碰撞解离,碰撞能量为25–40%,隔离窗口为0.3–1.5m/z,二级质谱扫描分辨率为30000–60000,自动增益控制目标值为1×104–1×106,离子注入时间为50–300ms,动态排除窗口为10–90s。
19、作为优选的技术方案,步骤(3)中,采用peaks online搜索引擎和/或maxquant搜索引擎对质谱数据进行数据库检索;但这并非对本发明的限制,其他如mascot、pnovo、pfind、proteome discoverer等搜索引擎均可以用于实施本发明;其中:
20、所述peaks online搜索引擎采用的数据库为uniprot/swissprot humandatabase,检索条件包括:胰酶酶切,肽段长度为6–45个氨基酸,允许不大于2–5个漏切位点;固定修饰为tmt标记,可变修饰为蛋氨酸的氧化和肽段n-端的乙酰化,denovo匹配时前体离子的容错度为15ppm,碎片离子的容错度为0.001–0.05da或1–10ppm,tmt报告离子检索时质量容错度为1–20ppm,假阳性率小于1–5%;
21、所述maxquant搜索引擎的人源蛋白质数据库为uniprot/swissprot humandatabase,检索条件包括:胰酶酶切,最小肽段长度为6–7个氨基酸,允许不大于2–5个漏切位点,固定修饰为tmt标记,可变修饰为蛋氨酸的氧化和肽段n-端的乙酰化,tmt报告离子检索时质量容错度为0.001–0.05da,谱图、肽段、蛋白质的假阳性率均要求小于1–5%。
22、作为优选的技术方案,步骤(3)中,对数据库搜索获得的单细胞蛋白质组数据集进行单细胞通道蛋白质组数据的汇总、归一化、批次效应去除的聚类分析,步骤为:保留数据集中同时在3个以上的单细胞定量到的蛋白质,数据矩阵结构为纵向为单个细胞通道数据、横向为蛋白质;对蛋白质丰度值取对数后,按照纵向每个细胞通道数据的中位数进行校正,再按照每列的正态分布进行缺失值填充后,横向进行z-score矫正;然后采用r包sva中的combat功能,进行多个tmt实验间批次效应的去除,获得最终的数据矩阵;所获数据矩阵文件导入包括perseus软件或r软件的数据分析工具,进行层次聚类分析和主成分分析,并导出图像文件。
23、本发明中ue-scp具有如下优点:无需微流控芯片;无需昂贵的超声设备;无需对液相系统进行难于维护的改造;能快速方便地实现自动化;设计通量高,可实现规模化单细胞蛋白质组数据的快速采集;兼容市售主流液质联用质谱仪。通过两种主流液质联用质谱仪分别采集两种人类细胞系的单细胞蛋白质组数据集,单个细胞蛋白质组的鉴定及定量深度技术水平高,来自不同细胞系的单细胞群体也可以依据它们的蛋白质组进行清晰聚类。
24、与现有技术相比,本发明的有益效果在于:
25、(1)本发明在无需任何定制器械或耗材、不改造仪器的前提下实现对单个细胞中的蛋白质组学分析,且能从单个人源常规细胞中检测到超过2000种包含精确定量信息的蛋白质,获得的单细胞蛋白质组数据集深度广且通量高,可以与现有主流10x genomics等单细胞转录组数据的深度匹敌。
26、(2)本发明采用稳定同位素亲和标记能极大提升单细胞蛋白质组学处理通量,以从单细胞悬液制备到分选同时操作2块384微孔板的最低分选通量来计算,本发明一个批次最低可同时对768个单细胞进行处理,完成从单细胞悬液制备到质谱检测全过程。若同时分选多块微孔板并实施自动化酶解和高通量脱盐过程,将丹麦evosep公司的evosep one等高通量蛋白组学分离系统与质谱仪联用可提高单位时间内质谱检测通量,都可以满足进一步提升通量与规模的需求。
27、(3)本发明首次将稳定同位素亲和标记和捕集离子淌度飞行时间质谱timstof联合运用,针对单细胞蛋白质组学分析进行优化,使定量蛋白质的数量和定量准确性均得到明显提升。同时也与复合四极杆静电场轨道阱orbitrap系列质谱仪联用,因而兼容了市售主流质谱仪,具有通用性,应用前景广。
28、(4)本发明采用的单细胞分选方法通过自动化提升通量,降低人为操作对微量样品处理引入的误差,减少处理大批量样品时所需的人力和时间成本,实现真正快速、高精度、无损、低样品容量、全自动的单细胞分离,每个被分离的单细胞均提供图像记录以便确认,分离过程对细胞活性几乎无损,可兼容直径为0.1–150μm的细菌、细胞核、细胞样品,尤其适用于珍贵的细胞样品。
- 还没有人留言评论。精彩留言会获得点赞!