银杏叶提取中间体或其制剂中松脂醇二葡萄糖苷的检测方法与流程
1.本发明属于分析化学和药物质量控制领域,具体涉及一种定性和/或定量检测银杏叶提取中间体或其制剂中松脂醇二葡萄糖苷的方法。
背景技术:
2.银杏叶提取中间体为银杏科植物银杏(ginkgo biloba l.)的干燥叶经提取、分离等步骤加工制备而成的、不含辅料的固态或液态提取物,《中国药典》2020年版已收载名为“银杏叶提取物”的固态提取中间体。已经上市的银杏叶制剂包括片剂、注射剂等。舒血宁注射液即是银杏叶提取中间体制成的灭菌水针剂。文献报道银杏叶中间体及其制剂的主要活性成分为黄酮类和银杏内酯类。近几年,通过对银杏叶提取中间体及其制剂化学成分的深入研究,发明人发现其还含有很多木脂素类成分,比如松脂醇二葡萄糖苷、(7s,8r)-二氢去氢二愈创木基醇4-o-β-d-葡萄糖苷、刺五加苷e等。木脂素类成分具有抗氧化、保护心肌细胞、抗心肌毒、舒张血管、抗血小板聚集、降血脂等作用,与银杏叶提取中间体及其制剂功能主治相关。因此木脂素类成分也应当作为银杏叶提取中间体及其制剂的活性成分,有必要对其进行质量控制,从而有利于质控溯源,保证用药的安全性,更好地指导生产,为全面建立银杏叶提取中间体及其制剂的质量控制标准提供科学依据。
3.银杏叶提取中间体及其制剂中含有的木脂素类成分数量众多,但含量均较低,有些成分极性非常相近,加上黄酮类成分对木脂素检测的干扰,使得其中的代表性成分——松脂醇二葡萄糖苷在高效液相色谱(hplc-uv)上达到良好的分离状态存在一定的难度。
4.现有技术中对木脂素类成分检测方法的报道多集中在五味子及含有五味子的中药制剂,如公开号cn111380964a(公开日2020年7月7日)的中国发明专利申请“五味子药材及灯盏生脉胶囊的指纹图谱的建立方法”,再如公开号cn108226316a(公开日2018年6月29日)的中国发明专利申请“一种同时测定五味子中7种木脂素含量的方法”。对于银杏叶提取中间体或其制剂中松脂醇二葡萄糖苷的检测方法,现有技术还鲜有报道。
技术实现要素:
5.为了克服现有技术的不足,本发明提供一种检测银杏叶提取中间体或其制剂中松脂醇二葡萄糖苷的方法。该方法基于高效液相色谱法,松脂醇二葡萄糖苷的分离度达到1.5左右,可准确地定量测定银杏叶提取中间体或其制剂中松脂醇二葡萄糖苷的含量。
6.为了实现上述技术效果,本发明采用了如下的技术方案:
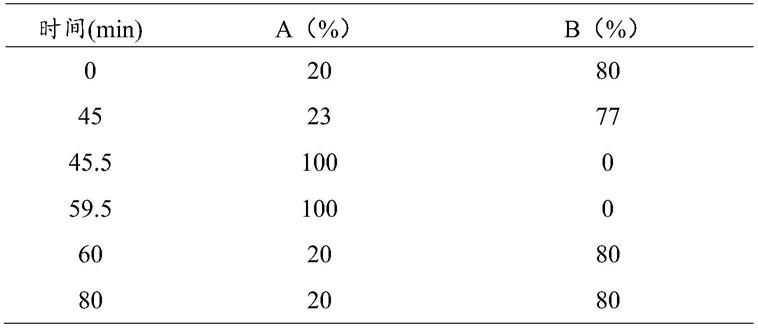
7.一种银杏叶提取中间体或其制剂中松脂醇二葡萄糖苷的检测方法,所述检测方法基于反相高效液相色谱法,包括色谱条件的建立和供试品溶液的制备;其中,所述色谱条件为:
8.色谱柱:tsk gel ods-100v,4.6mm
×
150mm,3μm,
9.流动相:以甲醇为流动相a,水为流动相b,按表1中的规定进行梯度洗脱,
10.表1梯度洗脱程序
[0011][0012]
柱温:40~46℃
[0013]
流速:0.65~0.75ml/min,
[0014]
检测波长:275~282nm;
[0015]
所述供试品溶液的制备,包括如下操作:
[0016]
i.取中性氧化铝固相萃取柱(规格100-200目,1g/6ml),依次用甲醇和水各10ml,以1~2ml/min的流速洗涤,再重复两次,得到活化后的中性氧化铝固相萃取柱;
[0017]
ii.取待测样品,用水制备成每1ml含总黄酮醇苷1.0mg的溶液,精密量取5ml,置所述活化后的中性氧化铝固相萃取柱上,以1ml/min的流速滤过,收集流出液;再取30%甲醇50ml,以1ml/min的流速洗脱,收集洗脱液,合并所述流出液和洗脱液,水浴蒸干,残渣用30%甲醇超声溶解,转移至2ml量瓶中,并稀释至刻度,摇匀,滤过,取续滤液,即得。
[0018]
本领域技术人员应该理解,对于固态的待测样品,如银杏叶提取物或银杏叶提取物制备的固体制剂(如片剂、颗粒剂等),在制备供试品溶液时,需按照上述步骤ii所述先用水制备成每1ml含总黄酮醇苷1.0mg的溶液,再进行后续的处理。对于液态的待测样品,总黄酮醇苷的浓度高于1.0mg/ml的,在制备供试品溶液时,需按照上述步骤ii所述方法先制备成每1ml含总黄酮醇苷1.0mg的溶液;如果总黄酮醇苷的浓度≤1.0mg/ml的,如舒血宁注射液,则直接取5ml进行处理。
[0019]
优选地,所述柱温为45℃。
[0020]
优选地,所述流速为0.7ml/min。
[0021]
优选地,所述检测波长为277~278nm。
[0022]
所述中性氧化铝固相萃取柱可以通过商购途径获得,优选艾杰尔(agela)中性氧化铝固相萃取柱。
[0023]
优选地,在所述色谱条件下,理论塔板数按松脂醇二葡萄糖苷计算应不低于4000。
[0024]
优选地,所述检测方法还包括对照品溶液的制备,具体操作为:
[0025]
取松脂醇二葡萄糖苷对照品适量,精密称定,加30%甲醇制成每1ml含18μg松脂醇二葡萄糖苷的溶液,即得。
[0026]
优选地,所述检测方法还包括测定法,具体操作为:
[0027]
分别精密吸取所述对照品溶液与所述供试品溶液各20μl,注入高效液相色谱仪,在所述色谱条件下,记录色谱图。
[0028]
优选地,所述测定法包括定性测定和/或定量测定;其中,所述定性测定的具体步骤为:
[0029]
分别精密吸取所述对照品溶液与所述供试品溶液各20μl,注入高效液相色谱仪,在所述色谱条件下,记录色谱图,以对照品溶液色谱图中松脂醇二葡萄糖苷吸收峰的保留时间为参照,考察供试品溶液色谱图中是否出现相同保留时间的吸收峰;
[0030]
所述定量测定的具体步骤为:
[0031]
分别精密吸取所述对照品溶液与所述供试品溶液各20μl,注入高效液相色谱仪,在所述色谱条件下,记录色谱图,以外标法计算供试品溶液中松脂醇二葡萄糖苷的含量。
[0032]
优选地,所述银杏叶提取中间体制剂为舒血宁注射液。
[0033]
本说明书中,如无特殊说明,溶液百分比浓度表示的是体积百分比浓度,如30%甲醇,即是指100体积份的溶液中,甲醇占30体积份,余量为水。
附图说明
[0034]
下面结合附图,对本发明做进一步的说明。
[0035]
图1示出的是松脂醇二葡萄糖苷的紫外光谱。
[0036]
图2示出的是舒血宁注射液的紫外光谱。
[0037]
图3示出的是黄酮类成分槲皮素的紫外光谱。
[0038]
图4示出的是实施例1中考察供试品溶液制备方法时,舒血宁注射液在中性氧化铝固相萃取柱上不同上样量下得到的hplc色谱图,其中:
[0039]
a:中性氧化铝固相萃取柱上样量0ml(舒血宁注射液直接进样);
[0040]
b:中性氧化铝固相萃取柱上样量2ml;其中,b-1是277nm下的色谱图,b-2是354nm下的色谱图;
[0041]
c:中性氧化铝固相萃取柱上样量5ml;其中,c-1是277nm下的色谱图,c-2是354nm下的色谱图。
[0042]
图5示出的是实施例2中供试品溶液在不同梯度洗脱程序下洗脱得到的hplc色谱图,其中:
[0043]
a:梯度洗脱程序1;
[0044]
b:梯度洗脱程序2;
[0045]
c:梯度洗脱程序3;
[0046]
d:梯度洗脱程序4;
[0047]
e:梯度洗脱程序5;
[0048]
f:梯度洗脱程序6。
[0049]
图6示出的是实施例2中供试品溶液在同一型号不同色谱仪上以梯度洗脱程序5洗脱得到的hplc色谱图。
[0050]
图7示出的是实施例3中不同品牌和规格的色谱柱得到的供试品溶液的hplc图谱,其中:
[0051]
a:色谱柱tsk gel ods-100v(4.6
×
150mm,3μm);
[0052]
b:色谱柱agilent xdb-c18色谱柱(4.6
×
150mm,5μm);
[0053]
c:色谱柱thermo acclaim 120 c18色谱柱(4.5
×
250mm,5μm)。
[0054]
图8示出的是实施例4中不同品牌中性氧化铝固相萃取柱处理得到的供试品溶液的hplc图谱,其中:
[0055]
a:艾杰尔中性氧化铝固相萃取柱;
[0056]
b:麦克林中性氧化铝固相萃取柱;
[0057]
c:上海歇阳中性氧化铝固相萃取柱。
[0058]
图9示出的是实施例5中专属性考察试验中对照品溶液和供试品溶液的hplc图谱;其中:
[0059]
a:对照品溶液在277nm下的色谱图;
[0060]
b:供试品溶液在277nm下的色谱图;
[0061]
c:供试品溶液在354nm下的色谱图。
[0062]
图10示出的是实施例5中线性考察试验中建立的标准曲线,图中横轴(x轴)是松脂醇二葡萄糖苷的含量(μg/ml),纵轴(y轴)是松脂醇二葡萄糖苷色谱峰的峰面积。
[0063]
图11示出的实施例6中测定的三批舒血宁注射液的hplc色谱图;其中:
[0064]
a:舒血宁注射液(zsa20190904)制备的供试品的色谱图;
[0065]
b:舒血宁注射液(zsa20190914)制备的供试品的色谱图;
[0066]
c:舒血宁注射液(zsa20190920)制备的供试品的色谱图。
[0067]
图12示出的实施例7中测定的三批银杏叶提取中间体的hplc色谱图;其中:
[0068]
a:银杏叶提取中间体(g13201201)制备的供试品的色谱图;
[0069]
b:银杏叶提取中间体(g13201202)制备的供试品的色谱图;
[0070]
c:银杏叶提取中间体(g13201203)制备的供试品的色谱图。
具体实施方式
[0071]
本发明提供一种银杏叶提取中间体或其制剂中松脂醇二葡萄糖苷的检测方法,所述检测方法基于反相高效液相色谱法,包括:
[0072]
色谱条件与系统适用性试验:以十八烷基硅烷键合硅胶为填充剂(色谱柱tsk gel ods-100v 4.6mm
×
150mm,3μm);以甲醇为流动相a,水为流动相b,按表1中的规定进行梯度洗脱;流速每分钟为0.65~0.75ml(优选0.7ml),检测波长为275~282nm(优选277nm);柱温40~46℃(优选45℃)。理论塔板数按松脂醇二葡萄糖苷计算应不低于4000。
[0073]
对照品溶液的制备:取松脂醇二葡萄糖苷对照品适量,精密称定,加30%甲醇制成每1ml含18μg的溶液,即得。
[0074]
供试品溶液的制备:取待测样品,用水制备成每1ml含总黄酮醇苷1.0mg的溶液,精密量取5ml,置活化后的中性氧化铝固相萃取柱上(100-200目,1g/6ml;活化处理:依次用甲醇和水各10ml,以1~2ml/min的流速洗涤,再重复两次),以1ml/min的流速滤过,收集流出液;再取30%甲醇50ml,以1ml/min的流速洗脱,合并以上流出液和洗脱液,水浴蒸干,残渣用30%甲醇超声溶解,转移至2ml量瓶中,并稀释至刻度,摇匀,滤过,取续滤液,即得。
[0075]
测定法:分别精密吸取对照品溶液与供试品溶液各20μl,注入液相色谱仪,测定,即得。
[0076]
发明人以舒血宁注射液(黑龙江珍宝岛药业股份有限公司)为供试品,对色谱柱、中性氧化铝固相萃取柱、流动相洗脱程序等进行了细致的考察,经过反复试验和摸索才建立了上述检测方法。
[0077]
以下参照具体的实施例来说明本发明。本领域技术人员能够理解,这些实施例仅
用于说明本发明,其不以任何方式限制本发明的范围。
[0078]
下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的原料、试剂材料等,如无特殊说明,均为市售购买产品。其中,部分试药和对照品购买情况如下:
[0079]
舒血宁注射液:黑龙江珍宝岛药业股份有限公司,批号:zsa20190904(每1ml注射液含总黄酮醇苷0.89mg)、zsa20190914(每1ml注射液含总黄酮醇苷0.90mg)、zsa20190920(每1ml注射液含总黄酮醇苷0.87mg);
[0080]
松脂醇二葡萄糖苷对照品:中国食品药品检定研究院,批号:111537-201706。
[0081]
实施例1供试品溶液的制备
[0082]
松脂醇二葡萄糖苷的紫外吸收光谱见图1。舒血宁注射液为银杏叶提取中间体的注射用制剂,其紫外吸收光谱见图2。黄酮类成分槲皮素的紫外吸收光谱见图3。图1示出松脂醇二葡萄糖苷在277~280nm有最大吸收,图2示出舒血宁注射液在277~280nm有吸收,图3示出舒血宁注射液中黄酮类成分槲皮素在250nm和360nm也有吸收,因此采用紫外检测器检测松脂醇二葡萄糖苷含量时,舒血宁注射液中黄酮类成分对松脂醇二葡萄糖苷会有干扰,需要排除。为此,将舒血宁注射液先通过经活化的中性氧化铝固相萃取柱,以排除干扰成分。本实施例考察了中性氧化铝固相萃取柱的上样量。
[0083]
仪器:waters e2695高效液相色谱仪;
[0084]
色谱柱:tsk gel ods-100v(4.6
×
150mm,3μm);
[0085]
柱温:45℃;
[0086]
进样量:20μl;
[0087]
流速:0.5~0.7ml/min;
[0088]
检测波长:277nm,354nm;
[0089]
中性氧化铝固相萃取柱:博纳艾杰尔科技有限公司,规格:100-200目,1g/6ml。
[0090]
供试品溶液制备:依次用甲醇和水各10ml,以1~2ml/min的流速洗涤中性氧化铝固相萃取柱,再重复两次,得到活化的中性氧化铝固相萃取柱。精密吸取一定体积的舒血宁注射液上样,以1ml/min的流速滤过,收集流出液;再取30%甲醇50ml,以1ml/min的流速洗脱,合并以上流出液和洗脱液,水浴蒸干,残渣用30%甲醇超声溶解,转移至2ml量瓶中,并稀释至刻度,摇匀,滤过,取续滤液,即得。
[0091]
1、直接进样
[0092]
精密吸取2ml舒血宁注射液,置5ml量瓶中,加水稀释并定容至刻度。精密吸取10μl该供试品溶液,注入高效液相色谱仪,流动相及梯度洗脱程序如表2所示,色谱图见图4中的a。
[0093]
表2梯度洗脱程序
[0094]
时间(min)水(%)甲醇(%)08020307030402080418020608020
[0095]
2、2ml注射液上样
[0096]
精密吸取2ml舒血宁注射液,按照上述“供试品溶液制备”的操作制备供试品溶液。精密吸取20μl该供试品溶液,注入高效液相色谱仪,流动相及梯度洗脱程序如表3所示,色谱图见图4中的b-1(277nm)和b-2(354nm)。
[0097]
表3梯度洗脱程序
[0098]
时间(min)甲醇-水(21:79,%)甲醇(%)0100045100045.5010055010055.51000901000
[0099]
3、5ml注射液上样
[0100]
精密吸取5ml舒血宁注射液,按照上述“供试品溶液制备”的操作制备供试品溶液。精密吸取20μl该供试品溶液,注入高效液相色谱仪,流动相及梯度洗脱程序见表1所示,色谱图见图4中的c-1(277nm)和c-2(354nm)。
[0101]
4、8ml注射液上样
[0102]
上样体积8ml时洗脱液呈黄色,说明中性氧化铝固相萃取柱过载,停止后续的操作。
[0103]
结论:对比图4中的a和b-1可知,采用中性氧化铝固相萃取柱可以除去舒血宁注射液中对松脂醇二葡萄糖苷的测定有干扰的成分。对比图4中的b-1和c-1,以及b-2和c-2可知:萃取柱上样体积2ml时浓度略低,色谱峰响应值小,易受基线波动的影响。因此,优选中性氧化铝固相萃取柱的舒血宁注射液上样体积为5ml。
[0104]
实施例2流动相和梯度洗脱程序的考察
[0105]
仪器:waters e2695高效液相色谱仪;
[0106]
色谱柱:tsk gel ods-100v(4.6
×
150mm,3μm);
[0107]
柱温:45℃;
[0108]
进样量:20μl;
[0109]
流速:0.5~0.7ml/min;
[0110]
检测波长:277nm;
[0111]
中性氧化铝固相萃取柱:博纳艾杰尔科技有限公司,规格:100-200目,1g/6ml。
[0112]
供试品溶液制备:依次用甲醇和水各10ml,以1~2ml/min的流速连续洗涤中性氧化铝固相萃取柱,再重复两次,得到活化的中性氧化铝固相萃取柱。精密吸取5ml舒血宁注射液上样,以1ml/min的流速滤过,收集流出液;再取30%甲醇50ml,以1ml/min的流速洗脱,合并以上流出液和洗脱液,水浴蒸干,残渣用30%甲醇超声溶解,转移至2ml量瓶中,并稀释至刻度,摇匀,滤过,取续滤液,即得。
[0113]
1.梯度洗脱程序1见表4所示;色谱图见图5的a。
[0114]
表4梯度洗脱程序1
[0115]
时间(min)甲醇(%)水(%)
0227840227841802055802055.52278802278
[0116]
2.梯度洗脱程序2见表5所示;色谱图见图5的b。
[0117]
表5梯度洗脱程序2
[0118]
时间(min)甲醇-水(21:79,%)甲醇(%)0100045100045.5010055010055.51000901000
[0119]
3.梯度洗脱程序3见表6所示;色谱图见图5的c。
[0120]
表6梯度洗脱程序3
[0121]
时间(min)(甲醇:水:甲酸=22:78:0.2,%)甲醇(%)0100045100045.5010055010055.51000901000
[0122]
4.梯度洗脱程序4见表7所示;色谱图见图5的d。
[0123]
表7梯度洗脱程序4
[0124]
时间(min)甲醇(%)水(%)0208045257545.5100059.51000602080802080
[0125]
5.梯度洗脱程序5见表8所示;色谱图见图5的e。
[0126]
表8梯度洗脱程序5
[0127]
时间(min)甲醇(%)水(%)02080452377
45.5100059.51000602080802080
[0128]
6.梯度洗脱程序6见表9所示;色谱图见图5的f。
[0129]
表9梯度洗脱程序6
[0130]
时间(min)甲醇(%)水(%)0208045227845.5100059.51000602080802080
[0131]
结论:比较图5中不同洗脱程序下得到的色谱图可知,梯度洗脱程序5对松脂醇二葡萄糖苷的分离效果最好,与前后相邻色谱峰的分离度达到了1.5。因此初步确定梯度洗脱程序5是优选的梯度洗脱程序。
[0132]
在三台同型号高效液相色谱仪(waters e2695高效液相色谱仪、waters e2695(4)高效液相色谱仪和waters e2695(5)高效液相色谱仪)上,分别按照所述梯度洗脱程序5进行洗脱,记录色谱图,见图6。三台仪器上得到的色谱图中,松脂醇二葡萄糖苷的分离度见表10。
[0133]
表10同一型号不同色谱仪对松脂醇二葡萄糖苷的分离度影响
[0134]
分离度waters e2695waters e2695(4)waters e2695(5)与前锋的分离度1.591.491.48与后峰的分离度1.641.521.53
[0135]
表10的数据示出梯度洗脱程序5在考察的3台仪器上基本都使松脂醇二葡萄糖苷达到了基线分离(分离度1.5)。说明该梯度洗脱程序专属性好。
[0136]
经过本实施例的研究和考察,确定流动相由甲醇(a相)和水(b相)组成,进行梯度洗脱,洗脱程序优选为上述梯度洗脱程序5,即表1和表8所示的洗脱程序。
[0137]
实施例3色谱仪和色谱柱的选择
[0138]
1.色谱柱的选择
[0139]
仪器:waters e2695高效液相色谱仪;
[0140]
柱温:45℃;
[0141]
进样量:20μl;
[0142]
流动相:甲醇-水,按照表1所示进行梯度洗脱;
[0143]
流速:0.5~0.7ml/min;
[0144]
检测波长:277nm;
[0145]
中性氧化铝固相萃取柱:博纳艾杰尔科技有限公司,规格:100-200目,1g/6ml。
[0146]
供试品溶液制备:依次用甲醇和水各10ml,以1~2ml/min的流速连续洗涤中性氧化铝固相萃取柱,再重复两次,得到活化的中性氧化铝固相萃取柱。精密吸取5ml舒血宁注
射液上样,以1ml/min的流速滤过,收集流出液;再取30%甲醇50ml,以1ml/min的流速洗脱,合并以上流出液和洗脱液,水浴蒸干,残渣用30%甲醇超声溶解,转移至2ml量瓶中,并稀释至刻度,摇匀,滤过,取续滤液,即得。
[0147]
1.色谱柱1
[0148]
型号:tsk gel ods-100v(4.6
×
150mm,3μm)。
[0149]
色谱图见图7中的a。
[0150]
2.色谱柱2
[0151]
型号:agilent xdb-c18色谱柱(4.6
×
150mm,5μm)。
[0152]
色谱图见图7中的b。
[0153]
3.色谱柱3
[0154]
型号:thermo acclaim 120 c18色谱柱(4.5
×
250mm,5μm)。
[0155]
色谱图见图7中的c。
[0156]
三种色谱柱上得到的色谱图中,松脂醇二葡萄糖苷的峰纯度见表11。
[0157]
表11不同色谱柱对松脂醇二葡萄糖苷的峰纯度影响
[0158][0159]
一般通过软件计算,色谱峰的峰纯度大于990或者纯度角小于纯度阈值,则峰纯度符合要求,色谱峰分离度较好。图7和表11示出,不同品牌和规格的色谱柱分离效果差距显著。采用agilent xdb-c18(4.6
×
150mm,5μm)和thermo acclaim 120 c18(4.5
×
250mm,5μm)色谱柱,松脂醇二葡萄糖苷的色谱峰分别与其前面和后面的色谱峰有包裹,峰纯度和分离度均不能达到要求。采用tsk gel ods-100v(4.6
×
150mm,3μm)色谱柱时,松脂醇二葡萄糖苷峰形最好,峰纯度符合要求,故优选采用该色谱柱。
[0160]
实施例4不同品牌中性氧化铝固相萃取柱的考察
[0161]
仪器:waters e2695高效液相色谱仪;
[0162]
色谱柱:tsk gel ods-100v(4.6
×
150mm,3μm);
[0163]
柱温:45℃;
[0164]
进样量:20μl;
[0165]
流动相:甲醇-水,按照表1所示进行梯度洗脱;
[0166]
流速:0.5~0.7ml/min;
[0167]
检测波长:277nm。
[0168]
供试品溶液制备:依次用甲醇和水各10ml,以1~2ml/min的流速连续洗涤中性氧化铝固相萃取柱,再重复两次,得到活化的中性氧化铝固相萃取柱。精密吸取5ml舒血宁注射液上样,以1ml/min的流速滤过,收集流出液;再取30%甲醇50ml,以1ml/min的流速洗脱,合并以上流出液和洗脱液,水浴蒸干,残渣用30%甲醇超声溶解,转移至2ml量瓶中,并稀释至刻度,摇匀,滤过,取续滤液,即得。
[0169]
1.艾杰尔中性氧化铝固相萃取柱:博纳艾杰尔科技有限公司,规格:100-200目,1g/6ml。
[0170]
色谱图见图8中的a。
[0171]
2.麦克林中性氧化铝固相萃取柱,规格100-200目,1g/6ml。
[0172]
色谱图见图8中的b。
[0173]
3.上海歇阳中性氧化铝固相萃取柱,规格100-200目,1g/6ml。
[0174]
色谱图见图8中的c。
[0175]
经过上述三种中性氧化铝固相萃取柱处理的供试品溶液,松脂醇二葡萄糖苷的含量测定结果见表12。
[0176]
表12不同中性氧化铝固相萃取柱处理后松脂醇二葡萄糖苷的含量测定结果
[0177]
含量μg/ml艾杰尔麦克林上海歇阳含量测定15.2964.9634.474含量测定25.2964.6855.041
[0178]
结论:图8和表12示出,不同品牌中性氧化铝固相萃取柱对舒血宁注射液中松脂醇二葡萄糖苷的含量测定有显著影响。优选艾杰尔中性氧化铝固相萃取柱。
[0179]
实施例5本发明建立的检测方法的方法学考察
[0180]
经过上述实施例1-4所述的研究和考察,建立了银杏叶提取中间体或其制剂中松脂醇二葡萄糖苷的检测方法,所述检测方法基于反相高效液相色谱法,包括:
[0181]
色谱条件与系统适用性试验:以十八烷基硅烷键合硅胶为填充剂(色谱柱tsk gel ods-100v 4.6mm
×
150mm,3μm);以甲醇为流动相a,水为流动相b,按表1中的规定进行梯度洗脱;流速每分钟为0.7ml,检测波长为277nm;柱温45℃。理论塔板数按松脂醇二葡萄糖苷计算应不低于4000。
[0182]
对照品溶液的制备:取松脂醇二葡萄糖苷对照品适量,精密称定,加30%甲醇制成每1ml含18μg的溶液,即得。
[0183]
供试品溶液的制备:取待测样品,用水制备成每1ml含总黄酮醇苷1.0mg的溶液,精密量取5ml,置活化后的艾杰尔中性氧化铝固相萃取柱上(100-200目,1g/6ml;活化处理:依次用甲醇和水各10ml,以1~2ml/min的流速洗涤,再重复两次),以1ml/min的流速滤过,收集流出液;再取30%甲醇50ml,以1ml/min的流速洗脱,合并以上流出液和洗脱液,水浴蒸干,残渣用30%甲醇超声溶解,转移至2ml量瓶中,并稀释至刻度,摇匀,滤过,取续滤液,即得。
[0184]
测定法:分别精密吸取对照品溶液与供试品溶液各20μl,注入液相色谱仪,测定,记录色谱图,即得。
[0185]
本实施例以舒血宁注射液为待测样品,直接上样活化后的艾杰尔中性氧化铝固相萃取柱制备供试品溶液,对上述检测方法从专属性、重复性、线性、稳定性、准确性、耐用性和重现性等方面进行方法学考察。
[0186]
1.专属性考察
[0187]
本发明所述的检测方法采用中性氧化铝固相萃取法去除待测样品中造成干扰的成分。以舒血宁注射液(批号zsa20190904)为待测样品按照上述方法制备供试品溶液,在上述色谱条件下进样,进行测定,记录色谱图,见图9。松脂醇二葡萄糖苷色谱峰的相关参数见表13所示。
[0188]
表13松脂醇二葡萄糖苷色谱峰参数
[0189]
色谱峰名称保留时间分离度不对称度理论塔板数峰纯度
松脂醇二葡萄糖苷36.9601.50.9421754994
[0190]
表13示出,本发明建立的检测方法,供试品溶液中松脂醇二葡萄糖苷不受黄酮类成分的干扰,色谱峰分离度1.5,峰纯度值大于990,该方法专属性强,可适用于舒血宁注射液中松脂醇二葡萄糖苷的含量测定。
[0191]
2.重复性
[0192]
取舒血宁注射液(批号zsa20190904)6份,按上述方法制备供试品溶液,测定,计算松脂醇二葡萄糖苷的含量,结果见表14。
[0193]
表14重复性试验结果
[0194][0195]
表14结果示出,6份平行样品测定的舒血宁注射液(批号zsa20190904)含量的rsd小于3.0%,说明该方法的重复性良好。
[0196]
3.线性
[0197]
按照表15所示配制6份不同浓度的对照品溶液,分别精密吸取20μl,注入高效液相色谱仪,测定,结果见表15。以松脂醇二葡萄糖苷的含量(μg/ml)为横轴(x轴),松脂醇二葡萄糖苷色谱峰的峰面积为纵轴(y轴),绘制标准曲线,建立回归方程。标准曲线见图10,回归方程如下所示:
[0198]
y=13,314.7013x+11,067.6013
[0199]
结果显示,松脂醇二葡萄糖苷在6.602μg/ml~165.060μg/ml范围内呈良好的线性关系。
[0200]
表15线性关系考察结果
[0201][0202][0203]
4.稳定性
[0204]
取舒血宁注射液(批号zsa20190904)按供试品溶液制备方法制备供试品溶液,室温放置,分别在0、3、6、12、24、36和48小时测定,记录色谱图,积分得到松脂醇二葡萄糖苷色谱峰的峰面积,结果见表16。
[0205]
表16稳定性试验结果
[0206][0207]
表16的结果示出,供试品溶液放置48小时内松脂醇二葡萄糖苷含量稳定。
[0208]
5.准确性
[0209]
分别量取0.4ml、0.8ml、1.2ml松脂醇二葡萄糖苷对照品溶液(含量17.42μg/ml)至活化后的中性氧化铝固相萃取柱,每个体积平行3份。再分别取已知松脂醇二葡萄糖苷含量为5.296μg/ml的舒血宁注射液(批号zsa20190904)2.5ml,分别加入上述每个中性氧化铝固相萃取柱,按供试品溶液制备方法进行处理,得到样品溶液。分别精密吸取上述样品溶液20μl,注入高效液相色谱仪,记录色谱图,测定松脂醇二葡萄糖苷的含量并按照如下公式计算回收率:
[0210]
加样回收率=(测得总量-样品中已有的量)/实际加入量
×
100%。
[0211]
结果见表17。
[0212]
表17回收率试验结果
[0213][0214][0215]
表17的数据显示,松脂醇二葡萄糖苷3个浓度的回收率在92.2%~102.9%之间,rsd均小于3.0%,说明该方法准确性良好。
[0216]
6.耐用性
[0217]
取批号为zsa20190904的舒血宁注射液,所述制备方法制备供试品溶液,分别考察供试品溶液在微调柱温、流速、有机相比例,检测波长、固相萃取柱洗脱液的甲醇比例、固相萃取柱洗脱体积的条件下以及在不同品牌液相色谱仪上测定的松脂醇二葡萄糖苷的含量变化情况。结果见表18。
[0218]
表18耐用性试验结果
[0219][0220]
表18的结果示出,上述参数或条件略微调整对含量测定基本无影响。说明本发明建立的检测方法的耐用性好。
[0221]
7.重现性
[0222]
分别在不同分析实验室,取3批舒血宁注射液(批号:zsa20190904、zsa20190912、zsa20190914),按本发明建立的方法操作,测定松脂醇二葡萄糖苷含量,结果见表19。
[0223]
表19重现性试验结果
[0224]
分析实验室zsa20190904zsa20190912zsa2019091414.9μg/ml11.4μg/ml9.7μg/ml24.7μg/ml10.0μg/ml8.5μg/ml偏差(%)2.16.66.6
[0225]
表19的结果显示,在不同分析实验室应用本发明的检测方法测定的松脂醇二葡萄糖苷含量偏差均小于11.0%,符合《中国药典》2020年版四部通则9101分析方法验证指导原则的规定,说明该方法重现性良好。
[0226]
实施例6舒血宁注射液中松脂醇二葡萄糖苷含量的测定
[0227]
色谱条件与系统适用性试验:以十八烷基硅烷键合硅胶为填充剂(色谱柱tsk gel ods-100v 4.6mm
×
150mm,3μm);以甲醇为流动相a,水为流动相b,按表1中的规定进行梯度洗脱;流速每分钟为0.7ml,检测波长为277nm;柱温45℃。理论塔板数按松脂醇二葡萄糖苷
计算应不低于4000。
[0228]
对照品溶液的制备:取松脂醇二葡萄糖苷对照品适量,精密称定,加30%甲醇制成每1ml含18μg的溶液,即得。
[0229]
供试品溶液的制备:精密量取舒血宁注射液5ml,置活化后的艾杰尔中性氧化铝固相萃取柱上(100-200目,1g/6ml;活化处理:依次用甲醇和水各10ml,以1~2ml/min的流速洗涤,再重复两次),以1ml/min的流速滤过,收集流出液;再取30%甲醇50ml,以1ml/min的流速洗脱,合并以上流出液和洗脱液,水浴蒸干,残渣用30%甲醇超声溶解,转移至2ml量瓶中,并稀释至刻度,摇匀,滤过,取续滤液,即得。
[0230]
测定法:分别精密吸取对照品溶液与供试品溶液各20μl,注入液相色谱仪,测定,以外标法计算供试品溶液中松脂醇二葡萄糖苷含量。
[0231]
色谱图见图11,测定结果见表20。
[0232]
表20舒血宁注射液中松脂醇二葡萄糖苷含量测定结果
[0233]
检测结果zsa20190904zsa20190914zsa20190920含量(μg/ml)4.99.78.2
[0234]
实施例7银杏叶提取中间体中松脂醇二葡萄糖苷含量的测定
[0235]
银杏叶提取中间体的制备:按照《中国药典》(2020年版,p434)收载的方法制备成银杏叶提取液。批号:g13201201、g13201202、g13201203。
[0236]
色谱条件与系统适用性试验:以十八烷基硅烷键合硅胶为填充剂(色谱柱tsk gel ods-100v 4.6mm
×
150mm,3μm);以甲醇为流动相a,水为流动相b,按表1中的规定进行梯度洗脱;流速每分钟为0.7ml,检测波长为277nm;柱温45℃。理论塔板数按松脂醇二葡萄糖苷计算应不低于4000。
[0237]
对照品溶液的制备:取松脂醇二葡萄糖苷对照品适量,精密称定,加30%甲醇制成每1ml含18μg的溶液,即得。
[0238]
供试品溶液的制备:取银杏叶提取中间体,用水制备成每1ml含总黄酮醇苷1.0mg的溶液,精密量取5ml,置活化后的艾杰尔中性氧化铝固相萃取柱(100-200目,1g/6ml;依次用甲醇和水各10ml,以1~2ml/min的流速预洗,重复两次)上,以1ml/min的流速滤过,收集流出液;再取30%甲醇50ml,以1ml/min的流速洗脱,合并以上流出液和洗脱液,水浴蒸干,残渣用30%甲醇超声溶解,转移至2ml量瓶中,并稀释至刻度,摇匀,滤过,取续滤液,即得。
[0239]
测定法:分别精密吸取对照品溶液与供试品溶液各20μl,注入液相色谱仪,测定,即得。
[0240]
色谱图见图12,测定结果见表21。
[0241]
表21银杏叶提取中间体中松脂醇二葡萄糖苷含量测定结果
[0242]
检测结果g13201201g13201202g13201203含量(μg/ml)15.015.415.9
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1