一种胎盘生长因子检测试剂盒及其制备方法与应用与流程
1.本发明涉及生物医药领域,特别是涉及一种胎盘生长因子检测试剂盒及其制备方法与应用。
背景技术:
2.胎盘生长因子(plgf)主要由合体滋养层细胞合成,可与位于滋养层细胞和血管内皮细胞的酪氨酸酶受体结合,是一个对滋养层细胞功能有自分泌作用和对血管生长有旁分泌作用的蛋白。plgf对滋养层细胞和内皮细胞功能有独特的调节作用,能够促进新生血管生成。
3.胎盘生长因子是血管内皮生长因子家族成员之一,也称为胎盘源性的血管生成因子。在未孕女性中,甲状腺上皮、角化细胞和黑色素瘤细胞等组织细胞中可有少量的表达,但含量低于10pg/ml。当妇女怀孕后,即由合体滋养细胞合成大量的plgf,这些plgf一方面通过自分泌方式促进滋养细胞增殖分化;另一方面通过旁分泌的方式调节胎盘血管形成和生理性重铸,同时还可与其他的血管内皮生长因子起到协同作用,显著提高其生物活性,促进胎盘血管发展,在胎盘血管的形成过程中起到了重要的生理作用,维持妊娠过程中胎盘正常的血供和功能,使其适应母体和胎儿发育的需要。plgf的浓度在母体血液循环中随着孕周的增加而升高,在孕26-30周浓度达到峰值,此后下降直到分娩。同时,由于plgf半衰期仅为15分钟,一个代谢周期75分钟左右,因而plgf可以很好的反应胎盘功能即时情况。
4.先兆子痫(pe)是一种严重的妊娠并发症,其主要临床表现是在孕后20周左右出现高血压和蛋白尿。约有3-5%的妊娠妇女会发生先兆子痫,并能导致产妇、胎儿或新生儿的死亡。先兆子痫的临床症状的程度轻重不一,与血小板减少以及肝脏酶活性升高相关的先兆子痫可表现为血小板减少综合征(溶血,肝脏酶升高,血小板减少)。先兆子痫的发生是由于胎盘释放出血管生成因子从而引起的内皮功能障碍。患先兆子痫女性的血清plgf(胎盘生长因子)和sflt-1(可溶性酪氨酸激酶-1,或称血管内皮生长因子受体-1)的浓度水平会出现改变。此外,血循环中plgf和sflt-1的水平可先于临床症状出现前鉴别正常妊娠和先兆子痫。正常妊娠的前6个月血管性前因子plgf水平升高并随着妊娠的进展直至终止而逐渐减低。与此相反,抗血管性因子sflt-1水平在妊娠早期和中期保持稳定,直到妊娠终止期才平稳升高。患先兆子痫的妇女sflt-1水平高于正常妊娠水平,同时plgf水平低于正常妊娠水平。测定sflt-1与plgf的比值比单独检测sflt-1或plgf更有价值。胎盘内皮因子是tgf-β家族中的一员,其在先兆子痫中被上调并以可溶性的内皮因子形式被释放至母体血循环中。可溶性endoglin已被证实在先兆子痫的重症病例中明显升高。
5.因此检测孕妇血液plgf水平在临床上可用于识别胎盘合体滋养层细胞存在供氧压力。可用于妊娠高血压预测与辅助诊断。
6.传统的胎盘生长因子的测定方法包括酶联免疫吸附法和化学发光法。
7.目前国内检测plgf的方法,大多数为酶联免疫吸附法和荧光层析法。酶联免疫吸附法耗时长,操作繁琐。此外,这两种检测方法检测灵敏度差,检测范围窄,非全自动测试。
国外检测plgf方法有电化学发光免疫分析法,但是该方法检测成本高,导致无法适用于资源有限地区的孕查。
技术实现要素:
8.基于此,本发明的目的之一在于提供一种免疫磁微粒的制备方法。
9.包括如下技术方案:
10.(1)预处理:磁微粒经预处理,得到混合液1;
11.(2)活化:利用交联剂对抗体进行活化处理;
12.(3)偶联:将步骤(2)中活化后的抗体加入步骤(1)得到的混合液1中,得到混合液2,经孵育,得到抗体-磁珠偶联物;
13.(4)封闭:在所述步骤(3)得到的抗体-磁珠偶联物中加入封闭液进行封闭,得到抗体-磁珠偶联的免疫磁微粒终产物;
14.其中,步骤(2)中的交联剂选自bs(peg)5、bmps和bm(peg)3中的任意一种;所述活化处理中,抗体与交联剂使用的质量比为103:(0.5~2.0)。
15.本发明的目的之一还在于提供根据上述制备方法获得的免疫磁微粒。
16.本发明的目的之一还在于提供一种上述免疫磁微粒在制备试剂盒或试剂盒检测试剂中的应用。
17.本发明的目的之一还在于提供一种胎盘生长因子捕获抗体磁微粒。
18.包括如下技术方案:
19.一种胎盘生长因子捕获抗体磁微粒,其通过上述免疫磁微粒的制备方法制备得到。
20.本发明的目的之一还在于提出一种胎盘生长因子化学发光免疫检测试剂盒。
21.包括如下技术方案:
22.一种胎盘生长因子化学发光免疫检测试剂盒,其包括上述胎盘生长因子捕获抗体磁微粒和化学发光标记物标记的胎盘生长因子检测抗体。
23.本发明的目的之一还在于提出一种非疾病诊断目的胎盘生长因子定量检测方法。
24.包括如下技术方案:
25.根据上述胎盘生长因子化学发光免疫检测试剂盒,建立标准拟合曲线;
26.获取待测样本,采用上述胎盘生长因子化学发光免疫检测试剂盒进行检测,记录待测样本发光值,代入上述标准拟合曲线中,得到样本中胎盘生长因子的浓度。
27.本发明的发明人为了解决现有技术中胎盘生长因子(plgf)检测的灵敏度差,检测范围窄等问题,采用双抗体夹心法联合磁微粒化学发光技术对胎盘生长因子进行检测,在进行胎盘生长因子捕获抗体磁微粒的制备过程中,意外发现采用发明人优化后的免疫微磁粒制备方法,特别是使用的交联剂为选自bs(peg)5、bmps和bm(peg)3中的任意一种时,经特定比例反应制备得到的胎盘生长因子捕获抗体磁微粒与发明人进一步通过特定比例交联剂spdp、dtt和封闭剂mmts制备得到的碱性磷酸酶标记的胎盘生长因子检测抗体,所形成的一种胎盘生长因子化学发光免疫检测试剂盒,能以全自动化学发光免疫分析仪为检测工具,自动完成检测,同时其检测性能还显著提高,检测灵敏度达到0.54pg/ml,相对于传统的胎盘生长因子的检测方法灵敏度至少提高了10倍,检测线性范围宽,能达到3pg/ml~
10000pg/ml。预示其具有广阔的检测应用前景。
附图说明
28.图1为本发明胎盘生长因子化学发光免疫测定试剂盒的制备流程示意图。
29.图2为实施例2中经检测系列plgf定标品得到的胎盘生长因子标准曲线图。
30.图3为实施例4中本发明胎盘生长因子化学发光免疫测定试剂盒与罗氏试剂盒检测结果的相关性分析统计图。
具体实施方式
31.下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(newyork:cold spring harbor laboratory press,1989)中所述的条件,或按照制造厂商所建议的条件。实施例中所用到的各种常用化学试剂,均为市售产品。
32.除非另有定义,本发明所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不用于限制本发明。本发明所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
33.在整个说明书和权利要求书中,以下术语具有与本文明确相关的含义,除非上下文另有明确规定。在本发明中使用的短语“在一个实施方案中”不一定指代相同的实施方案,尽管其可能是。此外,在本发明中使用的短语“在另一实施方案中”不一定指代不同的实施方案,尽管其可能是。因此,如下所述,可以容易地组合本发明的各个实施方案,而不脱离本发明的范围或精神。
34.此外,如本发明所使用的,术语“或”是包含性的“或”符号,并且等同于术语“和/或”,除非上下文另有明确规定。术语“基于”不是排他性的,并且允许基于未描述的其他因素,除非上下文另有明确规定。此外,在整个说明书中,“一个”、“一种”和“所述/该”的含义包括复数指示物。“在......中”中的含义包括“在......中”和“在......上”。
35.为了便于理解本发明,下面将对本发明进行更全面的描述。本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明公开内容的理解更加透彻全面。
36.本发明涉及缩略语和术语定义如下:
37.bs(peg)5:聚乙二醇化二(磺基琥珀酰亚胺基)辛二酸
38.plgf:胎盘生长因子
39.spdp:琥珀酰亚胺3-(2-吡啶基二硫基)-丙酸酯
40.mmts:甲基硫甲磺酸酯
41.bmps:n-β-马来酰亚胺丙基氧化丁二酰亚胺酯
42.bm(peg)3:1,11-双马来酰亚胺基-三乙二醇
43.dtbp:二硫代丙亚氨酸二甲酯二盐酸盐
44.dtssp:3,3
’‑
二硫双(磺基琥珀酰亚胺丙酸酯
45.amas:n-α-马来酰亚胺氧琥珀酰亚胺酯
46.以下结合具体实施例对本发明作进一步详细的说明。
47.本发明的一些实施例提供了一种免疫磁微粒的制备方法,其包括以下步骤:
48.(1)预处理:磁微粒经预处理,得到混合液1;
49.(2)活化:利用交联剂对抗体进行活化处理;
50.(3)偶联:将步骤(2)中活化后的抗体加入步骤(1)得到的混合液1中,得到混合液2,经孵育,得到抗体-磁珠偶联物;
51.(4)封闭:在所述步骤(3)得到的抗体-磁珠偶联物中加入封闭液进行封闭,得到抗体-磁珠偶联的免疫磁微粒终产物;
52.其中,步骤(2)中的交联剂选自bs(peg)5、bmps和bm(peg)3中的任意一种;所述活化处理中,抗体与交联剂使用的质量比为103:(0.5~1.5),进一步优选为,抗体与交联剂使用的质量比为103:1.0。
53.在其中一些实施例中,上述制备方法步骤(2)中的交联剂优选为bs(peg)5,抗体与交联剂bs(peg)5使用的质量比为103:1.0时,由于bs(peg)5是一个有5个peg的聚合物,有一个偶联“长臂”,从此可以作为一个“桥梁”增加抗体和磁珠之间的距离,降低两者的空间位阻,从而使得单位面积磁珠上可以连接上更多的抗体,进而后续能有更多的抗体可以与抗原结合,进而提升免疫分析方法的稳定性和灵敏度。
54.在其中一些实施例中,上述制备方法步骤(1)中,所述混合液1为磁微粒经缓冲液洗涤重悬后,在硫酸铵溶液中分散均匀得到;进一步地,所述硫酸铵溶液浓度为2~5m,ph为8~10。更优选为使用的硫酸铵溶液的浓度为3m,ph为9.5,此时硫酸铵作为反应促进剂,能加快后续磁珠与蛋白的结合速度。
55.在其中一些实施例中,上述制备方法步骤(1)中,所述缓冲液优选为pbs缓冲液和bbs缓冲液;进一步优选为,磁微粒先用0.01m,ph为7.4的pbs缓冲液洗涤,磁分离去上清后再用0.1m,ph为9.5的bbs缓冲液重悬。
56.在其中一些实施例中,上述制备方法步骤(1)中,所述磁微粒采用甲苯磺酰基修饰,即磁微粒具有的活性基团为甲苯磺酰基时,其可以与蛋白发生偶联,使得偶联后的蛋白与待检测物结合后能够利用外磁场的作用实现待检测物的高效分离和检测。
57.在其中一些实施例中,上述制备方法步骤(1)中,所述甲苯磺酰基化的磁微粒的粒径为0.9μm~1.8μm。
58.在其中一些实施例中,上述制备方法步骤(4)中,所述封闭液为含0.5%bsa的0.05m,ph为7.4的tris缓冲液。
59.在其中一些实施例中,上述制备方法步骤(4)中,所述抗体-磁珠偶联的免疫磁微粒终产物中,抗体与磁珠的质量比为1:(10~50)。进一步优选为,抗体与磁珠的质量比为1:20。
60.在其中一些实施例中,上述制备方法步骤(2)中,所述蛋白包括抗原和抗体,进一步地,所述蛋白为抗体,更优选地,为胎盘生长因子单克隆抗体。
61.本发明的一些实施例还提供了一种免疫磁微粒,其根据上述制备方法获得。
62.本发明的一些实施例还提供了上述免疫磁微粒在制备试剂盒或试剂盒检测试剂中的应用。
63.本发明的一些实施例还提供了一种胎盘生长因子捕获抗体磁微粒,其通过上述制
备方法制备得到。
64.本发明的一些实施例还提供了一种胎盘生长因子化学发光免疫检测试剂盒,其包括上述胎盘生长因子捕获抗体磁微粒和化学发光标记物标记的胎盘生长因子检测抗体。
65.在其中一些实施例中,上述化学发光标记物标记的胎盘生长因子检测抗体为dtt活化后的化学发光物和交联剂活化后的胎盘生长因子检测抗体经混合交联、封闭剂处理后得到。
66.在其中一些实施例中,上述化学发光标记物标记的胎盘生长因子检测抗体制备方法,具体包括如下步骤:
67.(1)抗体活化:利用交联剂对抗体进行活化处理;
68.(2)化学发光物活化:利用二硫苏糖醇对化学发光标记物进行活化处理;
69.(3)偶联:将步骤(2)中活化后的化学发光标记物与步骤(1)中活化后的抗体,混合,孵育,得到化学发光标记物-抗体偶联物;
70.(4)封闭:在所述步骤(3)得到的化学发光标记物-抗体偶联物中加入封闭剂进行封闭,得到化学发光标记物-抗体终产物;
71.所述交联剂选自spdp、dtbp、dtssp、amas中的任意一种,所述封闭剂为mmts。进一步地,所述交联剂优选为spdp,当使用的交联剂为5mg/ml spdp溶液时,此时spdp作为抗体活化剂,能最大效率的活化抗体,能大大提高后续抗体与化学发光标记物的偶联效率。从而能提高检测灵敏度。
72.在其中一些实施例中,步骤(1)中的活化处理时,抗体与交联剂的使用浓度相等,活化方式为室温孵育1小时。
73.在其中一些实施例中,步骤(2)中对化学发光标记物的活化处理为使用浓度为5mg/ml的dtt,室温下孵育1h。
74.在其中一些实施例中,步骤(4)中使用的封闭剂为5mg/ml的mmts,进一步地,还进行脱盐纯化处理,优选为,用0.01m,ph为7.4的pbs缓冲液回收上述脱盐纯化后的结合物至0.1mg/ml,接着加入等体积的甘油,混匀,得到化学发光标记物标记的胎盘生长因子检测抗体。
75.在其中一些实施例中,上述化学发光标记物标记的胎盘生长因子检测抗体中,所述化学发光标记物选自吖啶酯、三联吡啶钌、金刚烷、鲁米诺、鲁米诺的衍生物、异鲁米诺、异鲁米诺的衍生物、辣根过氧化物酶及碱性磷酸酶中的一种。当然,在其他实施方式中,经标记物标记的抗体中的标记物不限于上述,还可以是可用于化学发光免疫分析平台的其他物质。
76.在其中一些实施例中,上述化学发光标记物为碱性磷酸酶,所述碱性磷酸酶标记的胎盘生长因子检测抗体中,胎盘生长因子检测抗体与交联剂的质量比为100:(0.5~2.0)。进一步优选为,胎盘生长因子检测抗体与交联剂的质量比为100:1.0。
77.在其中一些实施例中,上述胎盘生长因子化学发光免疫检测试剂盒还包括胎盘生长因子定标品,进一步地,所述胎盘生长因子定标品采用定标缓冲液配制得到,所述定标缓冲液包括45mm~55mm tris,0.05%~0.15%bsa和0.9%nacl。优选为,上述定标缓冲液包括50mm tris,0.1%bsa,0.9%nacl,ph7.5。
78.在其中一些实施例中,上述盘生长因子化学发光免疫检测试剂盒还包括化学发光
底物液,进一步地,优选为aps底物液。
79.本发明的一些实施例还提供了一种非疾病诊断目的胎盘生长因子定量检测方法。
80.包括如下步骤:
81.根据上述胎盘生长因子化学发光免疫检测试剂盒,建立标准拟合曲线;
82.获取待测样本,采用上述胎盘生长因子化学发光免疫检测试剂盒进行检测,记录待测样本发光值,代入上述标准拟合曲线中,得到样本中胎盘生长因子的浓度。
83.在其中一些实施例中,上述待测样本为血清。
84.在其中一些实施例中,上述定量检测方法具体为:取20μl-100μl的血清样本,加入20μl-100μl的胎盘生长因子捕获抗体磁微粒和20μl-100μl的碱性磷酸酶标记的胎盘生长因子检测抗体,反应5min-15min后,进行磁分离,接着再加入100μl-300μl的底物液,混匀后,仪器将反应混合物送入暗室,最后记录发光值。优选为,取50μl的血清样本,加入50μl的胎盘生长因子捕获抗体磁微粒和50μl的碱性磷酸酶标记的胎盘生长因子检测抗体,反应10min后,进行磁分离,接着再加入200μl的底物液,混匀后,仪器将反应混合物送入暗室,最后记录发光值。
85.实施例1plgf化学发光免疫测定试剂盒的制备
86.(1)胎盘生长因子单克隆抗体包被的甲苯磺酰基化的磁微粒的制备:
87.取含有80mg粒径为0.9μm~1.8μm的甲苯磺酰基化磁微粒(magnospheretm,货号:ms160)的悬浮液,磁分离去上清,用0.01m,ph为7.4的pbs缓冲液洗涤磁微粒,磁分离去上清后用0.1m,ph为9.5的bbs缓冲液重悬,加入3ml的3m,ph为9.5的硫酸铵溶液,分散均匀,得到混合液1,接着在4mg的胎盘生长因子单克隆抗体(广州万孚生物技术股份有限公司,货号:plgf-34#)加入4μg的bs(peg)5(聚乙二醇化二(磺基琥珀酰亚胺基)辛二酸,thermofisher scientific)活化胎盘生长因子单克隆抗体,再将活化后抗体加入混合液1中得到混合液2。然后将混合液2放置旋转摇床上进行第一次孵育处理,磁分离上清液后用0.05m,ph为7.4的tris缓冲液洗涤,去上清液后,接着加入含0.5%的bsa溶液,进行第二次孵育处理,磁分离上清液后用0.05m,ph为7.4的tris缓冲液洗涤,最后用含0.5%bsa的0.05m,ph为7.4的tris缓冲液重悬到10mg/ml,得到胎盘生长因子单克隆抗体包被的甲苯黄酰基化的磁微粒,对应的磁珠母液命名为:plgf-r1
‑①
,保存于4℃备用。
88.(2)碱性磷酸酶标记的胎盘生长因子单克隆抗体的制备:
89.取含有1mg胎盘生长因子单克隆抗体的溶液(广州万孚生物技术股份有限公司,货号:plgf-30#),离心-去上清后,用0.01m,ph为7.4的pbs缓冲液进行置换原抗体中的液体到5mg/ml,接着加入2μl浓度为5mg/ml的spdp(琥珀酰亚胺3-(2-吡啶基二硫基)-丙酸酯,thermofisher scientific),室温下孵育1h,活化抗体;然后往50μl浓度为20mg/ml碱性磷酸酶中加入2μl浓度为5mg/ml的dtt,室温下孵育1h,活化碱性磷酸酶;接着把活化后的抗体和碱性磷酸酶混合在一起,室温下孵育1h,进行交联。最后往上述交联后的混合物中加入4μl浓度为5mg/ml的mmts(甲基硫甲磺酸酯,thermofisher scientific)进行封闭,接着脱盐纯化,用0.01m,ph为7.4的pbs缓冲液回收上述脱盐纯化后的结合物至0.1mg/ml,接着加入等体积的甘油,混匀,得到碱性磷酸酶标记的胎盘生长因子单克隆抗体结合物,对应的酶标母液命名为:plgf-r2
‑①
,保存于-20℃备用。
90.(3)胎盘生长因子定标品的制备:
91.用定标品缓冲液(50mm tris,0.1%bsa,0.9%nacl,ph7.5)将胎盘生长因子(r&d systems,inc.)配制成浓度为0pg/ml、10pg/ml、50pg/ml、100pg/ml、500pg/ml、1000pg/ml、2500pg/ml、5000pg/ml、8000pg/ml、11000pg/ml,每管0.5ml分装,-20℃保存备用。
92.实施例2plgf化学发光免疫测定试剂盒的检测方法
93.本发明试剂盒的检测原理是:包被胎盘生长因子(plgf)捕获抗体的磁微粒与碱性磷酸酶标记的胎盘生长因子(plgf)检测抗体和样本、校准品或质控品中的胎盘生长因子结合形成“三明治”复合物。在外加磁场的作用下,将免疫反应形成的复合物与未结合的其他物质分离,清洗复合物后,加入酶促化学发光底物。底物在酶作用下被催化裂解,形成不稳定的激发态中间体,当激发态中间体回到基态时发出光子,形成发光反应,即可使用化学发光仪检测反应的发光强度。同时,发光标记物碱性磷酸酶基本不被消耗,而反应体系中发光剂充分过量,因此发光信号强而稳定,且发光时间较长,在检测范围内,发光强度与样本中的胎盘生长因子的含量成正比,参考标准曲线可计算出样本中胎盘生长因子浓度。
94.以全自动化学发光免疫分析仪(广州万孚生物技术股份有限公司,型号fc-302)为检测工具,方法学模式为双抗体夹心,即仪器依次加入50μl的血清样本,加50μl的胎盘生长因子单克隆抗体包被的甲苯磺酰基化的磁微粒和50μl的碱性磷酸酶标记的胎盘生长因子单克隆抗体,反应10min后,进行磁分离,接着往里面加入200μl的底物液,混匀后,仪器将反应混合物送入暗室,最后记录发光值。
95.采用上述方法对实施例1中制备得到的plgf定标品进行检测,得到绘制标准曲线如图2所示。
96.接着测试实际样本,根据样本发光值计算样本浓度。
97.实施例3plgf化学发光免疫测定试剂盒的优化
98.(1)胎盘生长因子单克隆抗体包被的甲苯磺酰基化的磁微粒的制备中抗体活化剂的筛选:
99.参考实施例1所述方法制备得到混合液1,接着分别在4mg的胎盘生长因子单克隆抗体(广州万孚生物技术股份有限公司,货号:plgf-34#)加入4μg的bs(peg)5、4μg的bmps(n-β-马来酰亚胺丙基氧化丁二酰亚胺酯,thermofisher scientific)、4μg的bm(peg)3(1,11-双马来酰亚胺基-三乙二醇,thermofisher scientific)活化胎盘生长因子单克隆抗体,再分别将活化后抗体加入混合液1中得到3种混合液2。然后分别将这3种混合液2放置旋转摇床上进行第一次孵育处理,磁分离上清液后用0.05m,ph为7.4的tris缓冲液洗涤,去上清液后,接着加入含0.5%的bsa溶液,进行第二次孵育处理,磁分离上清液后用0.05m,ph为7.4的tris缓冲液洗涤,最后用含0.5%bsa的0.05m,ph为7.4的tris缓冲液重悬到10mg/ml,分别得到3个胎盘生长因子单克隆抗体包被的甲苯黄酰基化的磁微粒(bs(peg)5偶联剂对应的磁珠母液命名为:plgf-r1
‑①
;bmps偶联剂对应的磁珠母液命名为:plgf-r1
‑②
;bm(peg)3偶联剂对应的磁珠母液命名为:plgf-r1
‑③
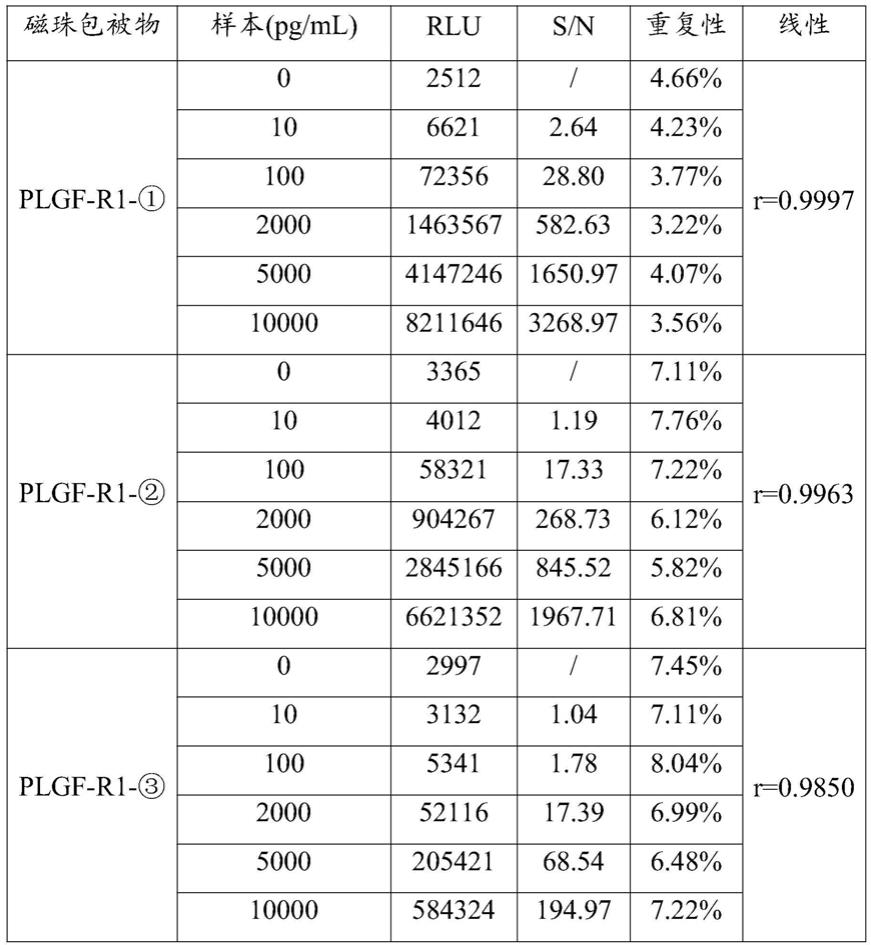
),保存于4℃备用,后续分别用这三个磁珠母液,搭配相应的碱性磷酸酶标记的胎盘生长因子单克隆抗体,对试剂的灵敏度、重复性、线性指标进行测试验证,具体结果请见下表3-1。
100.表3-1不同偶联剂磁微粒包被plgf抗体性能验证结果
[0101][0102]
由表3-1可以得知,plgf-r1
‑①
与plgf-r1
‑②
和plgf-r1
‑③
磁珠包被物比较,plgf-r1
‑①
磁珠包被物的信噪比(s/n)最大,重复性均在5%以内,线性r最优。
[0103]
因此,在胎盘生长因子单克隆抗体包被的甲苯磺酰基化的超顺磁性微粒中,所用到的抗体活化剂优选为bs(peg)5。
[0104]
(2)胎盘生长因子单克隆抗体包被的甲苯磺酰基化的磁微粒的制备中抗体活化剂浓度的筛选:
[0105]
参考实施例1所述方法制备得到混合液1,接着各取1mg的胎盘生长因子单克隆抗体(广州万孚生物技术股份有限公司,货号:plgf-34#),分别加入0.5μg的bs(peg)5、1.0μg的bs(peg)5和2.0μg的bs(peg)5来活化胎盘生长因子单克隆抗体,再分别将活化后抗体加入混合液1中得到3种混合液2。然后分别将这3种混合液2放置旋转摇床上进行第一次孵育处理,磁分离上清液后用0.05m,ph为7.4的tris缓冲液洗涤,去上清液后,接着加入含0.5%的bsa溶液,进行第二次孵育处理,磁分离上清液后用0.05m,ph为7.4的tris缓冲液洗涤,最后用含0.5%bsa的0.05m,ph为7.4的tris缓冲液重悬到10mg/ml,分别得到3个胎盘生长因子
单克隆抗体包被的甲苯黄酰基化的磁微粒(0.5μg的bs(peg)5偶联剂对应的磁珠母液命名为:plgf-r1
‑④
;1.0μg的bs(peg)5偶联剂对应的磁珠母液命名为:plgf-r1
‑⑤
;2.0μg的bs(peg)5偶联剂对应的磁珠母液命名为:plgf-r1
‑⑥
),保存于4℃备用,后续分别用这三个磁珠母液,搭配相应的碱性磷酸酶标记的胎盘生长因子单克隆抗体,对试剂的灵敏度、重复性、线性指标进行测试验证,具体结果请见下表3-2。
[0106]
表3-2不同浓度的bs(peg)5偶联剂磁微粒包被plgf抗体性能验证结果
[0107][0108][0109]
由表3-2可以得知,plgf-r1
‑④
与plgf-r1
‑⑤
和plgf-r1
‑⑥
磁珠包被物比较,plgf-r1
‑⑤
和plgf-r1
‑⑥
磁珠包被物的信噪比(s/n)、重复性和线性性能差不多,但均比plgf-r1
‑④
的性能优,最后优选plgf-r1
‑⑤
。
[0110]
因此,在胎盘生长因子单克隆抗体包被的甲苯磺酰基化的超顺磁性微粒中,所用到的抗体和抗体活化剂bs(peg)5的质量比优选103:1.0。
[0111]
(3)碱性磷酸酶标记的胎盘生长因子单克隆抗体的制备中交联剂的筛选:
[0112]
参考实施例1,各取1mg的胎盘生长因子单克隆抗体(广州万孚生物技术股份有限公司,货号:plgf-30#),用0.01m,ph为7.4的pbs缓冲液进行置换原抗体中的液体到5mg/ml,接着分别加入2μl浓度为5mg/ml的spdp、2μl浓度为5mg/ml的dtbp(二硫代丙亚氨酸二甲酯二盐酸盐,thermofisher scientific)、2μl浓度为5mg/ml的dtssp(3,3
’‑
二硫双(磺基琥珀酰亚胺丙酸酯),thermofisher scientific)和2μl浓度为5mg/ml的amas(n-α-马来酰亚胺氧琥珀酰亚胺酯,thermofisher scientific),室温下分别孵育1h,活化抗体;然后分别往50μl浓度为20mg/ml碱性磷酸酶中加入2μl浓度为5mg/ml的dtt,室温下孵育1h,活化碱性磷酸酶;接着把活化后的抗体和碱性磷酸酶混合在一起,室温下孵育1h,进行交联。最后分别往上述交联后的混合物中加入4μl浓度为5mg/ml的mmts进行封闭,接着脱盐纯化,用0.01m,ph为7.4的pbs缓冲液回收上述脱盐纯化后的结合物至0.1mg/ml,接着加入等体积的甘油,混匀,得到碱性磷酸酶标记的胎盘生长因子单克隆抗体结合物(spdp交联剂对应的酶标母液命名为:plgf-r2
‑①
;dtbp交联剂对应的磁珠母液命名为:plgf-r2
‑②
;dtssp交联剂对应的磁珠母液命名为:plgf-r2
‑③
;amas交联剂对应的磁珠母液命名为:plgf-r2
‑④
),保存于-20℃备用,后续分别用这三个酶标母液,搭配相应的胎盘生长因子单克隆抗体包被的甲苯磺酰基化的磁微粒,对试剂的灵敏度、重复性、线性指标进行测试验证,具体结果见下表3-3所示。
[0113]
表3-3不同交联剂碱性磷酸酶标记plgf抗体性能验证结果
[0114][0115][0116]
由上表3-3可以得知,plgf-r2
‑①
与plgf-r2
‑②
、plgf-r2
‑③
和plgf-r2
‑④
酶标记物比较,plgf-r2
‑①
酶标记物的信噪比(s/n)最大,重复性均在5%以内,线性r最优。
[0117]
因此,在碱性磷酸酶标记的胎盘生长因子单克隆抗体制备中,所用到的交联剂优选为spdp和dtt,封闭剂为mmts。
[0118]
(4)碱性磷酸酶标记的胎盘生长因子单克隆抗体的制备中交联剂浓度的筛选:
[0119]
参考实施例1,各取1mg的胎盘生长因子单克隆抗体(广州万孚生物技术股份有限公司,货号:plgf-30#),用0.01m,ph为7.4的pbs缓冲液进行置换原抗体中的液体到5mg/ml,接着分别加入1μl、2μl和4μl浓度为5mg/ml的spdp,室温下分别孵育1h,活化抗体;然后分别往50μl浓度为20mg/ml碱性磷酸酶中加入2μl浓度为5mg/ml的dtt,室温下孵育1h,活化碱性磷酸酶;接着把活化后的抗体和碱性磷酸酶混合在一起,室温下孵育1h,进行交联。最后分别往上述交联后的混合物中加入4μl浓度为5mg/ml的mmts进行封闭,接着脱盐纯化,用0.01m,ph为7.4的pbs缓冲液回收上述脱盐纯化后的结合物至0.1mg/ml,接着加入等体积的甘油,混匀,得到碱性磷酸酶标记的胎盘生长因子单克隆抗体结合物(1μl浓度为5mg/ml的spdp交联剂对应的酶标母液命名为:plgf-r2
‑⑤
;2μl浓度为5mg/ml的spdp交联剂对应的酶标母液命名为:plgf-r2
‑⑥
;4μl浓度为5mg/ml的spdp交联剂对应的酶标母液命名为:plgf-r2
‑⑦
),保存于-20℃备用,后续分别用这三个酶标母液,搭配相应的胎盘生长因子单克隆抗体包被的甲苯磺酰基化的磁微粒,对试剂的灵敏度、重复性、线性指标进行测试验证,具体结果见下表3-4所示。
[0120]
表3-4不同浓度的spdp交联剂碱性磷酸酶标记plgf抗体性能验证结果
[0121][0122]
由表3-4可以得知,plgf-r2
‑⑤
、plgf-r2
‑⑥
和plgf-r2
‑⑦
酶标记物比较,plgf-r2
‑⑥
和plgf-r2
‑⑦
磁珠包被物的信噪比(s/n)、重复性和线性性能差不多,但均比plgf-r2
‑⑤
的性能优,最后优选plgf-r2
‑⑥
。
[0123]
因此,在碱性磷酸酶标记的胎盘生长因子单克隆抗体制备中,所用到的抗体和交联剂spdp的质量比优选为100:1.0。
[0124]
实施例4plgf化学发光免疫测定试剂盒性能评价
[0125]
采用实施例2中的方法对plgf定标品进行检测,得到绘制标准曲线如图2所示。
[0126]
接着测试实际样本,根据样本发光值计算样本浓度。
[0127]
(1)灵敏度的检测:
[0128]
参照clsi ep17-a文件推荐实验方案,计算胎盘生长因子化学发光免疫测定试剂盒的灵敏度,求得的灵敏度为0.54pg/ml。
[0129]
(2)线性的检测:
[0130]
对浓度为0pg/ml、10pg/ml、50pg/ml、100pg/ml、500pg/ml、1000pg/ml、2500pg/ml、
5000pg/ml、8000pg/ml、11000pg/ml定标品做了线性分析,计算线性相关系数,r=0.9996,另外,该试剂盒对胎盘生长因子样本检测的线性范围为3pg/ml~10000pg/ml。
[0131]
(3)精密度的检测:
[0132]
取浓度为100pg/ml和5000pg/ml两个胎盘生长因子样本,每个样本各测试10次,用三批试剂盒进行检测,计算试剂盒批内及批间差,结果表明该试剂盒批内差小于5%,批间差小于10%,具体结果见下表4所示。
[0133]
(4)干扰性实验:
[0134]
取混合血清分别添加干扰物包括:胆红素(10mg/dl)、血红蛋白(500mg/dl)、甘油三酯(1000mg/dl),添加质量比按照1:20进行,分别测定混合血清和添加了各种干扰物后混合血清的测值。计算二者之间的偏差,以
±
10%为可接受范围,具体结果见下表4所示。结果表明,干扰性均达到nccls的文件标准,可用于临床实验室胎盘生长因子状况的准确评估。
[0135]
表4 plgf化学发光免疫测定试剂盒检测结果
[0136][0137][0138]
(5)临床性能的检测:
[0139]
取197例临床样本用本发明实施例1的试剂盒进行检测,测定发光值,并根据标准曲线(如图2所示),计算出浓度。
[0140]
同时使用罗氏公司的胎盘生长因子检测试剂盒(电化学发光法)对上述临床样本进行浓度测定。
[0141]
将本发明实施例中制备的试剂盒的检测浓度与罗氏公司的胎盘生长因子检测试剂盒(电化学发光法)的浓度测定结果进行分析对比,其中胎盘生长因子临床相关性为r2=0.9733,说明本发明试剂盒与罗氏试剂盒具有良好的相关性。临床相关性结果如图3所示。
[0142]
实施例5plgf化学发光免疫测定试剂盒的对比实验
[0143]
分别用化学发光检测方法和酶联免疫吸附法(r&d systems,inc.,货号:dpg00)对浓度为0pg/ml和10pg/ml的胎盘生长因子样本进行测试,两种方法检测灵敏度相比,数据如下表5-1所示:
[0144]
表5-1
[0145][0146]
[0147]
由上表可以看出,本发明提出的胎盘生长因子化学发光检测试剂盒检测的灵敏度较常规检测酶联免疫吸附法提高约10倍。
[0148]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1