双信号纳米探针及其在检测前列腺特异性抗原中的应用的制作方法
1.本发明涉及双信号纳米探针及其在检测前列腺特异性抗原中的应用,属于生物检测技术领域。
背景技术:
2.前列腺癌是指发生在前列腺的上皮性恶性肿瘤。2004年who《泌尿系统及男性生殖器官肿瘤病理学和遗传学》中,前列腺癌病理类型上包括腺癌(腺泡腺癌)、导管腺癌、尿路上皮癌、鳞状细胞癌、腺鳞癌。其中,前列腺腺癌占95%以上,因此,通常所说的前列腺癌就是指前列腺腺癌。2012年我国肿瘤登记地区前列腺癌发病率为9.92/10万,列男性恶性肿瘤发病率的第6位。发病年龄在55岁前处于较低水平,55岁后逐渐升高,发病率随着年龄的增长而增长,高峰年龄是70~80岁。家族遗传型前列腺癌患者发病年龄稍早,年龄≤55岁的患者占43%。
3.前列腺特异性抗原(psa)是前列腺癌的生物标志物,是诊断前列腺癌根治术患者癌症复发最重要的生物标志物,临床筛查阈值为4ng/ml。目前,定量检测前列腺特异性抗原的方法主要有酶联免疫吸附法(elisa)和高压液相色谱法(hplc)。但是,这两种方法均存在设备昂贵、检测步骤繁琐(需对待测样品进行前处理)、耗时长、需专职人员操作等缺点,无法满足资源匮乏地区批量样本检测的需求。因此,亟需开发一种成本低、步骤简单、耗时短、无需专职人员操作的定量检测前列腺特异性抗原的方法。
技术实现要素:
4.为解决上述问题,本发明提供了一种双信号纳米探针,所述双信号纳米探针为磷脂包裹的钙钛矿纳米粒子(cspbbr
3 ncs)。
5.在本发明的一种实施方式中,所述磷脂为1,2-二油酰基-sn-甘油-3-磷酸胆碱(dopc)、阳离子脂质体用(2,3-二油酰基-丙基)-三甲基氯化铵(dotap)、二油酰磷脂酰甘油(dopg)或二硬脂酰基磷脂酰乙醇胺-聚乙二醇-生物素(dspe-peg-biotin)。
6.本发明还提供了一种制备双信号纳米探针的方法,所述方法包括如下步骤:
7.分散步骤:将钙钛矿纳米粒子分散在有机溶剂中,得到分散液;
8.包裹步骤:将分散液和磷脂混合后在惰性气体中除去有机溶剂,得到固体产物;将混合液和缓冲液混合后进行超声,得到含有双信号纳米探针的反应液。
9.在本发明的一种实施方式中,所述包裹步骤后,还包括纯化步骤;所述纯化步骤为:将含有双信号纳米探针的反应液离心后,将沉淀再分散于缓冲液中,得到经纯化的反应液;将经纯化的反应液离心,取沉淀物,得到纳米探针。
10.在本发明的一种实施方式中,所述有机溶剂为氯仿。
11.在本发明的一种实施方式中,所述分散液中,钙钛矿纳米粒子的浓度为0.6~0.8mm。
12.在本发明的一种实施方式中,所述磷脂在分散液中的添加量为150~250μg/ml。
13.在本发明的一种实施方式中,所述磷脂为1,2-二油酰基-sn-甘油-3-磷酸胆碱(dopc)、阳离子脂质体用(2,3-二油酰基-丙基)-三甲基氯化铵(dotap)、二油酰磷脂酰甘油(dopg)或二硬脂酰基磷脂酰乙醇胺-聚乙二醇-生物素(dspe-peg-biotin)。
14.在本发明的一种实施方式中,所述惰性气体为氮气或氩气。
15.在本发明的一种实施方式中,所述混合液和缓冲液的混合体积比为1~3:5~10。
16.在本发明的一种实施方式中,所述缓冲液为pbs缓冲液、tris缓冲液或醋酸钠缓冲液。
17.在本发明的一种实施方式中,所述缓冲液的ph为5~8、浓度为0.1~1mm。
18.在本发明的一种实施方式中,所述超声的条件为:于100~150khz下超声10~30s。
19.在本发明的一种实施方式中,所述离心的条件为:于9000~15000rpm下离心15~25min。
20.本发明还提供了一种检测前列腺特异性抗原的方法,所述方法为使用上述双信号纳米探针对前列腺特异性抗原进行检测。
21.在本发明的一种实施方式中,所述方法包括如下步骤:
22.固定步骤:将一抗添加至酶标板中进行孵育,得到固定有一抗的酶标板;
23.孵育步骤:先将样品添加至固定有一抗的酶标板中进行孵育,然后将链霉亲和素标记的二抗和生物素标记的权利要求1或2所述的双信号纳米探针添加至固定有一抗的酶标板中进行孵育,得到孵育产物;
24.一次检测步骤:检测孵育产物的荧光强度值后,根据测得的荧光强度值和荧光强度值与前列腺特异性抗原浓度之间的关系,计算得到样本中前列腺特异性抗原的浓度;
25.显色步骤:将显色底物tmb添加至孵育产物中进行显色,得到显色液;
26.二次检测步骤:检测显色液的吸光度值后,根据测得的吸光度值和吸光度值与前列腺特异性抗原浓度之间的关系,计算得到样本中前列腺特异性抗原的浓度。样本中前列腺特异性抗原的浓度以一次检测步骤的计算结果,二次检测步骤的计算结果,或者,一次检测步骤计算结果和二次检测步骤计算结果的平均值为准。
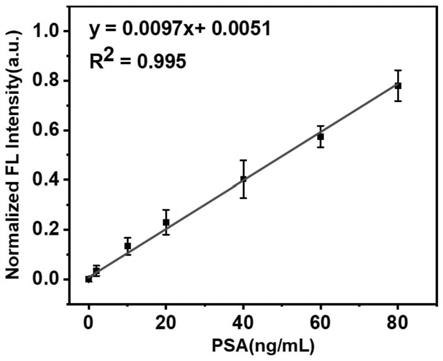
27.在本发明的一种实施方式中,所述一次检测步骤为:使用酶标仪检测孵育产物于521nm处的荧光强度后,将测得的荧光强度值离差标准化作为y值,带入根据荧光强度值与前列腺特异性抗原浓度之间的关系拟合而得的拟合方程y=0.0097x+0.0051,计算得到样品中前列腺特异性抗原的浓度。
28.在本发明的一种实施方式中,所述二次检测步骤为:使用紫外分光光度计检测显色液于652nm处的吸光度值后,将测得的吸光度值离差标准化作为y值,带入根据吸光度值与前列腺特异性抗原浓度之间的关系拟合而得的拟合方程y=0.0356x+0.0294,计算得到样品中前列腺特异性抗原的浓度。
29.在本发明的一种实施方式中,所述检测为定量检测。
30.本发明还提供了上述双信号纳米探针和上述方法在检测前列腺特异性抗原中的应用。
31.在本发明的一种实施方式中,所述检测为定量检测。
32.本发明技术方案,具有如下优点:
33.本发明提供了一种双信号纳米探针及使用此双信号纳米探针对前列腺特异性抗
原进行定量检测的方法,所述双信号纳米探针为磷脂包裹的钙钛矿纳米粒子(cspbbr
3 ncs)。传统的前列腺特异性抗原检测方法存在设备昂贵、检测步骤繁琐(需对待测样品进行前处理)、耗时长、需专职人员操作等缺点,无法满足资源匮乏地区批量样本检测的需求。本发明提供的双信号纳米探针及使用此双信号纳米探针对前列腺特异性抗原进行定量检测的方法基于钙钛矿纳米粒子,钙钛矿纳米粒子拥有优越的光电性能,例如,极高的荧光量子产率、窄的发光半峰宽,除此之外,还具有合成简单、成本低的优势,近年来在光电领域取得了巨大的发展。然而,钙钛矿纳米粒子在水环境中极不稳定,非常容易分解而导致荧光猝灭。因此,本发明利用脂质体对钙钛矿纳米粒子进行包封(cspbbr
3 ncs@pl),形成的磷脂膜一方面可以保护钙钛矿纳米粒子脆弱的内部晶体结构,另一方面可以使其充分发挥纳米酶的活性,催化过氧化氢、tmb底物,产生蓝色的可视化信号(oxtmb)。同时,作为荧光信号探针,随着oxtmb的产生,钙钛矿纳米粒子的荧光信号逐渐降低。两种信号互为补充,提供了更为精准的检测信息。因此,本发明无需使用昂贵的设备且无需对待测样品进行前处理即能实现对样本的快速分析,便捷经济,在大样本分析中具有较强的优势。并且,钙钛矿纳米粒子上涂覆的磷脂外膜提供了抗污能力,从而显着提高信噪比及检测性能。
34.进一步地,所述磷脂含有二油酰磷脂酰甘油;二油酰磷脂酰甘油可以显著提高钙钛矿纳米粒子的活性,以达到更准确的检测结果。
附图说明
35.图1:钙钛矿纳米粒子的tem图像。
36.图2:双信号纳米探针的tem图像。
37.图3:钙钛矿纳米粒子和双信号纳米探针的粉末xrd图谱。
38.图4:不同浓度的1,2-二油酰基-sn-甘油-3-磷酸胆碱(dopc)成分主导的双信号纳米探针催化的oxtmb在652nm处的吸光度变化。
39.图5:不同浓度的阳离子脂质体用(2,3-二油酰基-丙基)-三甲基氯化铵(dotap)成分主导的双信号纳米探针催化的oxtmb在652nm处的吸光度变化。
40.图6:不同浓度的二油酰磷脂酰甘油(dopg)成分主导的双信号纳米探针催化的oxtmb在652nm处的吸光度变化。
41.图7:定量检测前列腺特异性抗原的检测原理。
42.图8:不同前列腺特异性抗原浓度下测得的荧光强度值。
43.图9:以离差标准化的荧光强度值作为y轴,以前列腺特异性抗原浓度作为x轴绘制得到的标准曲线。
44.图10:不同前列腺特异性抗原浓度下测得的吸光度值。
45.图11:以离差标准化的吸光度值作为y轴,以前列腺特异性抗原浓度作为x轴绘制得到的标准曲线。
具体实施方式
46.提供下述实施例是为了更好地进一步理解本发明,并不局限于所述最佳实施方式,不对本发明的内容和保护范围构成限制,任何人在本发明的启示下或是将本发明与其他现有技术的特征进行组合而得出的任何与本发明相同或相近似的产品,均落在本发明的
保护范围之内。
47.下述实施例中未注明具体实验步骤或条件者,按照本领域内的文献所描述的常规实验步骤的操作或条件即可进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规试剂产品。
48.实施例1-1:一种双信号纳米探针
49.本实施例提供了一种双信号纳米探针,所述双信号纳米探针为1,2-二油酰基-sn-甘油-3-磷酸胆碱(dopc)包裹的钙钛矿纳米粒子(cspbbr
3 ncs)。
50.所述双信号纳米探针的制备方法包括如下步骤:
51.分散步骤:在圆底烧瓶中将钙钛矿纳米粒子(购自西安瑞禧生物有限公司)分散在氯仿中,得到400μl浓度为0.6mm的分散液;
52.包裹步骤:将400μl浓度为0.6mm的分散液和20μl浓度为30μg/ml的1,2-二油酰基-sn-甘油-3-磷酸胆碱(购自西安瑞禧生物有限公司)混合后,在氮气中除去氯仿,观察到产物在圆底烧瓶底部形成一层绿色荧光薄膜,得到混合液;将混合液和400μl pbs缓冲液(ph 7.4、浓度10mm,购自上海生工生物工程公司)混合后,于150khz下超声30s,得到含有双信号纳米探针的反应液;
53.纯化步骤:将含有双信号纳米探针的反应液于9000rpm下离心15min后,取沉淀再分散于400μl pbs缓冲液中,重复此操作3次以除去多余的磷脂,得到经纯化的反应液;将经纯化的反应液于9000rpm下离心15min,取沉淀物,得到磷脂包裹的钙钛矿纳米粒子,此磷脂包裹的钙钛矿纳米粒子即为双信号纳米探针。将磷脂包裹的钙钛矿纳米粒子再分散于400μl pbs缓冲液中备用。
54.实施例1-2:一种双信号纳米探针
55.本实施例提供了一种双信号纳米探针,所述双信号纳米探针为1,2-二油酰基-sn-甘油-3-磷酸胆碱(dopc)包裹的钙钛矿纳米粒子(cspbbr
3 ncs)。
56.所述双信号纳米探针的制备方法为在实施例1-1的基础上,将包裹步骤中的“浓度为30μg/ml的1,2-二油酰基-sn-甘油-3-磷酸胆碱”替换为“浓度为60μg/ml的1,2-二油酰基-sn-甘油-3-磷酸胆碱”。
57.实施例1-3:一种双信号纳米探针
58.本实施例提供了一种双信号纳米探针,所述双信号纳米探针为1,2-二油酰基-sn-甘油-3-磷酸胆碱(dopc)包裹的钙钛矿纳米粒子(cspbbr
3 ncs)。
59.所述双信号纳米探针的制备方法为在实施例1-1的基础上,将包裹步骤中的“浓度为30μg/ml的1,2-二油酰基-sn-甘油-3-磷酸胆碱”替换为“浓度为120μg/ml的1,2-二油酰基-sn-甘油-3-磷酸胆碱”。
60.实施例1-4:一种双信号纳米探针
61.本实施例提供了一种双信号纳米探针,所述双信号纳米探针为1,2-二油酰基-sn-甘油-3-磷酸胆碱(dopc)包裹的钙钛矿纳米粒子(cspbbr
3 ncs)。
62.所述双信号纳米探针的制备方法为在实施例1-1的基础上,将包裹步骤中的“浓度为30μg/ml的1,2-二油酰基-sn-甘油-3-磷酸胆碱”替换为“浓度为200μg/ml的1,2-二油酰基-sn-甘油-3-磷酸胆碱”。
63.实施例1-5:一种双信号纳米探针
64.本实施例提供了一种双信号纳米探针,所述双信号纳米探针为1,2-二油酰基-sn-甘油-3-磷酸胆碱(dopc)包裹的钙钛矿纳米粒子(cspbbr
3 ncs)。
65.所述双信号纳米探针的制备方法为在实施例1-1的基础上,将包裹步骤中的“浓度为30μg/ml的1,2-二油酰基-sn-甘油-3-磷酸胆碱”替换为“浓度为240μg/ml的1,2-二油酰基-sn-甘油-3-磷酸胆碱”。
66.实施例2-1:一种双信号纳米探针
67.本实施例提供了一种双信号纳米探针,所述双信号纳米探针为1,2-二油酰基-sn-甘油-3-磷酸胆碱(dopc)和阳离子脂质体用(2,3-二油酰基-丙基)-三甲基氯化铵(dotap)混合包裹的钙钛矿纳米粒子(cspbbr
3 ncs)。
68.所述双信号纳米探针的制备方法为在实施例1-3的基础上,将包裹步骤中的“将400μl浓度为0.6mm的分散液和20μl浓度为120μg/ml的1,2-二油酰基-sn-甘油-3-磷酸胆碱混合”替换为“将400μl浓度为0.6mm的分散液和20μl浓度为120μg/ml的1,2-二油酰基-sn-甘油-3-磷酸胆碱以及20μl浓度为5μg/ml的阳离子脂质体用(2,3-二油酰基-丙基)-三甲基氯化铵(购自西安瑞禧生物有限公司)混合”。
69.实施例2-2:一种双信号纳米探针
70.本实施例提供了一种双信号纳米探针,所述双信号纳米探针为1,2-二油酰基-sn-甘油-3-磷酸胆碱(dopc)和阳离子脂质体用(2,3-二油酰基-丙基)-三甲基氯化铵(dotap)混合包裹的钙钛矿纳米粒子(cspbbr
3 ncs)。
71.所述双信号纳米探针的制备方法为在实施例2-1的基础上,将包裹步骤中的“浓度为5μg/ml的阳离子脂质体用(2,3-二油酰基-丙基)-三甲基氯化铵”替换为“浓度为10μg/ml的阳离子脂质体用(2,3-二油酰基-丙基)-三甲基氯化铵”。
72.实施例2-3:一种双信号纳米探针
73.本实施例提供了一种双信号纳米探针,所述双信号纳米探针为1,2-二油酰基-sn-甘油-3-磷酸胆碱(dopc)和阳离子脂质体用(2,3-二油酰基-丙基)-三甲基氯化铵(dotap)混合包裹的钙钛矿纳米粒子(cspbbr
3 ncs)。
74.所述双信号纳米探针的制备方法为在实施例2-1的基础上,将包裹步骤中的“浓度为5μg/ml的阳离子脂质体用(2,3-二油酰基-丙基)-三甲基氯化铵”替换为“浓度为20μg/ml的阳离子脂质体用(2,3-二油酰基-丙基)-三甲基氯化铵”。
75.实施例2-4:一种双信号纳米探针
76.本实施例提供了一种双信号纳米探针,所述双信号纳米探针为1,2-二油酰基-sn-甘油-3-磷酸胆碱(dopc)和阳离子脂质体用(2,3-二油酰基-丙基)-三甲基氯化铵(dotap)混合包裹的钙钛矿纳米粒子(cspbbr
3 ncs)。
77.所述双信号纳米探针的制备方法为在实施例2-1的基础上,将包裹步骤中的“浓度为5μg/ml的阳离子脂质体用(2,3-二油酰基-丙基)-三甲基氯化铵”替换为“浓度为40μg/ml的阳离子脂质体用(2,3-二油酰基-丙基)-三甲基氯化铵”。
78.实施例2-5:一种双信号纳米探针
79.本实施例提供了一种双信号纳米探针,所述双信号纳米探针为1,2-二油酰基-sn-甘油-3-磷酸胆碱(dopc)和阳离子脂质体用(2,3-二油酰基-丙基)-三甲基氯化铵(dotap)混合包裹的钙钛矿纳米粒子(cspbbr
3 ncs)。
80.所述双信号纳米探针的制备方法为在实施例2-1的基础上,将包裹步骤中的“浓度为5μg/ml的阳离子脂质体用(2,3-二油酰基-丙基)-三甲基氯化铵”替换为“浓度为80μg/ml的阳离子脂质体用(2,3-二油酰基-丙基)-三甲基氯化铵”。
81.实施例3-1:一种双信号纳米探针
82.本实施例提供了一种双信号纳米探针,所述双信号纳米探针为1,2-二油酰基-sn-甘油-3-磷酸胆碱(dopc)和二油酰磷脂酰甘油(dopg)混合包裹的钙钛矿纳米粒子(cspbbr
3 ncs)。
83.所述双信号纳米探针的制备方法为在实施例1-3的基础上,将包裹步骤中的“将400μl浓度为0.6mm的分散液和20μl浓度为120μg/ml的1,2-二油酰基-sn-甘油-3-磷酸胆碱混合”替换为“将400μl浓度为0.6mm的分散液和20μl浓度为120μg/ml的1,2-二油酰基-sn-甘油-3-磷酸胆碱以及20μl浓度为5μg/ml的二油酰磷脂酰甘油(购自西安瑞禧生物有限公司)混合”。
84.实施例3-2:一种双信号纳米探针
85.本实施例提供了一种双信号纳米探针,所述双信号纳米探针为1,2-二油酰基-sn-甘油-3-磷酸胆碱(dopc)和二油酰磷脂酰甘油(dopg)混合包裹的钙钛矿纳米粒子(cspbbr
3 ncs)。
86.将包裹步骤中的“浓度为5μg/ml的二油酰磷脂酰甘油”替换为“浓度为10μg/ml的二油酰磷脂酰甘油”。
87.实施例3-3:一种双信号纳米探针
88.本实施例提供了一种双信号纳米探针,所述双信号纳米探针为1,2-二油酰基-sn-甘油-3-磷酸胆碱(dopc)和二油酰磷脂酰甘油(dopg)混合包裹的钙钛矿纳米粒子(cspbbr
3 ncs)。
89.将包裹步骤中的“浓度为5μg/ml的二油酰磷脂酰甘油”替换为“浓度为20μg/ml的二油酰磷脂酰甘油”。
90.实施例3-4:一种双信号纳米探针
91.本实施例提供了一种双信号纳米探针,所述双信号纳米探针为1,2-二油酰基-sn-甘油-3-磷酸胆碱(dopc)和二油酰磷脂酰甘油(dopg)混合包裹的钙钛矿纳米粒子(cspbbr
3 ncs)。
92.将包裹步骤中的“浓度为5μg/ml的二油酰磷脂酰甘油”替换为“浓度为40μg/ml的二油酰磷脂酰甘油”。
93.实施例3-5:一种双信号纳米探针
94.本实施例提供了一种双信号纳米探针,所述双信号纳米探针为1,2-二油酰基-sn-甘油-3-磷酸胆碱(dopc)和二油酰磷脂酰甘油(dopg)混合包裹的钙钛矿纳米粒子(cspbbr
3 ncs)。
95.将包裹步骤中的“浓度为5μg/ml的二油酰磷脂酰甘油”替换为“浓度为80μg/ml的二油酰磷脂酰甘油”。
96.实施例4-1:一种双信号纳米探针
97.本实施例提供了一种双信号纳米探针,所述双信号纳米探针为1,2-二油酰基-sn-甘油-3-磷酸胆碱(dopc)、二油酰磷脂酰甘油(dopg)和二硬脂酰基磷脂酰乙醇胺-聚乙二
醇-生物素(dspe-peg-biotin)包裹的钙钛矿纳米粒子(cspbbr
3 ncs)。
98.所述双信号纳米探针的制备方法为在实施例3-1的基础上,将包裹步骤中的“将400μl浓度为0.6mm的分散液和20μl浓度为120μg/ml的1,2-二油酰基-sn-甘油-3-磷酸胆碱混合”替换为“将400μl浓度为0.6mm的分散液和20μl浓度为120μg/ml的1,2-二油酰基-sn-甘油-3-磷酸胆碱20μl浓度为80μg/ml的二油酰磷脂酰甘油以及20μl浓度为60μg/ml的二硬脂酰基磷脂酰乙醇胺-聚乙二醇-生物素(购自西安瑞禧生物有限公司)混合”。
99.实验例1-1:双信号纳米探针的性能验证
100.实验一:以钙钛矿纳米粒子为对照,使用透射电子显微镜获得钙钛矿纳米粒子和实施例3的双信号纳米探针的tem图像。tem图像见图1~2。
101.实验二:以钙钛矿纳米粒子为对照,使用x射线衍射仪获得钙钛矿纳米粒子和实施例3的双信号纳米探针的粉末xrd图谱。粉末xrd图谱见图3。
102.实验三:使用紫外分光光度计检测实施例1-1~1-5的双信号纳米探针的吸光度值,得到不同浓度的1,2-二油酰基-sn-甘油-3-磷酸胆碱(dopc)成分主导的双信号纳米探针催化的oxtmb在652nm处的吸光度变化。吸光度变化见图4。
103.实验四:使用酶标仪检测实施例2-1~2-5的双信号纳米探针的吸光度值,得到不同浓度的阳离子脂质体用(2,3-二油酰基-丙基)-三甲基氯化铵(dotap)成分主导的双信号纳米探针催化的oxtmb在652nm处的吸光度变化。吸光度变化见图5。
104.实验五:使用酶标仪检测实施例3-1~3-5的双信号纳米探针的吸光度值,得到不同浓度的二油酰磷脂酰甘油(dopg)成分主导的双信号纳米探针催化的oxtmb在652nm处的吸光度变化。吸光度变化见图6。
105.由图1~2可知,钙钛矿纳米粒子和实施例3的双信号纳米探针的形貌表明,包裹磷脂成功,且并未改变纳米粒子的原有形貌。
106.由图3可知,钙钛矿纳米粒子和实施例3的双信号纳米探针的形貌的粉末xrd图谱表明,包裹磷脂前后均符合斜方晶系结构。
107.由图4可知,不同浓度的1,2-二油酰基-sn-甘油-3-磷酸胆碱(dopc)成分不会明显改变双信号纳米探针的催化活性。
108.由图5可知,不同浓度的阳离子脂质体用(2,3-二油酰基-丙基)-三甲基氯化铵(dotap)成分不会明显改变双信号纳米探针的催化活性。
109.由图6可知,不同浓度的二油酰磷脂酰甘油(dopg)成分可以明显增加双信号纳米探针的催化能力。
110.实施例5-1:一种定量检测前列腺特异性抗原的方法
111.本实施例提供了一种定量检测前列腺特异性抗原的方法(检测原理见图7),所述方法包括如下步骤:
112.固定步骤:使用pbs缓冲液(ph 7.4、浓度10mm,购自上海生工生物工程公司)配置浓度为1mg/ml的一抗(ab1,购自上海生工生物工程公司)溶液;以每孔10μl的添加量将一抗溶液添加至96孔酶标板中,于37℃孵育12h,得到固定有一抗的酶标板;
113.封闭步骤:使用pbs缓冲液配置浓度为10%(w/v,g/100ml)的bsa(购自西格玛公司)溶液;以每孔100μl的添加量将bsa溶液添加至96孔酶标板中,于37℃孵育2h后用pbs缓冲液洗涤,重复此操作两次,得到经封闭的酶标板;
114.孵育步骤:先以每孔50μl的添加量将待测样品添加至经封闭的酶标板中,于37℃孵育2h后用bsa溶液洗涤三次,然后分别以每孔100μl的添加量将链霉亲和素标记的二抗(ab2,购自上海生工生物工程公司)和实施例4-1中的生物素标记的双信号纳米探针添加至经封闭的酶标板中,于37℃孵育1h后用bsa溶液洗涤三次,得到孵育产物;
115.一次检测步骤:使用酶标仪检测孵育产物于521nm处的荧光强度后,将测得的荧光强度值线性离差标准化作为y值(y=(x-min)/(max-min),x为测出值),带入根据荧光强度值与前列腺特异性抗原浓度之间的关系拟合而得的拟合方程y=0.0097x+0.0051,计算得到样品中前列腺特异性抗原的浓度;
116.显色步骤:以每孔100μl的添加量将显色底物tmb(购自西格玛公司)添加至孵育产物中静置20min进行显色,得到显色液;
117.二次检测步骤:使用紫外分光光度计检测显色液于652nm处的吸光度值后,将测得的吸光度值线性离差标准化作为y值(y=(x-min)/(max-min),x为测出值),带入根据吸光度值与前列腺特异性抗原浓度之间的关系拟合而得的拟合方程y=0.0356x+0.0294,计算得到样品中前列腺特异性抗原的浓度。样本中前列腺特异性抗原的浓度以一次检测步骤的计算结果,二次检测步骤的计算结果,或者,一次检测步骤计算结果和二次检测步骤计算结果的平均值为准。
118.所述根据荧光强度值与前列腺特异性抗原浓度之间的关系拟合而得的拟合方程的获得过程包括如下步骤:
119.固定步骤:使用pbs缓冲液(ph 7.4、浓度10mm,购自上海生工生物工程公司)配置浓度为1mg/ml的一抗(ab1,购自上海生工生物工程公司)溶液;以每孔10μl的添加量将一抗溶液添加至96孔酶标板中,于37℃孵育12h,得到固定有一抗的酶标板;
120.封闭步骤:使用pbs缓冲液配置浓度为10%(w/v,g/100ml)的bsa(购自西格玛公司)溶液;以每孔100μl的添加量将bsa溶液添加至96孔酶标板中,于37℃孵育2h后用pbs缓冲液洗涤,重复此操作两次,得到经封闭的酶标板;
121.孵育步骤:先以每孔50μl的添加量分别将浓度为0、2、10、20、40、60、80、100、120、140ng/ml的前列腺特异性抗原标准品溶液(购自上海生工生物工程公司)添加至经封闭的酶标板中,于37℃孵育2h后用bsa溶液洗涤三次,然后分别以每孔100μl的添加量将链霉亲和素标记的二抗(ab2,购自上海生工生物工程公司)和实施例4-1中的生物素标记的双信号纳米探针添加至经封闭的酶标板中,于37℃孵育1h后用bsa溶液洗涤三次,得到孵育产物;
122.检测步骤:使用酶标仪检测孵育产物于521nm处的荧光强度后,将测得的荧光强度值线性离差标准化作为y值,以前列腺特异性抗原标准品溶液的浓度作为x值绘制标准曲线,并拟合得到拟合方程y=0.0097x+0.0051(r2=0.995),检测及拟合结果见图8~9。
123.所述根据吸光度值与前列腺特异性抗原浓度之间的关系拟合而得的拟合方程的获得过程如下包括步骤:
124.固定步骤:使用pbs缓冲液(ph 7.4、浓度10mm,购自上海生工生物工程公司)配置浓度为1mg/ml的一抗(ab1,购自上海生工生物工程公司)溶液;以每孔10μl的添加量将一抗溶液添加至96孔酶标板中,于37℃孵育12h,得到固定有一抗的酶标板;
125.封闭步骤:使用pbs缓冲液配置浓度为10%(w/v,g/100ml)的bsa(购自西格玛公司)溶液;以每孔100μl的添加量将bsa溶液添加至96孔酶标板中,于37℃孵育2h后用pbs缓
冲液洗涤,重复此操作两次,得到经封闭的酶标板;
126.孵育步骤:先以每孔50μl的添加量分别将浓度为0、2、10、20、40、60、80、100、120、140ng/ml的前列腺特异性抗原标准品溶液(购自上海生工生物工程公司)添加至经封闭的酶标板中,于37℃孵育2h后用bsa溶液洗涤三次,然后分别以每孔100μl的添加量将链霉亲和素标记的二抗(ab2,购自上海生工生物工程公司)和实施例4-1中的生物素标记的双信号纳米探针添加至经封闭的酶标板中,于37℃孵育1h后用bsa溶液洗涤三次,得到孵育产物;
127.显色步骤:以每孔100μl的添加量将显色底物tmb(购自西格玛公司)添加至孵育产物中静置20min进行显色,得到显色液;
128.检测步骤:使用紫外分光光度计检测显色液于652nm处的吸光度值后,将测得的吸光度值线性离差标准化作为y值,以前列腺特异性抗原标准品溶液的浓度作为x值绘制标准曲线,并拟合得到拟合方程y=0.0356x+0.0294(r2=0.983),检测及拟合结果见图10~11。
129.显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1