一种基于双劈裂功能核酸变构的孔雀石绿生物传感器
1.本发明属于生物传感器领域,具体是一种基于双劈裂功能核酸变构的孔雀石绿生物传感器。
背景技术:
2.孔雀石绿属于人工合成的碱性三苯甲烷类工业染料,因其具有抗菌广谱、杀菌效果好的特点,在水产养殖和运输过程中常作为杀菌剂,用于预防鱼类的烂鳃病、水霉病及寄生虫病等,以使水产品的存活时间延长。孔雀石绿进入鱼类体内后,大部分会迅速发生生物转化作用而形成其还原代谢产物隐性孔雀石绿。由于孔雀石绿及其代谢产物具有高残留、高毒性、致癌、致畸、致突变等毒副作用。因此,欧盟、加拿大、美国及中国均已将其列入水产养殖禁用药物。但由于其价格低廉,对预防烂鳃病和水霉病的效果显著,并且没有更好的替代品出现,因此在鱼类养殖中添加孔雀石绿的情况时有发生,对消费者的健康造成严重威胁。因此,对孔雀石绿及其代谢物的检测方法进行优化,以对该类禁用药物进行准确快速的测定,为鱼类产品质量安全监测提供技术支撑,具有重要意义。
3.核酸适配体是一类能够与靶物质特异性结合的寡核苷酸序列。适配体的筛选主要依靠指数富集进化技术(systematic evolution of ligands byexponential enrichment,selex),即在体外含有随机序列的分子池中选择可与靶物质高亲和性结合的核酸序列,通过靶物质诱导适配体发生构象变化,形成配体络合物,并不断的对配体络合物进行pcr扩增、富集、测序等过程,最终将单个核酸从文库中筛选出来。1990年,ellington和szostak首次通过selex技术体外筛选获得适配体。1999年,grate和wilson通过selex技术筛选出孔雀石绿rna适配体。研究发现,孔雀石绿与其rna适配体结合,可以使自身的荧光强度增加2000多倍。基于孔雀石绿rna适配体的生物传感器已早有报道。2005年,kolpashchikov团队将38nt的孔雀石绿rna适配体劈裂成2个部分,其中一条链长为10nt,另一段链长为16nt,劈裂适配体的碱基数比原适配体碱基数减少了12nt。同时,劈裂适配体减少了与配体结合中不必要的空间位阻,节约了合成成本。而且,劈裂的核酸适配体与靶标仍然具有高亲和力和高效的识别能力,并降低了与靶标类物的亲和力,提高了特异性检测靶标的能力。目前,基于孔雀石绿dna适配体的报道较少。
4.g四链体是由4个鸟嘌呤通过hoogsteen氢键键合形成的高级结构。荧光染料tht可以诱导寡核苷酸序列的四重折叠,其结合在g四链体上会导致荧光增强。后有研究表明,劈裂g四链体也能激发tht荧光。本发明基于g四链体和tht的相互作用以及孔雀石绿与其适配体的相互作用关系构建了一种基于双劈裂功能核酸变构的孔雀石绿生物传感器。体系中孔雀石绿的存在会使传感器的高级结构发生变化,进而影响tht的荧光强度,因此可以将tht作为传感器的输出信号,实现孔雀石绿的简便、快速、低成本和超灵敏检测。
5.与201410008020.3专利相比,本技术不需要电化学的表面修饰,以及电化学工作站对输出信号进行检测;并且本技术用的核酸序列是dna序列,更稳定,价格更低廉,且不需要抗体,简化了实验操作,在均相反应体系中即可实现孔雀石绿的高灵敏度检测;与
201611175306.6专利相比,本技术虽然也用到了相同的dna适配体结合,但是本技术将其劈裂,并证实劈裂之后的适配体与孔雀石绿同样具有亲和性。基于此,将劈裂的dna适配体结合劈裂g四链体构建孔雀石绿的传感器,实现孔雀石绿简便、快速、低成本、超灵敏的检测。
技术实现要素:
6.基于此,本发明的提供一种基于双劈裂功能核酸变构的孔雀石绿生物传感器。
7.一方面,本发明开发一种基于双劈裂功能核酸变构的孔雀石绿生物传感器,主要包括:(1)双劈裂传感器序列;(2)双劈裂功能核酸传感器离子优化;(3)孔雀石绿的检测;
8.所述双劈裂传感器序列是由双劈裂传感器-1和双劈裂传感器-2组成;
9.所述双劈裂传感器-1的序列是5
’‑
gccaggtaacgaatggatcc gggattggg-3’,如seq id no.6所示;
10.所述双劈裂传感器-2的序列是5
’‑
gggttaggg ggatcccgactggc-3’,如seq id no.7所示;
11.所述双劈裂功能核酸传感器离子优化是指对在双劈裂功能核酸传感器的缓冲溶液中优化对g四链体结构有影响的离子浓度;
12.具体的,在双劈裂功能核酸传感器的缓冲溶液10mmol
·
l-1
tris-hcl(ph 6.0)中增加5~50mmol
·
l-1
mg
2+
;
13.优选地,双劈裂功能核酸传感器mg
2+
浓度是30mmol
·
l-1
。
14.所述孔雀石绿的检测是依据双劈裂功能核酸中劈裂g四链体与tht结合的荧光强度受孔雀石绿适配体与待检靶标亲和性的变化;无孔雀石绿时,tht与劈裂g四链体结合产生强荧光,加入孔雀石绿后,诱导双劈裂传感器构象发生转变,g四链体解体,tht荧光降低。
15.所述双劈裂传感器-1和双劈裂传感器-2分别由孔雀石绿dna劈裂适配体和劈裂g四链体结合组成。
16.所述孔雀石绿dna劈裂适配体由劈裂孔雀石绿适配体-1和劈裂孔雀石绿适配体-2组成;
17.所述劈裂孔雀石绿适配体-1:5
’‑
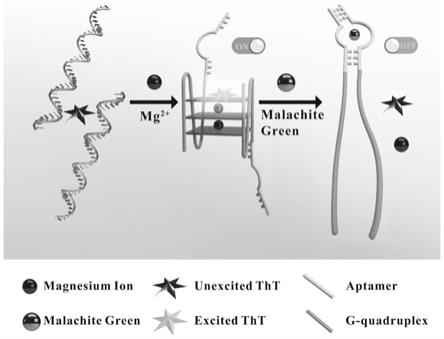
gccaggtaacgaatggatcc-3’,如seq id no.2所示;
18.所述劈裂孔雀石绿适配体-2:5’ggatcccgactggc-3’,如seq id no.3所示。
19.所述劈裂g四链体是由劈裂g四链体-1和劈裂g四链体-2组成;
20.所述劈裂g四链体-1:5
’‑
gggttaggg-3’,如seq id no.4所示;
21.所述劈裂g四链体-2:5
’‑
gggattggg-3’,如seq id no.5所示。
22.另一方面,证明双劈裂功能核酸变构的生物传感器对孔雀石绿的选择性。
23.选用孔雀石绿结构类似物:结晶紫(crystal violet,cv)、亮绿(brilliant green,bg)和隐性孔雀石绿(leucomalachite green,lmg)代替孔雀石用双劈裂功能核酸变构的孔雀石绿生物传感器进行实验,检测440nm处tht的荧光变化。
24.另一方面,双劈裂功能核酸变构的生物传感器对孔雀石绿进行定量检测的方法,具体操作如下:
25.将终浓度为1~2μmol
·
l-1
双劈裂传感器序列和3~6mmol
·
l-1
tht溶于10mmol
·
l-1
tris-hcl缓冲液(5~50mmol
·
l-1
mg
2+
,ph 6.0)中,随后在检测缓冲体系中梯度加入孔雀
石绿,使孔雀石绿的终浓度分别为0,0.005,0.01,0.05,0.1,0.5,1,5,10,15,20,30,40,50,100,500μmol
·
l-1
,室温振荡混匀;利用荧光分光光度计测定440nm处tht的荧光强度,并绘制标准曲线;显示孔雀石绿双劈裂生物传感器在5nmol
·
l-1
~500μmol
·
l-1
范围内具有较好的线性关系,检出限低至4.17nmol
·
l-1
;
26.优选地,将终浓度为1μmol
·
l-1
双劈裂传感器序列和5mmol
·
l-1
tht溶于10mmol
·
l-1
tris-hcl缓冲液(30mmol
·
l-1
mg
2+
,ph 6.0)中,随后在检测缓冲体系中加入孔雀石绿完成检测。
27.另一方面,双劈裂功能核酸变构的生物传感器对含有孔雀石绿实际样品检测,具体操作如下:
28.将鲈鱼样品剁碎,用1~3ml盐酸羟胺(20%)和2~4ml醋酸铵(0.05mol
·
l-1
,ph 4.5)进行均质处理,获得5.0g匀浆。随后在1.0g匀浆中分别加入0.5、25或100μl孔雀石绿(40μmol
·
l-1
)进行加标回收实验,并用1~3ml乙腈处理,超声处理1~10min后再离心(10,000rpm)5min,对上清液信号输出分子tht的荧光强度,荧光激发波长为440nm;
29.优选地,将鲈鱼样品剁碎,用1.5ml盐酸羟胺(20%)和3.5ml醋酸铵(0.05mol
·
l-1
,ph 4.5)进行均质处理,获得5.0g匀浆。随后在1.0g匀浆中分别加入0.5、25或100μl孔雀石绿(40μmol
·
l-1
)进行加标回收实验,并用2ml乙腈处理,超声处理5min后再离心(10,000rpm)5min,对上清液信号输出分子tht的荧光强度,荧光激发波长为440nm。
30.另一方面,双劈裂功能核酸变构的生物传感器在食品安全检测中的应用,以及在孔雀石绿检测试剂盒中的应用。
31.与现有技术相比,本发明的有益效果是:
32.1、本发明基于劈裂g四链体和孔雀石绿dna劈裂适配体构建了孔雀石绿的无标记、荧光、均相生物传感器;
33.2、本发明将原有的孔雀石绿rna适配体转化为dna适配体,并对其劈裂,证明与孔雀石绿同样具有亲和性;
34.3、本发明利用dna序列提升了生物传感器稳定性和应用广泛性,同时还极大程度降低了组装成本;
35.4、本发明提出的孔雀石绿生物传感器能够实现简便、快速、低成本和超灵敏的孔雀石绿检测,具有一定的通用性和产业化潜力;
36.5、本发明提出的孔雀石绿生物传感器在5nmol
·
l-1
~500μmol
·
l-1
范围内具有较好的线性关系,并且最低检出限能够达到4.17nmol
·
l-1
。
附图说明
37.图1为孔雀石绿dna适配体和劈裂适配体与孔雀石绿的亲和性验证。(a)为金纳米粒子结合的比色结果;(b)为孔雀石绿dna适配体与孔雀石绿的亲和性比色结果;(c)为孔雀石绿劈裂适配体与孔雀石绿的亲和性比色结果。
38.图2为不同核酸链的圆二色光谱图。split g4:劈裂g四链体组;split g4-half:劈裂g四链体-1组;split g4-mga:双劈裂传感器;split g4-mga@mg:双劈裂传感器和孔雀石绿组。
39.图3为双劈裂传感器检测孔雀石绿的原理图。
40.图4为双劈裂传感器可行性验证的结果图。(a)为加入不同互补链和孔雀石绿前后双劈裂传感器的荧光光谱图;(b)为加入不同互补链和孔雀石绿前后双劈裂传感器的荧光峰值变化图。其中,f为检测结果荧光值,f0为初始荧光值。
41.图5为双劈裂传感器选择性验证的结果图。
42.图6为双劈裂传感器检测体系离子优化的结果图。(a)为k
+
优化结果图;(b)为mg
2+
优化结果图;(c)为na
+
优化结果图;(d)为pb
2+
优化结果图;(e)为不同离子条件下劈裂g四链体的圆二色光谱图;(f)为k
+
条件下,加入不同浓度孔雀石绿后双劈裂传感器的荧光光谱图;(g)为k
+
条件下,根据荧光变化绘制的标准曲线图。
43.图7为根据双劈裂传感器检测孔雀石绿的结果图。(a)为mg
2+
条件下,加入不同浓度孔雀石绿后双劈裂传感器的荧光光谱图;(b)为mg
2+
条件下,根据荧光变化绘制的标准曲线图。
具体实施方式
44.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
45.实施例1.孔雀石绿适配体的dna转化和劈裂
46.1.孔雀石绿适配体的dna转化
47.目前报道的孔雀石绿适配体为rna适配体,但由于rna易降解、成本高,所以将其序列转化成dna,并通过金纳米粒子(aunps)比色实验验证dna适配体亲和性。其原理为:高盐(nacl)条件下,aunps会受到盐的作用而发生团聚,溶液颜色由红色变成蓝色。核酸可以通过静电作用吸附在aunps表面,对aunps起到保护作用,可使aunps在高盐溶液中不发生聚集而呈红色。基于此,孔雀石绿适配体可以吸附于aunps上,并在高盐条件下稳定aunps;而当体系中存在孔雀石绿时,孔雀石绿会与适配体特异性结合,使适配体从aunps表面脱离,游离的aunps遇盐发生聚集呈蓝色。通过测定溶液525/626nm处的吸光度判断适配体与靶标的亲和性。
48.具体的aunps比色实验步骤如下:
49.5μl孔雀石绿适配体(1μmol
·
l-1
)和5μl不同浓度的孔雀石绿孵育40min,加入100μl柠檬酸盐包被的aunps孵育40min。向体系中加入9μl 0.5mol
·
l-1
氯化钠溶液,孵育15min,拍照并利用酶标仪同时记录溶液525nm和626nm处的吸光度。数据处理利用626和525nm处吸光度的比值表明孔雀石绿适配体的亲和性,分散状态下a525值高,a626值低,即a626/a525值低。
50.实验中用到的孔雀石绿dna适配体序列如seq id no.1所示:5
’‑
ggatcccgact ggcgagagccaggtaacgaatggatcc-3’51.由图1a和b实验结果可知随着孔雀石绿浓度的增加,aunps的颜色由红变蓝,a626/a525 nm逐渐增大。该结果表明,孔雀石绿适配体的dna转化同样具有孔雀石绿识别的特异性。
52.2.孔雀石绿适配体的劈裂
53.实验中用到的孔雀石绿劈裂适配体序列为劈裂孔雀石绿适配体-1和劈裂孔雀石绿适配体-2,其核酸序列分别为seq id no.2和seq id no.3:
54.劈裂孔雀石绿适配体-1:5
’‑
gccaggtaacgaatggatcc-3’(seq id no.2)
55.劈裂孔雀石绿适配体-2:5
’‑
ggatcccgactggc-3’(seq id no.3)
56.孔雀石绿劈裂适配体与孔雀石绿孵育的实验步骤与孔雀石绿dna适配体操作相同,由图1a和c可知,随着孔雀石绿浓度逐渐增大,劈裂适配体组的溶液颜色变深和吸光度比值变大,均说明孔雀石绿劈裂适配体对孔雀石绿仍具有亲和性。并且dna适配体和劈裂适配体与孔雀石绿的亲和性无显著差异。
57.实施例2.g四链体的劈裂
58.实验中用到的劈裂g四链体序列如下:
59.劈裂g四链体-1:5
’‑
gggttaggg-3’(seq id no.4)
60.劈裂g四链体-2:5
’‑
gggattggg-3’(seq id no.5)
61.利用上述劈裂g4链体通过圆二色光谱对其产生g四链体结构的能力进行评估。将10μmol
·
l-1
劈裂g四链体在含5mmol
·
l-1
mg
2+
的tris-hcl缓冲液(ph 6.0)中进行圆二色光谱。在220~340nm范围内,以2nm/s的速率进行3次扫描。
62.结果如图2所示,加入劈裂g四链体的一条核酸链后,圆二色光谱于240nm左右处呈现微弱正峰,260nm左右处为微弱负峰,形成正平行g四链体的能力较弱;加入两条核酸链后,正平行g四链体结构稳定性提升,说明该劈裂g四链体具有形成稳定正平行g四链体的能力。
63.实施例3.双劈裂传感器的构建
64.1.双劈裂传感器的原理
65.双劈裂传感器的原理如图3所示。当体系中不含有孔雀石绿和mg
2+
时,劈裂g四链体无法形成稳定的g四链体结构,tht荧光不能被显著激发。当加入mg
2+
后,稳定正平行g四链体的形成,此时溶液中的tht荧光被显著增强。当体系中含有孔雀石绿时,由于孔雀石绿与其dna劈裂适配体的亲和力大于mg
2+
稳定正平行g四链体的能力,诱导双劈裂传感器实现变构。孔雀石绿与其dna劈裂适配体结合,正平行g四链体发生解构,tht的荧光强度显著下降,根据加入不同浓度孔雀石绿前后的溶液荧光值变化,实现孔雀石绿的定量检测。
66.其中,双劈裂传感器序列seq id no.6和seq id no.7:
67.双劈裂传感器-1:5
’‑
gccaggtaacgaatggatcc gggattggg-3’(seq id no.6)
68.双劈裂传感器-2:5
’‑
gggttaggg ggatcccgactggc-3’(seq id no.7)
69.(加粗部分为劈裂g4,斜体部分为孔雀石绿劈裂适配)
70.2.双劈裂传感器的可行性验证
71.将终浓度为10μmol
·
l-1
的双劈裂传感器在含5mmol
·
l-1
mg
2+
和500μmol
·
l-1
孔雀石绿的tris-hcl缓冲液(ph 6.0)中进行圆二色光谱。结果如图2所示,不加入孔雀石绿时,双劈裂传感器的g四链体部分能够形成极其稳定的正平行g四链体结构;加入孔雀石绿后,发现双劈裂传感器的正平行g四链体结构被破坏。
72.将终浓度为1μmolvl-1
的双劈裂传感器、1μmol
·
l-1
的互补链和5mmol
·
l-1
tht溶于10mmol
·
l-1
tris-hcl缓冲液(30mmol
·
l-1
mg
2+
,ph 6.0),室温振荡混匀。随后利用荧光分光光度计测定该传感器信号输出分子tht的荧光强度,荧光激发波长为440nm。通过比较加入
互补链破坏g四链体结构前后的荧光变化程度判断传感器的可行性。
73.其中,互补链序列seq id no.8和seq id no.9:
74.12nt互补链:5
’‑
ccccctaggccc-3’(seq id no.8)
75.16nt互补链:5
’‑
ccccctagctaggccc-3’(seq id no.9)
76.如图4所示,随着互补链的个数增多,互补链抑制g四链体形成的趋势越明显,荧光值下降越显著,在加入孔雀石绿后,则可进一步破坏g四链体的形成,荧光值相应降低。
77.3.双劈裂传感器的选择性验证
78.选用孔雀石绿的结构类似物:结晶紫(crystal violet,cv)、亮绿(brilliant green,bg)和隐性孔雀石绿(leucomalachite green,lmg)进行验证,具体步骤为:将鲈鱼样品剁碎,用1.5ml盐酸羟胺(20%)和3.5ml醋酸铵(0.05mol
·
l-1
,ph 4.5)进行均质处理,获得5.0g匀浆。随后在1.0g匀浆中分别加入0.5、25或100μl孔雀石绿(40μmol
·
l-1
)进行加标回收实验,并用2ml乙腈处理,超声处理5min后再离心(10,000rpm)5min,对上清液信号输出分子tht的荧光强度,荧光激发波长为440nm。通过比较加入互补链前后的荧光变化程度判断孔雀石绿的结构类似物对孔雀石绿含量测定的影响。
79.如图5所示,加入cv、bg和lmg未能对孔雀石绿的检测结果产生显著影响,表明该孔雀石绿适配体具有较好的选择性。
80.实施例4.双劈裂传感器的反应条件优化
81.将终浓度为1μmol
·
l-1
双劈裂传感器、15μmol
·
l-1
孔雀石绿和5mmol
·
l-1
tht溶于含有不同离子浓度和种类的10mmol
·
l-1
tris-hcl缓冲液(ph 6.0)中,室温振荡混匀。随后利用荧光分光光度计测定该传感器信号输出分子tht的荧光强度,荧光激发波长为440nm。通过比较加入孔雀石绿前后的荧光变化程度判断检测体系的最优离子种类和浓度。其中,离子终浓度和种类分别设定为5,10,20,30,40,50mmol
·
l-1
的k
+
,mg
2+
,na
+
和pb
2+
。
82.通过圆二色光谱对不同离子条件下劈裂g四链体形成g四链体结构的能力进行评估。将10μmol
·
l-1
劈裂g四链体在含100mmol
·
l-1k+
、mg
2+
、na
+
、pb
2+
的tris-hcl缓冲液(ph6.0)中进行圆二色光谱。在220~340nm范围内,以2nm/s的速率进行3次扫描。
83.此外,在k
+
条件下对于已知浓度的孔雀石绿进行检测,依据荧光强度制作标准曲线。将终浓度为1μmol
·
l-1
双劈裂传感器和5mmol
·
l-1
tht溶于10mmol
·
l-1
tris-hcl缓冲液(30mmol
·
l-1k+
,ph 6.0)中,随后在检测缓冲体系中梯度加入孔雀石绿,使孔雀石绿的终浓度分别为0,0.005,0.01,0.05,0.1,0.5,1,5,10,15,20,30,40,50,100,500μmol
·
l-1
;室温振荡混匀。随后利用荧光分光光度计测定该传感器信号输出分子tht的荧光强度,荧光激发波长为440nm,基于最大荧光发射强度处的荧光值绘制标准曲线。
84.如图6所示可知,除了pb
2+
外,其他离子对于检测均产生了相对显著的影响(图6a-d)。据报道,k
+
和na
+
均是稳定g四链体的良好离子配体,因此其可能使g四链体过于稳定,导致孔雀石绿的引入无法触发传感器构象变化。根据不同离子条件下劈裂g四链体的圆二色光谱图可知(图6e),相比于na
+
和pb
2+
体系,mg
2+
形成的正平行g四链体结构最稳定,而k
+
体系中的g四链体并非正平行结构,这可能导致检测的灵敏度降低。因此用k
+
体系中对孔雀石绿进行检测,如图6f和g所示,低浓度孔雀石绿加入时,双劈裂传感器的荧光值并未呈现规律的梯度趋势,其检测限(6.32nmol
·
l-1
)也高于mg
2+
体系的检测限(4.17nmol
·
l-1
),说明k
+
体系的检测灵敏度低,检测范围较窄。此外,mg
2+
作为核酸适配体与靶标结合的良好缓冲介
质,能够提升孔雀石绿检测的灵敏度,扩大检测范围。综合以上结果,实验选用了30mmol
·
l-1
mg
2+
作为检测的最适离子条件。
85.实施例5.双劈裂传感器用于真实样品中孔雀石绿的检测
86.首先,在mg
2+
条件下对于已知浓度的孔雀石绿进行检测,依据荧光强度制作标准曲线。将终浓度为1μmol
·
l-1
双劈裂传感器和5mmol
·
l-1
tht溶于10mmol
·
l-1
tris-hcl缓冲液(30mmol
·
l-1
mg
2+
,ph 6.0)中,随后在检测缓冲体系中梯度加入孔雀石绿,使孔雀石绿的终浓度分别为0,0.005,0.01,0.05,0.1,0.5,1,5,10,15,20,30,40,50,100,500μmol
·
l-1
;室温振荡混匀。随后利用荧光分光光度计测定该传感器信号输出分子tht的荧光强度,荧光激发波长为440nm,基于最大荧光发射强度处的荧光值绘制标准曲线。
87.如图7所示,孔雀石绿双劈裂生物传感器在5nmol
·
l-1
~500μmol
·
l-1
范围内具有较好的线性关系(r2=0.9919),检出限低至4.17nmol
·
l-1
。
88.真实样品加标回收实验中,将鲈鱼样品剁碎,用1.5ml盐酸羟胺(20%)和3.5ml醋酸铵(0.05mol
·
l-1
,ph 4.5)进行均质处理,获得5.0g匀浆。随后在1.0g匀浆中分别加入0.5、25或100μl孔雀石绿(40μmol
·
l-1
)进行加标回收实验,并用2ml乙腈处理,超声处理5min后再离心(10,000rpm)5min,对上清液信号输出分子tht的荧光强度,荧光激发波长为440nm。将测得的荧光值代入标准曲线,计算得到待测样品中孔雀石绿的含量,实现对孔雀石绿的定量检测。
89.如表1所示,基于双劈裂传感器的鲈鱼样品的孔雀石绿加标回收率比较理想,说明该生物传感器能够实现真实样品中的孔雀石绿定量检测。
90.表1基于双劈裂传感器的鲈鱼样品的孔雀石绿加标实验
91.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1