一种用于鉴别抗体检测生物学假阳性的方法
1.本发明属于抗原抗体检测技术领域,具体涉及一种用于鉴别抗体检测生物学假阳性的方法。
背景技术:
2.梅毒由苍白梅毒螺旋体(treponema pallidum,tp)引起,是当今世界,特别是高收入国家的一个重要公共卫生问题。当前,虽然可以通过直接检测tp从而为梅毒的诊断提供依据,但在临床上往往难以获得合适的病原检测样本。因此,梅毒血清学试验(包括密螺旋体和非密螺旋体血清学试验),仍然是诊断和管理梅毒的首选方法。其中,非密螺旋体试验通常用于梅毒筛查和监测梅毒的治疗疗效,这种方法对梅毒的筛查属于非特异性的,导致临床上的某些疾病患者样本(如老年群体、肿瘤、孕妇、自身免疫性疾病、感染性疾病等)也容易出现生物学假阳性反应,从而容易误导临床医生。梅毒螺旋体血清学试验则主要用于梅毒的筛查和确认,检测对象为梅毒螺旋体特异性抗体,用于检测的抗原为苍白梅毒螺旋体菌体或纯化的天然抗原,由于梅毒螺旋体菌种繁殖成本较高,特异性抗原提纯困难、产量低等原因,导致其特异性检测试剂的规模化应用受到了限制。
3.结核病(tuberculosis,tb)在我国是一个非常严重的公共卫生问题。结核分支杆菌 (mycobacterium tuberculosis,mtb)是结核病的主要致病菌。快速、准确的诊断结核分枝杆菌(mtb)感染,对于结核病的控制具有重要意义。然而,目前mtb的血清学检测也容易出现生物学假阳性的问题。
4.当前,用于实验诊断的病原体靶抗原一般有四种:天然抗原、纯化抗原、基因工程抗原和人工合成抗原。四种抗原中只有天然抗原保持着病原体靶抗原的天然结构,用于检测的抗体均为特异性抗体,其它三种抗原则都属于非病原体靶抗原的天然结构,用于检测抗体时,特异性会受到一定的影响。因此,建立高效的特异性抗原筛选方法对于临床医学病原学检测具有重要的意义。随着生物技术的发展,目前基因工程抗原已经代替了天然抗原用于临床梅毒等特异性血清学的检测实验,并建立了诸如酶联免疫吸附法(elisa)、免疫层析法 (immunochromatography)、化学发光免疫法(chemiluminescence immunoassay,clia)、化学发光微粒子免疫法(chemiluminescent microparticle immunoassay,cmia)等可自动化操作的检测技术,并且实验的灵敏度也在不断地提高,方便了临床的规模化筛查。但是,随着高灵敏性检测技术在临床医学中的广泛使用,样本检测出现生物学假阳性的问题也不断涌现,从而严重影响了临床医生对疾病诊断的判断。造成上述问题的主要原因在于基因工程抗原在复性过程中会形成非特异性反应位点,或者是抗原在纯化过程中造成了蛋白质高级结构的改变,最终形成了假阳性反应。
5.因此,有必要设计一套解决临床样本生物学假阳性,即非特异性反应的变性基因工程抗原免疫技术。
技术实现要素:
6.为了克服上述现有技术的不足,本发明公开了一种用于鉴别抗体检测生物学假阳性的方法,将多种变性抗原和非变性抗原同时成对线性或点状包被在载体上,然后通过免疫实验检测相应的特异性抗体,即可用于鉴别抗体的生物学假阳性。
7.为实现上述目的,本发明所采用的技术方案为:
8.一种用于鉴别抗体检测生物学假阳性的方法,该方法包括以下步骤:
9.s1、将多种抗原分别溶解于含有蛋白质二硫键还原剂的变性缓冲液中,经过高温水浴后离心收集上清,制备得到处理抗原;再将相同的抗原分别溶解于不含蛋白质二硫键还原剂的缓冲液中,经过离心后收集上清,制备得到非处理抗原;
10.s2、将步骤s1的抗原上清按照相同种类以处理抗原和非处理抗原成对线性或点状包被在固相载体上,制备包被抗原的固相载体;
11.s3、包被抗原的固相载体经过1%脱脂奶粉封闭后,剪裁成抗原检测条;
12.s4、用免疫印迹工作液浸湿抗原检测条后,加入待测抗体样本,经孵育、洗涤、加酶标二抗、洗涤、显色后观察结果;
13.s5、结果判读:非处理抗原和处理抗原均阳性,说明样本中有针对包被抗原的特异性抗体存在;非处理抗原阳性,处理抗原阴性,说明样本中有针对包被抗原的非特异性抗体存在,即存在生物学假阳性;非处理抗原和处理抗原均阴性,说明样本中没有针对该包被抗原的特异性抗体存在。
14.基因工程抗原表达的是蛋白质的一级结构(氨基酸序列),复性后的抗原为非天然结构,存在非特异性免疫反应位点,本发明利用蛋白质二硫键还原剂打开基因工程抗原的二级或三级结构,使其恢复为蛋白质一级结构,以氨基酸序列特异性抗原决定簇作为靶点,检测特异性抗体,并与非解链处理的抗原成对比对检测,从而鉴别假阳性反应。因为蛋白质一级结构氨基酸序列产生的特异性抗原决定簇是天然结构,为特异性的,检测到的抗体也一定是特异性抗体!而复性后的抗原二级结构或三级结构一定不是天然结构,会出现错误折叠,造成生物学假阳性反应。
15.优选地,所述含有蛋白质二硫键还原剂的变性缓冲液和不含蛋白质二硫键还原剂的缓冲液中,所采用的缓冲液均为ph8.0,且浓度为0.025m的tris-hcl缓冲液。
16.优选地,所述蛋白质二硫键还原剂包括β-巯基乙醇、二硫苏糖醇、三(2-氯乙基)磷酸酯。
17.优选地,所述蛋白质二硫键还原剂在变性缓冲液中的浓度为0.1%。
18.优选地,所述高温水浴为100℃水浴3-5分钟。
19.优选地,所述待测抗体包括梅毒抗体和结核抗体。当然,其他疾病的待测抗体同样适用于本发明。
20.优选地,所述固相载体包括nc膜、pvdf膜、玻片、有机塑料片、硅片。具体地,所述固相载体为nc膜。
21.优选地,所述待测抗体样本包括抗体血清或脑脊液,所述抗体血清或脑脊液的加入量为 10-20ul。
22.优选地,步骤s1中,各抗原在含有蛋白质二硫键还原剂的变性缓冲液和不含蛋白质二硫键还原剂的缓冲液中的终浓度均为0.5-1.0mg/ml。
23.优选地,所述1%脱脂奶粉为含1%脱脂奶粉的0.05m pbs缓冲液,缓冲液的ph=7.4。
24.优选地,1%脱脂奶粉的封闭时间为1-2小时。
25.优选地,所述抗原检测条的宽度为2-3mm。具体地,所述抗原检测条的宽度为2.5mm。
26.优选地,孵育、洗涤、加酶标二抗、洗涤、显色这些步骤为常规免疫印迹方法,具体为:
27.(1)孵育:将多抗原膜条置于反应槽中,每槽加1ml工作液浸湿膜条后,加入待测抗体样本10-20ul,置于摇摆平台上,室温孵育60分钟。
28.(2)洗涤:弃去槽中的液体,并在吸水纸上轻轻扣干,再加入工作液,置于摇摆平台摇动洗涤3次,每次每槽1ml,每次1分钟。
29.(3)加酶标二抗:用加样器往每槽准确加入1ml工作液,再加入特定酶标二抗,置于摇摆平台上,室温孵育30分钟。
30.(4)洗涤:同(2)。即,弃去槽中的液体,并在吸水纸上轻轻扣干,再加入工作液,置于摇摆平台摇动洗涤3次,每次每槽1ml,每次1分钟。
31.(5)显色:每槽加入1ml即用显色剂,充分摇匀,室温孵育5分钟,弃去槽中的液体,用0.05m pbs缓冲液(ph=7.4)漂洗2次,弃去液体,在槽中观察结果即可。
32.本发明还提供了一种用于鉴别抗体检测生物学假阳性的试剂盒,所述试剂盒包括抗原检测条,所述抗原检测条由包被抗原的固相载体剪裁而成,所述抗原检测条上包括处理抗原和非处理抗原,所述处理抗原和非处理抗原成对线性或点状包分布,所述处理抗原为经含有蛋白质二硫键还原剂的变性缓冲液高温水浴后的抗原,所述非处理抗原为经不含蛋白质二硫键还原剂的缓冲液处理后的抗原。
33.优选地,所述含有蛋白质二硫键还原剂的变性缓冲液和不含蛋白质二硫键还原剂的缓冲液中,所采用的缓冲液均为ph8.0,且浓度为0.025m的tris-hcl缓冲液;所述蛋白质二硫键还原剂包括β-巯基乙醇、二硫苏糖醇、三(2-氯乙基)磷酸酯;所述蛋白质二硫键还原剂在变性缓冲液中的浓度为0.1%。
34.优选地,所述高温水浴为100℃水浴3-5分钟。
35.优选地,所述固相载体包括nc膜、pvdf膜、玻片、有机塑料片、硅片。
36.优选地,所述抗原检测条为包被抗原的固相载体经过1%脱脂奶粉封闭1小时后剪裁而成。
37.优选地,所述试剂盒还包括常规免疫印迹所用到的试剂。
38.上述试剂盒的使用方法为:
39.1)将抗原检测条置于反应槽中,每槽加1ml工作液浸湿膜条后,加入待测抗体样本 10-20ul,置于摇摆平台上,室温孵育60分钟。
40.2)洗涤:弃去槽中的液体,并在吸水纸上轻轻扣干,再加入工作液,置于摇摆平台摇动洗涤3次,每次每槽1ml,每次1分钟。
41.3)酶标抗体的孵育:用加样器往每槽准确加入1ml工作液,再加入特定酶标二抗,置于摇摆平台上,室温孵育30分钟。
42.4)洗涤:同步骤5。
43.5)显色及终止:每槽加入1ml即用显色剂,充分摇匀,室温孵育5分钟,弃去槽中的液体,用0.05m pbs缓冲液(ph=7.4)漂洗2次,弃去液体,在槽中观察结果即可。
44.6)结果判读:
45.a:非处理抗原和处理抗原均阳性,说明样本中有针对包被抗原的特异性抗体存在。
46.b:非处理抗原阳性,处理抗原阴性,说明样本中有针对包被抗原的非特异性抗体存在,即存在生物学假阳性。
47.c:非处理抗原和处理抗原均阴性,说明样本中没有针对该包被抗原的特异性抗体存在。
48.与现有技术相比,本发明的有益效果是:
49.本发明公开了一种用于鉴别抗体检测生物学假阳性的方法,将多种变性抗原和非变性抗原同时成对线性或点状包被在载体上,然后通过免疫实验检测相应的特异性抗体,即可用于鉴别抗体的生物学假阳性。本发明方法可同时用于鉴别多种抗原的非特异性反应,并可检测特异性抗体的免疫反应,避免生物学假阳性对临床血清学检测的影响,具有重要的临床应用价值。
附图说明
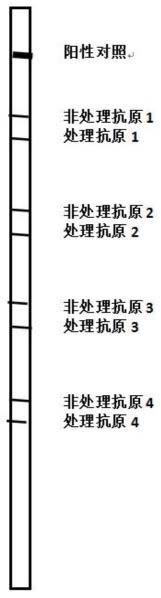
50.图1为抗原线性包被模式图;
51.图2为梅毒抗体检测结果的判读模式图(a.非处理抗原和处理抗原均阳性;b.非处理抗原阳性,处理抗原阴性;c.部分处理抗原阴性,或非处理抗原和处理抗原均阴性);
52.图3为梅毒抗原线性包被模式图;
53.图4为梅毒抗体检测的结果判读模式图(a.非处理抗原和处理抗原均阳性;b.非处理抗原阳性,处理抗原阴性;c.部分处理抗原阴性,或非处理抗原和处理抗原均阴性);
54.图5为梅毒抗体检测结果的实例图(1、2号样本为梅毒阳性样本;3、4、5、6、7、8、 10、11、13、15、16号样本为梅毒阴性样本;9号为tp45抗原假阳性样本;12号为tp17抗原假阳性样本;14号为tp45、tp17抗原假阳性样本);
55.图6为结核抗原线性包被模式图;
56.图7为结核抗体检测结果的判读模式图(a.非处理抗原和处理抗原均阳性;b.非处理抗原阳性,处理抗原阴性;c.部分处理抗原阴性,或非处理抗原和处理抗原均阴性);
57.图8为结核病人的血清检测结果;
58.图9为自身免疫病人的血清检测结果;
59.图10为老年人组血清的检测结果;
60.图11为儿童组血清的检测结果。
具体实施方式
61.下面对本发明的具体实施方式作进一步说明。在此需要说明的是,对于这些实施方式的说明用于帮助理解本发明,但并不构成对本发明的限定。此外,下面所描述的本发明各个实施方式中所涉及的技术特征只要彼此之间未构成冲突就可以相互组合。
62.下述实施例中的实验方法,如无特殊说明,均为常规方法,下述实施例中所用的试
验材料,如无特殊说明,均为可通过常规的商业途径购买得到。
63.实施例1抗体检测生物学假阳性鉴别方法的建立
64.(1)抗原处理:将多种抗原分别溶解于变性缓冲液(即浓度为0.025m、且ph=8.0的 tris-hcl缓冲液,含0.1%蛋白质二硫键还原剂,所述还原剂选自β-巯基乙醇、二硫苏糖醇或三(2-氯乙基)磷酸酯等)中,抗原的终浓度为0.5-1.0mg/ml,经100℃水浴3-5分钟、10000rpm 离心后取上清备用(为处理抗原);再将相同的抗原分别溶解于浓度为0.025m、且ph=8.0 的tris-hcl缓冲液中,抗原终浓度为0.5-1.0mg/ml,10000rpm离心后取上清备用(为非处理抗原)。
65.(2)将上述抗原按照相同种类以非处理抗原和处理抗原成对线性(或点状)包被在载体上(以nc膜为例),如图1所示。
66.(3)将包被抗原的nc膜用含1%脱脂奶粉的0.05m pbs缓冲液(ph=7.4)封闭1小时,然后裁成2.5mm宽的检测用抗原膜条,备用。
67.(4)待测标本的孵育:将抗原膜条置于反应槽中,每槽加1ml工作液【0.5%脱脂奶粉的0.05m pbs缓冲液(ph=7.4)】浸湿膜条后,加入待测抗体样本10-20ul,放于摇摆平台上,室温孵育60分钟。
68.(5)洗涤:弃去槽中的液体,并在吸水纸上轻轻扣干,再加入工作液,置于摇摆平台上摇动洗涤3次,每次每槽1ml,每次1分钟。
69.(6)酶标抗体的孵育:用加样器往每槽准确加入1ml工作液,再加入即用酶标二抗,置于摇摆平台上,室温孵育30分钟。
70.(7)洗涤:同步骤5。
71.(8)显色及终止:每槽加入1ml即用显色剂【0.01%4-氯-1奈酚的0.05m pbs缓冲液 (ph=7.4)】,充分摇匀,室温孵育5分钟,弃去槽中的液体,用0.05m pbs缓冲液(ph=7.4) 漂洗2次,弃去液体,在槽中观察结果即可。
72.(9)结果判读:如图2所示:
73.a:非处理抗原和处理抗原均阳性,说明样本中有针对包被抗原的特异性抗体存在。
74.b:非处理抗原阳性,处理抗原阴性,说明样本中有针对包被抗原的非特异性抗体存在,即存在生物学假阳性。
75.c:非处理抗原和处理抗原均阴性,说明样本中没有针对该包被抗原的特异性抗体存在。
76.实施例2一种用于鉴别临床梅毒抗体检测生物学假阳性的方法
77.按照实施例1建立的抗体检测生物学假阳性鉴别方法鉴别临床梅毒抗体检测生物学假阳性,具体方法包括以下步骤:
78.(1)购置目前世界上公认的临床梅毒特异性抗体诊断所用四种基因工程抗原:tp47、 tp45、tp17、tp15(购于厦门英博迈生物科技有限公司,但不同供应商产品可能有不同的命名),-20℃保存备用。
79.(2)基因工程抗原处理:将上述四种基因工程抗原分别溶解于变性缓冲液中(即浓度为 0.025m、且ph=8.0的tris-hcl缓冲液,含0.1%β-巯基乙醇),抗原的终浓度为0.5-1.0mg/ml,经过100℃水浴3-5分钟、10000rpm离心后取上清备用(为处理抗原);将上述四种
相同的基因工程抗原分别溶解于0.025m tris-hcl缓冲液(ph=8.0)中,抗原的终浓度为0.5-1.0mg/ml, 10000rpm离心后取上清备用(为非处理抗原)。
80.(3)将上述四种抗原按照相同种类以非处理抗原和处理抗原成对线性包被在载体nc膜上,如图3所示,。
81.(4)将包被抗原的nc膜用含1%脱脂奶粉的0.05m pbs缓冲液(ph=7.4)封闭1小时,然后裁成2.5mm宽检测用的抗原膜条,备用。
82.(5)待测标本的孵育:将抗原膜条置于反应槽中,每槽加1ml工作液浸湿膜条后,加入临床待测样本(患者血清或脑脊液,来源于本院实验室的样本库)10-20ul,置于摇摆平台上,室温孵育60分钟。
83.(6)洗涤:弃去槽中的液体,并在吸水纸上轻轻扣干,再加入工作液,置于摇摆平台摇动洗涤3次,每次每槽1ml,每次1分钟。
84.(7)酶标抗体的孵育:用加样器往每槽中准确加入1ml工作液,加入即用酶标二抗(抗人igg或抗人igm酶标二抗),置于摇摆平台上,室温孵育30分钟。
85.(8)洗涤:同步骤6。
86.(8)显色及终止:每槽加入即用显色剂1ml,充分摇匀,室温孵育5分钟,弃去槽中的液体,用0.05m pbs缓冲液(ph=7.4)终止漂洗2次,弃去液体,在槽中观察结果即可。
87.10、结果判读:如图4和5所示,该出结果判读如下:
88.a:非处理抗原和处理抗原均阳性,说明样本中有针对包被抗原的特异性抗体存在,即样本中有梅毒tp47、tp45、tp17、tp15抗原的特异性抗体。
89.b:非处理抗原阳性,处理抗原阴性,说明样本中有针对包被抗原的非特异性抗体存在,即出现的梅毒tp47、tp45、tp17、tp15抗原的抗体为生物学假阳性。
90.c:非处理抗原和处理抗原均阴性,说明样本中没有针对该包被抗原的特异性抗体存在,该抗原的抗体为阴性。若出现只有阳性对照条带,其余条带均不出现,此样本为梅毒阴性样本。
91.实施例3一种用于鉴别临床结核抗体检测生物学假阳性的方法
92.(1)将tb4、ce85c(一种结核分枝杆菌的分泌蛋白)、l88a(是结核分枝杆菌的 cfp10+38kd+48kd三个抗原融合表达的片段)、mtb8(即rv0379,结核分枝杆菌的转铁蛋白) 这四种抗原分别溶解于变性缓冲液(即浓度为0.025m、且ph=8.0的tris-hcl缓冲液,含0.1%β-巯基乙醇)中,抗原的终浓度为0.5-1.0mg/ml,经100℃水浴3-5分钟、10000rpm离心后取上清备用(为处理抗原);将四种相同的抗原分别溶解于0.025m tris-hcl缓冲液(ph=8.0) 中,抗原的终浓度为0.5-1.0mg/ml,10000rpm离心后取上清备用(为非处理抗原)。
93.(2)将以上四种抗原按照相同种类以非处理抗原和处理抗原成对线性包被在载体nc膜上(如图6所示)。
94.(3)将包被抗原的nc膜用含1%脱脂奶粉的0.05m pbs缓冲液(ph=7.4)封闭1小时,然后裁成2.5mm宽检测用的抗原膜条,备用。
95.(4)将抗原膜条置于反应槽中,每槽加1ml工作液浸湿膜条后,加临床待测样本【结核病组,非结核疾病组(自身免疫病人血清),健康组的血清(老年人血清和儿童血清)样本,所有样本均来源于本院实验室的样本库】10-20ul,置于摇摆平台上,室温孵育60分钟。
96.(5)洗涤:弃去槽中的液体,并在吸水纸上轻轻扣干,再加入工作液,置于摇摆平台
上摇动洗涤3次,每次每槽1ml,每次1分钟。
97.(6)酶标抗体的孵育:用加样器往每槽准确加入1ml工作液,加入即用酶标二抗(抗人igg酶标二抗),置于摇摆平台上,室温孵育30分钟。
98.(7)洗涤:同步骤5。
99.(8)显色及终止:每槽加入1ml显色剂,充分摇匀,室温孵育5分钟,弃去槽中的液体,用0.05m pbs缓冲液(ph=7.4)终止漂洗2次,弃去液体,在槽中观察结果即可。
100.(9)结果判读:如图7-11所示,给出的结果判读说明如下:
101.a:非处理抗原和处理抗原均阳性,说明样本中有针对包被抗原的特异性抗体存在,即样本中有结核tb4、ceb5c、l88a、mtb8抗原的特异性抗体。
102.b:非处理抗原阳性,处理抗原阴性,说明样本中有针对包被抗原的非特异性抗体存在,即出现的结核tb4、ceb5c、l88a、mtb8抗原的抗体为生物学假阳性。
103.c:非处理抗原和处理抗原均阴性,说明样本中没有针对该包被抗原的特异性抗体存在,该抗原的抗体为阴性。若出现只有阳性对照条带,其余条带均不出现,此样本为结核抗体阴性样本。
104.以上对本发明的实施方式作了详细说明,但本发明不限于所描述的实施方式。对于本领域的技术人员而言,在不脱离本发明原理和精神的情况下,对这些实施方式进行多种变化、修改、替换和变型,仍落入本发明的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1