一种检测样品中多聚泛素化信号的检测方法
1.本发明属于生物技术领域,涉及一种检测泛素链信号的方法。
背景技术:
2.蛋白质的泛素化修饰(ubiquitination)是一种高度保守且过程可逆的翻译后修饰。在泛素化修饰形成过程中,泛素经由泛素活化酶e1,泛素结合酶e2和泛素连接酶e3的级联酶促反应,通过其c末端的甘氨酸羧基与蛋白质底物的赖氨酸ε-氨基共价连接。泛素本身含有的7个赖氨酸(lys6,lys11,lys27,lys29,lys33,lys48和lys63)以及其n端的蛋氨酸(m1)可以继续被泛素分子共价修饰,形成8种不同连接方式的多聚泛素链。不同连接方式的泛素链具有不同的空间拓扑结构,可以被不同的泛素结合蛋白所识别进而介导不同的生物学功能。如最经典的k48链主要介导底物被26s蛋白酶体降解;k63泛素链则主要参与溶酶体的胞内运输、细胞内信号传导和dna修复等非降解过程;非经典的线性泛素链(m1 chain)主要参与nf-κb激酶的激活等过程;k11泛素链引导内质网相关的蛋白质降解和细胞周期调控等过程。泛素化修饰纷繁复杂的结构特征与功能的多样性构成了精密的调控语言,称之为“泛素密码”。如何能够高效灵敏地检测泛素化蛋白上的泛素链信号具有重要的技术和应用需求。
3.多聚泛素链信号可以被细胞内的泛素化系统识别并传递,进而将修饰底物引导到蛋白酶体降解或者其他细胞器发挥功能。泛素化修饰功能的发挥依赖于信号重要传递者——含有泛素结合结构域(ubiquitin binding domain,ubd)的蛋白质。研究表明在人的蛋白质组中存在250多个包含有ubd的泛素受体蛋白。根据其生化与结构特征可分为16类,ubd种类与结构的多样性决定了其与泛素结合的亲和力的多样性和特异性。不同的ubd结合泛素单体的能力存在很大差异,其解离常数(kd)从2到750μm不等,ubd与泛素的识别机制决定了ubd与泛素及泛素链的结合能力与特异性。
4.利用人工表达泛素结合结构域ubd亲和纯化泛素化蛋白质成为有效的方法。hjerpe等发现4个串联的uba泛素结合结构域与泛素链的结合能力明显提高,而且能够保护多聚泛素化修饰,避免其被蛋白酶体降解及去泛素化酶的作用。hikaru等改造ub-prot并结合酶切技术实现对泛素链长度与种类的分析。shi等利用4个串联的uba泛素结合结构域成功地从哺乳动物细胞中富集到许多原先未鉴定到的泛素化蛋白质。这些报道中均使用了单一的uba结构域,在大规模泛素化蛋白质富集过程中,会根据所选择的泛素结合结构域的特性对不同泛素链修饰底物进行富集。高媛和李衍常等系统评价了不同ubd对泛素链的亲和能力与结合偏性,选择性组合不同的泛素结合结构域,构建了人工杂种蛋白,发展了高效、无偏性的串联杂合泛素结合结构域(tandem hybrid ubiquitin binding domain,thubd),实现对细胞或组织样本的内源泛素化蛋白的高效无偏性富集。申请号为201410323921.1的中国专利申请公开了该人工构建的杂种泛素结合结构域多肽及其应用。
5.然而,泛素链的有效检测还存在诸多挑战。目前,蛋白质免疫印迹法(即western blot),是分子生物学、生物化学和免疫遗传学中常用的检测手段,其原理是通过特异性抗
体对凝胶电泳处理过的蛋白样品或生物组织样品中靶标蛋白进行孵育结合,通过分析着色的位置和着色深度获得特定蛋白质的表达情况。目前,生物样品内源的泛素化修饰检测主要依赖于泛素抗体识别泛素的特定序列。由于抗体是通过泛素序列中的抗原表位识别泛素分子,因此抗原表位的充分暴露成为了抗体识别泛素的先决条件。同时,由于不同的泛素链具有不同的空间结构,其中k63和m1链的结构是充分舒展的,k6,k11,k27,k33,k48链的结构是比较紧密的,k29链的空间舒展程度介于k63和k48之间。不同的空间拓扑结构,导致不同类型的泛素链中泛素抗原表位的暴露程度不同,泛素分子的抗原表位被包埋则会降低泛素抗体的识别效率,具体表现就是泛素抗体对泛素链的识别存在偏好性。由此造成的问题是利用泛素抗体无法真实的反映样本中泛素化信号的强度。目前,缺乏能够区分开单泛素化修饰和多聚泛素链修饰的检测方法,现有的泛素抗体检测泛素链的灵敏度、无偏性和准确性有待提高。
6.far-western blotting技术是一种基于western blotting的分子生物学方法,可以用来检测蛋白-蛋白之间的相互作用。并将该策略命名为tuf-wb,后续的研究中发明人发现tuf-wb的检测灵敏度高度依赖于标签抗体的质量,为了进一步提升技术的稳定性,cn201910491358.1利用与8种泛素链具有高亲和能力、且无偏性的泛素蛋白结合结构域(thubd)作为诱饵蛋白,结合far-western blotting技术,实现高灵敏无偏性检测细胞或组织内源蛋白泛素化修饰。
7.但上述检测方法依然存在检测灵敏度低,流程稳定性差,且检测所需时间较长的缺陷。
技术实现要素:
8.本发明的目的是建立一种快速、高效、灵敏且特异的泛素化修饰检测方法,实现对生物样本内源所有泛素链信号的高灵敏度、无偏性的识别与检测。
9.本发明用马来酰亚胺活化酯连接的辣根过氧化物酶(hrp)与thubd上gst标签的半胱氨酸巯基进行反应,发展了hrp化学标记的thubd(thubd-hrp)。thubd上的hrp可以直接用于信号显示,相对于最初的tuf-wb策略相比,本化学标记策略提高了实验流程的稳定性、缩短了实验时间同时也显著提升了对于泛素化信号的检测灵敏度。在此基础上,利用同样的原理,开发了一种荧光素标记的thubd(thubd-flu),可用于泛素化信号的直接成像和可视化,具有较高的灵敏度和准确性,实现对细胞内源性泛素化信号的定位与定量,为泛素化基础研究提供有效的检测工具。
10.本实验室自主开发的串联杂种泛素蛋白结合结构域(tandem hybrid ubiquitin binding domain,thubd),可以实现对所有赖氨酸连接8种泛素链的无偏性高效识别,比天然的泛素蛋白结合结构域具有更强的识别能力。thubd的n末端含有gst标签,通过其与辣根过氧化物酶或荧光素连接,可以高效地检测内源蛋白泛素化修饰。与tuf-wb策略相比,简化了实验流程,显著缩短了实验的操作时间,并且可以高效、灵敏且特异的检测泛素化修饰,并有望实现对泛素化修饰的高效检测。
11.根据本发明,一种检测样品中多聚泛素化信号的检测方法,包括下述步骤:
12.1)提供待测样品;
13.2)将待测样品与至少一种包含杂合泛素结合结构域多肽的检测试剂接触;
14.3)获得可读取的检测结果;
15.其中步骤1)所述待测样品为石蜡包埋组织样品,或原位组织细胞;
16.步骤2)所述包含杂合泛素结合结构域多肽的检测试剂为下述之一:
17.a.与化学标记物连接的杂合泛素结合结构域多肽;或
18.b.与荧光标记物连接的杂合泛素结合结构域多肽。
19.本发明所述的检测方法,其中步骤2)所述的检测试剂为与辣根过氧化物酶连接的杂合泛素结合结构域多肽。
20.本发明所述的检测方法,其中步骤2)所述的检测试剂为与荧光素连接的杂合泛素结合域结构多肽。
21.本发明所述的检测方法,其中优选的是所述杂合泛素结合结构域多肽与一谷胱甘肽-s-转移酶标签连接,并通过一活性化学反应基团与3-4分子的化学标记物或荧光标记物连接。
22.本发明所述的检测方法,其中所述活性化学反应基团可以选自碘乙酰胺、苄基卤化物和溴甲基酮等,或可与蛋白或多肽中半胱氨酸、活性氨基反应的化学基团,更优选的是马来酰亚胺。
23.根据本发明的一个优选实施方式,本发明所述的检测方法应用于细胞中多聚泛素化信号的原位荧光检测,包括下述步骤:
24.a)提供培养细胞作为待测样品;
25.b)将步骤a)的待测样品与包含杂合泛素结合结构域多肽的检测试剂接触,所述检测试剂为与荧光标记物连接的杂合泛素结合结构域多肽;
26.c)将步骤b)的细胞进行荧光信号检测,获得检测结果。
27.更优选的是,本发明所述的方法包括下述步骤:
28.a)培养细胞至合适的密度;
29.b)以步骤a)获得的细胞,进行4%多聚甲醛固定和0.5%tritonx-100打孔;
30.c)将步骤b)的细胞进行5%bsa封闭;
31.d)将步骤c)的细胞与所述的检测试剂进行孵育结合;
32.f)将步骤d)的细胞进行荧光信号检测。
33.根据本发明的另一个具体实施方式,本发明所述的方法应用于石蜡包埋样品或组织细胞中多聚泛素化信号的原位检测,包括下述步骤:
34.a)提供石蜡切片作为待测样品;
35.b)将步骤a)的待测样品与包含杂合泛素结合结构域多肽的检测试剂接触,所述检测试剂为与辣根过氧化物酶连接的杂合泛素结合结构域多肽;
36.c)将步骤b)的切片显色并读取信号,获得检测结果。
37.更优选的是,本发明所述的检测方法包括下述步骤:
38.a)石蜡切片进行脱蜡与封闭:二甲苯ⅰ、ⅱ,梯度酒精:100%,95%,80%,70%处理;3%h2o2封闭内源性过氧化物酶,蒸馏水清洗;
39.b)将步骤a)中的切片进行抗原修复:将切片置于10mm ph 6.0的枸橼酸钠缓冲液中,于微波炉中加热沸腾加热,滴加5%bsa封闭,滴加所述的检测试剂孵育;
40.c)将步骤b)中切片pbs清洗3次,dab显色;自来水充分冲洗,苏木素复染15-20秒,
自来水冲洗返蓝;
41.d)梯度酒精:80%,95%,100%脱水处理,二甲苯透明:ⅰ、ⅱ二甲苯;
42.f)中性树脂封片,显微镜观察,检测信号强度。
43.根据本发明的另一方面,提供泛素结合结构域多肽在制备检测试剂中的应用,其中所述检测试剂用于石蜡包埋组织样品或原位组织细胞中的多聚泛素化信号的检测;所述泛素结合结构域多肽为人工构建的杂合泛素结合结构域多肽,选自:
44.a.与化学标记物连接的杂合泛素结合结构域多肽;或
45.b.与荧光标记物连接的杂合泛素结合结构域多肽。
46.根据本发明的再一方面,提供一种检测试剂盒,包括至少一种包含杂合泛素结合结构域多肽的检测试剂,所述包含杂合泛素结合结构域多肽的检测试剂为下述之一:
47.a.与化学标记物连接的杂合泛素结合结构域多肽;或
48.b.与荧光标记物连接的杂合泛素结合结构域多肽。
49.本发明所利用的杂合泛素结合结构域多肽为人工构建表达的杂种泛素结合结构域多肽(thubd),n端带有gst标签蛋白。
50.本发明所利用的杂种泛素结合结构域多肽,具体由至少两个泛素结合结构域串联而成;且在组成所述杂种泛素结合结构域多肽的所有泛素结合结构域中,至少有两个泛素结合结构域是不同的。
51.进一步,所述杂种泛素结合结构域多肽如下(a)或(b):
52.(a)由至少两个(如两个)不同的泛素结合结构域串联而成;
53.(b)由至少两个相同的或不同的杂种泛素结合结构域单元串联而成;所述杂种泛素结合结构域单元由至少两个(如两个)不同的泛素结合结构域串联而成。
54.所述泛素结合结构域具体可选自如下现有的16类泛素结合结构域(ubd):uba结构域、uim结构域、paz结构域、miu结构域、cue结构域、gat结构域、ubz结构域、ubc结构域、uev结构域、ubm结构域、nzf结构域、ubpznf结构域、znf-a20结构域、glue结构域、jab1/mpn结构域和pfu结构域。
55.在本发明中,所利用的杂种泛素结合结构域多肽具体如下:
56.由两个相同的杂种泛素结合结构域单元串联而成。杂种泛素结合结构域单元:来自于酵母的dsk2p蛋白的uba结构域,以及来自于人类的ubqln2蛋白的uba结构域;
57.本发明所利用的杂种泛素结合结构域多肽,为在所述杂种泛素结合结构域多肽上连接标签蛋白后得到的多肽(既可为氨基端连接,也可为羧基端连接);
58.所述标签蛋白为能够进行化学标记的标签蛋白或活性氨基酸;
59.所述标签蛋白具体可选自如下现有蛋白标签:谷胱甘肽-s-转移酶(gst)标签、his标签、flag标签、ha标签、myc标签、麦芽糖结合蛋白(mbp)标签、t7标签、纤维素结合域(cbd)标签、钙调蛋白标签。
60.在本发明中,所利用的标签蛋白为谷胱甘肽-s-转移酶(gst)标签。
61.所述活性化学反应基团具体选自如下:碘乙酰胺、马来酰亚胺、苄基卤化物和溴甲基酮等,可与蛋白或多肽中的半胱氨酸反应的反应基团;
62.所述标签蛋白为能够进行化学检测的荧光素或者化学酶促发光蛋白,包括荧光蛋白、不同波长的荧光素、辣根过氧化物酶等化学酶促发光蛋白。
63.在本发明的较佳实施方案中,具体实验流程如下:(1)泛素化修饰的固相检测:将变性条件或者非变性条件下提取的细胞或者组织蛋白质,利用二硫苏糖醇(dtt)60℃还原30分钟,室温避光条件下碘乙酰胺(iaa)烷基化30分钟,经sds-page分离后将蛋白电泳转移到固相载体如硝酸纤维素膜(nc膜)或者pvdf膜上,经tbst溶解的10%脱脂奶粉室温封闭1小时。然后,用10%脱脂奶粉溶液稀释的检测试剂thubd-hrp/thubd-flu对膜进行室温孵育2小时,孵育后,用tbst洗去膜上未结合的蛋白,重复三次,每次10分钟。最后进行检测。(2)细胞内泛素化修饰的免疫荧光检测:将细胞铺于12孔板中,37℃,5%co2培养箱中过夜培养。待细胞长至60-70%,吸去培养基,pbs洗3次,每次3min。4%多聚甲醛室温固定15min,pbs洗3次,每次3min,0.5%tritonx-100室温放置30min,pbs洗3次,每次3min。5%bsa室温封闭40min之后,加入溶解在5%bsa的thubd-flu,抗体稀释比例为1:1000,室温避光孵育2小时或者4℃孵育过夜,pbs洗3次,每次3min,滴加dapi中性树脂封片,1h后激光共聚焦显微镜观察荧光。
64.有益效果:本发明所提供的技术策略能够特异高效的检测8种泛素链的信号,而对泛素分子以及非泛素修饰蛋白无法识别。首先,本发明通过对串联杂种泛素结合结构域(thubd)的化学标记得到的检测试剂(thubd-hrp/thubd-flu),能够直接对泛素化修饰进行检测,与tuf-wb策略相比,省略了二抗的孵育过程,简化了实验流程,缩短实验时间;与常用的商品化泛素抗体相比,本发明所提供的检测试剂具有更高的灵敏度以及更低的检测下限。同时,thubd-hrp可以特异地检测ffpe(石蜡包埋样品)样本中的泛素化修饰蛋白,而thubd-flu可以对细胞原位中的泛素化修饰蛋白进行检测。综上,本发明为泛素化研究者提供了一种操作性强,高效,准确且无偏性的泛素链检测方法,能够比商品化的泛素抗体更加真实的检测待测样本中泛素化修饰的含量,以及对细胞原位中的泛素化修饰进行可视体现。
附图说明
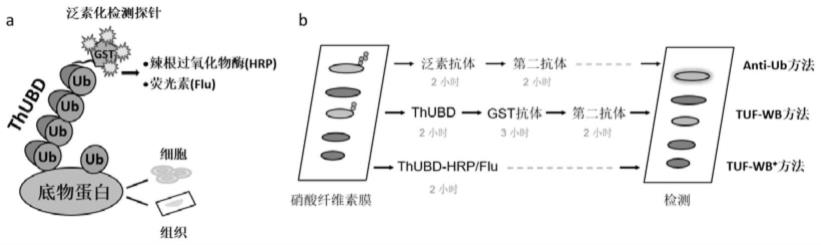
65.图1:通过发展一类新型的多聚泛素化信号检测试剂,建立了一种高效、简洁的泛素化信号检测技术方法,缩短了实验操作的时间。检测试剂识别泛素化修饰底物的原理图(a),在thubd的gst标签上可以标记检测基团,如辣根过氧化物酶(hrp)或荧光素(flu),通过thubd-hrp或thubd-flu可以分别识别组织或细胞中的多聚泛素化信号,并直接用于信号检测。将检测试剂检测固体膜上的泛素化信号的过程命名为tuf-wb+,与tuf-wb方法和基于泛素抗体的检测方法相比,本发明方法省略了二抗的孵育过程,简化了实验流程,并且明显缩短了实验的操作时间(b)。
66.图2:thubd的巯基可以高效标记hrp或荧光素分子。对thubd、hrp以及标记后的混合物进行sds-page电泳并进行银染(a),对thubd和hrp的混合物以及镍柱纯化之后的混合物进行sds-page电泳并进行银染(b),lc-ms/ms对镍柱纯化前后的thubd和hrp的混合物进行分析(c),对镍柱纯化后的thubd和hrp的混合物进行lc-ms/ms重复检测(d);对thubd和荧光素标记thubd(thubd-flu)进行sds-page电泳及荧光检测(e),thubd与thubd-flu色谱峰的相对强度(f)及荧光素的标记效率(g)。
67.图3:与现有的方法相比,本发明方法具有超高的检测灵敏度。用本发明方法(thubd-hrp)和已经报道的tuf-wb、传统的泛素抗体方法进行平行比较。对2ng和5ng的m1四
聚泛素链进行检测,分别曝光3s、10s和120s(a),并对5ng曝光10s时检测到的信号强度进行定量(b),对等量(1.25-20μg)的293t全细胞裂解液平行进行sds-page电泳并转移至固体膜上,分别进行本方法(thubd-hrp)和基于泛素抗体的检测方法,对膜进行同时曝光,曝光时间为1-300s(c、d),丽春红染色表征上样量,并对本发明的检测方法曝光30s和基于泛素抗体检测方法曝光120s时的信号强度进行定量并绘制上样量与信号强度的定量曲线(e),对两种检测方法曝光30s时的信号强度进行定量比较(f);分别用不同稀释比例的泛素抗体和荧光素标记法(thubd-flu)孵育相同浓度的m1四聚泛素链(200ng),并进行荧光检测(g),以及用相同稀释比例的泛素抗体和thubd-flu(1:1000)孵育不同浓度的m1四聚泛素链(25-200ng),然后分别和同时进行荧光检测(i),将两种方法检测到的泛素信号进行灰度定量并进行比较(h、j):本发明方法检测到的信号强度均高于以泛素抗体为检测方法的信号强度。
68.图4:与现有方法相比,本发明方法具有良好的特异性和定量准确性。在大肠杆菌全细胞裂解液(20μg)中加入不同浓度(30-1000ng)的m1四聚泛素链,并用本发明方法(thubd-hrp)进行检测(a),用本发明方法对不同浓度(1-20μg)的293t全细胞裂解液进行检测(c),并根据本发明方法检测到的信号强度绘制定量曲线(b、d),丽春红染色表征上样量;用本发明方法(thubd-flu)对不同浓度的m1四聚泛素链(25-400ng)进行检测(e),同时对加入到大肠杆菌全细胞裂解液中的m1四聚泛素链进行检测(g),并根据本发明方法检测到的信号强度绘制定量曲线(f、h)。
69.图5:本发明方法(thubd-hrp)能够特异地检测ffpe样品中的多聚泛素化信号,且与抗体法相比能够更加准确的测定组织里的泛素化信号的空间分布。thubd-hrp(1ng/μl)和泛素抗体(2ng/μl)平行检测鼠肝组织中的泛素化信号,苏木素染色作为阴性对照(a),将其作为背景,利用image j1.48v软件对细胞浆和细胞核检测到的泛素化信号进行定量(b),提取鼠肝组织的细胞浆和细胞核蛋白,并用thubd-hrp进行泛素化信号的检测,gapdh和lamin b1抗体用来表征细胞浆和细胞核蛋白(c),同时对提取的细胞浆和细胞浆蛋白进行lc-ms/ms分析,对鉴定到的泛素和k48链、k63链的信号进行定量比较(d、e)。
70.图6:本发明方法(thubd-flu)检测hela细胞中的泛素化信号并比泛素抗体灵敏。分别用不同浓度的thubd-flu(a)和泛素抗体(b)孵育hela细胞并进行荧光检测,并对检测到荧光信号进行定量(c),使用浓度如图所示,绿色荧光为thubd-flu检测到的泛素化信号,dapi染细胞核。
71.图7:本发明方法(thubd-flu)对神经元细胞中泛素化信号进行检测,检测灵敏度比商业化抗体法更加灵敏。tubulinβ-iii抗体孵育神经元,展示神经元细胞的整体结构,为红色荧光,thubd-flu检测神经元细胞中的泛素化信号,为绿色荧光,dapi染细胞核,为蓝色荧光(a)。thubd-flu(1:1000)与泛素抗体(1:500)同时对神经元细胞中的泛素化信号进行检测(b)。
具体实施方式
72.下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,除了thubd之外,如无特殊说明,均可从商业途径得到。thubd的制备引入申请号为201410323921.1的中国专利申请作为参考。
73.实施例1:thubd通过-sh与马来酰亚胺反应标记hrp分子或荧光素分子
74.一、thubd融合蛋白的表达与纯化
75.将含有gst标签的thubd编码基因的表达载体转化到大肠杆菌bl21(de3)(北京康为世纪生物科技有限公司产品,目录号:cw0808a)中。在37℃条件下用lb培养基培养到密度为a600(600nm处的吸光值)为0.4-0.6时,加入异丙基-丙基入0硫代吡喃半乳糖苷(iptg)至终浓度为0.5mm,并在30℃条件下诱导融合蛋白表达4小时,收集菌液并在6000rpm,4℃条件下离心5分钟收集细胞。
76.收集的细胞重悬于裂解液(配方:1
×
pbs,ph7.4,1mm dtt,10%甘油),超声破碎仪裂解细胞(工作2秒,静置4秒,总共超声30分钟,功率为25%),然后在4℃,15000rpm离心10分钟,将上清液转移到新离心管中。在上清液中加入谷胱甘肽琼脂糖凝胶颗粒(200微升,qiagen公司产品,其产品目录号为30900),在4℃旋转孵育60分钟。琼脂糖凝胶颗粒用洗杂缓冲液(配方:1
×
pbs,ph7.4,1mm dtt)清洗3次,每次10毫升,降低非特异性结合的污染蛋白,得到特异性结合在琼脂糖凝胶颗粒上带有gst标签的thubd融合蛋白。用洗脱缓冲液(配方:1
×
pbs,ph7.4,1mm dtt,5-20mm还原型谷胱甘肽)对结合在琼脂凝胶颗粒上的thubd融合蛋白进行洗脱,设置5,10,15,20mm gsh四个洗脱梯度,每个梯度洗脱2毫升。洗脱液合并,用超滤置换的方法将缓冲液置换为1
×
pbs,20%甘油,用bca法测浓度(thermofisher,其产品目录号为23228)后,冻存于-30℃冰箱备用。
77.二、thubd标记hrp分子或荧光素分子
78.将纯化的thubd蛋白浓度调整为2μg/μl,与ez-link马来酰亚胺活化辣根过氧化物酶(hrp)(thermofisher,其产品目录号为31485)以1:4分子比孵育。室温下标记1h,4℃下继续标记5h,标记条件避光保存,标记6h后,与100μl ni-nta beads 4℃孵育2h,常规洗涤洗脱,洗脱后的蛋白质储存在20%甘油中备用。将thubd、hrp和它们的混合物进行sds-page电泳并银染,同时对标记后的混合物和ni-nta beads纯化的混合物进行电泳并银染并对其进行lc-ms/ms检测。
79.向200μl thubd蛋白溶液(约500ug)中加入摩尔量25倍高的荧光素-5-马来酰亚胺试剂(thermofisher,其产品目录号为62245),充分混匀,室温2h避光偶联,使用超滤的方法除去没有偶联的荧光素分子,最后定容到500ul。标记好的thubd-flu分装,避光保存于-30℃。将thubd和荧光素标记的thubd进行凝胶电泳,并进行荧光检测。然后,对标记前后的thubd进行lc-ms/ms检测。
80.结果如图2所示,根据银染结果显示,标记之后,未标记的thubd明显减少,而标记hrp的thubd在高分子量区域明显增多,说明thubd有效标记上了hrp分子。ni-nta纯化之后,hrp分子明显减少,说明纯化成功,为了进一步计算hrp的标记效率,利用lc-ms/ms分析ni-nta纯化前后hrp标记thubd的混合物,在ni-nta纯化前后测定样品中hrp与thubd的质谱信号强度ibaq比值分别为0.53:1和0.44:1。纯化前的hrp与thubd的初始摩尔比为4:1,则可计算出thubd与thubd的分子比为(0.44/0.53)成功,为了进。重复样品分析,最终比值分别为3.3和3.4,一致性较高。综上所述,通过标记实验,平均有3.3个hrp分子附着在一个thubd上。
81.荧光素标记的thubd相对于thubd向高分子量迁移,并且荧光检测之后,荧光素标记thubd产生了条带,而thubd没有产生条带,说明thubd标记上了荧光素分子,根据质谱检测结果,主要产物为thubd-flu,标记效率达到了98.3%,这说明thubd几乎全部标记上了荧
光素分子。
82.通过实施例1,表达并定量了串联杂合泛素结合结构域多肽thubd,并完成了hrp和荧光素标记thubd蛋白,并且都具有比较高的标记效率,平均1分子的thubd偶联了3-4分子的发光基团。
83.实施例2:与泛素抗体的检测方法相比,tuf-wb
+
方法的检测灵敏度最大提升超过50倍
84.一、thubd融合蛋白的表达、纯化与标记
85.thubd融合蛋白的表达、纯化与标记方法参照实施例1。
86.二、tuf-wb
+
方法固相识别泛素化蛋白
87.将2ng和5ng的m1四聚泛素链平行上样3次,经sds-page电泳分离之后转移到固体膜上,分别进行thubd-hrp、tuf-wb和基于泛素抗体的检测,对膜同时曝光,曝光时间为3s-120s,并对检测到的信号强度进行定量。同样的检测方法,用thubd-hrp和基于泛素抗体的检测方法对1.25-20μg的293t全细胞裂解液进行检测,相同显色条件下同时曝光1-300s,根据检测结果利用image j 1.48v软件对信号强度进行检测,并对tuf-wb+方法曝光30s和泛素抗体曝光120s时检测到的信号强度与上样量绘制定量曲线。
88.将相同量的m1四聚泛素链(200ng)在10%sds-page电泳分离后,转移到固相nc膜上,用不同稀释浓度的thubd-flu(1:1000、1:2000、1:4000、1:10000)和商品化的泛素抗体(1:250、1:500、1:1000、1:2000)分别进行孵育,并进行荧光检测。同样,将不同量的m1四聚泛素链(25-200ng)在10%sds-page电泳分离后,转移到固相nc膜上,用相同稀释浓度的thubd-flu和商品化的泛素抗体(1:1000)分别进行孵育,最后进行荧光检测。将显色的深度转变为灰度数值,用于定量分析。
89.结果如图3所示,tuf-wb
+
方法(thubd-hrp)在曝光10s时可以检测到明显的泛素化信号,而tuf-wb策略和泛素抗体在曝光120s时才能检测到泛素化信号,根据信号强度量化的结果,tuf-wb策略检测到的信号强度是泛素抗体的3.67倍,而tuf-wb+方法检测到的信号强度是泛素抗体的46.65倍,说明tuf-wb+方法具有很好的检测灵敏度,同样,在对293t的全细胞裂解液进行检测时,tuf-wb+检测到的信号强度明显高于泛素抗体,在对tuf-wb+方法曝光30s和泛素抗体曝光120s时的信号强度与上样量绘制定量曲线都呈现了良好的线性关系,在曝光30s时,tuf-wb+方法检测到的信号是泛素抗体检测到的信号的51.8倍,说明tuf-wb+方法的检测灵敏度远高于泛素抗体。
90.在检测相同浓度的泛素链时,thubd-flu可以检测到明显的泛素化信号,并且与稀释倍数成正相关,但泛素抗体检测时泛素化信号非常弱,并且与稀释倍数无关。同时,用相同稀释浓度的泛素抗体和thubd-flu孵育不同浓度的泛素链,当同时曝光时,thubd-flu可以检测到明显的泛素化信号,而泛素抗体几乎检测不到信号,当分别曝光时,thubd-flu同样可以检测到明显的泛素化信号,而泛素抗体只能检测到微弱的泛素化信号。综上所述,thubd-flu的检测灵敏度显著高于商业化泛素抗体的检测灵敏度。基于灰度值,得到本检测方法和泛素抗体检测的信号强度,相同上样量和相同显色条件下,本发明方法的检测灵敏度约是泛素抗体检测灵敏度的10倍。
91.通过实施例2,证明了tuf-wb+方法固相识别泛素化蛋白的灵敏度显著高于基于泛素抗体的检测方法。
92.实施例3:tuf-wb+方法固相识别泛素化蛋白的特异性和定量准确性
93.一、thubd融合蛋白的表达、纯化与标记
94.thubd融合蛋白的表达、纯化与标记方法参照实施例1。
95.二、tuf-wb+方法特异性识别泛素化蛋白并定量准确性高
96.将30~1000ng的m1四聚泛素链添加到20μg的大肠杆菌全细胞裂解液中,经sds-page电泳分离之后转移到固体膜上,封闭之后孵育thubd-hrp并进行检测,利用image j1.48v进行灰度定量,绘制上样量与信号强度定量曲线。同样的方法对1-20μg的293t全细胞裂解液进行检测。
97.25-400ng的m1四聚泛素链经sds-page电泳分离后转移至固体膜上,封闭之后孵育thubd-flu并检测,利用image j1.48v进行灰度定量,绘制上样量与信号强度定量曲线。同样的方法对加入到大肠杆菌全细胞裂解液的25-400ng的m1四聚泛素链的进行检测。
98.结果如图4所示,真核细胞293t具有丰富的泛素化修饰,作为阳性信号的检测样品;原核细胞大肠杆菌缺乏泛素化修饰,作为阴性样本。与预期一致,大肠杆菌的全细胞裂解液检测不到阳性信号,但在大肠杆菌全细胞裂解液中添加的m1四聚泛素链检测到了泛素化信号,说明thubd-hrp具有高特异性,并且检测信号与上样量呈现良好的线性关系(r2=0.99);在293t全细胞裂解液中也观察到显著的线性关系(r2=0.99),说明thubd-hrp具有定量准确性。
99.同样,利用thubd-flu检测大肠杆菌全细胞裂解液中添加的m1四聚泛素链,可以明显的检测到m1四聚泛素链的信号,但是检测不到大肠杆菌全细胞裂解液的信号,说明thubd-flu具有高特异性,并且上样量与信号强度呈现良好的线性关系(r2=0.99),说明thubd-flu也具有定量准确性。
100.通过实施例3,证明了该检测方法可以特异地检测样本中的泛素化蛋白,同时本发明在不同上样量与其信号强度呈现良好的线性关系,证明其良好的定量准确性。
101.实施例4:thubd-hrp有效检测甲醛固定石蜡包埋(ffpe)样品中的多聚泛素化信号
102.一、thubd融合蛋白的表达、纯化与标记
103.thubd融合蛋白的表达、纯化与标记方法参照实施例1。
104.二、thubd-hrp检测ffpe样品中的泛素化信号
105.对福尔马林固定石蜡包埋(ffpe)的鼠肝组织切片进行免疫组化实验:石蜡切片置于60℃,脱蜡1小时,二甲苯ⅰ、ⅱ,各10分钟,梯度酒精:100%,95%,80%,70%,各2分钟。蒸馏水洗5分钟,2次,3%h2o2封闭内源性过氧化物酶,温室避光放置10-15分钟,蒸馏水洗5分钟,3次;抗原修复:将切片置于切片架中,放入塑料容器内,枸橼酸钠缓冲液(10mm ph6.0)淹没切片,置于微波炉中,选择中高或高档,加热10分钟,自然冷切至室温后取出,pbs洗5分钟,3次,取出切片,滴加5%bsa,37℃封闭1小时,吸去bsa,分别滴加thubd-hrp(1ng/μl)和anti-ub(2ng/μl)),37℃孵育2小时,也可置于4℃冰箱过夜;然后pbs洗5分钟,3次,其中泛素抗体要孵育anti-mouse抗体,37℃孵育2小时,pbs洗5分钟,3次,dab显色,适时终止;自来水充分冲洗,苏木素复染15-20秒,自来水冲洗返蓝15分钟,梯度酒精脱水:80%,95%,100%,各2分钟,二甲苯透明:ⅰ、ⅱ二甲苯各5分钟,中性树脂封片,显微镜观察,根据检测到的信号强度,利用image j 1.48v软件对信号强度进行量化。
106.三、提取鼠肝的细胞浆和细胞核蛋白并进行lc-ms/ms检测
107.利用试剂盒(碧云天,其产品目录号为p0028)提取正常鼠肝和hela细胞的细胞浆和细胞核蛋白,经sds-page电泳分离后转移到固体膜上,封闭之后分别孵育thubd-hrp、gapdh、lamin b1抗体,最后进行发光检测。同时对鼠肝和hela细胞的细胞浆和细胞核蛋白进行lc-ms/ms检测。
108.结果如图5所示,根据阴性对照的染色结果,anti-ub抗体主要检测到细胞核中的泛素化信号高于细胞质中的泛素化信号,而thubd-hrp检测到细胞核中的泛素化信号高于细胞核信号。根据信号强度的检测结果,泛素抗体检测时细胞浆与细胞核的泛素化信号比值为0.57:1,thubd-hrp检测时细胞浆与细胞核的泛素化信号比值为1.92:1。gapdh抗体检测时,在细胞浆有较强的信号,在细胞核中的信号较弱,lamin b1抗体只在细胞核中检测到信号,说明有效分离了细胞浆和细胞核蛋白,根据thubd-hrp检测到的泛素化信号,说明细胞浆中的泛素化信号高于细胞核中的泛素化信号,质谱检测结果同样证明了此现象,说明细胞浆中的泛素化信号高于细胞核中的泛素化信号。同时对细胞浆和细胞核中的k48和k63链进行定量,发现在细胞浆中k48链的含量高于k63链,但是在细胞核中k63链的含量高于k48链。因为泛素抗体对泛素链的检测有偏性,对k63链的亲和力高于k48链,而thubd对泛素链的检测几乎无偏性,能够检测所有的泛素链,抗体法偏性的问题导致检测失真,而thubd-hrp更加准确的反映了泛素化信号的空间分布。
109.通过实施例4,证明了thubd-hrp可以有效地检测ffpe样品中的泛素化信号,并且证明了细胞浆蛋白中的泛素化信号要高于细胞核蛋白中的泛素化信号。相较于商业化的抗体法,该发明方法可以更加准确的反映泛素化信号的空间分布特征。
110.实施例5:利用thubd-flu检测细胞中的泛素化信号并进行荧光成像
111.一、thubd融合蛋白的表达、纯化与标记
112.thubd融合蛋白的表达纯化与标记方法、显色方法参照实施例1、2.
113.二、thubd-flu检测hela细胞中的泛素化信号
114.在含有10%胎牛血清的dmem培养基中培养hela细胞,放置于37℃,5%co2的培养箱中培养至细胞密度为70-80%时,进行细胞免疫荧光。去掉培养基,pbs洗3次,在经4%多聚甲醛室温固定15min,0.5%tritonx-100室温放置30min,5%bsa室温封闭40min后,加入不同浓度的thubd-flu,室温避光孵育2h,pbs清洗3次,含有dapi的中性树脂封片,超高分辨率激光共聚焦观察荧光;泛素抗体检测时,一抗封闭后,再孵育荧光标记的二抗,方法同上,最后对检测到的荧光信号进行定量。
115.结果如图6所示,在免疫荧光分析中,thubd-flu高灵敏的检测到hela细胞细胞浆和细胞核中泛素信号,而泛素抗体只标记了细胞核外周区域的泛素且信号模糊不清,结果显示泛素抗体法的检测灵敏度远低于thubd-flu的检测灵敏度。当抗体浓度达到1:100时,荧光信号强度仍弱于thubd-flu为1:4000时的荧光信号强度。当thubd-flu稀释倍数为1:10000时,仍能检测到荧光信号,而泛素抗体在1:1000时不能检测到荧光信号,进一步证实了thubd-flu在免疫荧光检测泛素方面的显著优势。
116.通过实施例5,以hela细胞的泛素化检测为应用实例,证明了thubd-flu可以原位检测细胞中的泛素化信号,进行高灵敏成像分析,且操作简洁、检测灵敏度高。
117.实施例6:thubd-flu检测神经元细胞中的泛素化信号。
118.一、thubd融合蛋白的表达、纯化与标记
119.thubd融合蛋白的表达纯化与标记方法、显色方法参照实施例1、2.
120.二、thubd-flu检测神经元细胞中的泛素化信号
121.检测神经元细胞中的泛素化信号,培养小鼠原代神经元细胞,待其长到10-16天时进行细胞免疫荧光,步骤参照实施案例5,分别孵育thubd-flu(1;1000)、tubulinβ-iii抗体和泛素抗体(1:500),后两者分布孵育对应荧光标记的二抗,最后用超高分辨率激光共聚焦检测荧光信号。
122.结果如图7所示,免疫荧光染色显示,dapi染色显示斑点清晰,分布均匀。主要表达于神经元细胞的神经元标志物微管蛋白β
‑ⅲ
在胞体周围和轴突上均表现出强烈的红色信号,清晰地勾勒出细胞边界。同样,thubd-flu对原代培养的小鼠神经元细胞的免疫荧光分析显示,泛素在胞体和轴突中均有分布,但是与轴突相比,胞体的荧光信号非常明亮,这一结果与tubulinβ
‑ⅲ
染色结果相反。与泛素抗体染色相比,thubd-flu在胞体和轴突上显示明亮的荧光信号,而泛素抗体则几乎没有检测到信号,这些结果有力地支持了thubd-flu作为检测细胞内多聚泛素化信号的特异性和敏感性,并可以进行高分辨率的荧光成像分析。
123.通过实施例6,通过对神经元细胞中泛素化信号的检测,证明了thubd-flu检测神经元细胞中泛素化信号的效果优于泛素抗体法,能够更加灵敏、准确的检测到神经元细胞中的泛素化信号,为高灵敏荧光成像分析多聚泛素化信号提供了有效检测试剂和方法。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1