一种通过肥大细胞脱颗粒状态快速检测化妆品舒缓功效的方法与流程
1.本发明属于生物医药领域,具体涉及一种通过肥大细胞脱颗粒状态快速检测化妆品舒缓功效的方法。
背景技术:
2.过敏反应又叫变态反应,是一种常见多发的疾病。据统计有30%-40%的人都曾经患过过敏性疾病,变态反应科1年约接纳4万多病人,其中1/3是鼻炎、1/3是哮喘、1/3就是皮肤病病人。过敏反应是身体对一种或多种物质(过敏原)的不正常反应,而这些过敏原对大多数人是无害的。过敏反应主要起因是由于过敏患者在接触过敏原后,体内过多地产生了一种抗过敏原的特异性的ige抗体。这些抗过敏性特异性ige抗体会被组织肥大细胞表面的fcεri受体捕捉,使机体即处于致敏状态。当人体再次接触同一过敏原时,肥大细胞和嗜碱性粒细胞表面抗过敏原特异性ige会与同一过敏性相互结合,引起肥大细胞和嗜碱性粒细胞活化并发生脱颗粒,释放组胺、白三烯等生物活性介质。这些炎症介质继而作用在相应的组织上产生各种过敏症状,如支气管哮喘、过敏性鼻炎、过敏性皮肤病。
3.除此之外,还有一些成分(诸如c48/80、黄蜂毒素等)可介导非ige依赖的非特异性过敏反应。它们可以直接激活三聚体g蛋白,g蛋白通过α、β、γ三个亚基向下进一步传递信号,触发细胞脱颗粒,产生超敏反应。脱颗粒释放的介质会引起平滑肌收缩和微血管通透性升高,并募集炎症细胞,造成组织损伤和变态反应。因此,肥大细胞的脱颗粒现象是过敏反应发生的基础。
4.过敏跟个人体质、基因以及身体状况相关。在一些多发性过敏的病人中,通过检测过敏源,可以指导病人尽量避免与之接触,从而降低过敏的发生。同时在化妆品的评估中,成分是否安全,具体化妆品是否有舒缓功效,也可以通过过敏的发生检测。在化妆品舒缓功效评价中,对过敏反应的快速,有效,精准的检测非常关键。
5.根据《化妆品功效宣称评价指导原则》和《化妆品分类规则和分类目录(征求意见稿)》附表1中对舒缓的定义,舒缓是指有助于改善皮肤刺激状态。基于皮肤刺激的机理,目前化妆品的舒缓功效主要通过以下几种方式达到改善皮肤刺激性状态的目的:(1)修复皮肤屏障功能,如促进三大脂质的合成以及调节三大脂质的平衡;(2)调节树突状细胞的反应性,增强皮肤的耐受性;(3)神经镇静作用,通过抑制pge2释放、降低肥大细胞脱颗粒数量达到镇静神经的作用;(4)改善皮肤炎症反应,炎症是皮肤刺激及敏感的主要症状,通过抑制白细胞介素1(il-1α)、肿瘤坏死因子(tnfα)、白细胞介素(il-8)、白细胞介素(il-6)、胸腺基质淋巴细胞生成素(tslp)等炎症细胞因子以及炎性介质前列腺素(pge2)的释放,抑制肥大细胞脱颗粒数量,起到改善皮肤炎症反应,达到舒缓的功效。
6.皮肤过敏的发生首先下游的细胞因子(抗炎因子和促炎因子)发生变化,而后会引起细胞脱颗粒情况变化,再然后会释放组胺等生物活性介质,最终导致皮肤敏感的发生。化妆品舒缓效果主要通过(1)修复屏障;(2)通过调节trpv1,从而使人体不敏感;(3)调节敏感
因子,从而达到根本上的舒缓效果。第一个方案是隔绝过敏源,第二个是让身体感受不到过敏源,但免疫过程还在继续发生。而根本上需要改变免疫反应的过程,从而达到舒缓的效果。因此评价过程就转化为对细胞因子的检测,细胞脱颗粒状态的检测,以及再下游的组胺等生物活性物质的检测。
7.现有的肥大细胞的脱颗粒化评价一般是通过检测其脱颗粒化后释放的炎症介质比如组胺、β-氨基己糖苷酶。这些炎症介质的检测一般需要基于酶联免疫方法,不能直观的反应单个肥大细胞的脱颗粒情况。
8.公开号为cn213275623u的中国实用新型专利提出了检测多种特异性ige的方法,但是过敏反应并非都由特异性ige介导。
9.公开号为cn102156113a的中国发明专利提出了肥大细胞脱颗粒的直接观察方法。然而,通过肉眼观察具有一定的主观性,无法给出准确的定量结果,准确度较低,且分析速度慢,效率低下。
10.另外,还有测试肥大细胞脱颗粒之后组胺释放量,然而一般通过分光光度计检测,精度不够,而使用酶联免疫方法,则容易受到其他成分的影响,因此在检测微量组胺时,并没有很好的手段。此外,这种检测手段并不能反映单个肥大细胞脱颗粒状况。因此,目前亟需一种能够方便、准确的检测化妆品舒缓功效的方法。
技术实现要素:
11.本发明要解决的技术问题是:提供一种快速检测化妆品舒缓功效的方法。
12.本发明解决上述技术问题的技术方案如下:
13.一种快速检测化妆品舒缓功效的方法,其特征在于通过流式细胞术直接测定肥大细胞的脱颗粒状态。
14.优选的,所述快速检测化妆品舒缓功效的方法采用荧光标记亲和素蛋白(avidin)结合脱颗粒化的肥大细胞后,再采用流式细胞仪检测荧光标记脱颗粒细胞。
15.优选的,所述快速检测化妆品舒缓功效的方法包括如下步骤:
16.(1)设置阳性对照组、阴性对照组和试验组,分别将肥大细胞加入流式细胞管,并加入培养液培养;
17.(2)向阳性对照组、阴性对照组和试验组中加入外源非免疫性激活剂进行培养,培养结束后终止刺激;
18.(3)将阳性对照组、阴性对照组和试验组分别离心,进行流式细胞分析;
19.(4)计算脱颗粒化率及脱颗粒化抑制率。
20.优选的,外源非免疫性激活剂选自compound 48/80(c48/80)。c48/80保存液长期保存于-20℃。在每次试验之前,用培养基稀释c48/80保存液制备获得1mg/ml c48/80溶液。
21.优选的,所述阴性对照组和试验组的培养液选用无血清高糖dmem;阳性对照组培养液选用添加了1mg/ml色甘酸钠的无血清高糖dmem。
22.c48/80推荐使用浓度为10μg/ml。本技术中测试了10μg/ml和100μg/ml c48/80对p815细胞脱颗粒的作用。通过直接形态学观察可见,10μg/ml c48/80较明显地诱导了肥大细胞脱颗粒化(图1),而100μg/ml c48/80则导致全部肥大细胞发生脱颗粒化。因此,在本方案中10μg/ml c48/80选定为体外刺激浓度。
23.优选的,本技术中的阳性对照培养液中加入了色苷酸钠以抑制肥大细胞脱颗粒化的进行,色苷酸钠的给药浓度为0.5mg/ml。
24.由于肥大细胞胞内颗粒包含一种蛋白多糖基质,其中嵌入了多种肥大细胞炎症介质。蛋白多糖是由硫化的蛋白质核心与带负电荷的糖胺聚糖(例如肝素/硫酸肝素或硫酸软骨素)相连。生物素蛋白(avidin)可选择性地结合肝素糖胺聚糖并且高度优先地结合肥大细胞胞内颗粒而非其他细胞结构。肥大细胞发生脱颗粒时,颗粒和细胞质膜融合在一起,颗粒基质与细胞外环境接触后可立即被偶联了荧光染料的亲和素结合。因此,偶联了荧光染料的亲和素可以直观地示踪肥大细胞的脱颗粒化过程。
25.如上所述,本发明的,具有以下有益效果:
26.本发明通过流式细胞术检测手段直接测定肥大细胞的脱颗粒状态,能够更好地反应整体和单个肥大细胞脱颗粒化的真实状况,从而可以快速精确地评估过敏的状态或者抑制过敏的效果。
附图说明
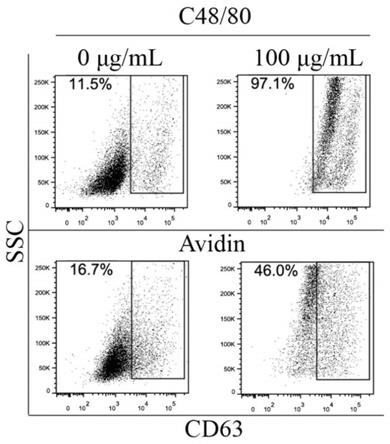
27.图1为本技术具体实施方式中cd63和avidin检测肥大细胞脱颗粒化比较流式图;
28.图2为本技术具体实施方式中形态学观察肥大细胞p815在c48/80诱导后的脱颗粒化照片;
29.图3为本技术具体实施方式中肥大细胞系p815在c48/80处理后的脱颗粒化流式图;
30.图4为本技术具体实施方式中化妆品舒敏功效评价流式图;
31.图5韦em care classic(二裂酵母发酵产物溶胞产物)化妆品原料舒敏功效评价图。
具体实施方式
32.以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。须知,下列实施例中未具体注明的工艺设备或装置均采用本领域内的常规设备或装置。此外应理解,本发明中提到的一个或多个方法步骤并不排斥在所述组合步骤前后还可以存在其他方法步骤或在这些明确提到的步骤之间还可以插入其他方法步骤,除非另有说明;还应理解,本发明中提到的一个或多个设备/装置之间的组合连接关系并不排斥在所述组合设备/装置前后还可以存在其他设备/装置或在这些明确提到的两个设备/装置之间还可以插入其他设备/装置,除非另有说明。而且,除非另有说明,各方法步骤的编号仅为鉴别各方法步骤的便利工具,而非为限制各方法步骤的排列次序或限定本发明可实施的范围,其相对关系的改变或调整,在无实质变更技术内容的情况下,当亦视为本发明可实施的范畴。
33.除非另外说明,本发明中所公开的实验方法、检测方法、制备方法均采用本技术领域常规的分子生物学、生物化学、染色质结构和分析、分析化学、细胞培养、重组dna技术及相关领域的常规技术。这些技术在现有文献中已有完善说明,具体可参见sambrook等
c48/80溶液。
59.用无血清高糖dmem培养基溶解制备1mg/ml色甘酸钠溶液,长期保存于-20℃。
60.实施例1.比较avidin和cd63检测肥大细胞脱颗粒效果
61.本方案中,肥大细胞p815在0μg/ml和100μg/ml的c48/80刺激15分钟后,经avidin-ftic或cd63-fitc染色分析肥大细胞脱颗粒化情况。100μg/ml的c48/80刺激显著诱导肥大细胞发生脱颗粒化(图1)。cd63-ftic可以检测肥大细胞的脱颗粒化。但是,avidin-fitc相对cd63-fitc识别更高比例的脱颗粒化肥大细胞(图1)。
62.实施例2.确立c48/80体外诱导脱颗粒化试验条件
63.本方案中测试了10μg/ml和100μg/ml c48/80刺激1小时后对p815细胞脱颗粒的作用。通过直接形态学观察可见,10μg/ml c48/80较明显地诱导了肥大细胞脱颗粒化(图2),而100μg/ml c48/80则导致全部肥大细胞发生脱颗粒化。因此,在本方案中10μg/ml c48/80选定为体外刺激浓度用于后续实验。
64.实施例3.确立色苷酸钠作为抑制肥大细胞脱颗粒的阳性对照
65.1)给药
66.加入50μl重悬的p815细胞(或人肥大细胞lad2或hmc-1)至1.2ml流式细胞管,阴性对照组加入无血清高糖dmem培养液,阳性对照组加入50μl含有1mg/ml色甘酸钠的无血清高糖dmem培养液,每孔总体积100μl。给药完毕后将细胞放置在培养箱中(37℃、5%co2、95%rh)培养2小时。
67.2)脱颗粒化诱导
68.向阴性对照组和阳性对照组快速加入0μl、1μl和2μl的c48/80溶液(1mg/ml),使得c48/80终浓度分别为0μg/ml、10μg/ml和20μg/ml,同时加入每孔1μl avidin-fitc(0.5mg/ml)。此外,单独设置阴性对照组和阳性对照组各1管,仅分别加入0μl和2μl c48/80溶液(1mg/ml),使得c48/80终浓度分别为0μg/ml和20μg/ml,作为avidin阴性细胞对照组。操作完毕后将24孔板放置在培养箱中(37℃、5%co2、95%rh)培养15分钟。加入1000μl冰预冷1
×
pbs至所有反应管中,并在0℃冰水浴中静置10min,终止c48/80的刺激。
69.3)脱颗粒化分析
70.500g,4℃离心5分钟,弃掉上清。加入200μl的1
×
pbs重悬细胞,进行流式细胞分析。
71.根据未加入avidin-fitc的阴性和阳性对照组的流式数据,设置avidin阴性群(图3,a)。发生脱颗粒的肥大细胞在avidin-fitc染色后则为ssc
high
avidin
+
细胞(图3,b)。图3显示,肥大细胞系p815在无血清dmem培养基处理后,6.56%细胞为ssc
high
avidin
+
细胞。10μg/ml和20μg/ml c48/80处理显著诱导23.9%和82%的肥大细胞发生脱颗粒化(图3,b)。但是,在色苷酸钠(0.5mg/ml)无血清dmem培养基预处理2小时后,10μg/ml和20μg/ml c48/80处理仅诱导12.2%和20.5%肥大细胞发生脱颗粒化(图3,b)。以上数据表明,0.5mg/ml的色肝素钠可以作为抑制肥大细胞脱颗粒化的阳性对照。
72.实施例4.化妆品舒敏评价具体实施案例
73.1)给药
74.加入50μl重悬的p815细胞至1.2ml流式细胞管,空白对照组加入无血清高糖dmem培养液,阳性对照组加入50μl含有1mg/ml色甘酸钠的无血清高糖dmem培养液,试验组加入
50μl含有化妆品受试物(1%symrepair100)的无血清高糖dmem培养液,每孔总体积100μl。给药完毕后将细胞放置在培养箱中(37℃、5%co2、95%rh)培养2小时。
75.2)脱颗粒化诱导
76.向空白对照组、阳性对照组和受试物试验组快速加入1μl的c48/80溶液(1mg/ml)和1μl avidin-fitc(0.5mg/ml)。此外,单独设置空白对照组1管,作为avidin阴性细胞对照组。操作完毕后将24孔板放置在培养箱中(37℃、5%co2、95%rh)培养15分钟。加入1000μl冰预冷1
×
pbs至所有反应管中,并在0℃冰水浴中静置10min,终止c48/80的刺激。
77.3)脱颗粒化分析
78.500g,4℃离心5分钟,弃掉上清。加入200μl的1
×
pbs重悬细胞,进行流式细胞分析。
79.根据未加入avidin-fitc的空白对照组的流式数据,设置avidin阴性群(图4)。图4显示,肥大细胞系p815在10μg/ml的c48/80处理后,脱颗粒化的肥大细胞为31.6%。scg阳性对照组中脱颗粒化的肥大细胞为16.1%。含1%受试物(symrepair100)预处理肥大细胞p815后,10μg/ml的c48/80诱导的脱颗粒化的肥大细胞为22.4%(图4)。
80.4)脱颗粒化率及脱颗粒化抑制率计算
81.脱颗粒化率=ssc
high
avidin
+
细胞/总细胞数
82.试验组脱颗粒化抑制率=(1-试验组脱颗粒化率/阴性对照组脱颗粒化率)
×
100%=(1-22.4%/31.6%)
×
100%=29.1%
83.阳性对照组脱颗粒化抑制率=(1-阳性对照组脱颗粒化率/阴性对照组脱颗粒化率)
×
100%=(1-16.1%/31.6%)
×
100%=49.0%
84.实施例5.二裂酵母发酵产物溶胞产物(em care classic)舒敏评价具体实施案例
85.1)给药
86.加入50μl重悬的hmc-1肥大细胞或lad2肥大细胞至1.2ml流式细胞管,空白对照组加入无血清高糖dmem培养液,阳性对照组加入50μl含有1mg/ml色甘酸钠的无血清高糖dmem培养液,试验组加入50μl含有em care classic化妆品原料(5%)的无血清高糖dmem培养液,每孔总体积100μl。给药完毕后将细胞放置在培养箱中(37℃、5%co2、95%rh)培养3小时。
87.2)脱颗粒化诱导
88.向空白对照组、阳性对照组和受试物试验组快速加入1μl的c48/80溶液(1mg/ml)和1μl avidin-fitc(0.5mg/ml)。此外,单独设置空白对照组1管,作为avidin阴性细胞对照组。操作完毕后将24孔板放置在培养箱中(37℃、5%co2、95%rh)培养15分钟。加入1000μl冰预冷1
×
pbs至所有反应管中,并在0℃冰水浴中静置10min,终止c48/80的刺激。
89.3)脱颗粒化分析
90.500g,4℃离心5分钟,弃掉上清。加入200μl的1
×
pbs重悬细胞,进行流式细胞分析。
91.根据未加入avidin-fitc的空白对照组的流式数据,设置avidin阴性群(图5)。图5显示,hmc-1肥大细胞或lad2肥大细胞在10μg/ml的c48/80处理后,脱颗粒化的肥大细胞为48.6%和45.7%。scg阳性对照组中脱颗粒化的肥大细胞为22.8%和24.1%。化妆品原料二裂酵母发酵产物溶胞产物(em care classic),添加量5%,预处理hmc-1肥大细胞或lad2肥
大细胞后,10μg/ml的c48/80诱导的脱颗粒化的肥大细胞为24.1%和21.5%(图5)。
92.以上的实施例是为了说明本发明公开的实施方案,并不能理解为对本发明的限制。此外,本文所列出的各种修改以及发明中方法、组合物的变化,在不脱离本发明的范围和精神的前提下对本领域内的技术人员来说是显而易见的。虽然已结合本发明的多种具体优选实施例对本发明进行了具体的描述,但应当理解,本发明不应仅限于这些具体实施例。事实上,各种如上所述的对本领域内的技术人员来说显而易见的修改来获取发明都应包括在本发明的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1