一种异胡豆苷合成酶活性的检测试剂盒及检测方法与流程
1.本发明属于试剂盒技术领域,具体涉及一种异胡豆苷合成酶活性的检测试剂盒及检测方法。
背景技术:
2.异胡豆苷合成酶(str)是萜类吲哚生物碱(tias)生物合成途径中一种重要的关键酶,异胡豆苷合成酶可以将色胺和裂环马钱子苷耦合形成异胡豆苷,异胡豆苷是萜类吲哚生物碱的前体化合物,也是生成各类吲哚生物碱的通用前体,该反应也是萜类吲哚生物碱生物合成过程中的中心反应,可见,异胡豆苷合成酶在萜类吲哚生物碱代谢过程中具有至关重要的作用。
3.萜类吲哚生物碱具有广泛的活性和广阔的药用价值,可以从植物体中提取得到,植物体中的异胡豆苷合成酶会促进异胡豆苷的合成,进而生成萜类吲哚生物碱,通过研究植物体中异胡豆苷合成酶的活性,可对萜类吲哚生物碱的合成过程进行研究。
4.而现有技术中尚无可靠准确的检测方法来研究异胡豆苷合成酶的活性。
技术实现要素:
5.本发明的目的在于提供一种异胡豆苷合成酶活性的检测试剂盒及检测方法,以解决背景技术中提出的技术问题。
6.为了实现上述目的,本发明公开了一种异胡豆苷合成酶活性的检测试剂盒,包括以下试剂:
7.试剂1:tris+mgso4·
7h2o+dtt+蔗糖+盐酸+水;
8.试剂2:色胺;
9.试剂3:裂环马钱子苷;
10.试剂4:atp(腺嘌呤核苷三磷酸)。
11.进一步地,所述试剂1的制备过程为:将0.588g tris、0.04g mgso4·
7h2o、0.042g dtt和11.3g蔗糖加入水中溶解后,用盐酸调节ph为7.5,然后定容至100ml,4℃保存。
12.本发明同时要求保护一种异胡豆苷合成酶活性的检测方法,使用了上述的异胡豆苷合成酶活性的检测试剂盒,包括如下步骤:(1)绘制异胡豆苷的标准曲线;(2)从植物样本中提取异胡豆苷合成酶;(3)采用提取的异胡豆苷合成酶催化色胺和裂环马钱子苷进行耦合反应;(4)仪器检测;(5)计算。
13.进一步地,步骤(1)中,配制浓度已知且浓度不同的多组异胡豆苷标准溶液,采用高效液相色谱仪进行测试,得到一系列谱图,拟合得到谱图的峰面积与异胡豆苷标准溶液的浓度之间的标准曲线。
14.进一步地,步骤(2)中,采用试剂1提取植物样本中的异胡豆苷合成酶。
15.进一步地,检测之前,将一定量的试剂1与一定量的试剂2混匀后,得到试剂5;将一定量的试剂1与一定量的试剂3混匀后,得到试剂6;将一定量的试剂1与试剂4混匀后,得到
试剂7;步骤(3)中,在步骤(2)提取得到的异胡豆苷合成酶中依次加入试剂5、试剂6和试剂7,进行反应。
16.进一步地,步骤(3)中,将步骤(2)提取得到的异胡豆苷合成酶在沸水浴中加热,然后冷却至室温后,再依次加入试剂5、试剂6和试剂7进行反应,作为对照组;步骤(3)中,将步骤(2)提取得到的异胡豆苷合成酶,未经沸水浴加热直接依次加入试剂5、试剂6和试剂7进行反应,作为检测组。
17.进一步地,步骤(4)中,将对照组和检测组的产物采用高效液相色谱仪进行测试。
18.进一步地,采用高效液相色谱仪进行测试时,流动相中,乙腈与水的体积比为20:80,且流动相中含有磷酸。
19.进一步地,步骤(5)中,根据对照组和检测组的色谱图中的峰面积,以及异胡豆苷的标准曲线,计算检测组中异胡豆苷的浓度,以此计算得到植物样本中异胡豆苷合成酶的活性。
20.本发明中,首先从植物样本中提取异胡豆苷合成酶,异胡豆苷合成酶催化色胺和裂环马钱子苷生成异胡豆苷,定义异胡豆苷合成酶的活性单位为μg/min/g鲜重,因此异胡豆苷合成酶的活性数值代表每g植物样本鲜重每分钟合成多少μg的异胡豆苷,也即多少个酶活力单位。试验中设置对照组和检测组,对照组中异胡豆苷合成酶进行沸水浴失活,作为空白对照,检测组中得到的异胡豆苷的量,减去对照组中得到的异胡豆苷的量,即为实际得到的异胡豆苷的量。
21.与现有技术相比,本发明的异胡豆苷合成酶活性的检测试剂盒及检测方法具有如下优点:
22.(1)本发明的检测试剂盒中试剂来源广泛,生产成本低。
23.(2)本发明的检测过程中采用高效液相色谱法进行检测,且检测中设置空白对照组和检测组,检测灵敏度高、准确度高。
24.(3)本发明的检测试剂盒及检测方法适用性广,无论对于植物的叶片、根茎,还是果实等,均可使用。
附图说明
25.图1:其中一组异胡豆苷标准溶液的谱图。
26.图2:异胡豆苷的标准曲线。
27.图3:对照管中产物的谱图。
28.图4:测定管中产物的谱图。
具体实施方式
29.下面通过具体实施例进行详细阐述,说明本发明的技术方案。
30.首先准备试验用品:高效液相色谱仪、离心机、氮吹仪、溶剂抽滤装置、针头式过滤器(有机系,50个,0.22μm)、滤膜(水系和有机系各1个,0.45μm)、c18柱(4.6
×
250mm)、可调式移液器、样品瓶(50个,2ml)、乙腈(色谱级)和超纯水。
31.下列实施例1和实施例2中,用到的水均为超纯水。
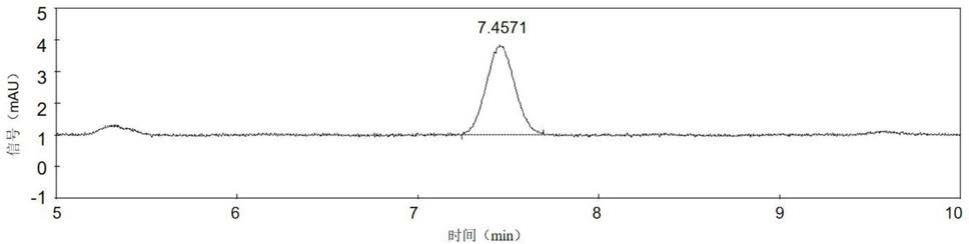
32.实施例1
33.绘制异胡豆苷的标准曲线。
34.1、准备流动相
35.首先,将超纯水500ml和乙腈500ml用0.45μm的滤膜抽滤,以除去溶剂中的杂质,防止堵塞色谱柱。(注:超纯水用水系滤膜抽滤,乙腈用有机系滤膜抽滤)。
36.然后,将乙腈和超纯水按照20:80的体积比制成流动相,该实施例1中可取100ml乙腈和400ml超纯水混合,然后再加入0.4ml磷酸,混匀。
37.最后,将配制好的流动相超声20min,以脱去流动相中的气泡,防止堵塞色谱柱。
38.2、绘制异胡豆苷的标准曲线
39.首先,配制多组浓度不同且浓度已知的异胡豆苷标准溶液(溶剂是乙腈),备用;
40.然后,对高效液相色谱仪进行条件设置,设置紫外波长为254nm,流速为1ml/min,柱温30℃,进样体积10μl,测试时间10min。
41.然后,将异胡豆苷标准溶液加入高效液相色谱仪中进行测试,得到一系列异胡豆苷标准溶液的谱图,如图1为其中一组异胡豆苷标准溶液的谱图,出峰时间为7.4571min;一系列异胡豆苷标准溶液的浓度,以及与其对应的谱图中的峰面积,如表1所示。
42.表1异胡豆苷标准溶液的浓度与对应的谱图中的峰面积
43.x(浓度μg/ml)20501005001000y(峰面积)0.9212.1023.4615.4132.234
44.根据表1中的数据,进行曲线拟合,如图2所示,得到拟合后的异胡豆苷标准溶液的标准曲线:y=0.0317x+0.2481,r2=0.9991。
45.其中,x:异胡豆苷溶液的浓度,y:峰面积,r2≈1,说明标准曲线的可靠性较高。
46.实施例2
47.采用异胡豆苷合成酶活性的检测试剂盒对植物样本中异胡豆苷合成酶的活性进行检测。
48.异胡豆苷合成酶活性的检测试剂盒,包括以下试剂:
49.试剂1:0.588g tris+0.04g mgso4·
7h2o+0.042g dtt+11.3g蔗糖+盐酸+水,4℃保存;
50.试剂2:色胺,粉剂1瓶,4℃保存;
51.试剂3:裂环马钱子苷,粉剂1瓶,4℃保存;
52.试剂4:atp(腺嘌呤核苷三磷酸),-20℃保存;
53.其中,试剂1的制备过程为:将0.588g tris、0.04g mgso4·
7h2o、0.042g dtt和11.3g蔗糖加入水中溶解后,用盐酸调节ph为7.5,然后定容至100ml,4℃保存;
54.一种异胡豆苷合成酶活性的检测方法,使用上述异胡豆苷合成酶活性的检测试剂盒,包括如下步骤:
55.在临用之前,称取0.16g试剂2,加入10ml试剂1,充分溶解后形成试剂5,4℃保存,备用;称取0.388g试剂3,加入10ml试剂1,充分溶解后形成试剂6,4℃保存,备用;称取0.24g试剂4,加入5ml水,充分溶解后形成试剂7,-20℃保存,备用。
56.试剂4的atp为反应提供能量,促进反应的正常进行。采用试剂1来分别溶解试剂2、试剂3和试剂4,可使从植物样本中提取的异胡豆苷合成酶保持稳定,不易失活,保证反应正常进行,并提高检测的准确度。
57.1、对长春花植物样本进行异胡豆苷合成酶的提取:取新鲜的长春花植物样本0.2g,置于研钵中,加入2ml预冷的试剂1,在冰浴条件下研磨成浆,然后将浆液置于离心机中,在10000rpm条件下,4℃离心10min,取上清液于ep管中,置于冰上冷却备用;上清液即为植物样本提取液;
58.2、分别再取2支ep管,分别为测定管和对照管,在测定管中加入步骤1中得到的上清液200μl,然后将对照管放入沸水浴中水浴5min,然后取出冷却至室温,然后再依次加入试剂5100μl、试剂6100μl和试剂7100μl,混合均匀;在对照管中依次加入步骤1中得到的上清液200μl、试剂5100μl、试剂6100μl和试剂7100μl,混合均匀;最后将测定管和对照管同时置于25℃水浴中,保温反应60min;
59.其中,对照管中的步骤1中得到的上清液在沸水浴中水浴5min,其中的异胡豆苷合成酶的活性受热破坏,因此可做为空白对照;
60.3、保温反应结束后,加入500μl乙腈终止反应,混匀后静置2min。将测定管和对照管中的液体经过0.22μm滤膜过滤,过滤后的滤液送入高效液相色谱仪中进行检测;
61.其中,高效液相色谱仪的条件设置与实施例1相同。
62.对照管中的样品得到的高效液相色谱图如图3所示,出峰时间为7.4801min;测定管中的样品得到的高效液相色谱图如图4所示,出峰时间为7.4701min。
63.记对照管中样品的色谱图中信号峰的面积为s
对照
,检测管中样品的色谱图中信号峰的面积为s
检测
。
64.4、按样本鲜重计算异胡豆苷合成酶的活性:
65.活性=[(s
检测-0.2481)/0.0317-(s
对照-0.2481)/0.0317]
·
2.5
·
2/(t
·
w)。
[0066]
其中,活性:异胡豆苷合成酶的活性,单位为μg/min/g鲜重,即将每g植物样本鲜重每分钟合成1μg的异胡豆苷定义为1个酶活力单位,最终得到的活性数值代表检测的植物样本中异胡豆苷合成酶的活性为多少酶活力单位,以此可以定量分析试验的植物样本中异胡豆苷合成酶的活性;
[0067]s检测
:检测管中样品的色谱图中信号峰的面积;
[0068]s对照
:对照管中样品的色谱图中信号峰的面积;
[0069]
2.5:稀释倍数,上述步骤2中,取上清液200μl,加入试剂5100μl、试剂6100μl,以及试剂7100μl,相当于上清液被稀释了2.5倍,所以计算结果中需要乘以2.5;
[0070]
1:提取体积,上述步骤1中,取0.2g样本,加入2ml的试剂1,这个2就是提取体积2ml;
[0071]
t:反应时间,即60min;
[0072]
w:步骤1中称取的植物样本质量,即0.2g。
[0073]
根据高效液相色谱图中的峰面积s
检测
和s
对照
,计算即可得到拟南芥植物样本中水杨酸-3-羟化酶的活性:
[0074]
活性=[(s
检测-0.2481)/0.0317-(s
对照-0.2481)/0.0317]
·
2.5
·
2/(t
·
w)=13.1441
·
(s
检测-s
对照
)。
[0075]
实施例2中,在正式测定前选择2-3个预期差异较大的样本做预测定,以提高实际测定结果的准确度。
[0076]
以上所述仅为本发明的较佳实施例,并不用于限制本发明,凡在本发明的设计构
思之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1