包含人IV型胶原7S结构域的片段的测定方法以及用于该测定方法的试剂盒与流程
包含人iv型胶原7s结构域的片段的测定方法以及用于该测定方法的试剂盒
技术领域
1.本发明涉及试样中的包含人iv型胶原7s结构域的片段的测定方法以及用于该测定方法的试剂盒。
背景技术:
2.iv型胶原是与层粘连蛋白(laminin)一同构成基底膜的主要蛋白质,以具有由3条α链构成的螺旋结构的三聚体作为结构单元。虽然根据组织而构成所述三聚体的亚单位不同,但在以肝脏为例的许多组织中,所述三聚体由两条α1链和一条α2链构成。iv型胶原分子在形成所述螺旋结构的th结构域(triple helical collagenous domain)的两端具有iv型胶原分子特有的结构,将n末端的结构称为7s结构域,将c末端的结构称为nc1结构域(noncollagenous domain)。c末端的nc1结构域与其它iv型胶原分子的nc1结构域形成二聚体,另外,n末端的7s结构域与其它iv型胶原分子的7s结构域形成四聚体。这些多聚体均通过共价键分别牢固地结合,通过这些的聚合,iv型胶原分子形成网眼结构(chicken-wire network)。
3.众所周知,人的肝脏中,基于乙型、丙型的病毒性慢性肝炎或酒精性慢性肝炎的长期化、进行性的非酒精性脂肪性肝炎(non-alcoholic steatohepatitis:nash)等,肝纤维化逐渐进行而发展为肝硬化或肝癌,而此时iv型胶原增加。由于iv型胶原伴随着这样的肝纤维化的进行而从基底膜漏出到血中的量增加,因此来源于iv型胶原分子的成分的血中浓度成为肝纤维化进行的指标。特别是,认为通过共价键牢固地结合的7s结构域不易受到蛋白水解酶的影响并在血液中也稳定,从而作为用于肝纤维化的进展度(重症度)或肝硬化的诊断的生物标记使用。
4.但是,作为诊断剂得到批准的这样的7s结构域的测定试剂,只有作为使用了放射性免疫测定(ria)的诊断剂的“iv型胶原
·
7s试剂盒(denis pharma株式会社制造)”。iv型胶原
·
7s试剂盒是使用抗人iv型胶原兔多克隆抗体的试剂。
5.另外,在日本特开平2-1553号公报(专利文献1)中记载了如下方法:将与胃蛋白酶可溶化人iv型胶原7s结构域进行交叉反应的单克隆抗体作为酶标记抗体,使仅与人iv型胶原7s结构域反应的单克隆抗体与固相载体结合而作为抗体结合固相载体(捕获抗体),通过一步法夹心免疫测定对人iv型胶原7s结构域进行定量。现有技术文献专利文献
6.专利文献1:日本特开平2-1553号公报
技术实现要素:
发明要解决的技术问题
7.但是,在所述iv型胶原
·
7s试剂盒中,使用针对人iv型胶原的多克隆抗体,并且由
于是以结合竞争抑制为原理,因此测定精度还不充分。特别是,本发明人等发现了如下技术问题:来源于健康人的样本的测定值变高,假阳性率变高,不适于肝纤维化的初期阶段的患者的筛选或鉴别。
8.另外,在来源于发生了肝纤维化的患者(肝硬化患者、nash患者等)的血中,作为包含7s结构域的iv型胶原片段,存在小~大分子各种形态的胶原片段,而本发明人们发现:所述iv型胶原
·
7s试剂盒、或将与胃蛋白酶可溶化人iv型胶原7s结构域进行交叉反应的单克隆抗体用作酶标记抗体的专利文献1中记载的方法并不能充分检测小分子化的胶原片段,因此难以全部网罗这些胶原片段来进行测定,由此,存在测定精度有时根据样本而降低的技术问题。
9.进而,本发明人发现:在这些以往的方法中,由于容易受到试样中包含的iv型胶原的7s结构域以外的部位或其它成分的影响,所以也存在测定精度容易降低的技术问题。
10.本发明是鉴于上述本发明人等新发现的技术问题而完成的,其目的在于提供一种测定方法以及用于其的试剂盒,其不会使针对来源于患者的试样(阳性样本)的特异性降低,能够使针对来源于健康人的试样(阴性样本)的非特异性降低,并且能够高精度地测定试样中的包含人iv型胶原7s结构域的片段。用于解决技术问题的技术方案
11.为了解决上述技术问题进行了潜心研究,结果本发明人们发现:通过组合了能够对人iv型胶原7s结构域进行部位特异性结合的单克隆抗体的夹心免疫测定,其不会使来源于患者的试样(阳性样本)的测定值降低,能够充分降低来源于健康人的试样(阴性样本)的测定值,特别是在包含人iv型胶原7s结构域的片段的低浓度区域中,能够实现比以往高的测定精度。另外,根据该方法,作为包含7s结构域的iv型胶原片段,无论哪种形态的胶原片段均能够网罗性地测定,进一步地,也不易受到试样中存在的物质或iv型胶原的7s结构域以外的部位的影响,由此能够实现比以往更高的测定精度,从而完成了本发明。
12.由该见解得到的本发明的方式如下。[1]一种测定方法,使用能够与人iv型胶原7s结构域特异性结合的第一单克隆抗体固定在载体上而形成的捕获抗体和能够与人iv型胶原7s结构域特异性结合的第二单克隆抗体结合于标记物质而形成的标记抗体,通过夹心免疫测定来测定试样中的包含人iv型胶原7s结构域的片段。[2]根据[1]所述的测定方法,其包含:捕获工序,所述捕获工序使所述试样与所述捕获抗体接触,用所述捕获抗体捕获所述包含人iv型胶原7s结构域的片段;以及标记工序,所述标记工序在所述捕获工序之后,使所述标记抗体与被所述捕获抗体捕获的包含人iv型胶原7s结构域的片段接触,标记被所述捕获抗体捕获的包含人iv型胶原7s结构域的片段。[3]根据[1]或[2]所述的测定方法,其中,所述包含人iv型胶原7s结构域的片段与第一单克隆抗体的反应体系的盐浓度为0.35m以上。
[4]一种试剂盒,其用于[1]~[3]中任一项所述的测定方法,所述试剂盒包含:能够与人iv型胶原7s结构域特异性结合的第一单克隆抗体;能够与第一单克隆抗体结合的载体;能够与人iv型胶原7s结构域特异性结合的第二单克隆抗体;以及能够与第二单克隆抗体结合的标记物质。[5]根据[4]所述的试剂盒,其包含:第一单克隆抗体固定在所述载体上而形成的捕获抗体;以及第二单克隆抗体结合于所述标记物质而形成的标记抗体。发明效果
[0013]
根据本发明,能够提供一种测定方法以及用于其的试剂盒,其不会使针对来源于患者的试样(阳性样本)的特异性降低,能够使针对来源于健康人的试样(阴性样本)的非特异性降低,并且能够高精度地测定试样中的包含人iv型胶原7s结构域的片段。
附图说明
[0014]
图1是表示实施例1(1)的胶原酶处理中的sds-page的结果的电泳照片。图2是表示将iv型胶原7s片段作为抗原时的各单克隆抗体的浓度与吸光度的关系的图表。图3是表示将胃蛋白酶可溶化iv型胶原片段作为抗原时的各单克隆抗体的浓度与吸光度的关系的图表。图4是表示标准溶液中的iv型胶原7s片段的浓度与发光量的关系的图表。图5是表示标准溶液中的iv型胶原7s片段的实际浓度与定量值的变异系数的关系的图表。图6是表示实施例2的测定结果(cl 7s)和比较例1的测定结果(ria7s)的相关关系的分散图(dispersion diagram)。图7是表示仅对于健康人组,实施例2的测定结果(cl 7s)与比较例1的测定结果(ria 7s)的相关关系的分散图。图8是表示对于健康人组1,实施例3((b)cl 7s)以及比较例2((a)ria 7s)的测定值的分布的图表。图9是表示对于健康人组2,实施例3((b)cl 7s)以及比较例2((a)ria 7s)的测定值的分布的图表。图10是表示对于肝硬化组,实施例2(cl 7s)以及比较例1(ria 7s)的roc曲线的图。图11是表示对于nash组,实施例2(cl 7s)以及比较例1(ria 7s)的roc曲线的图。图12是表示使用civ09抗体固相化磁性粒子时的、样本lc58的各级分的发光量(a)、样本lc51的各级分的发光量(b)、健康人样本的各级分的发光量(c)的图表。图13是表示使用civ09抗体固相化磁性粒子时或civ03抗体固相化磁性粒子时的、样本lc58的各级分的发光量(a)、iv型胶原7s片段的各级分的发光量(b)的图表。
图14是表示使用civ09抗体固相化磁性粒子或civ03抗体固相化磁性粒子时的、样本lc51的各级分的发光量的图表。图15是表示图14的池(pool)1~6的各池的定量值(池回收值)的图表。
具体实施方式
[0015]
以下,根据本发明的优选实施方式详细地说明本发明。
[0016]
《包含人iv型胶原7s结构域的片段的测定方法》本发明提供一种包含人iv型胶原7s结构域的片段的测定方法(以下根据情况简称为“本发明的测定方法”),其使用能够与人iv型胶原7s结构域特异性结合的第一单克隆抗体固定在载体上而形成的捕获抗体和能够与人iv型胶原7s结构域特异性结合的第二单克隆抗体结合于标记物质而形成的标记抗体,通过夹心免疫测定来测定试样中的包含人iv型胶原7s结构域的片段。
[0017]
在本发明中,作为“试样”,只要是能够存在包含人iv型胶原7s结构域的片段的试样,就没有特别限制。一般而言,使用从诊断对象(人)采集的血液样本,作为所述血液样本,可举出血清、血浆、全血,优选举出血清或血浆,更优选为血清。另外,作为所述试样,可以是根据需要用下述稀释液适当稀释或悬浮而得到的试样,也可以是实施了前处理的试样。作为所述前处理,例如可举出胶原酶处理。
[0018]
(包含人iv型胶原7s结构域的片段)在所述试样(优选血液样本)中,作为来源于人iv型胶原分子的成分,能够存在从小分子到大分子的人iv型胶原分子的各种形态的片段。作为这样的片段的形态,例如,可举出:不包含th结构域以及nc1结构域的由7s结构域构成的片段(以下,根据情况称为“iv型胶原7s片段”);不包含nc1结构域以及7s结构域的由th结构域构成的片段;不包含th结构域以及7s结构域的由nc1结构域构成的片段;以及包含两个以上这些结构域的各自全部或一部分的片段;这些片段与其它基底膜成分、例如层粘连蛋白的复合物。需要说明的是,在本发明中,在“7s结构域”中,包含未形成多聚体的7s结构域以及形成二~四聚体的7s结构域的任一个,在“th结构域”中,包含未形成螺旋结构的th结构域以及形成所述螺旋结构的th结构域的任一个,在“nc1结构域”中,包含未形成多聚体的nc1结构域以及形成二聚体的nc1结构域的任一个。
[0019]
在本发明中,“iv型胶原7s片段”优选表示由7s结构域的四聚体构成并将通过胃蛋白酶消化而可溶化的胃蛋白酶可溶化iv型胶原片段进一步进行胶原酶处理而得到的分解产物的、相当于人iv型胶原7s结构域的四聚体的分子量的凝胶过滤级分,更具体而言,表示分子量为200,000(或质量为200kda)以上且400,000附近(例如300kda~440kda)的凝胶过滤级分中包含的片段,或具有与其相当的分子量的包含7s结构域的人iv型胶原的片段。所述胶原酶处理的时间根据添加的胶原酶的浓度而有所不同,例如优选为30分钟~14小时,处理温度优选为30~37℃。需要说明的是,在本发明中,“胃蛋白酶可溶化iv型胶原片段”是指通过胃蛋白酶消化而可溶化的人iv型胶原片段,表示下述中的两种以上的混合物:由7s结构域构成的片段(iv型胶原7s片段)、由th结构域构成的片段、由nc1结构域构成的片段、以及包含两个以上这些结构域的各自全部或一部分的片段。胃蛋白酶可溶化iv型胶原片段能够通过适当的现有公知的方法取得。例如,能够通过用胃蛋白酶处理来自人胎盘的包含
人iv型胶原分子的提取物而得到,也可以是市售品。
[0020]
在本发明中,作为测定对象的“包含人iv型胶原7s结构域的片段”,只要是包含7s结构域的人iv型胶原的片段即可,例如,可举出:所述iv型胶原7s片段;由7s结构域和th结构域的全部或一部分构成的片段;由7s结构域和th结构域的全部或一部分和nc1结构域构成的片段,可以是其中的单独1种,也可以是两种以上的混合物。根据本发明的测定方法,作为所述包含人iv型胶原7s结构域的片段,对于包含分子量小的所述iv型胶原7s片段,或者包含分子量大而7s结构域有可能未充分暴露的片段,都可以进行测定,能够比以往更高精度地测定包含人iv型胶原7s结构域的片段。
[0021]
(单克隆抗体)在本发明中,“能够与人iv型胶原7s结构域特异性结合的第一单克隆抗体”和“能够与人iv型胶原7s结构域特异性结合的第二单克隆抗体”(以下根据情况将这些统称为“抗7s结构域抗体”)是能够仅特异性识别并结合人iv型胶原7s结构域的单克隆抗体。即,所述抗7s结构域抗体不与人iv型胶原的7s结构域以外的部位结合。抗体是所述抗7s结构域抗体,例如,能够通过以下方式加以确认:能够特异性识别并结合所述iv型胶原7s片段;或者,能够与试样的凝胶过滤级分中相当于人iv型胶原7s结构域(优选四聚体)的分子量的级分中所包含的分子结合,并且不仅能够与包含th结构域或nc1结构域的iv型胶原片段(例如,通过胃蛋白酶处理而可溶化的胃蛋白酶可溶化iv型胶原片段)结合,还能够与所述iv型胶原7s片段结合。
[0022]
需要注意的是,在本发明的“抗体”中,除了完整的抗体以外,还包含抗体片段(例如,fab、fab'、f(ab')2、fv、单链抗体、双抗体等)或使抗体的可变结构域结合而得到的低分子化抗体。
[0023]
本发明所涉及的抗7s结构域抗体能够通过适当采用、改良现有公知的方法来产生,例如,能够通过融合抗体产生细胞和骨髓瘤细胞的细胞(杂交瘤)的产生单克隆抗体的方法(代表性的是通过基于科勒和米尔斯坦的方法(kohler&milstein,nature,256:495,1975)产生。
[0024]
作为所述抗体产生细胞,可举出:用免疫原免疫的动物(例如小鼠、大鼠、仓鼠、兔子、猴子、山羊、绵羊、驴、骆驼、羊驼、鸡)的脾脏细胞、淋巴结细胞、外周血白细胞等,也能够使用通过使免疫原在培养基中作用于从未免疫的动物中预先分离的上述细胞或淋巴细胞等而得到的抗体产生细胞。
[0025]
在本发明中,作为上述免疫原,只要是所述包含人iv型胶原7s结构域的片段即可,没有特别限定,例如,可举出:所述iv型胶原7s片段、所述胃蛋白酶可溶化iv型胶原片段、通过胶原酶将上述胃蛋白酶可溶化iv型胶原部分消化而得到的片段(相当于实施例的“胶原酶部分消化iv型胶原片段”)。
[0026]
作为所述骨髓瘤细胞,能够使用公知的各种细胞株。作为所述抗体产生细胞和所述骨髓瘤细胞,只要这些能够融合,则可以是来源于不同的动物种属的细胞,但优选是来源于同一动物种属的细胞。
[0027]
所述杂交瘤例如通过从用所述免疫原免疫的小鼠获得的脾细胞与小鼠骨髓瘤细胞之间的细胞融合而得到。从得到的许多杂交瘤中,筛选产生对所述iv型胶原7s片段显示出高反应性的单克隆抗体的杂交瘤,另外,根据需要从其中进一步进行筛选,对所得杂交瘤
产生的单克隆抗体进行表位分析,对产生与所述iv型胶原7s片段结合的单克隆抗体的克隆进行鉴定,由此能够获得产生能够与人iv型胶原7s结构域特异性结合的单克隆抗体(抗7s结构域抗体)的杂交瘤。该单克隆抗体能够通过培养该杂交瘤或从给药了该杂交瘤的哺乳动物的腹水中获得。
[0028]
另外,作为抗7s结构域抗体,例如,如果能够取得编码该抗体的dna,则也能够通过重组dna法制作。作为所述重组dna法,可举出通过从杂交瘤或所述抗体产生细胞等中克隆编码上述抗体的dna,将其插入适当的载体,将其导入宿主细胞(例如哺乳类细胞株、大肠杆菌、酵母细胞、昆虫细胞、植物细胞等),作为重组抗体而产生的方法(例如,p.j.delves,antibody production:essential techniques,1997,wiley;p.shepherd and c.dean monoclonal antibodies,2000,oxford university press;vandamme a.m.et al.,eur.j.biochem.192:767-775,1990)。在编码上述抗体的dna的表达中,可以将编码重链或轻链的dna分别插入表达载体来转化宿主细胞,也可以将编码重链和轻链的dna插入单一的表达载体来转化宿主细胞(例如,国际公开第94/11523号中记载的方法)。
[0029]
所述重组抗体能够通过培养所述宿主细胞,从培养的宿主细胞内或培养液中分离/纯化,从而以实质上纯粹且均匀的形态获得。所述重组抗体的分离/纯化能够使用通常的多肽的纯化中使用的方法。如果使用转基因动物制作技术来制作插入了抗体基因的转基因动物(例如牛、山羊、绵羊、猪等),则也能够从该转基因动物的奶中大量获得来源于抗体基因的单克隆抗体。
[0030]
本发明中,第一单克隆抗体和第二单克隆抗体可以相同也可以不同。在所述试样为血液样本的情况下,在该血液样本中,通常人iv型胶原7s结构域形成二~四聚体(优选四聚体),因此,即使第一单克隆抗体和第二单克隆抗体是识别/结合同一部位的同种抗体,也能够分别与多聚体中任一个iv型胶原7s结构域结合。
[0031]
(捕获抗体)在本发明的测定方法中,作为捕获所述包含人iv型胶原7s结构域的片段的捕获抗体,使用将第一单克隆抗体固定在载体上而形成的捕获抗体。
[0032]
在本发明中,作为“载体”,只要能够使第一单克隆抗体固定并担载的载体,就没有特别限制。作为这样的载体的材质,只要是一般在免疫测定中使用的材质即可,没有特别限制,例如,可举出:高分子聚合物(例如聚苯乙烯、(甲基)丙烯酸酯、聚甲基丙烯酸甲酯、聚酰亚胺、尼龙等)、明胶、纤维素、硝化纤维素、玻璃、胶乳、二氧化硅、金属(例如金、铂、铁、钴、镍等)、金属化合物(例如氧化铁、氧化钴、镍铁氧体等)以及这些的复合材料或合金。另外,作为所述载体,例如,可以是用羧基、环氧基、对甲苯磺酰基、氨基、羟基、异硫氰酸酯基、异氰酸酯基、叠氮基、醛基、碳酸酯基、烯丙基、氨基氧基、马来酰亚胺基、硫醇基、nhs酯(n-羟基酯)基中的1种或两种以上的活性基团进行表面修饰而得到的载体。
[0033]
另外,在本发明中,作为所述载体的形状也没有特别限制,例如可以是板、纤维、膜、粒子等中的任一种,但从容易控制固定的第一单克隆抗体的密度,具有容易变得均匀的倾向的观点出发,优选为粒子。进一步地,作为所述粒子,从自动化/短时间化的观点出发,优选为磁性粒子。
[0034]
所述载体为粒子时,作为其大小,没有特别限制,优选粒径在0.01~100μm的范围内,更优选在0.1~10μm的范围内。如果所述粒子的粒径不足所述下限,则在为磁性粒子的
情况下,存在需要更多的集磁所需要的磁和时间的倾向,另一方面,如果超过所述上限,则存在粒子的比表面积变小,第一单克隆抗体在粒子上的结合量变少的倾向。
[0035]
作为这样的粒子,能够适当使用以往公知的粒子,例如能够适当使用日本特开平3-115862号公报中记载的磁性粒子(铁氧体包覆粒子、羧基化铁氧体粒子)等公知的粒子,或dynabeads(thermo fisher社制造)、magnosphere(jsr株式会社制造)、magurapitud(
マグラピツド
)(三洋化成工业株式会社制造)等市售的粒子。另外,作为所述粒子,可以是单独使用其中的1种,也可以是两种以上的组合。
[0036]
作为本发明所涉及的捕获抗体的制造方法,作为在所述载体上固定第一单克隆抗体的方法,能够适当采用以往公知的方法或以其为基准的方法,可以直接固定在所述载体的表面,也可以间接固定。作为直接结合的方法,例如可举出对所述载体赋予所述活性基团,或者使用具有这些活性基团的物质作为所述载体,通过基于该活性基团的共价键结合第一单克隆抗体的方法。
[0037]
作为间接固定的方法,例如,通过将与第一单克隆抗体结合的物质固定在所述载体表面,使第一单克隆抗体与该物质结合,从而能够将第一单克隆抗体间接固定在所述载体表面。作为与第一单克隆抗体结合的物质,没有特别限制,例如可举出能够与第一单克隆抗体结合的二次抗体、蛋白g、蛋白a、具有所述活性基团的接头分子等接头。另外,当第一单克隆抗体被生物素化或抗生物素蛋白化(或链酶抗生物素蛋白化)时,也能够使所述载体被抗生物素蛋白化(或链酶抗生物素蛋白化)或生物素化,通过生物素与抗生物素蛋白(或链酶抗生物素蛋白)的相互作用来固定该抗体。
[0038]
另外,作为本发明的测定方法所涉及的捕获抗体,可以预先由第一单克隆抗体和能够与第一单克隆抗体结合的载体来制造直接或间接地将第一单克隆抗体固定在所述载体上而形成的捕获抗体,然后供给到夹心免疫测定,也可以向夹心免疫测定的反应体系中分别供给第一单克隆抗体和能够与第一单克隆抗体结合的载体,在该反应体系内将第一单克隆抗体固定在所述载体上,或者在形成第一单克隆抗体和包含人iv型胶原7s结构域的片段的复合物后将第一单克隆抗体固定在所述载体上。作为此时的“第一单克隆抗体和能够与第一单克隆抗体结合的载体”的组合,可举出上述的第一单克隆抗体与所述载体的任意组合,但在将这些分别提供给反应体系的情况下,优选将第一单克隆抗体间接地固定在所述载体上的方法中所述的第一单克隆抗体和固定有与第一单克隆抗体结合的物质的载体的组合、以及生物素化或抗生物素蛋白化(或链霉抗生物素蛋白化)的第一单克隆抗体与抗生物素蛋白化(或链霉抗生物素蛋白化)或生物素化的载体的组合。
[0039]
本发明所涉及的捕获抗体至少包含第一单克隆抗体和所述载体,除此之外,根据需要,也可以包含所述接头、封闭剂等。
[0040]
(标记抗体)在本发明的测定方法中,作为标记所述包含人iv型胶原7s结构域的片段的标记抗体,使用第二单克隆抗体与标记物质结合而形成的标记抗体。
[0041]
在本发明中,作为“标记物质”,只要是与第二单克隆抗体结合而能够检测出的物质即可,没有特别限制,例如,可举出:酶;吖啶鎓衍生物等发光物质;铕等荧光物质;别藻蓝蛋白(apc)和藻红蛋白(r-pe)等荧光蛋白质;
125
i等放射性物质;异硫氰酸荧光素(fitc)和异硫氰酸罗丹明(ritc)等低分子量标记物质;金粒子;抗生物素蛋白;生物素;胶乳;二硝基
苯酚(dnp);地高辛(dig)。其中,作为本发明所涉及的标记物质,从具有能够进行简便且具有稳定性的试验的倾向的观点、以及能够简便迅速且进行高灵敏度的测定的观点出发,优选酶以及发光物质,更优选酶。作为所述酶,例如能够举出辣根过氧化物酶(hrp)、碱性磷酸酶(alp)、β-半乳糖苷酶(β-gal)、葡萄糖氧化酶、荧光素酶,但并不限于这些。
[0042]
作为本发明所涉及的标记抗体的制造方法,作为使所述标记物质与第二单克隆抗体结合的方法,能够适当采用以往公知的方法或以其为基准的方法,可以直接结合,也可以间接结合。作为这样的结合方法,可举出与在本发明所涉及的捕获抗体中作为所述载体与第一单克隆抗体的结合方法举出的方法相同的方法。
[0043]
另外,作为本发明的测定方法所涉及的标记抗体,能够预先由第二单克隆抗体和能够与第二单克隆抗体结合的标记物质来制造所述标记物质和第二单克隆抗体直接或间接结合而形成的标记抗体,然后供给到夹心免疫测定,也可以向夹心免疫测定的反应体系中分别供给第二单克隆抗体和能够与第二单克隆抗体结合的标记物质,在该反应体系内使所述标记物质和第二单克隆抗体结合,或者在形成第二单克隆抗体和包含人iv型胶原7s结构域的片段的复合物后使所述标记物质和第二单克隆抗体结合。作为此时的“第二单克隆抗体和能够与第二单克隆抗体结合的标记物质”的组合,可举出上述的第二单克隆抗体和所述标记物质的任意组合,但在将这些分别提供给反应体系的情况下,优选第二单克隆抗体和结合有与第二单克隆抗体结合的物质的标记物质的组合、以及生物素化或抗生物素蛋白化(或链霉抗生物素蛋白化)的第二单克隆抗体和抗生物素蛋白化(或链霉抗生物素蛋白化)或生物素化的标记物质的组合。作为与第二单克隆抗体结合的物质,可举出与作为与第一单克隆抗体结合的物质而举出的物质相同的物质。
[0044]
本发明所涉及的标记抗体至少包含第二单克隆抗体和所述标记物质,除此之外,根据需要,也可以包含所述接头、封闭剂等。
[0045]
(夹心免疫测定)本发明的测定方法使用所述捕获抗体和所述标记抗体,通过夹心免疫测定来测定试样中的包含人iv型胶原7s结构域的片段。
[0046]
在本发明中,在“测定”中,除了以信号形式获取试样中的对象物质是否存在以及量的检测之外,还包含所述对象物质的量的定量或者半定量。在本发明中,所述对象物质的测定优选通过检测由标记物质产生的信号,根据需要对其进行定量来进行。所述“信号”包含基于显色(发色)、反射光、发光、荧光、放射性同位素产生的放射线等,除了能够用肉眼确认的信号之外,还包含能够通过与信号的种类对应的测定方法/装置确认的信号。
[0047]“夹心免疫测定”是用固定(固相化)在固相上的捕获用的抗体(在本发明中是“捕获抗体”)捕获对象物质(在本发明中是“包含人iv型胶原7s结构域的片段”),另外,使结合了标记物质的检测用抗体(在本发明中是“标记抗体”)识别所述对象物质,形成捕获抗体-对象物质-标记抗体的复合物,根据需要将其清洗后,进行与所述标记物质的种类对应的检测的方法。
[0048]
另外,在本发明的测定方法中,在“用固定(固相化)在固相上的捕获用的抗体(在本发明中是“捕获抗体”)捕获对象物质(在本发明中是“包含人iv型胶原7s结构域的片段”)”中包括:在形成未固定于固相(在本发明中是“载体”)上的第一抗体(在本发明中是“第一单克隆抗体”)与所述对象物质的复合物后,或者在形成未固定于固相上的第一抗体
与所述对象物质与所述标记抗体(或下述的第二抗体)的复合物后,在所述固相上固定形成了所述复合物的第一抗体,在该固相上经由第一抗体捕获所述对象物质(或所述对象物质以及所述标记抗体)。作为此时的第一抗体与固相的组合,包含其优选方式在内,与上述捕获抗体的“第一单克隆抗体和能够与第一单克隆抗体结合的载体”中举例的组合相同。
[0049]
进一步地,在本发明的测定方法中,在“使结合了标记物质的检测用抗体(在本发明中是“标记抗体”)识别所述对象物质”包括:在形成不与标记物质结合的第二抗体(在本发明中是“第二单克隆抗体”)与所述对象物质的复合物,或在形成未结合标记物质的第二抗体与所述对象物质与所述捕获抗体(或所述的第一抗体)的复合物后,使所述标记物质与形成了所述复合物的第二抗体结合,使该标记物质经由第二抗体识别所述对象物质(或者,所述对象物质和所述捕获抗体)。作为此时的第二抗体与标记物质的组合,包含其优选方式在内,与上述标记抗体的“第二单克隆抗体和能够与第二单克隆抗体结合的标记物质”中举例的组合相同。
[0050]
作为这样的夹心免疫测定,例如,可举出:作为化学发光免疫测定法(clia法)的一个方式的夹心clia法、作为化学发光酶免疫测定法(cleia法)的一个方式的夹心cleia法、作为放射免疫测定法(ria法)的一个方式的irma法(免疫放射定量法)、作为电化学免疫测定法(eclia法)的一个方式的夹心eclia法、作为荧光免疫测定法(fia法)的一个方式的夹心fia法。
[0051]
在本发明的测定方法中,所述包含人iv型胶原7s结构域的片段与第一单克隆抗体的反应体系(优选用所述捕获抗体捕获所述包含人iv型胶原7s结构域的片段的反应体系)的盐浓度为0.35m(m:mol/l,下同)以上。作为所述盐浓度,更优选为0.35~1.3m,进一步优选为0.42~1.0m,更进一步优选为0.43~0.99m。在本发明的测定方法中,特别是通过使所述盐浓度在所述范围内,能够进一步减轻来源于健康人的样本的非特异性反应,另外,能够进一步提高测定精度。
[0052]
本发明人发现:在包含人iv型胶原7s结构域的片段的测定中,通过使其与第一单克隆抗体结合时(优选用所述捕获抗体捕获时)的盐浓度高于以往的夹心免疫测定中的盐浓度(例如,0.15m左右),特别是能够减弱与来源于健康人的试样中包含的人iv型胶原7s结构域的结合,并且能够维持/增强与来源于发生了肝纤维化的患者(肝硬化患者、nash患者等)的试样中包含的7s结构域的结合。这是因为,作为包含人iv型胶原7s结构域的片段,来源于患者的试样中包含的胶原片段与来源于健康人的试样中包含的胶原片段的组成不同,根据本发明的测定方法,在高盐浓度中对来源于健康人的试样中包含的胶原片段的非特异性降低。另外,以下也被认为是一个原因:在试样中,根据所包含的th结构域等的长度或胶原的网眼结构的大小,7s结构域的暴露度不同的胶原片段的变化多样,甚至有分子量大者,因此,在低盐浓度中,由抗7s结构域抗体得到的测定值与实际的试样中的包含人iv型胶原7s结构域的片段量之间容易产生偏离,与此相对,通过提高盐浓度,该遮蔽解除,7s结构域暴露,能够消除所述偏离。
[0053]
作为所述包含人iv型胶原7s结构域的片段与第一单克隆抗体的反应体系(优选用所述捕获抗体捕获的反应体系),只要是包含所述试样与第一单克隆抗体(优选所述捕获抗体)与所述盐的反应体系,就没有特别限定,优选为水溶液,除此以外,还能够包含:生理盐水、纯化水;mes、tris、cfb、mops、pipes、hepes、三(羟甲基)甲基甘氨酸缓冲液、n-二甘氨酸
缓冲液、甘氨酸缓冲液等缓冲液;bsa等稳定化蛋白质;各种表面活性剂,另外,在采用反向夹心法或一步法的情况下,还能够包含所述标记抗体。另外,在这些其它成分中包含盐的情况下,所述反应体系的盐浓度中也包含该盐的浓度。
[0054]
另外,所述试样中包含盐的情况下,所述反应体系的盐浓度中也包含该盐的浓度。血液样本(全血、血清、血浆)中一般包含合计相当于140mm~150mm的盐。例如,在使用血液样本(全血、血清、血浆等)作为所述试样的情况下,如下述实施例所示,在50μl的包含0.6m~1.5m的盐的粒子(捕获抗体)悬浊液中加入30μl的作为试样的血清样本时,用所述捕获抗体捕获所述包含人iv型胶原7s结构域的片段的反应体系的盐浓度为0.43m~0.99m。
[0055]
作为所述盐,没有特别限定,优选为选自由碱金属离子、碱金属离子的无机盐和碱金属离子的有机盐组成的组中的至少1种,作为所述碱金属离子的无机盐,例如可举出碱金属的氯化物、碱金属的酒石酸盐、碱金属的硝酸盐、碱金属的硫酸盐。作为所述碱金属离子,优选钠离子、钾离子。在此情况下,所述盐浓度表示相当于碱金属离子的浓度的浓度。
[0056]
在这样的夹心免疫测定中,通过使第一单克隆抗体和能够与第一单克隆抗体结合的载体(例如所述捕获抗体)、所述试样、以及第二单克隆抗体和能够与第二单克隆抗体结合的标记物质(例如所述标记抗体)接触,最终形成所述复合物(捕获抗体-包含人iv型胶原7s结构域的片段(对象物质)-标记抗体)。作为这样的接触方法,没有特别限制,能够适当采用以往公知的方法或以其为基准的方法,例如,可举出在所述试样中添加第一单克隆抗体和所述载体(例如所述捕获抗体),和/或,第二单克隆抗体和所述标记物质(例如所述标记抗体)的方法;或者,例如,可举出在所述捕获抗体液(例如,所述载体为粒子时为粒子悬浊液)和/或所述标记抗体液中添加所述试样等的方法。另外,作为所述试样,能够适当使用用稀释液稀释或悬浮的物质。
[0057]
在使第一单克隆抗体和能够与第一单克隆抗体结合的载体(例如所述捕获抗体)、所述试样、以及第二单克隆抗体和能够与第二单克隆抗体结合的标记物质(例如所述标记抗体)分别接触时,优选使第一单克隆抗体(优选所述捕获抗体)与所述试样接触时的盐浓度满足所述条件,但其它没有特别限制,例如,除了所述捕获抗体液的溶剂(例如,所述载体为粒子时的粒子悬浮介质)、所述标记抗体液的溶剂、所述稀释液以外,还可以适当添加反应用缓冲液。作为所述捕获抗体液的溶剂、所述标记抗体液的溶剂、所述稀释液、所述反应用缓冲液,没有特别限制,例如能够分别独立地举出:生理盐水、纯化水;缓冲液(磷酸钠缓冲液、mes、tris、cfb、mops、pipes、hepes、三(羟甲基)甲基甘氨酸缓冲液、n-二甘氨酸缓冲液、甘氨酸缓冲液)等,另外,分别独立地可以为添加了bsa等稳定化蛋白质而得到的物质等。需要说明的是,在这些溶液中包含盐的情况下,所述反应体系的盐浓度中也包含该盐的浓度。另外,所述试样中包含盐的情况下,所述反应体系的盐浓度中也包含该盐的浓度。
[0058]
在所述复合物的形成中,作为反应体系中的第一单克隆抗体的含量(在是两种以上的组合的情况下是这些的合计量,以下相同),没有特别限制,能够根据试样的种类、浓度、检测方法等适当调整,因此没有特别限制,但从在短时间内高效捕获的观点出发,例如优选为0.000001~0.01w/v%,更优选为0.00001~0.001w/v%。需要说明的是,本说明书中“w/v%”的符号表示重量/体积百分比(g/100ml)。
[0059]
另外,在所述复合物的形成中,作为反应体系中的第二单克隆抗体的含量(在是两种以上的组合的情况下是这些的合计量,以下相同),没有特别限制,能够根据试样的种类、
浓度、检测方法等适当调整,因此没有特别限制,但从在短时间内高效捕获的观点出发,例如优选为0.000001~0.01w/v%,更优选为0.00001~0.001w/v%。
[0060]
进一步地,作为所述接触时的条件也没有特别限制,能够分别独立地适当调整,例如,能够在4~45℃,优选在20~37℃,ph6~9左右,优选ph6.5~8下,进行30秒~12小时左右,优选1分钟~1小时左右,但并不限定于这些条件。
[0061]
作为所述夹心免疫测定,能够举出:作为二步法的正向夹心法(依次进行基于载体的捕获(优选为捕获抗体与试样中的包含人iv型胶原7s结构域的片段的反应)、基于标记物质的识别(优选为与捕获抗体结合的包含人iv型胶原7s结构域的片段与标记抗体的反应)的方法)、反向夹心法(预先通过标记物质识别(优选为使标记抗体与试样中的包含人iv型胶原7s结构域的片段反应)、用载体捕获(优选与捕获抗体反应)生成的复合物的方法)、以及一步法(同时用一步进行捕获抗体、试样中的包含人iv型胶原7s结构域的片段和标记抗体的反应的方法),能够采用这些中的任一种。
[0062]
其中,作为本发明的测定方法,从测定精度的观点出发,优选二步法,更优选正向夹心法。作为这样的正向夹心法的本发明的测定方法的方式,例如,可举出一种测定方法,其包含:捕获工序,所述捕获工序使所述试样与所述捕获抗体接触,用所述捕获抗体捕获所述包含人iv型胶原7s结构域的片段;以及标记工序,所述标记工序在所述捕获工序之后,使所述标记抗体与被所述捕获抗体捕获的包含人iv型胶原7s结构域的片段接触,标记被所述捕获抗体捕获的包含人iv型胶原7s结构域的片段。
[0063]
[捕获工序]在所述捕获工序中,使所述捕获抗体和所述试样接触,经由所述包含人iv型胶原7s结构域的片段与第一单克隆抗体的结合,使所述捕获抗体捕获所述包含人iv型胶原7s结构域的片段,即形成第一单克隆抗体与所述包含人iv型胶原7s结构域的片段的第一免疫复合物。作为使所述捕获抗体与所述试样接触的方法以及此时的条件,没有特别限制,但优选满足所述盐浓度的条件,能够应用上述的使所述捕获抗体、所述试样以及所述标记抗体分别接触的方法以及条件中记载的方法以及条件。
[0064]
[清洗工序]作为本发明的测定方法,优选在所述捕获工序之后且在下述的标记工序之前,还包含将被所述捕获抗体捕获的包含人iv型胶原7s结构域的片段和除此以外的未与所述捕获抗体结合(未捕获)的夹杂物分离,除去所述夹杂物的清洗工序。作为除去所述夹杂物的方法,没有特别限制,能够适当采用以往公知的方法或以其为基准的方法,例如,可举出在所述捕获工序之后通过离心或集磁回收所述捕获抗体而除去液相(上清)的方法。另外,在所述清洗工序中,接着也能够根据需要反复进行清洗液的注入和除去。作为所述清洗液,例如,可举出:中性(优选ph6~9)的公知的缓冲液(磷酸钠缓冲液,mes、tris、cfb、mops、pipes、hepes、三(羟甲基)甲基甘氨酸缓冲液、n-二甘氨酸缓冲液、甘氨酸缓冲液等),另外,分别独立地也可以是添加了bsa等稳定化蛋白质、表面活性剂等而得到的物质。
[0065]
[标记工序]在所述标记工序中,使所述标记抗体与被所述捕获抗体捕获的包含人iv型胶原7s
结构域的片段接触,标记被所述捕获抗体捕获的包含人iv型胶原7s结构域的片段,即形成第二单克隆抗体与被所述捕获抗体捕获的包含人iv型胶原7s结构域的片段的第二免疫复合物。作为使所述标记抗体与被所述捕获抗体捕获的包含人iv型胶原7s结构域的片段接触的方法以及此时的条件,没有特别限制,能够应用上述的使所述捕获抗体、所述试样以及所述标记抗体分别接触的方法以及条件中记载的方法以及条件。
[0066]
通过上述捕获工序以及标记工序,形成包含捕获抗体-包含人iv型胶原7s结构域的片段-标记抗体的所述复合物(第二免疫复合物)。在所述标记工序之后,为了除去没有形成所述复合物的标记抗体等,根据需要也可以包含清洗工序。作为该清洗工序,与上述的清洗工序相同。
[0067]
在本发明的测定方法中,用与该标记物质对应的规定的方法测定所述复合物(捕获抗体-包含人iv型胶原7s结构域的片段-标记抗体)的标记物质。例如,所述标记抗体的标记物质为酶时,添加与该酶对应的发色底物、发光底物、化学发光底物等,检测通过使酶与底物反应而产生的信号(发色、发光等)。由此,能够将试样中的包含人iv型胶原7s结构域的片段是否存在和量以信号形式检测出来。另外,试样中的包含人iv型胶原7s结构域的片段的量的定量一般通过与包含各浓度的包含人iv型胶原7s结构域的片段的标准溶液的测定值的比较来进行。作为所述标准溶液中使用的包含人iv型胶原7s结构域的片段,没有特别限制,例如,可举出:所述iv型胶原7s片段、所述胶原酶部分消化iv型胶原片段。在这种情况下,例如,通过调查在试样中得到的测定值位于根据标准溶液的测定值制作的标准曲线上的哪个位置,从而能够求出试样中的包含人iv型胶原7s结构域的片段的量。
[0068]
本发明的测定方法能够用于与iv型胶原的血中浓度异常相关的疾病的诊断(罹患或其风险的评价)及其辅助。在此,作为“与iv型胶原的血中浓度异常相关的疾病”,例如可举出:肝纤维化进行的疾病,例如,可举出:b型、c型的病毒性慢性肝炎、酒精性肝炎、非酒精性脂肪性肝炎(nash)、肝硬化、肝癌。
[0069]
另外,本发明的测定方法也能够用于所述肝纤维化的进展度(重症度)的诊断或其辅助或鉴别、或有可能引起肝纤维化的患者的筛选。特别是,根据本发明的测定方法,不会使针对来源于患者的试样(阳性样本)的特异性降低,能够使针对来源于健康人的试样(阴性样本)的非特异性降低,能够在包含人iv型胶原7s结构域的片段的低浓度区域实现高的测定精度,因此作为用于肝纤维化进展度在初期阶段的患者的、从健康人组的筛选以及与健康人的鉴别的测定方法是非常有用。
[0070]
《用于包含人iv型胶原7s结构域的片段的测定方法的试剂盒》本发明也提供一种包含人iv型胶原7s结构域的片段的测定方法用试剂盒(以下,根据情况简称为“本发明的试剂盒”),其是用于所述本发明的测定方法的试剂盒,所述试剂盒包含:能够与人iv型胶原7s结构域特异性结合的第一单克隆抗体;能够与第一单克隆抗体结合的载体;能够与人iv型胶原7s结构域特异性结合的第二单克隆抗体;以及能够与第二单克隆抗体结合的标记物质。作为本发明的试剂盒,优选以下方式,包含:第一单克隆抗体固定在所述载体上而形成的捕获抗体;以及第二单克隆抗体结合于所述标记物质而形成的标记抗体。
[0071]
作为本发明的试剂盒中包含的第一单克隆抗体、能够与第一单克隆抗体结合的载体、第二单克隆抗体、能够与第二单克隆抗体结合的标记物质、捕获抗体和标记抗体,包括优选方式在内分别如本发明的测定方法中所述那样。另外,作为本发明的试剂盒中包含的第一单克隆抗体、能够与第一单克隆抗体结合的载体、第二单克隆抗体、能够与第二单克隆抗体结合的标记物质、捕获抗体和标记抗体,可以各自独立地为固体(粉末)状,也可以为溶解于缓冲液等中的液体状。
[0072]
作为本发明的试剂盒,还可以具备elisa、cleia、eclia、clia、fia、免疫层析等通常的夹心分析中应具备的构成。例如,还能够具备从由所述标准溶液(各浓度)、对照试剂、所述稀释液、所述捕获抗体液的溶剂(粒子悬浊液等)、所述标记抗体液的溶剂、所述反应用缓冲液、所述清洗液以及稀释用盒构成的组中选出的至少一种。另外,例如,在所述标记物质为酶的情况下,还可以包含该标记物质的检测/定量所需的底物或反应停止液等。进一步地,根据需要,还可以包含用于进行试样的前处理的前处理液或该试剂盒的使用说明书等。实施例
[0073]
以下,基于实施例和比较例对本发明进行更具体的说明,但本发明并不限定于以下的实施例。需要说明的是,在各实施例和比较例中,“%”的符号在没有特别记载的情况下,是指重量/体积百分比(w/v%:g/100ml)。
[0074]
《使用抗iv型胶原7s结构域单克隆抗体的夹心免疫测定》(实施例1)(1)胶原酶处理iv型胶原7s片段基于risteli等的方法(eur j biochem,108,p.239-250)进行制备。即,首先,将通过胃蛋白酶消化制备的胃蛋白酶可溶化iv型胶原片段(来源于人胎盘,sigma社,c-7521)溶解于0.5m乙酸中,对包含0.2m的nacl、2mm的cacl2的50mm的tris(ph7.2)进行透析。接着,向其中加入胶原酶(collagenase“amano”,wako社,607-19021),在37℃下培养1小时,进一步消化胃蛋白酶可溶化iv型胶原片段(胶原酶处理)。将胶原酶处理后的处理液离心分离,将上清通过凝胶过滤进一步分离。分别使用superdex200pg 16/60作为凝胶过滤柱,使用1mm的edta 3na、pbs作为凝胶过滤缓冲液。图1中,显示了mw marker(no.1,分子量/1000)、胃蛋白酶可溶化iv型胶原片段(no.2)、胶原酶处理后的处理液(no.3)及其沉淀(no.4)和上清(no.5),各级分(fraction(gf fr.3~7;no.6~10)的sds-page(2-15%pag non-reduce)的结果。将相当于人iv型胶原7s结构域的四聚体的分子量的分子量为250,000(或质量为250kda)以上且分布在400,000附近(300kda~440kda)的级分集中,作为以下的iv型胶原7s片段使用。
[0075]
在本实施例和比较例中,“iv型胶原7s片段”是不含th区结构域的由7s结构域构成的人iv型胶原片段,能够通过这样利用胶原酶进行处理,并且选择凝胶过滤级分来获得。另外,作为下述的免疫原,使用胶原酶部分消化iv型胶原片段。“胶原酶部分消化iv型胶原片段”是以分子量为500k以上的物质为主成分的、通过胶原酶在25℃的处理温度下将胃蛋白酶可溶化iv型胶原片段(sigma社制造)消化1小时,从而制备的片段,是主要由所述iv型胶原7s片段和由7s结构域及th区结构域的一部分构成的人iv型胶原片段构成的混合物。需要说明的是,所述的“胃蛋白酶可溶化iv型胶原片段”是通过利用胃蛋白酶消化进行可溶化而制备的片段,是由7s结构域、th结构域或nc1结构域构成的人iv型胶原片段、以及包含两个
以上其中的各自全部或一部分的人iv型胶原片段的混合物。
[0076]
(2)单克隆抗体的制作以所述(1)中制备的“胶原酶部分消化iv型胶原片段”作为免疫原,制作单克隆抗体。具体而言,对于balb/c小鼠,将10μg(1mg/ml)的胶原酶部分消化iv型胶原片段与等量的完全弗氏佐剂混合,间隔两周进行两次腹腔内免疫。进一步地,用不完全弗氏佐剂间隔两周时间进行两次腹腔免疫。进一步地,将10μg的溶解于pbs中的胶原酶部分消化iv型胶原片段作为最终免疫给药尾静脉内。最终免疫后第3天,从该小鼠摘除脾脏,解离成单个细胞,用rpmi-1640培养基清洗3次。将对数增殖期的小鼠骨髓瘤细胞株sp2/oag14用rpmi-1640培养基清洗3次后,与所述脾脏细胞混合,进行细胞融合。将得到的融合细胞通过离心分离(200
×
g,5分钟)除去peg后,悬浮于包含10%胎牛血清、以及次黄嘌呤、氨基蝶呤和胸苷(hat)的rpmi-1640培养基中,接种于96孔细胞培养板中。培养约10天而仅使杂交瘤增殖。
[0077]
将胃蛋白酶可溶化iv型胶原片段和上述(1)中制备的iv型胶原7s片段作为抗原,分别用pbs稀释至1μg/ml,以100μl/孔分注到96孔板(nunc maxisorp社,469914)中。在4℃下使各抗原吸附过夜后,将板在封闭缓冲液(1%bsa,3%蔗糖,0.1%proclin300,pbs中)中封闭两小时。接着,加入上述制备的杂交瘤的培养上清,培养1小时。用清洗缓冲液(0.05%tween 20in pbs)清洗4次后,在各孔中添加100μl/孔的5000倍稀释的pod-goat抗小鼠iggfcγ(jackson immuno research社,115-036-071)。培养30分钟后,用清洗缓冲液清洗各孔4次,用tmb溶液(nacalai社,05298)使其发色。用h2so4使发色反应停止,用酶标仪测定各孔的吸光度。
[0078]
由此,选择出产生与固相化所述iv型胶原7s片段的板结合的、抗iv型胶原7s结构域单克隆抗体(抗7s结构域抗体)的杂交瘤株(civ09株、civ13株)。这样选择出的civ09株和civ13株与所述胃蛋白酶可溶化iv型胶原片段和所述iv型胶原7s片段均结合。另一方面,选择出产生抗iv型胶原单克隆抗体的杂交瘤株(civ03株),该抗iv型胶原单克隆抗体与固相化所述胃蛋白酶可溶化iv型胶原片段的板结合,但不与固相化所述iv型胶原7s片段的板结合。各杂交瘤株用无血清培养基(hybridoma sfm,gibco社)培养,用蛋白a柱从得到的培养上清纯化,得到分别包含各抗iv型胶原7s结构域单克隆抗体和抗iv型胶原单克隆抗体的抗体溶液。各抗体溶液的蛋白质浓度由波长280nm下的吸光度决定。
[0079]
(3)单克隆抗体的反应特异性的确认将上述(1)中制备的iv型胶原7s片段和胃蛋白酶可溶化iv型胶原片段作为抗原,分别用pbs稀释至1μg/ml,以100μl/孔分注到96孔板中。在4℃下使各抗原吸附过夜后,将板在所述封闭缓冲液中封闭两小时。接着,将所述(2)中得到的各抗体溶液逐级稀释成1000ng/ml~3.9ng/ml并以100μl/孔分注,培养1小时。用所述清洗缓冲液清洗4次后,在各孔中添加100μl/孔的5000倍稀释的所述pod-goat抗小鼠iggfcγ。培养30分钟后,用清洗缓冲液清洗各孔4次,用tmb溶液使其发色。用h2so4使发色反应停止,用酶标仪测定各孔的吸光度。
[0080]
分别地,图2示出了以所述(1)中制备的iv型胶原7s片段为抗原时的各单克隆抗体的浓度(ab浓度(ng/ml))与吸光度(波长450nm与630nm之比(a450/630),下同)的关系的结果,图3示出了以胃蛋白酶可溶化iv型胶原片段为抗原时的各单克隆抗体的浓度(ab浓度(ng/ml))与吸光度的关系的结果。确认了分别得到:与所述胶原酶处理得到的iv型胶原7s
片段特异性结合的单克隆抗体(civ09、civ13:抗iv型胶原7s结构域单克隆抗体)、和与胃蛋白酶可溶化iv型胶原片段结合,但不与iv型胶原7s片段结合的单克隆抗体(civ03::抗iv型胶原单克隆抗体)。
[0081]
(4)抗体结合粒子的制作使用羧基-胺交联剂(碳二亚胺,thermo-fisher scientific社),按照产品手册,使抗iv型胶原7s结构域单克隆抗体civ09(以下,根据情况称为“civ09抗体”)与磁性粒子(fujirebio社制造)化学结合,得到civ09抗体固相化磁性粒子。同样地,使抗iv型胶原单克隆抗体civ03(以下,根据情况称为“civ03抗体”)与磁性粒子化学结合,得到civ03抗体固相化磁性粒子。
[0082]
(5)标记抗体的制作将抗iv型胶原7s结构域单克隆抗体civ13(以下,根据情况称为“civ13抗体”)与来源于牛小肠的碱性磷酸酶(oriental yeast co.,ltd.制造)通过yoshitake等的方法(yoshitake et al.,j.biochem.1982,92(5),p.1413-1424)结合,制备碱性磷酸酶标记civ13抗体。即,首先,按照惯例,将脱盐处理后的civ13抗体和胃蛋白酶在0.1m柠檬酸缓冲液(ph3.5)中混合,在37℃下静置1小时,进行胃蛋白酶消化。使反应停止后,进行凝胶过滤纯化,得到除去了fc区域的civ13抗体。接着,添加2-巯基乙胺盐酸盐,进行硫醇化。再对其进行脱盐处理,得到civ13抗体的fab'片段。
[0083]
将n-(4-马来酰亚胺丁酰基)琥珀酰亚胺(gmbs)处理过的碱性磷酸酶与所述civ13抗体的fab'片段混合,进行偶联。向偶联液中加入2-巯基乙胺盐酸盐和碘乙酰胺,停止反应,由此得到碱性磷酸酶标记civ13抗体(alp标记civ13抗体)。
[0084]
(6)盐浓度的研究首先,向50μl的包含0.03%的所述(4)中制备的civ09抗体固相化磁性粒子且盐浓度不同的粒子悬浊液(50mm tris、1%bsa、0.15m~1.5mnacl)中加入30μl的试样,在37℃下反应8分钟。作为所述试样,使用来源于肝硬化或非酒精性脂肪性肝炎(肝病)或肝癌的患者的血清(患者样本)以及来源于健康人的血清(健康人样本)、以及分别用tris缓冲液(50mm tris、2%bsa、0.15m nacl、ph7.2)稀释成10ng/ml的、上述(1)中制备的iv型胶原7s片段(type iv col 7s)、胃蛋白酶可溶化iv型胶原片段(type iv col)、以及胶原酶部分消化iv型胶原片段(部分消化type iv col)。在所述粒子悬浮液包含0.15m、0.3m、0.6m、1.0m、1.2m和1.5m的nacl的情况下,添加了各试样的反应体系的盐浓度分别为0.15m、0.24m、0.43m、0.68m、0.80m和0.99m。
[0085]
反应后,用磁铁进行b/f分离,用lumipulse(注册商标)清洗液(fujirebio社制造)清洗后,加入50μl的包含1μg/ml的上述(5)中制备的alp标记civ13抗体的标记体液(50mm bis-tris、600mm nacl、2%bsa、1mm mgcl2、0.3mm zncl2),在37℃下反应8分钟。用磁铁进行b/f分离,用lumipulse清洗液清洗后,添加200μl的包含3-(2'-螺旋金刚烷)-4-甲氧基-4-(3"-磷酰氧基)苯-1,2-二氧杂环丁烷二钠盐(amppd)的lumipulse(注册商标)底物液(fujirebio社制造),在37℃下进行4分钟酶反应,测定波长463nm下的发光量。同样地,测定包含已知浓度的所述iv型胶原7s片段的标准溶液(50mm tris、0.15m nacl、2%bsa、ph7.2),制作标准曲线。使用制成的标准曲线,由各试样的发光量算出各试样中的包含7s结构域的人iv型胶原片段的浓度。
[0086]
结果如下述表1~表3所示。在表1~表3中,盐浓度表示所述粒子悬浮液的盐浓度,并且各值表示各条件下的发光量相对于粒子悬浮液的盐浓度0.15m时的发光量的比率(“%”)。另外,在表1中,患者样本的各值表示15个来源于肝病患者的样本的平均值(肝病平均),健康人样本的各值表示130个来源于健康人的样本的平均值(健康人平均)。另一方面,在表3中,患者样本和健康人样本分别表示各样本中的5个(样本1~5)的值。
[0087]
[表1]盐浓度0.15m0.6m1.0m1.2m1.5mtype iv col 7s100%104%101%103%106%肝病平均100%90%90%91%90%健康人平均100%83%80%80%76%
[0088]
[表2]盐浓度0.6m1.0m1.2m1.5mtype iv col105%123%132%164%部分消化type iv col104%114%118%117%
[0089]
[表3]
[0090]
如表1、表3所示,在试样为iv型胶原7s片段(type iv col 7s)的情况下,没有发现由于盐浓度的变化而发光量变化。另一方面,如表3所示,若将盐浓度设为0.3m(以反应体系的盐浓度计为0.24m),则患者样本、健康人样本的发光量都降低,健康人样本尤为降低。进一步地,如果从此将盐浓度提高到0.6m~1.0m(以反应体系的盐浓度计为0.43m~0.68m),则患者样本的发光量上升,但在健康人样本中,随着盐浓度变高,发光量降低,该倾向相对于患者样本显著增大。而且,如表1所示,当盐浓度为0.6m~1.5m(以反应体系的盐浓度计为0.43m~0.99m)时,健康人样本中的发光量显著降低。由此表明,在高盐浓度下,健康人样本中的非特异性反应尤为减轻。
[0091]
另外,如表1、表2所示,相对于没有发现由于盐浓度的变化而发光量变化的iv型胶原7s片段,在胃蛋白酶可溶化iv型胶原片段(type iv col)和胶原酶部分消化iv型胶原片段(部分消化type iv col)为试样时,如果盐浓度为0.6m(以反应体系的盐浓度计为0.43m)
以上,则发光量随着盐浓度增大而增加。认为这是因为:在胃蛋白酶可溶化iv型胶原片段或胶原酶部分消化iv型胶原片段中包含的、除iv型胶原7s片段以外的、包含th区结构域的一部分或全部的片段中,7s结构域被遮蔽,由于盐浓度上升而使遮蔽解除。
[0092]
由此认为:在样本中,包含7s结构域的人iv型胶原片段的变化多样,如所述胃蛋白酶可溶化iv型胶原片段或胶原酶部分消化iv型胶原片段中包含的包含th区结构域的片段那样,包含7s结构域被遮蔽而暴露度小的胶原片段,与此相对,通过使盐浓度上升,该暴露度达到一定程度,能够得到更准确的测定值。
[0093]
由以上确认了:特别是通过使反应体系的盐浓度为0.35m以上(例如0.43m(粒子悬浮液的盐浓度0.6m)以上),在组合使用抗iv型胶原7s结构域单克隆抗体固相化磁性粒子和标记抗iv型胶原7s结构域单克隆抗体的本发明的夹心免疫测定中,尤为减轻了健康人样本中的非特异性反应。
[0094]
(7)测定系统的灵敏度的研究作为试样,将上述(1)中制备的iv型胶原7s片段用标准溶液稀释液(50mm tris、0.15m nacl、2%bsa、ph7.2)进行重量稀释,制备8种稀释系列的标准溶液。除了将所述粒子悬浮液的盐浓度设为0.6m,使用所制备的试样之外,以与上述(6)相同的方式测量发光量,另外,使用标准曲线计算各试样中的包含7s结构域的人iv型胶原片段的浓度。测定中,对各低浓度标准溶液(2.0ng/ml以下)重复测定20次,对于其它,重复测定两次。
[0095]
图4中示出了标准溶液中的iv型胶原7s片段的浓度(7s浓度(ng/ml))与发光量(信号、平均值)的关系的结果。另外,图5中示出了标准溶液中的iv型胶原7s片段的实际浓度(7s浓度(ng/ml))与由标准曲线定量的包含7s结构域的人iv型胶原片段的浓度(定量值)的变异系数(cv值(%)、平均值)的关系的结果。检测限设为:比低浓度标准溶液的发光量(信号)的平均值-2sd(sd:标准偏差)值低0ng/ml时的测定计数的平均值+2sd的浓度。另外,定量限是变异系数(cv值(%))为10%以下的浓度。根据图4,检测限为0.1ng/ml以下,根据图5,定量极限为0.3ng/ml以下。
[0096]
《与现有方法(比较例)的对比》(实施例2)作为试样,分别使用30例来源于健康人的血清(健康人组)、56例来源于肝硬化患者的血清(肝硬化组)、38例来源于nash患者的血清(nash组)的样本。除了使用这些各样本以外,以与所述实施例1的(7)同样的方式测定发光量,使用标准曲线计算出各样本中的包含iv型胶原7s结构域的片段的浓度。
[0097]
(比较例1)对于与实施例2相同的样本,使用作为使用了抗人iv型胶原兔多克隆抗体的放射性免疫测定的iv型胶原
·
7s试剂盒(denis pharma社制造,以下,根据情况称为“ria试剂盒”),按照所附文件进行测定,计算出各样本中的包含iv型胶原7s结构域的片段的浓度。根据ria试剂盒,样本中的包含iv型胶原7s结构域的片段(ria试剂盒中、“iv型胶原
·
7s”、靶物质)与抗人iv型胶原兔多克隆抗体反应,形成包含iv型胶原7s结构域的片段-抗人iv型胶原兔多克隆抗体复合物(复合物1)。接着,若加入包含碘化的iv型胶原7s结构域的片段(ria试剂盒中、“iv型胶原
·
7s(
125
i)”)(标记抗原),则未与样本中的靶物质结合的抗人iv型胶原兔多克隆抗体与所述标记抗原反应,形成标记抗原-抗人iv型胶原兔多克隆抗体复合物
(复合物2)。向其中加入抗兔γ-球蛋白山羊血清(山羊抗体),该山羊抗体与复合物2反应,形成标记抗原-抗人iv型胶原兔多克隆抗体-山羊抗体复合物,并沉淀。由此,通过在除去未反应的标记抗原后测定沉淀物的放射能,能够求出所述靶物质(包含iv型胶原7s结构域的片段)的浓度。
[0098]
(相关性)在图6中示出了实施例2的测定结果(cl 7s:样本中的包含iv型胶原7s结构域的片段的浓度(ng/ml))与比较例1的测定结果(ria 7s:样本中的包含iv型胶原7s结构域的片段的浓度(ng/ml))之间的相关关系。另外,其中,在图7中仅示出关于健康人组的相关关系。需要说明的是,在图6中不包含下述的lc51、lc28(即,肝硬化组:54例)。如图6所示,基于本发明的组合了抗iv型胶原7s结构域单克隆抗体固相化磁性粒子和标记抗iv型胶原7s结构域单克隆抗体的夹心免疫测定的测定结果(cl 7s)和基于ria试剂盒的测定结果(ria 7s)的相关性非常高,相关系数为0.947。但是,如图7所示,仅在健康人组中,其相关系数低至0.581,可知根据本发明的夹心免疫测定,健康人样本的测定值明显下降。即,根据本发明的使用了所述单克隆抗体的夹心免疫测定,肝硬化组以及nash组的测定值不会降低,但能够仅使健康人组的测定值降低,与以往的ria试剂盒相比,能够更高精度地区分开患者组和健康人组。
[0099]
(诊断能力的评价1)(实施例3)作为试样,分别使用25例来源于健康人的血清(健康人组1)以及30例来源于健康人的血清(健康人组1)的样本。除了使用这些各样本以外,以与所述实施例2同样的方式测定发光量,使用标准曲线计算出各样本中的包含iv型胶原7s结构域的片段的浓度。
[0100]
(比较例2)除了使用与实施例3相同的样本以外,以与比较例1同样的方式使用ria试剂盒,计算出各样本中的包含iv型胶原7s结构域的片段的浓度。
[0101]
(分布)在图8中示出了关于健康人组1的实施例3((b)cl 7s)以及比较例2((a)ria 7s)的测定结果(测定值:样本中的包含iv型胶原7s结构域的片段浓度(ng/ml))的分布。另外,在图9中示出了关于健康人组2的、实施例3((b)cl 7s)以及比较例2((a)ria 7s)的测定结果的分布。
[0102]
如图8~9所示,确认了在本发明的使用了所述单克隆抗体的夹心免疫测定中,在任一健康人组中,与ria试剂盒相比,测定值均明显降低,能够降低健康人组中的假阳性率。
[0103]
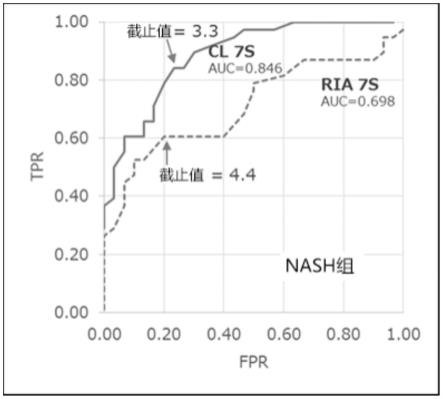
(诊断能力的评价2)通过roc(receiver operating characteristic,受试者操作特性)分析比较实施例2(cl 7s)以及比较例1(ria 7s)的诊断精度。分别地,在图10中示出了肝硬化组的roc曲线(fpr(假阳性率、1-特异性)和tpr(阳性率、灵敏度)曲线),在图11中示出nash组的roc曲线。如图10所示,在肝硬化组中,比较例1(ria 7s)中的auc值为0.824,与此相对,实施例2(cl 7s)中的auc值为0.898,表示在本发明的使用了所述单克隆抗体的夹心免疫测定中,肝硬化的诊断精度特别高。另外,如图11所示,在nash组中,比较例1(ria 7s)中的auc值为0.698,与此相对,实施例2(cl 7s)中的auc值为0.846,表示在本发明的夹心免疫测定中,
nash的诊断精度特别高。
[0104]
(可测定的iv型胶原的形态)在上述实施例2与比较例1的相关性中,在肝硬化组的样本中,发现了比较例1的测定值与实施例2的测定值相比非常低的偏离样本(lc51、lc28)。因此,对分别包含在该偏离大的肝硬化组的样本(lc51)、测定值的偏离比较小的肝硬化组的样本(lc58)、以及健康人组的样本(健康人样本)中的iv型胶原的形态进行了比较。
[0105]
(实施例4)首先,将500μl的各样本上样到用分级用缓冲液(50mm tris、150mm nacl、0.05%chaps、0.09%nan3、ph7.2)平衡化的superose 6fplc 10/300上,用该分级用缓冲液以0.5ml/min展开,进行凝胶过滤。以每级分为0.25ml的方式进行分级,作为试样,以与所述实施例1的(7)同样的方式测定各级分的发光量(cl信号)。另外,作为对照组试样,对所述(1)中制备的iv型胶原7s片段也以同样的方式进行分级并测定。
[0106]
(比较例3)作为比较对象,除了使用civ03抗体固相化磁性粒子作为所述抗体固相化磁性粒子以外,以与实施例4同样的方式测定各试样的各级分的发光量。
[0107]
[结果]分别地,在图12的(a)中示出了使用civ09抗体固相化磁性粒子时(实施例4)的样本lc58的各级分的发光量(实线),在图12的(b)中示出了使用civ09抗体固相化磁性粒子时(实施例4)的样本lc51的各级分的发光量(实线),在图12的(c)中示出了使用civ09抗体固相化磁性粒子时(实施例4)的健康人样本的各级分的发光量(实线)。在图12的(a)~(b)中还一并示出了iv型胶原7s片段的各级分的发光量(type iv col 7s、虚线)。另外,分别地,在图13的(a)中示出了使用civ09抗体固相化磁性粒子时(实施例4、实线)或使用civ03抗体固相化磁性粒子时(比较例3、虚线)的样本lc58的各级分的发光量,在图13的(b)中示出了iv型胶原7s片段的各级分的发光量。
[0108]
如图12的(a)所示,在样本lc58中,仅在高分子量级分检测到信号。另一方面,如图12(b)所示,在实施例2与比较例1之间偏离大的样本lc51中,除了所述高分子量级分以外,在相当于通过胶原酶处理得到的iv型胶原7s片段的分子量的级分中也检测到信号。另外,如图13的(a)~(b)所示,如果使用civ03抗体固相化磁性粒子进行测定,则在iv型胶原7s片段中不能够从任何级分检测出信号(图13的(b)),同样地,也不能够在样本lc58中的相当于iv型胶原7s片段的级分检测出信号(图13的(a))。
[0109]
即,示出了:对于以也包含小分子化的iv型胶原7s片段的方式全部网罗地测定来源于肝硬化等的患者的样本中的“包含iv型胶原7s结构域的片段”而言,将与胃蛋白酶可溶化iv型胶原片段结合但不与iv型胶原7s片段结合的单克隆抗体(例如,civ03抗体:比较例3)用于至少捕获抗体或标记抗体的夹心免疫测定不充分的。因此,示出了通过将iv型胶原7s结构域特异性的单克隆抗体用于捕获抗体和标记抗体中的任一个的本发明的夹心免疫测定,能够更高精度地测定来源于肝硬化等的患者的样本中的包含iv型胶原7s结构域的片段。
[0110]
(定量性评价)对于在所述实施例2与比较例1之间测定值偏离的样本,研究稀释直线性。在通过
特异性反应得到测定值的情况下,如果稀释后进行测定,则能够根据稀释率得到低的测定值,因此能够确认到稀释直线性。
[0111]
(实施例5)作为试样,分别使用将肝硬化组的各样本用标准溶液稀释液(50mm tris、0.15m nacl、2%bsa、ph7.2)稀释5倍或10倍而得到稀释液。除了使用这些各样本以外,以与所述实施例2同样的方式测定发光量,使用标准曲线计算出各样本中的包含iv型胶原7s结构域的片段的浓度。
[0112]
(比较例4)除了使用与实施例5相同的样本以外,以与比较例1同样的方式使用ria试剂盒,计算出各样本中的包含iv型胶原7s结构域的片段的浓度。
[0113]
[结果]对于肝硬化组的样本中的、包括在所述实施例2与比较例1之间偏离大的lc51以及lc28在内的lc27、lc28、lc37、lc51以及lc58,在下述表4中分别示出了实施例5(cl 7s)以及比较例4(ria 7s)中的各测定值及其回收率(测定值
×
稀释倍率/稀释倍率1时的测定值
×
100(%))。
[0114]
[表4]
[0115]
如表4所示,在任一样本中,本发明的使用所述单克隆抗体的夹心免疫测定的回收率几乎为100%,能够确认到稀释直线性(定量性),与此相对,ria试剂盒不能得到稀释直线性。
[0116]
(测定值偏离样本的分析)(实施例6)对于在所述实施例2与比较例1之间测定值的偏离最大的样本lc51,以与上述的(可测定的iv型胶原的形态)同样的方式进行凝胶过滤,测定各级分的发光量(信号)。另外,除了使用civ03抗体固相化磁性粒子作为对照的抗体固相化磁性粒子以外,以与其同样的方式测定各级分的发光量。进一步地,将得到的各级分分为池1~6,以与实施例1的(7)同样的方式测定各池的发光量(信号)。另一方面,对凝胶过滤前的样本lc51也以同样的方式进
行测定,作为直接测定值。
[0117]
(比较例5)除了使用与实施例6相同的池以外,以与比较例1同样的方式使用ria试剂盒测定各池的发光量。另一方面,对凝胶过滤前的样本lc51也以同样的方式进行测定,作为直接测定值。
[0118]
[结果]在图14中示出了关于样本lc51的、使用civ09抗体固相化磁性粒子时(实施例6、实线)的各级分的发光量和使用civ03抗体固相化磁性粒子时(虚线)的各级分的发光量。另外,由各池的测定值计算出各池中的包含iv型胶原7s结构域的片段的浓度作为池回收值(ng/ml)。在图15中分别示出了关于样本lc51的、使用单克隆抗体的夹心免疫测定(实施例6、cl7s、实线)的各池回收值、以及使用ria试剂盒时(比较例5、ria 7s、虚线)的各池回收值。
[0119]
另外,将池1~6的池回收值的合计作为回收值,根据各直接测定值,利用下式:回收率(%)=回收值/直接测定值
×
100计算回收率的结果是使用本发明的单克隆抗体的夹心免疫测定(实施例6、cl 7s)的回收率为87%,与此相对,ria试剂盒(比较例5、ria)的直接测定值低,回收率为237%,远远超过100%。由此,推测civ03抗体或ria试剂盒中使用的抗人iv型胶原多克隆抗体受到试样中存在的物质或iv型胶原的7s结构域以外的部位的影响较大,认为使用这些的测定无法给出正确的值。另一方面,示出了在本发明的使用了所述单克隆抗体的夹心免疫测定中,能够特异性地检测出包含iv型胶原7s结构域的片段。产业上的可利用性
[0120]
根据本发明,能够提供一种测定方法以及用于其的试剂盒,其不会使针对来源于患者的试样(阳性样本)的特异性降低,能够使针对来源于健康人的试样(阴性样本)的非特异性降低,并且能够高精度地测定试样中的包含人iv型胶原7s结构域的片段。
[0121]
血中的包含人iv型胶原7s结构域的片段主要用作诊断肝硬化或非酒精性脂肪性肝炎(nash)的生物标记,通过将本发明用于辅助诊断,能够提高诊断精度,并且能够充分减轻针对来源于健康人的样本的非特异性,因此能够在肝纤维化的初期阶段进行患者的筛选和鉴别。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1