用于检测分析物的方法与流程
用于检测分析物的方法
1.本发明涉及一种用于检测分析物的方法,尤其涉及一种用于检测由于样品中存在分析物而导致的各个结合事件的方法。
2.有许多技术可用于测量人样品(例如血液、血浆、血清、组织等)中的生物学相关参数。一种常见的方法是使用与目的目标结合的捕获试剂和具有某种标签的报告试剂。捕获试剂可以结合至固相,例如微量滴定板、小珠或膜。当样品与捕获试剂一起孵育时,分析物与捕获试剂结合。报告试剂也与分析物结合。然后可以(通过洗涤)除去过量的报告物(reporter),并且可以测量报告试剂的量,从而测量样品中存在的分析物的量。关于如何进行这些类型的结合测定有许多不同的变化。例如,分析物可以先与捕获试剂结合,然后可以在单独的步骤中添加报告物,或者分析物可以先与报告物结合,然后再与捕获试剂结合。
3.存在许多种试剂可在这种类型的结合测定中用作捕获物和报告物,包括核酸、碳水化合物、抗原、肽、蛋白质和抗体。还存在许多种目标分析物,包括肽、蛋白质、抗体、核酸、细胞、碳水化合物、小分子、治疗药物、滥用的药物、类固醇、激素、脂质等。
4.使用抗体的测定通常称为免疫测定。免疫测定可以采用多种格式。例如,当捕获抗体用于捕获分析物并且报告抗体用于产生可测量的信号时,这通常称为夹心免疫测定。替代的格式是已知的,其中结合剂连接至固相并且目标分析物在溶液中与也结合至结合剂的标记试剂竞争。在不存在分析物的情况下,由于结合了高水平的标记试剂,因此获得了高信号。在存在分析物的情况下,一部分结合位点被阻断,因此结合了较少的标记试剂并且信号减弱。这些测定通常称为抑制或竞争测定。几种类型的竞争测定是已知的。例如,抗体可以与固相结合,并且标记的分析物(或分析物的类似物)可以竞争抗体上的结合位点。或者,可以固定分析物的类似物,并且标记的抗体可以结合到该表面。在样品中存在分析物的情况下,这将与溶液中的抗体结合,从而阻止与表面的结合,并且信号会减弱。
5.测定有许多格式,以及可以使用许多不同类型的标记物。例如,测定可以是非均相的,因为在进行测量之前,例如通过使用洗涤步骤除去过量的标记物。也可以通过使样品和报告物流动经过捕获区域来实现除去过量的标记物。这种方法用在免疫层析或横向流动条带中,其例如用在用于传染病测试和妊娠测试的快速测试中。或者,均相测定是已知的,其中没有将过量的报告物除去。均相测定倾向于依赖捕获物和报告物的紧密接近,从而产生某种形式的信号。均相测定的一个实例是凝集测定,其中颗粒在溶液中结合在一起。凝集的颗粒引起光的散射,这可以通过比浊法或浊度法测量。使用颗粒的均相测定的另一个实例是发光氧通道免疫测定(loci),下文将进一步详细描述。
6.均相测定的另一个实例是荧光共振能量转移(fret),其中捕获试剂和报告试剂分别是供体和受体荧光团,供体的激发导致能量转移到受体,接着是光发射。
7.一种在全血中起作用而不除去细胞物质的均相测定格式是热光免疫测定(pyro-optical immunoassay)。捕获抗体包被在热电聚偏乙烯pvdf传感器上,碳颗粒用作报告物。通过用光照射样品产生信号,导致颗粒局部加热。与传感器结合的那些将能量转移给热电传感器,导致被检测为电信号的热应力。碳结合的越多,信号越大。
8.连接至报告结合剂的标记物可以是吸收光的试剂,例如染料、金颗粒或染色的胶
乳微球。原则上,较大的颗粒可以吸收更多的光,并且产生更多的信号。然而,如下文更详细地描述的,存在尺寸限制,使得颗粒标记物不能用在测定中。发光标记物也是已知的,例如荧光、化学发光、生物发光和电化学发光标记物。发光标记物也已被包封在颗粒中以用于某些类型的测定。信号的放大也可以通过使用酶促反应或催化反应来进行。可将酶用于使底物从无色染料转化为有色形式,或转化为荧光或发光形式。在添加底物之前,通常使用洗涤步骤除去过量的酶,以使得信号仅是由与分析物特异性结合的酶产生的。
9.不使用标记物的免疫测定也是已知的,例如使用表面等离子共振作为信号转导方法的测定。然而,无标记物测定倾向于缺乏使用标记物来增强信号的测定的灵敏度。
10.有关免疫测定领域的更多信息,请参见“the immunoassay handbook:4th edition:theory and applications of ligand binding,elisa and related techniques”,ed.d.wild,elsevier science,2013。
11.所有的结合测定(包括免疫测定),在可以可靠测量的分析物的最小和最大浓度方面都有限制。
12.信号最大值通常受诸如可用于结合分析物的捕获抗体的总量和产生信号的报告抗体的总量等因素的限制。如果捕获抗体固定在固相上,那么固相的表面积会限制检测的上限。此外,某些信号转导技术可能容易饱和,例如比色法,这取决于光通过样品时需要经过的路径长度。发光方法不易饱和,因为可以衰减检测器上的增益以处理更高水平的光发射。当非均相测定中的所有抗体结合位点都充满分析物时,则达到最大信号并且系统已饱和。通常会在洗涤步骤中除去过量的分析物,然后添加报告物。均相测定也可能受到称为高剂量钩状效应的影响,其中分析物的浓度大于捕获和/或报告抗体的有效浓度。在这种情况下,在非常高的浓度下,捕获物和报告物上的所有结合位点都可能被阻断,检测信号可能会减弱,从而产生错误的结果。
13.较低的检测水平由许多不同的因素决定。通常,所有测定都会受到属性的影响,例如所用抗体的质量(亲和力和特异性)以及抗体与相关分析物的交叉反应性。检测下限还取决于测定装置和影响系统设计信噪比的因素。例如,在标准的酶联免疫吸附测定(elisa)中,捕获抗体包被在96孔微量滴定板的表面上,然后样品在孔中孵育,从而捕获分析物。洗涤孔,然后加入过量的报告物,与捕获的分析物结合。然后洗去过量的报告物,并添加可以与酶反应的底物,将其转化为活性形式。例如,在过氧化氢的存在下,通过辣根过氧化物酶可以将没有颜色的无色染料(例如2,2'-连氮基-双(3-乙基苯并噻唑啉-6-磺酸)(abts))转化为氧化的绿色形式。当分析物以非常低的量存在(例如小于1皮摩尔)时,只有非常少量的酶结合到孔的表面。abts与酶反应生成绿色形式,然后扩散到大部分流体中,生成一种稀释到无法与背景信号区分开来的溶液。底物的自动转换也会产生干扰测量的颜色。类似地,其他检测方法(例如荧光)可能会受到干扰因素和样品或反应孔中组分的自发荧光的影响。
14.免疫测定中的另一个混杂因素可能是报告试剂与捕获表面的非特异性结合。例如,在上述elisa测定中,在微量滴定孔上包被一层蛋白质,其中一些蛋白质在包被过程中会变性。在测定过程中,报告物结合到捕获表面的区域并不少见。如果该报告物转换(turn over)底物以对整体信号做出贡献,则无法区分特异性结合报告物的信号与非特异性结合报告物的信号。非特异性结合也可以被原始样品中存在的许多组分所促进,它们可以在初始孵育过程中与捕获表面结合,从而改变捕获层的表面特性,形成可以结合报告物的表面。
减少报告物的非特异性结合,包括仔细优化测定过程中使用的所有试剂和反应条件,包括抗体、洗涤剂、温度和离子强度。
15.通常,传统免疫测定的检测限约为0.1皮摩尔至1纳摩尔,取决于测定方法。使用传统方法开发检测限极低的检测方法通常需要大量的优化,并采用严格的洗涤步骤来减少非特异性结合并使信噪比最大化。此外,与样品体积相比,捕获表面通常较小,以确保与背景相比,信号足够高。
16.一种用于克服与信噪比相关的问题并提高检测限的方法是测量单个结合事件,如果测量值高于局部阈值,则将这些结合事件计作“开启”或“关闭”事件。通过这种方式,可以消除大部分背景噪声。可以通过音频或通信信号的数字化来进行类比。这些数字化的测定已被证明达到了以前使用传统模拟方法无法达到的检测限。例如,已经报道了在低的飞摩尔(10-15
mol/l)以及甚至渺摩尔(10-18
mol/l)范围内的检测限。参见例如“evaluation of highly sensitive immunoassay technologies for quantitative measurements of sub-pg/ml levels of cytokines in human serum”,yeung et al.,journal of immunological methods,2016,437,53和“digital detection of biomarkers assisted by nanoparticles:application to diagnostics”,cretich et al.,trends in biotechnology,2015,33,343。
17.测定中使用的大多数标记物/报告物(例如荧光团、染料等)使用宽视场显微术无法单独看到,甚至在高放大倍率下也是如此,因为它们的尺寸低于可见光的衍射极限。因此,这些标记物的存在只能作为一种整体现象来测量,而不是通过计数每个标记物。相比之下,如果颗粒标记物(例如胶乳颗粒)高于一定尺寸,理论上可以通过宽视场光学显微术观察到。根据光学设置,当颗粒直径达到数百纳米及以上时,可以开始观察到颗粒,具体取决于显微镜的数值孔径和类型。
18.然而,由于多种原因,使用这种尺寸的颗粒作为标记物来监测捕获表面上的各个结合事件(例如抗体-抗原相互作用)变得不切实际。例如,与其他类型的标记物相比,这种尺寸的颗粒扩散非常缓慢,从而降低了平坦表面的反应速率。它们也开始表现出宏观浮力效应,如果颗粒的密度与包含它们的介质显著不同,它们会沉淀或漂浮,这也可能导致测定格式出现问题。这种尺寸的颗粒特别容易与表面非特异性结合,导致高背景,难以除去。最后,必须除去多余的颗粒,这需要清洗步骤。然而,大颗粒在存在流体流动的情况下开始受到剪切效应的影响,此时颗粒上的剪切力变得大于抗体-抗原相互作用的破裂强度(约60-250pn),导致颗粒被冲走(参见“rapid femtomolar bioassays in complex matrices combining microfluidics and magnetoelectronics”,mulvaney et al.,biosensors and bioelectronics,2007,23,191)。
19.数字化测定的实例包括quanterix单分子阵列(simoa)系统和merck millipore单分子计数(smc)系统。
20.quanterix simoa系统使用抗体包被的顺磁小珠从溶液中捕获分析物。然后洗涤磁珠,并且加入酶标记的报告抗体。小珠的数量需足以使每个小珠具有多于一种分析物和报告物的可能性降至最低。再次洗涤小珠,然后装入每孔只能容纳一个小珠的微孔阵列中。微孔的体积为飞升级别。如果小珠连接有酶,则将孔中的荧光底物会被转换。孔的小尺度防止荧光产物变得过于分散。如果荧光高于阈值,则每个孔都被计为“开启”或“关闭”事件。
21.smc系统用于merck millipore的erenna和smcxpro系统。这两个系统的基本测量技术是相同的。包被了捕获抗体的磁珠在夹心测定中用于捕获目标分析物。在分析物存在的情况下,荧光标记的报告抗体也与小珠结合。用磁铁将小珠拉下来,然后洗掉过量的荧光标记的报告物。然后加入洗脱缓冲液,导致夹心复合物解离,然后将其转移到测量容器中。然后使用共聚焦荧光显微镜测量荧光标记的存在,该显微镜依次从少量样品中获取数据(interrogate)以确定荧光标记是否存在。如果每个单独测量的信号高于阈值,则这将被视为该测量的“开启”事件。
22.几项关于高灵敏度免疫测定的独立学术综述强调,免疫测定的数字化方法可以前所未有地提高检测限(参见上文的参考文献yeung and cretich)。
23.quanterix和merck millipore系统的检测限取决于测定中使用的样品量。对于10微升血清或血浆样品,理论上的限制是检测单个结合事件,对应于1个分子。然而,就摩尔浓度而言,这相当于每升样品100,000个分子,或每升样品的浓度为0.16
×
10-18
摩尔(0.16渺摩尔)。
24.然而,上述的quanterix和merck millipore系统既复杂又繁琐,每个都需要许多清洗和转移步骤。此外,只能对不含细胞材料的样品进行测定,并且系统需要昂贵的仪器才能实现它们所提供的性能。因此,仍然需要更简单和更具成本效益的高灵敏度系统。
25.因此,本发明提供了一种用于检测样品中的分析物的方法,该方法包括以下步骤:
26.(i)向装置提供包含样品、报告试剂和预活化剂的混合物,该装置包括具有光学组件和结合组件的基板,其中光学组件和结合组件连接至基板的表面,报告试剂能够在吸收电磁辐射时从预活化剂中产生活性氧簇,并且光学组件在与活性氧簇反应时能够从第一光学状态变化为第二光学状态;
27.(ii)通过结合组件,使一部分报告试剂根据分析物的浓度成比例地结合到基板表面;
28.(iii)用电磁辐射照射该装置以进行报告试剂的吸收,从而在基板上形成具有第二光学状态的光学组件的局部区域集,其中,在照射之前,将基板与氘富集流体接触,和/或基板在其表面上具有氘富集层;以及
29.(iv)检测基板上具有第二光学状态的局部区域集。
30.因此,本发明提供了一种用于检测样品中的分析物的方法,其中仅在基板表面的邻近区域内的报告试剂会产生信号,所述信号成为处于第二光学状态的光学组件的局部区域。并且可以检测处于第二光学状态的光学组件的局部区域集。通过活性氧簇与光学组件的反应产生信号,并且氘富集环境提供更容易成像的更大信号。因此,本发明简化了分析物的数字化检测,并且有利于对一系列样品进行均相测定,其中样品包括那些含有细胞材料的样品。
31.现在将参考附图来描述本发明,其中:
32.图1示出了可用于本发明的各种组件;
33.图2示出了将报告试剂通过与分析物形成夹心以结合到基板表面的装置;
34.图3示出了照射的装置;
35.图4示出了在非氘富集环境中进行照射之后的装置;
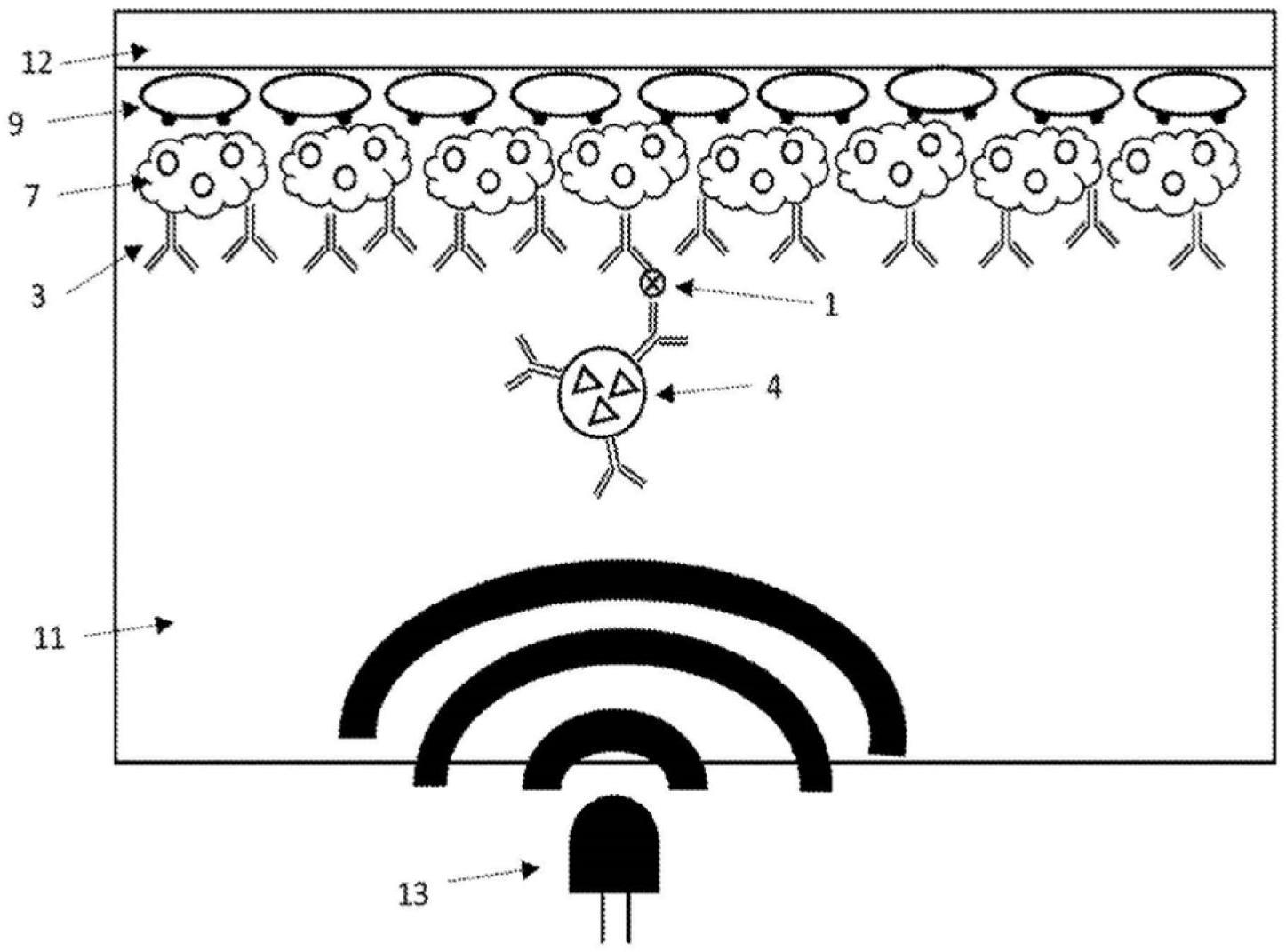
36.图5示出了在氘富集环境中进行照射之后的装置;
37.图6示出了均相测定形式,其中过量的标记的报告物和细胞组件在测定的持续时间内存在于溶液中;
38.图7示出了用于检测的光学装置;
39.图8示出了创建的用于本发明的基板和孔;
40.图9示出了使用图8的基板和孔创建的样品室;
41.图10示出了实施例4的检测结果;以及
42.图11示出了实施例5的检测结果。
43.本发明用于检测样品中的分析物(其可以通过检测分析物的复合物或衍生物)。
44.图1的组件为:分析物1;光敏剂2;捕获抗体3;注入光敏剂的胶乳颗粒的报告抗体偶联物4;荧光染料5;漂白后的荧光染料6;荧光染料标记的链霉亲和素7;荧光染料标记的链霉亲和素(漂白后)8;生物素标记的bsa 9和红细胞10。
45.本发明方法的步骤(i)包含向装置提供包括样品、报告试剂和预活化剂的混合物,该装置包括基板12,其具有光学组件和结合组件,其中光学组件和结合组件连接至基板12表面。样品、报告试剂和预活化剂可以在将混合物添加到装置之前预先混合,或者样品、报告试剂和预活化剂可以依次添加到装置中以形成混合物;该混合物还可以包含额外的试剂,但优选地,该混合物由样品、报告试剂和预活化剂组成。
46.通过解释本发明的基本原理,图2示出了一种装置,其中报告试剂在照射之前通过分析物1结合到基板表面。该装置包括基板12和样品室24,样品室24用于容纳含有溶解或悬浮于其中的分析物的样品。基板可以是允许检测基板上的具有第二光学状态的局部区域集的任何基板。优选地,基板是透明的基板,更优选地,基板是玻璃。基板12通常是平面的。
47.基板12具有通过荧光染料标记的链霉亲和素7和生物素标记的bsa 9连接至基板12表面上的捕获抗体3。荧光染料作为光学组件,而捕获抗体3作为结合组件。生物素标记的bsa和链霉亲和素是惰性大分子,它们有助于将光学和结合组件连接至基板12的表面。当光学组件是水溶性的时可使用这种方法,因为光学组件需要被拴系在基板12的表面以使其被固定。
48.尽管以这种方式示出了光学和结合组件,但是用于将光学和结合组件保持在基板12的表面附近的任何技术都是适用的。例如,光学组件和结合组件可以是单独的试剂并且结合组件连接至光学组件上。
49.还可以将光学组件包封在聚合物层内,将该聚合物层涂覆在基板12的表面上,并且结合组件连接至聚合物层上。聚合物可以是硅树脂、聚苯乙烯或聚异丁烯,或可用于包封光学组件的任何其他适合的聚合物塑料。当光学组件不溶于水时,可以使用这种方法。
50.或者,凝胶(例如水凝胶)层可以用光学组件浸渍,将凝胶/水凝胶层涂覆在基板12的表面上,并且结合组件连接至凝胶/水凝胶层上。
51.本发明方法的步骤(ii)包括通过结合组件使一部分报告试剂按分析物的浓度成比例地结合到基板表面。这可以通过让设备静置一段时间来实现,例如10分钟。
52.在图2中,捕获抗体3通过荧光染料标记的链霉亲和素7和生物素标记的bsa 9连接至基板12的表面上。注入光敏剂的胶乳颗粒的报告抗体偶联物4作为报告试剂。
53.报告试剂显示通过分析物1结合到基板12的表面。通过这种方式,当存在分析物时,报告试剂以所谓的“夹心”复合物形式(如下文中参考图6所讨论的),按分析物的浓度成
比例地结合到基板表面。
54.到目前为止,所有步骤都是在没有光的情况下进行的。本发明方法的步骤(iii)包括用电磁辐射照射装置以进行报告试剂的吸收,从而在基板12上形成具有第二光学状态的光学组件的局部区域集。本发明方法的步骤(iii)还涉及提供氘富集环境,其中,在照射之前,将基板与氘富集流体接触,和/或基板在其表面上具有氘富集层。
55.因此,本发明提供了一种方法,其中用电磁辐射照射装置,并且该辐射被报告试剂的光敏剂吸收。然后,报告试剂从预活化剂中产生活性氧簇,该活性氧簇与光学组件反应,该光学组件从第一光学状态变化为第二光学状态,从而在基板12上形成具有第二光学状态的光学组件的一组局部区域。
56.图3示出了用电磁辐射(通常称为“光”)照射图2的装置,优选为来自照明源13的可见光。光源用具有适当波长的光照射样品室24以激发注入胶乳颗粒的光敏剂2。波长取决于光敏剂,但优选的波长为680nm。通常将该装置照射至少30秒。优选地,该装置用电磁辐射源照射超过1秒,更优选至少2秒,更优选至少5秒,更优选至少10秒,更优选至少15秒,更优选至少20秒,更优选至少25秒,最优选至少30秒。这确保了基板表面上存在不可逆的光学变化,从而可以区分长期存在的和瞬时的结合事件。
57.图4示出了照射之后的图3的装置,其中基板在照射之前不与氘富集流体接触。由注入光敏剂的胶乳颗粒4的光敏剂与荧光染料标记的链霉亲和素7的染料光学组件产生的活性氧簇反应使染料从荧光状态变化为非荧光状态。处于荧光状态的荧光染料标记的链霉亲和素7变成处于非荧光状态的荧光染料标记的链霉亲和素8。只有紧邻报告试剂的染料从第一光学状态变化为第二光学状态。
58.图5示出了照射之后的图3的装置,其中基板在照射之前与氘富集流体接触。注入光敏剂的胶乳颗粒3的光敏剂与荧光染料标记的链霉亲和素7的染料光学组件产生的活性氧簇反应使染料从荧光状态变化为非荧光状态。处于荧光状态的荧光染料标记的链霉亲和素7变成处于非荧光状态的荧光染料标记的链霉亲和素8。只有紧邻报告试剂的染料从第一光学状态变化为第二光学状态。与图4相比,与报告试剂相距远得多的染料从第一光学状态变化为第二光学状态。
59.尽管显示染料从荧光状态变化为非荧光状态,但其他光学组件可发生替代变化。在一个实施方案中,染料从非荧光状态变化为荧光状态。在另一个实施方案中,光学组件在处于第一光学状态时吸收一个或多个波长的光,而光学组件在处于第二光学状态时吸收一个或多个第二波长的光,其中第一和第二波长不同。光优选可见光。第一和第二波长不同。在本实施方案中,光学组件发生颜色变化。
60.替代的第一和第二光学状态可以包括光偏振、荧光寿命、折射率、光散射(包括拉曼散射)和其他光学效应的变化。
61.图6示出了一种装置,其中在照射之后就存在全血样品和过量报告试剂。全血样品还包含额外的组分,例如红细胞10。优选地,基板12形成样品室24的顶部,其可以使红细胞10从基板12沉淀下来。
62.一部分报告试剂通过分析物1和捕获抗体3的夹心复合物结合到基板12的表面。因此,样品在溶液中含有结合的报告试剂和游离的未结合报告试剂。样品室24的深度被设计成使报告试剂的扩散路径长度降至最低,并允许快速达到平衡。通常,样品室的深度为50至
200μm。
63.在使用本发明的典型夹心免疫测定中,基板12具有通过荧光染料标记的链霉亲和素7和生物素标记的bsa 9连接至基板17表面上的捕获抗体3,以及连接至聚链霉亲和素-染料缀合物11上的抗体5。染料作为光学组件,而抗体作为结合组件。尽管以这种方式示出了光学和结合组件,但是用于将光学和结合组件保持在基板12的表面附近的任何技术都是适用的,例如上文所述的那些。
64.在本发明中,样品室24填充有包含分析物1的样品。报告试剂例如注入光敏剂的胶乳颗粒4的抗体缀合物也被添加到样品室24中。如果使用全血样品,则样品还可能包含其他组件,例如红细胞10。全血和血浆样品将天然地含有溶解氧,其可以充当预活化剂。
65.然后达到平衡。注入光敏剂的胶乳颗粒4的抗体缀合物通过捕获抗体3按分析物1的浓度成比例地结合到基板12的表面。注入光敏剂的胶乳颗粒4的抗体缀合物作为报告试剂。包含过量的注入光敏剂的胶乳颗粒4的抗体缀合物,使得所有的分析物1形成夹心复合物。因此,一部分报告试剂通过结合组件按分析物1的浓度成比例地结合到基板12的表面。因此,样品在溶液中含有结合的报告试剂和游离的未结合报告试剂。
66.报告试剂必须在整个照射期间永久地结合到基板12的表面,以实现第一光学状态到第二光学状态的完全转换。在整个照射期间未永久结合到基板12的表面的任何报告试剂将导致较少的光学组件从第一光学状态变化为第二光学状态,从而导致信号较小。溶液中任何未结合的报告试剂都不会导致光学组件从第一光学状态变化为第二光学状态。
67.这提供了优于其他数字化测定方法的显著优势,因为它无需洗涤步骤。通过这种方式,本发明可以均相测定进行。在常规测定中,在进行任何测量之前必须将未结合的报告试剂与结合的报告试剂分离,因为未结合的报告试剂会干扰由结合的报告试剂产生的信号。然而,由于本发明提供的局部表面变化,可以区分结合和未结合的报告试剂。实际上,区分接近基板12表面的报告试剂(即结合的)和本体溶液(bulk solution)中的报告试剂(即未结合的)的能力是本发明的一个特别优势。优选地,步骤(i)和(ii)在没有洗涤步骤的情况下进行,即实施该方法而未在步骤(i)和(ii)中从基板中移除样品。
68.结合的报告试剂部分的光敏剂通过额外的试剂间接与光学组件相互作用以引起变化(即,光敏剂被激发并将此能量转移给额外的组件,然后该组件将这个能量转移给光学组件)。
69.在一个优选的实施方案中,光敏剂的吸收是用于与混合物中存在的预活化剂(pre-activator)试剂相互作用从而产生活性氧簇,并且活化剂是用于与光学组件相互作用以从第一光学状态变化为第二光学状态。
70.预活化剂可以存在于样品中,或者预活化剂可以作为额外的试剂添加到样品和报告试剂的混合物中。预活化剂可以是基态氧,也称为三重态氧。预活化剂可以是在用电磁辐射照射后与光敏剂相互作用时能够产生活性氧簇的任何试剂。在一个优选的实施方案中,预活化剂是三线态氧。在另一个优选的实施方案中,活化剂是活性氧簇。优选地,活性氧簇选自羟基自由基、超氧化物、过氧化物、有机过氧化物、过氧亚硝酸盐、单线态氧及其混合物。更优选地,活性氧簇是单线态氧。
71.据信,光敏剂吸收光以产生激发态,该激发态可以与存在于样品中且接近报告试剂的氧发生系统间穿越(isc)以产生单线态氧。然后单线态氧继续与光学组件反应,如下所
述。在一个特别优选的实施方案中,预活化剂是三线态氧并且活化剂是单线态氧。
72.单线态氧以前已用于发光氧通道免疫测定(loci)中的免疫测定。loci免疫测定是一种使用供体和受体小珠的均相非数字化测定。供体小珠在以680nm照射时产生单线态氧,而受体小珠在被单线态氧激活时产生化学发光信号。抗体-抗原结合促进供体与受体小珠的结合。通常将反应混合物照射0.5至1.0秒,然后测量发光信号0.5至1.0秒。至关重要的是,测量是在所有未结合的供体和受体小珠存在的情况下进行的。小珠的空间分离使背景信号降至最低;然而,由于测量时间短,loci测定无法区分长期存在的和瞬时的结合事件。彼此紧密接近的未结合的小珠也可能产生不想要的背景信号。对于最敏感的测定,例如白细胞介素6(il-6)或促甲状腺激素(tsh),loci测定可以达到约1-5pg/ml的检测限。本发明甚至进一步使背景信号降至最低,因为“供体”颗粒(即报告试剂)需要靠近基板12的表面(而不是溶液中的颗粒)以便检测到信号,并且在照射期间也必须在那里。因此,本发明比loci测定更灵敏并且可以检测更低浓度的分析物。
73.在一个实施方案中,在照射之前使基板与氘富集流体接触。提供氘富集流体的任何方法可适用于本发明。可以通过在分析之前使样品与氘富集流体接触来提供氘富集流体。例如,可以在照射之前用氘富集流体稀释或洗涤样品。氘富集流体优选包括氧化氘,并且可以是氘富集缓冲液。使用氧化氘的成本并不高。
74.在另一个实施方案中,基板在其表面上具有氘富集层。在基板的表面上提供氘富集层的任何方法可适用于本发明。所述层可以通过与氘化流体(例如,氧化氘)进行质子交换而实现氘富集,或者所述层可以使用氘富集的起始材料来合成。
75.氘富集层可以包含氘富集聚合物,例如氘富集蛋白质或氘富集多糖。氘富集聚合物可以是氘富集凝胶(特别是水凝胶)的形式。优选地,氘富集层包括氘富集蛋白质层或氘富集多糖层。
76.该层可以通过非氘富集的起始材料的氢-氘交换来制备。或者,可通过生物合成制备氘富集的多糖或蛋白质。在另一个实施方案中,氘富集层可以包含氘富集凝胶,其中凝胶使用氘富集起始材料合成。在另一个实施方案中,氘富集层可以包含水凝胶,其中固相和/或液相可以是氘富集的。氘富集固相可以由氘富集起始材料制备,或者液相可以包含氘富集液体。优选地,氘富集液体也是氧化氘。
77.在另一个实施方案中,在照射之前使基板与氘富集流体接触,并且基板在其表面上具有氘富集层。
78.氘交换是众所周知的化学反应,其中共价键合的氢原子被氘原子置换。其可以最容易地应用于可交换质子。可交换的氢原子通常是与羟基或氨基结合的那些氢原子,尽管硫醇也可以是氘交换的靶标。它们通常使用d2o引入。分子中不可交换的氢原子也可以被氘取代,但这需要氘代起始材料。
79.基板的表面通常通过使用氘化聚合物来富集氘。也可以使用氘交换,特别是对于含有氨基和羟基的蛋白质和多糖。然而,当基板与样品接触时,这些可交换的氘原子可能损失到本体溶液中,因此优选使用预氘化的起始材料作为基板的元件。
80.当通过处理样品或使用洗涤步骤进行氘增强时,氘交换是优选的方法。
81.一旦产生,活性氧簇具有它们可以从其来源移动的最大距离。因此,活性氧簇与连接至基板表面的光学组件的反应将形成以报告试剂为中心的局部区域。
82.据信,作为与报道分子的距离的函数的活性氧簇的浓度由三个因素控制:径向扩散、活性氧簇的寿命和活性氧簇的双分子反应速率。
83.活性氧簇的双分子反应可以是产出性的,由于活性氧簇与光学组件的分子反应,将光学组件从第一光学状态变化为第二光学状态。
84.活性氧簇的双分子反应也可以是非产出性的,由于活性氧簇与非光学组件的分子反应,导致活性氧簇淬灭。非产出性反应的实例是活性氧簇与活性氢原子(例如nh或oh官能团的氢原子)的反应。还已知活性氧簇(例如单线态氧)与芳族基团(例如蛋白质的组氨酸残基)形成加合物。
85.已经发现,降低报告试剂周围的活性氢原子的有效浓度将降低活性氧簇的非产出性反应与产出性反应的比率。以这种方式,结合的报告试剂的区域中的更多数量的光学组件分子将从第一光学状态变化为第二光学状态,产生更大的信号对比度。另外,将光学组件从第一光学状态转换到第二光学状态所花费的时间将减少。
86.降低报告试剂周围的活性氢原子的有效浓度还将导致活性氧簇进一步远离报告试剂,从而导致第二光学状态下的光学组件的局部区域更大。更大的局部区域更容易使用简单的光学方法可视化。
87.本发明提供了一种通过使用混合物的氘富集类似物,或装置的组件的氘富集类似物来降低报告试剂周围的活性氢原子有效浓度的方法。据信,用氘替换氢的动力学同位素效应降低了与活性氧簇的反应速率。
88.用于降低报告试剂周围的活性氢原子有效浓度的其他方法适合于实施本发明,例如使用具有较少活性氢的材料制备装置的组件,例如用惰性聚合物代替由多糖或蛋白质形成的层。
89.用于减少活性氧簇的非产出性反应的其它方法也可包括在本发明的方法和装置中。
90.因此,本发明提供了一种氘富集环境,其中产生活性氧簇。通过这种方式,与在非氘富集环境中相比,活性氧簇将从报告试剂扩散得更远,因此产生更大的信号。在一个实施方案中,报告试剂产生更大的信号。在另一个实施方案中,使用较小的报告试剂颗粒产生相同大小的信号。另外,可以更快地产生特定大小的信号,或者可以使用较低强度的电磁辐射来刺激光敏剂。
91.产生较大信号的益处在于它们相比于较小信号更容易检测。对于标准光学显微镜,透镜的选择(包括透镜的数值孔径及其放大率)与测量波长相结合,定义了系统的分辨率和景深。优选使用尽可能的最低放大率透镜以便测量暗点。较低放大率的镜头具有更大的景深和更宽的视野。这使得更容易将透镜聚焦在表面上,并且还允许在不必使透镜或基板相对于彼此移动的情况下使更多的表面区域可视化。反之,这降低了仪器的复杂性和成本。
92.尽管样品和报告物可以在提供给装置之前进行混合,但孵育和结合通常在小体积中进行而不混合。因此,有利的是,报告试剂包含较小的颗粒,因为较小的颗粒可更快速地扩散到基板表面。另外,较小的颗粒在空间上受到较少的约束并且具有较大的旋转能,从而在它们扩散到基板表面时提高结合速率。更大的结合速率允许在更短的时间范围内进行测定,这对于护理点应用(point-of-care applications)特别有益。另外,更大的结合速率允
许更灵敏的测定。
93.因此,本发明的方法便于检测在本发明的步骤(iii)中形成的信号。
94.在一个优选实施方案中,光学组件为染料。优选地,所述光学组件选自以下染料及其混合物之一:
[0095][0096][0097]
染料(1)-(5)是已知的,其可用作细胞探针以监测在氧化应激下细胞中的活性氧簇形成。然而,这些染料不是已知可用于标准或数字化的免疫测定。染料(6)是一种常见的荧光染料。已知染料(7)和(8)与单线态氧特异性反应,尽管不清楚它们在免疫测定中的用途。有许多其他的可商购获得并适用于本发明的荧光染料,包括alexafluor染料、bodipy染料、罗丹明(rhodamine)染料、德克萨斯红(texas red)、俄勒冈绿(oregon green)、喀斯喀特黄(cascade yellow)、太平洋蓝(pacific blue)等。更多实例参见the molecular probes handbook,thermo fisher scientific(分子探针手册,赛默飞世尔科技)。
[0098]
染料单线态氧传感器绿色(singlet oxygen sensor green,sosg)(1)与单线态氧反应,将其从弱荧光形式转变为高荧光形式。单线态氧与蒽基反应形成内过氧化物。在一个优选的实施方案中,光学组件为sosg。
[0099]
染料硼-二吡咯亚甲基
581/591
(bodipy
581/591
)(2)与活性氧簇(例如单线态氧和羟基自由基)反应,导致荧光激发/发射最大值的浅色移动。
[0100]
染料(3)-(5)具有相同的核心结构,并与包括单线态氧在内的一般氧化剂反应,以
将其转化为荧光形式。因此这些染料可以从无色状态转变为荧光状态。
[0101]
已发现染料(6)与单线态氧反应以将其从荧光形式转变为非荧光形式。使用荧光素时,出人意料地发现可以完全消除光敏剂附近的荧光以在荧光基板上创建一个暗组件的、非荧光的区域。染料(7)和(8)在uv下发荧光并与单线态氧反应以产生内过氧化物,得到非荧光产物。
[0102]
优选地,当处于第一和第二光学状态中的一种时,光学组件是荧光的,而当处于第一和第二光学状态中的另一种时,光学组件是非荧光的。在一个实施方案中,处于第一光学状态时的光学组件是非荧光的,而处于第二光学状态时的光学组件是荧光的。然而,更优选地,处于第一光学状态时的光学组件是荧光的,而处于第二光学状态时的光学组件是非荧光的。
[0103]
在另一个优选的实施方案中,光学组件在处于第一光学状态时以一个或多个波长发出荧光,而光学组件在处于第二光学状态时以一个或多个其他波长发出荧光。在该实施方案中,光学组件改变其荧光激发/发射最大值。
[0104]
优选地,从第一光学状态到第二光学状态的变化是不可逆的。这允许对基板进行后续扫描,以识别其中发生光学状态变化的区域。
[0105]
本发明方法的步骤(iv)包括检测基板上具有第二光学状态的局部区域集。
[0106]
具有第二光学状态的光学组件在基板上形成局部区域集。有利地,具有第二光学状态的局部区域可以作为单独的结合事件进行计数。本发明因此适用于进行数字化测定。然而,如果存在大量的结合事件使得大部分光学组件处于第二光学状态,则可以检测到整体变化。
[0107]
在优选的实施方案中,通过对基板上具有第二光学状态的局部区域集中的局部区域进行计数或通过测量基板上具有第二光学状态的局部区域集(作为一个整体属性),来检测基板上具有第二光学状态的局部区域集。更优选地,通过对基板上具有第二光学状态的局部区域集中的局部区域进行计数来检测基板上具有第二光学状态的局部区域集。
[0108]
根据第一和第二光学状态,具有第二光学状态的局部区域可能需要高于对应于背景信号,或者对应于暂时结合事件的阈值。例如,样品可能有一些背景自发荧光,但如果这不高于阈值,则由于测定的数字化性质,它不应影响信号。计算机软件可以用于检测局部区域的存在,并且将高于阈值的局部区域与低于阈值的局部区域区分开。
[0109]
此外,可在照射光敏剂之前扫描基板表面以给出表面的2d图像,然后在照射之后扫描,从照射后图像中减去作为背景的照射前图像以减少来自表面上或样品本身中人工制品、污染物和任何自发荧光的干扰。因此,在优选的实施方案中,本发明的方法还包括在步骤(iv)中用电磁辐射照射装置之前,从检测到的基板上具有第二光学状态的局部区域集中减去检测到的基板上具有第二光学状态的任何组件。用这种方式,减去背景的图像将仅显示基板光学特性的变化(例如荧光强度的变化)。
[0110]
基板上具有第二光学状态的局部区域集通常是基板上的离散区域。然而,由于它们的形态,一些局部区域可能会被排除在检测之外。对应于单个结合事件的局部区域倾向于是均匀的和圆形的,但对应于人工制品来说,一些局部区域的形状可能是不规则的。此外,一些局部区域可能比其中颗粒聚集在一起的其他区域大。因此,在优选的实施方案中,仅检测基板上具有第二光学状态的均匀、圆形的局部区域。
[0111]
可以使用简单的光学手段检测基板上的局部区域集。适合于检测的光学装置示于图7中。图7的组件为:透镜14;分色镜15;发射滤光片16;光电探测器/照相机17;微处理器18;数据输出器19;激发滤光片20;光源(led/激光器)21。在优选的实施方案中,使用光学显微术检测基板上具有第二光学状态的局部区域集。更优选地,使用宽视场显微术检测基板上具有第二光学状态的局部区域集。宽视场显微术是最简单的显微术形式,整个样品同时被照射和成像,而更复杂的技术如共聚焦显微术一次只照射和记录单独一个焦点。共聚焦显微术的好处是通过消除离焦雾度,以及通过样品深度拍摄一堆图像的能力来增加对比度。超分辨率显微术技术也是已知的,例如光激活定位显微术(palm或fpalm)和随机光学重建显微术(storm)。与简单的宽视场方法相比,这些方法增加了复杂性和成本。
[0112]
如果使用染料(1)和(3)-(5),则可以在光学组件已转变为第二光学状态的基板表面上观察到荧光局部区域(或者,如果存在大量结合事件,则荧光增强)。为了检测这种荧光,可以在染料的激发波长下照射基板,并扫描基板表面的光发射。
[0113]
如果使用染料(2),可以测量610nm处荧光发射的减少或515nm处荧光发射的增加,或者可以同时监测两个波长。
[0114]
如果使用染料(6)-(8),则可以在光学组件已转变为第二光学状态的基板表面上观察到暗局部区域(或者,如果存在大量结合事件,则可以观察到暗图像)。为了检测这些暗点或暗图像,可以使用具有光源(例如led)和光电检测器(例如光电倍增管或照相机,例如ccd)的宽视场荧光显微镜,使用适用于检测每个荧光团的激发和发射滤光片(例如荧光素490nm处的激发和520nm处的发射可以被检测)。
[0115]
当发生结合事件时,光敏剂靠近基板。也就是说,光敏剂足够靠近基板的表面以与光学组件相互作用并在照射装置时将其从第一光学状态转变为第二光学状态。然而,光敏剂与基板表面之间的实际距离将取决于许多变量,例如光敏剂的大小和性质,结合组件、报告试剂和分析物的大小和性质,以及样品介质的性质。
[0116]
结合组件具有结合位点,该结合位点能够使报告试剂按样品中分析物的浓度成比例地结合。该比例对于测定的功能(functioning)很重要,因为对于要确定的分析物浓度的任何有意义的测量来说,结合都必须取决于分析物的浓度。结合可以与分析物的浓度成正比或间接成比例,这取决于所进行的测定类型。在非竞争性测定的情况下,例如在免疫测定法中,结合与分析物的浓度成正比,但对于竞争性测定而言,结合与分析物的浓度间接成比例。
[0117]
本文提出了一种特定类型的竞争性测定,其中将针对分析物的抗体固定在基板上,并将分析物的标记的类似物引入样品中。然后分析物和分析物的标记的类似物“竞争”表面上的抗体。在没有分析物的情况下,标记的类似物将以最大可能的速率结合。然而,在存在分析物的情况下,基板上的抗体会被分析物占据(populate),并且类似物的结合率会降低。
[0118]
结合组件可被改造以适于结合分析物或分析物的复合物或衍生物,在这种情况下,报告试剂将在分析物或分析物的复合物或衍生物存在的情况下与结合组件结合。在这种情况下,结合组件具有能够在分析物或分析物的复合物或衍生物存在的情况下与报告试剂结合的结合位点。然而,结合仍然与分析物的浓度成比例。
[0119]
或者,结合组件本身可以是分析物的类似物,并且报告试剂直接与结合组件结合
(它是类似物,因为它通过共价键合或非共价相互作用结合到基板表面)。在这种情况下,结合组件将与未结合的分析物或未结合的分析物的复合物或衍生物竞争结合报告试剂。因此,结合组件将只能够与报告试剂结合。
[0120]
确定报告试剂与结合组件的结合程度(直接或由分析物/分析物的复合物或衍生物介导)提供了对样品中分析物浓度的测量。
[0121]
该测定还需要存在报告试剂。本发明的报告试剂包括光敏剂。在吸收电磁辐射时,光敏剂与预活化剂反应以产生活性氧簇。该活性氧簇继续与光学组件相互作用。正是这种相互作用导致光学组件从第一光学状态变化为第二光学状态。
[0122]
因此,光敏剂可以包括能够以这种方式与电磁辐射相互作用的任何材料。适合的光敏剂在光动力疗法(pdt)中被称为pdt试剂。pdt试剂用于癌症治疗和皮肤病学,以在照射时破坏细胞(shafirstein et al.,cancers,2017,9,12;wan and lin,clinical,cosmetic and investigational dermatology,2014,7,145)。
[0123]
在用电磁辐射照射时,pdt试剂被提升到激发的三重态。这种激发的三重态可以在所谓的i型过程中直接与细胞组件相互作用,或者可以在所谓的ii型过程中与氧相互作用。i型和ii型过程都可以导致活性氧簇的形成。在ii型过程中,主要产物是单线态氧,通过系统间的交叉机制。
[0124]
单线态氧是具有高度反应性的氧的激发态。它在衰变之前可以进行多种反应,包括狄尔斯-阿尔德(diels-alder)型反应和烯反应。它还与含硫和含氮的化合物发生一般氧化反应。单线态氧的无差别的反应性是其用于光动力疗法的原因之一。
[0125]
许多光敏剂化合物是已知的,包括卟啉、二氢卟酚(chlorins)(例如鲍光过敏素(pyropheophorbide)-a)、酞菁和其他多芳族物质(参见,例如,antibody-directed phototherapy,pye等人,antibodies,2013,2,270)。
[0126]
在一个实施方案中,光敏剂选自卟啉、二氢卟酚、酞菁和其他多芳族物质。光敏剂可以通过共价键直接结合至报告试剂。或者,可将大量光敏剂包封在颗粒内,例如聚苯乙烯胶乳颗粒,并且抗体可以结合到该颗粒上。使用颗粒的益处是更大数量的光敏剂可以与报告试剂偶联。另外,许多光敏剂是在水性介质中溶解性差的聚芳族物质。将它们包封在胶体颗粒中避免了溶解度的问题。聚苯乙烯胶乳颗粒有多种尺寸可以选择,从10纳米到更大的直径。
[0127]
结合组件和报告试剂的性质取决于分析物的性质,但它们优选地是抗体。本发明在免疫测定中具有特殊的适用性。在一个特别优选的实施方案中,结合组件是针对分析物或分析物的复合物或衍生物产生的抗体,并且报告试剂包括针对分析物或分析物的复合物或衍生物产生的抗体。原则上,每种试剂都可以使用单个分子,但实际上,结合组件和报告试剂是一群分子。术语“抗体”在其范围内优选地包括fab片段、单链可变片段(scfv)和重组结合片段。
[0128]
作为抗体-抗原反应的替代方案,结合组件、报告试剂和分析物可以是第一和第二核酸,其中第一和第二核酸互补,或者为含有抗生物素蛋白或其衍生物的试剂和含有生物素或其衍生物的分析物,反之亦然。结合组件和报告试剂也可以是适体。该系统也不限于生物测定并且可以应用于例如水中重金属的检测。该系统也不必限于液体并且可以使用任何流体系统,例如检测空气中的酶、细胞和病毒等。
[0129]
可观察的最大信号是在监测光敏剂与表面结合时可以实现的最大信号。颗粒与基板的结合受分析物和报告试剂的扩散速率控制,而扩散速率又在很大程度上受这些组件的流体动力学半径和样品的粘度/温度控制。
[0130]
在本发明中使用的装置可以进一步包括对照,该对照可补偿测量系统的组件的自然变异性、被测样品的变异性以及测量期间环境条件的变异性。这可以通过将样品暴露于基板表面上的试剂来实现。不同的试剂通常位于基板表面的不同区域,这些区域涂覆有不同的试剂。这些对照被定义为“阴性”和“阳性”对照,即在没有分析物的情况下,阴性对照应该接近预期信号,而当分析物使系统饱和时,阳性对照应该接近预期信号。
[0131]
为了用这些对照进行检测,本发明的装置优选地包括结合组件、阴性对照试剂和阳性对照试剂,它们中的每一个都如上文所述地连接至基板表面上。
[0132]
结合组件如上文所述。
[0133]
在测定条件下,阴性对照试剂对报告试剂的亲和力低于结合组件。因此,阴性对照试剂提供阴性对照。在测定条件下考虑亲和力是重要的。其原因是在非竞争性测定的情况下,结合组件对报告试剂的亲和力是由分析物或分析物的复合物或衍生物的存在介导。因此,在不存在分析物或分析物的复合物或衍生物的情况下,结合组件和阴性对照试剂都对报告试剂没有任何亲和力。然而,在存在分析物或分析物的复合物或衍生物的情况下,阴性对照试剂对报告试剂的亲和力低于结合组件。
[0134]
此外,在结合组件结合至分析物或分析物的复合物或衍生物的实施方案中,阴性对照试剂对分析物或分析物的复合物或衍生物(如果使用的话)的亲和力优选地低于结合组件。阴性对照试剂优选地为蛋白质,更优选地为抗体。阴性对照试剂通常具有与结合组件相似的化学和物理性质,但在测定条件下对报告试剂的亲和力很小或没有。在一个特别优选的实施方案中,阴性对照试剂在测定条件下对报告试剂基本上没有亲和力。优选地,阴性对照试剂对分析物或分析物的复合物或衍生物基本上没有亲和力。即,报告试剂或在适用的情况下分析物或分析物的复合物或衍生物与阴性对照试剂的结合是非特异性的。以这种方式,阴性对照试剂可以补偿报告试剂与结合组件的非特异性结合。另外,如果报告物与阴性对照的结合高于阈值,则这会触发错误代码并且会中止测量。
[0135]
阳性对照试剂与报告试剂结合并对报告试剂具有亲和力,与结合组件相比,该亲和力受样品中分析物或分析物的复合物或衍生物(如果使用的话)浓度的影响较小,因此提供了阳性对照。优选地,阳性对照试剂对报告试剂的亲和力基本上与分析物或分析物的复合物或衍生物的浓度无关。更优选地,在测定条件下,阳性对照试剂对报告试剂的亲和力高于结合组件。以这种方式,阳性对照试剂测量系统中的最大预期信号。
[0136]
为了增加根据本发明进行的测定的动态范围,同时也提高精确度,优选地在基板上的多个位置上具有结合组件。通过改变每个位置的结合组件的浓度,可以将这些位置调整到不同的灵敏度。每个位置也可能有自己的阴性对照和阳性对照试剂,以作为不同动态范围的对照。这尤其适用于对构成系统的每个单独组件的浓度特别敏感的竞争性测定。
[0137]
尽管上述描述可以使测定在激活光敏剂之前达到平衡,但也有可能通过在一个时间过程中的离散时间周期照射光敏剂并在达到平衡之前监测在反应过程中发生的结合事件来监测结合事件的动力学。
[0138]
分析物可以是大分子或小分子。大分子通常是蛋白质,例如基于蛋白质的激素,也
可以是较大颗粒的一部分,例如病毒、细菌、细胞(例如红细胞)或朊病毒。小分子可以是药物。
[0139]
本文使用的术语“小分子”是本领域的术语,用于将分子与诸如蛋白质和核酸的大分子区分开来。小分子在免疫测定领域中通常被称为“半抗原”,作为一种小分子,当它与诸如蛋白质的大载体分子连接时,可以引发免疫反应,并包括诸如激素和合成药物的分子。这种类型的小分子通常具有2,000或更小的分子量,通常为1,000或更小,甚至500或更小。结合组件可以被改造以适于结合到分析物本身,尽管分析物在结合到结合组件之前可以经历化学反应或初始络合事件。例如,分析物可在测定条件的ph值下被质子化/去质子化。因此,与结合组件结合的分析物可以是分析物本身或分析物的衍生物;两者都包括在本发明的范围内。
[0140]
在优选的实施方案中,本发明可用于同时检测同一样品中多种分析物的存在。不同的结合组件可用于基板上的不同位置以测量每种分析物。夹心和竞争测定可以并行运行,并且这些测定可以使用与如上文所述相同的阴性和阳性对照,或者可以对每种被测量的分析物使用单独的对照。
[0141]
被怀疑含有目的分析物的样品通常是流体样品,例如液体样品,通常是生物样品,例如体液,例如血液、血浆、唾液、血清、眼内液、脑脊液或尿液。样品可以含有悬浮颗粒,甚至可以是全血。在一个优选的实施方案中,样品未经处理,更优选为未经处理的流体。未经处理是指样品/流体在与报告试剂和其他测定组件混合之前没有通过过滤、稀释或任何其他预处理步骤进行预处理。然而,在本发明的范围内,处理样品以提供氘富集混合物,例如通过用氘富集的流体稀释,或用氘富集的流体孵育。本发明方法的一个优点是可以对确实含有悬浮颗粒的样品进行测定,而不会过度影响测定结果。优选地,除了氘富集之外,样品是未处理的。
[0142]
在一个优选的实施方案中,样品是全血。出人意料的是,全血的组分不干扰本发明的检测方法。通常从血液中除去红细胞以测量血液的血浆或血清组分中的荧光,这是由于细胞组件对光的不可预测的散射,这种散射因样品而异。然而,在本发明中,因为将在基板上测量荧光,并且因为可以测量个体结合事件,所以测量可以在全血中进行。
[0143]
样品通常为微升量级(例如1-100μl,优选1-10μl)。为了保持流体样品,基板优选地位于具有一个或多个侧壁、上表面和下表面的样品室中。因此,在本发明中使用的装置优选地还包括用于容纳含有与基板接触的分析物的样品的室。
[0144]
背景干扰的一个潜在额外来源是悬浮颗粒在基板表面的沉降,包括报告试剂和样品的细胞组件。这种干扰源可以通过将基板放置在本体溶液上方来减少,例如放置在反应室的上表面。因此,如果发生任何沉降,它不会干扰基板。优选地,基板形成如图所示的上表面。优选地,基板是基本平面的。更优选地,基板是平面的。“基本平面的”是指基板偏离平面性仅达到其在本发明中保持功能的点,例如,使得整个基板在成像时保持在单个焦点范围或视野内。显然,光学和结合组件将位于室的内表面上,以允许与样品接触。这种和其他修改包括在本发明的范围内。
[0145]
样品可以简单地通过表面张力保留在例如毛细通道内。
[0146]
报告试剂和任选的一种或多种额外的试剂优选地储存在纳入到本发明中使用的装置中的室中。
[0147]
本发明在护理点(poc)检测中特别有用。poc检测被定义为在护理点处或附近进行的诊断检测,即床边检测。poc检测可实现方便和快速的检测,从而改进决策和分类,同时更好地分配医院资源,例如事故和急诊护理以及病床。这与传统检测形成鲜明对比,传统检测是在护理点采集样品,然后送到实验室进行检测。采用此类检测,通常需要数小时或数天才能获得结果,在此期间,必须在没有所需信息的情况下继续进行护理。poc检测通常将检测试剂盒与便携式仪器结合使用。
[0148]
本发明对于监测通常为非常低丰度的分析物的浓度或者存在/不存在特别有用。潜在应用包括测量心脏病(如高敏肌钙蛋白)、传染病(如丙型肝炎核心抗原)、衰老/痴呆(如阿尔茨海默病标志物β和磷酸化tau,神经丝轻链)、细胞因子和肿瘤学(如循环肿瘤标志物)中的生物标志物。
[0149]
本发明还提供了一种用于检测样品中的分析物的装置,该装置包括:具有光学组件和结合组件的基板,其中光学组件和结合组件连接至基板表面上,光敏剂能够在吸收电磁辐射时从预活化剂中产生活性氧簇,并且光学组件在与活性氧簇反应时能够从第一光学状态变化为第二光学状态,并且其中基板在其表面上具有氘富集层。
[0150]
该装置的特征与上述本发明中使用的装置相同。
[0151]
在一个优选的实施方案中,该装置还包括用于容纳样品和报告试剂的混合物的室。
[0152]
本发明的装置可以包括经改造适于产生电磁辐射的辐射源和经改造适于检测处于第二光学状态的光学组件的检测器,从而允许精确确定光敏剂相对于基板的位置。
[0153]
本发明的装置可以采用与单独的读数器一起使用的盒(cartridge)的形式。读数器可以合并辐射源和检测器。读数器优选地是便携式读数器。优选地,该装置包括盒,其中基板在盒内,并且其中该装置还包括用于检测基板上具有第二光学状态的该局部区域集的检测器。本发明还可以提供包括基板以及本文所定义的光学和结合组件的盒。该盒优选地是一次性盒。
[0154]
本发明还提供了一种用于检测样品中分析物的系统,其包括:本发明的装置;以及用于形成包括样品的混合物的报告试剂和预活化剂,报告试剂在吸收电磁辐射时能够从预活化剂中产生活性氧簇,并且光学组件在与活性氧簇反应时能够从第一光学状态变化为第二光学状态,并且其中在照射之前,基板可以与氘富集流体接触。
[0155]
优选地,报告试剂的光敏剂能够吸收电磁辐射以与存在于混合物中的预活化剂相互作用以产生活性氧簇,并且活性氧簇能够与光学组件反应以将光学组件从第一光学状态变化为第二光学状态。
[0156]
在优选的实施方案中,本发明的系统基本上由上述特征组成。“基本上”是指不需要其他特征来实施测定。
[0157]
现在将参考以下实施例描述本发明,这些实施例并非旨在限制。
实施例
[0158]
材料
[0159]
根据本领域已知的技术制备生物素化的牛血清白蛋白(bsa)和荧光素标记的链霉亲和素。这些材料也是市售可得的。使用可从perkin elmer获得的方案将抗tsh抗体5407
(medix biochemica)缀合至醛包被的alpha screen供体小珠(perkin elmer目录号6762013)。这些方案涉及在氰基硼氢化物存在下将小珠和抗体孵育过夜,然后添加(羧基甲氧基)胺以淬灭反应。通过离心和洗涤步骤除去过量的抗体。
[0160]
实施例1
[0161]
硅烷化玻璃盖玻片
[0162]
通过将50ml的30%过氧化氢溶液添加到150ml的浓硫酸中来制备新鲜的食人鱼溶液(piranha solution)。然后将22mm x 22mm盖玻片23(商标,目录号4700 55)装载到不锈钢架上,然后浸入食人鱼溶液中30分钟,然后在去离子水中冲洗三次,然后在异丙醇中冲洗三次。然后将盖玻片浸入新鲜的溶于异丙醇中的5%二氯(甲基)苯基硅烷(merck,目录号440116)溶液中2分钟。然后将它们在异丙醇中洗涤三次并在烘箱中在100℃下干燥1小时。
[0163]
实施例2
[0164]
基板表面的制备
[0165]
将切出6mm直径孔的1cm x 1cm正方形块的200μm厚的压敏粘合剂(psa)22连接至实施例1中所述的硅烷化盖玻片23,以产生浅孔24,如图8所示。然后将50μl生物素化的bsa(10μg/ml,溶于40mm磷酸盐缓冲液中)置于孔中并孵育2小时,然后用洗涤缓冲液(40mm磷酸盐、2%蔗糖、0.9%nacl、0.03%bsa)洗去。然后将30μl荧光素标记的链霉亲和素(10μg/ml,溶于40mm磷酸盐、2%蔗糖、0.9%nacl、0.03%bsa中)加入孔中并孵育60分钟,然后用洗涤缓冲液洗涤三次。然后将30μl生物素化的5409抗tsh抗体(20μg/ml,溶于40mm磷酸盐缓冲液、2%蔗糖、0.9%nacl、0.03%bsa中)孵育30分钟,然后用洗涤缓冲液洗涤三次并在室温下在空气中干燥。
[0166]
然后从psa移除释放衬垫(release liner),将基板倒置并连接至一片丙烯酸片材25上,其中钻通有两个小孔26以产生反应室,如图9中的轮廓所示。
[0167]
实施例3
[0168]
光敏剂小珠与表面的结合
[0169]
将包被有抗tsh抗体(0.5%固体)的200nm alphascreen供体小珠以1:500稀释到tsh(100pg/ml)在含有0.5%bsa和0.05%tween-20的磷酸盐缓冲液中的溶液中。用移液管将8μl该混合物通过其中一个孔加入反应室中,并在黑暗中孵育30分钟。30分钟后,用磷酸盐缓冲液冲洗腔室三次。
[0170]
实施例4
[0171]
在非氘化环境中产生漂白区域
[0172]
使用窄锥角680nm led以15mw的总光输出聚焦到玻璃盖玻片的表面上照射实施例3的反应室1分钟。然后将表面在euromex iscope反射荧光显微镜上成像,该显微镜具有汞放电灯泡和gxcam hichrome met照相机(1080x1920像素),使用连接至具有0.85的数值孔径的60x空气透镜的荧光素激发/发射滤光片组。图7示出了光学装置。表面的一部分的代表性图像如图10所示。每个暗点表示在表面上发生结合事件的位置。该图像中暗点的近似直径为0.4μm。
[0173]
实施例5
[0174]
在氘化环境中产生漂白区域
[0175]
如实施例3中制备第二反应室,不同之处在于在氘化磷酸盐缓冲液中进行三次最
终洗涤,氘化磷酸盐缓冲液通过将磷酸盐缓冲液片剂溶解于氧化氘中来制备。以与实施例4中相同的方式对表面成像。表面的代表性图像如图11所示。在这种情况下,暗点的直径约为两倍,平均为0.8μm。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1